Перейти к:
Клинико-нейроиммунологические корреляции при постинсультной эпилепсии на примере нейронспецифической енолазы и фактора роста эндотелия сосудов
https://doi.org/10.17749/2077-8333/epi.par.con.2024.205
Аннотация
Актуальность. В связи с прогрессом в лечении пациентов, перенесших инсульт, увеличивается распространенность постинсультной эпилепсии (ПИЭ). Поиск биомаркеров, определяющих прогноз осложнений ишемического инсульта (ИИ) и развитие ПИЭ, с разработкой протокола диагностики полезен для совершенствования тактики терапии ПИЭ.
Цель: исследование уровней нейронспецифической енолазы (англ. neuron-specific enolase, NSE) и фактора роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF) в сыворотке крови пациентов с ПИЭ, изучение клинико-нейроиммунологических корреляций.
Материал и методы. Обследованы 140 пациентов в возрасте от 28 до 84 лет с последствиями первого ИИ. Из них у 70 больных впервые развились поздние эпилептические приступы (основная группа), у 70 имел место ИИ без эпилептических приступов (группа сравнения). В контрольную группу вошли 30 пациентов без ИИ и эпилепсии. Степень тяжести ИИ оценивали по шкале инсульта Национальных институтов здравоохранения США (англ. National Institutes of Health Stroke Scale, NIHSS), степень инвалидизации – по модифицированной шкале Рэнкина (англ. modified Rankin Scale, mRS), уровень базовой функциональной активности пациента – по индексу Бартела (англ. Barthel Index, BI). Прогнозирование появления поздних приступов после ИИ осуществляли по шкале SeLECT (англ. SEverity of stroke, Large artery atherosclerosis, Early seizure, Cortical involvement, Territory of the middle cerebral artery). Для оценки тяжести течения эпилепсии использовали классификацию K. Lühdorf et al. У всех пациентов проводили иммуноферментный анализ уровня нейротрофического фактора NSE и фактора ангиогенеза VEGF в сыворотке крови.
Результаты. Отмечено значительное увеличение концентрации NSE в основной группе (в 4,72 раза) и группе сравнения (в 4,45 раза), в отличие от контрольной группы. Выявлено статистически значимое повышение показателей VEGF в основной группе (в 1,59 раза) и группе сравнения (в 1,54 раза) относительно контрольных значений. Кроме того, уровни NSE и VEGF в основной группе статистически значимо превышали таковые в группе сравнения (в 1,06 и 1,03 раза соответственно). Также наблюдалась тенденция к повышению обоих биомаркеров у больных со среднетяжелым и тяжелым течением ПИЭ. Определен уровень корреляционных взаимосвязей между показателями, которые характеризуют повреждение нервной ткани и процесс ангиогенеза, и степенью тяжести, инвалидизации, реабилитационного потенциала, активности пациентов в повседневной жизни, а также прогностической значимости NSE и VEGF в развитии и утяжелении эпилепсии у больных с последствиями ИИ и эпилептическими приступами.
Заключение. Гиперэкспрессия NSE и VEGF имеет значение в прогнозировании развития или прогрессирования (утяжеления) эпилепсии после ИИ.
Ключевые слова
Для цитирования:
Рахимбаева Г.С., Собирова Д.С. Клинико-нейроиммунологические корреляции при постинсультной эпилепсии на примере нейронспецифической енолазы и фактора роста эндотелия сосудов. Эпилепсия и пароксизмальные состояния. 2024;16(4):316-326. https://doi.org/10.17749/2077-8333/epi.par.con.2024.205
For citation:
Rakhimbaeva G.S., Sobirova D.S. Сlinical and neuroimmunological correlations in post-stroke epilepsy illustrated by analyzing serum neuron-specific enolase and vascular endothelial growth factor. Epilepsy and paroxysmal conditions. 2024;16(4):316-326. https://doi.org/10.17749/2077-8333/epi.par.con.2024.205
ВВЕДЕНИЕ / INTRODUCTION
Цереброваскулярные заболевания могут приводить к развитию эпилепсии у пожилых людей. Острые нарушения мозгового кровообращения (ОНМК) становятся причиной примерно 10% всех случаев эпилепсии и 55% впервые выявленных приступов у пожилых людей. В большинстве случаев инсульты происходят у людей старше 45 лет. До 90% инсультов являются ишемическими (ИИ), а остальные 10% – геморрагическими [1][2].
Постинсультная эпилепсия (ПИЭ), одна из форм приобретенной структурной эпилепсии, может вызывать осложнения, которые ухудшают качество жизни, повышают смертность и увеличивают затраты на медицинскую помощь [3]. Примерно у 10% людей, перенесших инсульт, развивается ПИЭ. Учитывая значительное бремя инсульта во всем мире, ПИЭ является серьезной проблемой [2]. Кроме того, 40% случаев позднего начала эпилепсии связаны с цереброваскулярными заболеваниями, и эпилепсия с поздним началом часто сопровождается рецидивом ОНМК, что показывает важность данного вопроса как на глобальном, так и на национальном уровне.
Риск развития эпилепсии увеличивается у людей с отдаленными последствиями ИИ [4][5]. Ранние эпилептические приступы наблюдаются в течение первых 2 дней после инсульта, в то время как поздние приступы могут проявляться между 6-м месяцем и 1-м годом после инсульта, согласно исследованию М.Y. Xu (2018 г.) [6]. Первоначальные приступы, как правило, возникающие в течение первых 7 дней острого периода инсульта, поздние приступы (с 8-го по 21-й день острой стадии инсульта) и предвестники (приступы, предшествующие инсульту) систематизируются в соответствии с классификацией G.S. Barolin (1962 г.) [7]. По данным A. Pezzini et al. (2024 г.) [1], H. Stefan и G. Michelson (2024 г.) [4], после инсульта частота ранних эпилептических приступов у пациентов колеблется от 2–33% до 50–78%, а поздних постинсультных приступов – от 3–4,5% до 67%. Однако их роль в развитии ПИЭ недостаточно изучена. До сих пор остаются неясными механизмы формирования ПИЭ, основные предикторы постинсультных эпилептических приступов и роль различных биомаркеров в их патогенезе и исходе заболевания.
На развитие эпилепсии после ОНМК могут указывать различные биомаркеры, которые можно измерить. При биологическом процессе нейровоспаления высвобождаются воспалительные медиаторы, такие как простагландины, хемокины, цитокины, компоненты комплемента, факторы роста и молекулярные паттерны, связанные с повреждением (англ. damage-associated molecular patterns, DAMPs) [8–10]. Повышенная возбудимость, изменения в синаптической передаче, глиоз, нарушение функции гематоэнцефалического барьера (ГЭБ) и аномальный нейрогенез – все это последствия длительного нейровоспаления [11–14]. Изменения концентрации биомаркеров в крови могут указывать на наличие или развитие заболевания [15][16], а некоторые из них обладают нейропротекторными свойствами [16][17], поэтому их исследование является актуальным.
Для диагностики различных нейродеструктивных заболеваний центральной нервной системы (ЦНС), таких как эпилепсия, исследование нейронспецифической енолазы (англ. neuron-specific enolase, NSE) стало перспективным направлением в нейроиммунологии. В исследовании Г.С. Рахимбаевой и Н.С. Рашидовой (2011 г.) было обнаружено, что уровень NSE в сыворотке крови пациентов с посттравматической эпилепсией выше, чем у больных с сосудистой эпилепсией [18]. Пациенты с более частыми приступами имели самые высокие значения NSE. Это особенно верно для молодых людей, о чем сообщается также в работах X. Bai еt al. (2022 г.) [19], H. Eriksson еt al. (2021 г.) [20].
Фактор роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF) – еще одна молекула, связанная с дисфункцией ГЭБ в головном мозге [16, 21–23]. Ангиогенез, процесс образования новых сосудов из ранее существовавших, может наблюдаться как при физиологических (т.е. при развитии), так и при патологических состояниях [24]. В основе формирования и прогрессирования сосудистых пороков (мальформаций) лежит локальная сверхэкспрессия VEGF [25–27]. V. Rigau et al. (2007 г.) установили, что плотность сосудов в гиппокампе у пациентов с эпилепсией примерно в два раза выше, чем в гиппокампе у неэпилептических контрольных групп [22]. Однако остается неясным, каким образом VEGF-индуцированная дисфункция ГЭБ влияет на развитие эпилепсии и эпилептических приступов.
Таким образом, в связи с прогрессом в лечении пациентов, перенесших инсульт, распространенность ПИЭ увеличивается. Важное практическое значение имеют настороженность по поводу возникновения ПИЭ, ее профилактика и ранняя диагностика. Поиск биомаркеров, определяющих прогноз осложнений ИИ и развития ПИЭ, с разработкой протокола диагностики представляет научный и практический интерес.
Цель – исследование уровней NSE и VEGF в сыворотке крови пациентов с ПИЭ, изучение клинико-нейроиммунологических корреляций.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
В период с 2020 по 2024 гг. в многопрофильной клинике Ташкентской медицинской академии и Городской клинической больнице № 7 г. Ташкента (Узбекистан) было проведено исследование с участием 170 пациентов в возрасте от 28 до 84 лет.
Критерии включения и исключения / Inclusion and exclusion criteria
При составлении когорты исследования учитывали следующие критерии включения:
– возраст старше 18 лет;
– поздний восстановительный период и период остаточных явлений ИИ (для групп с ИИ).
Критерии исключения из исследования:
– детский и подростковый возраст;
– острейший и острый период ИИ;
– геморрагический инсульт;
– гипертонические кризы и транзиторные ишемические атаки;
– эпилепсия, предшествовавшая инсульту;
– опухоли, травмы головного мозга;
– токсические поражения;
– клиническая смерть;
– воспалительные заболевания головного мозга (менингиты, менингоэнцефалиты, энцефалиты, лептоменингиты, лейкодистрофии, нейросифилис, синдром Гийена–Барре);
– демиелинизирующие заболевания головного мозга (рассеянный склероз, рассеянный энцефаломиелит, миастении, полинейропатии);
– психические нарушения.
Группы пациентов / Patient groups
Пациенты, перенесшие ИИ, были разделены на две группы в зависимости от того, диагностирована у них эпилепсия или нет.
В основную (1-ю) группу вошли 70 пациентов (42 (60%) мужчины и 28 (40%) женщин) с поздними эпилептическими приступами после первого ИИ. Возраст больных составил 62,95±9,98 года (от 28 до 79 лет, медиана 63 года).
Группу сравнения (2-ю) составили 70 пациентов (51 (72,86%) мужчина и 19 (27,14%) женщин) с последствиями ИИ без эпилептических приступов. Средний возраст составил 62,24±11,55 года (от 30 до 84 лет, медиана 62 года).
В контрольную группу включены 30 пациентов (9 (42,9%) мужчин и 12 (57,1%) женщин) с астено-невротическим синдромом и дорсопатией, у которых не было ИИ, эпилепсии или других серьезных соматических и неврологических заболеваний. Средний возраст составил 55,18±10,48 года (от 45 до 59 лет, медиана 55 лет).
Диагностика / Diagnostics
Пациентам выполняли нейровизуализацию (магнитно-резонансную томографию (МРТ) и компьютерную томографию (КТ) головного мозга), нейрофизиологическое исследование (электроэнцефалографию (ЭЭГ)), а также клиническое и неврологическое обследование на момент первичного осмотра с последующим наблюдением в течение 6–12 мес.
МРТ-исследование проводили на аппарате Phillips American G (напряженность магнитного поля 1,5 Тл) в режимах Т1, Т2, FLAIR, FSE-axial, FSE-coronar, Т2*/SWI, DWI. Бесконтрастную КТ и КТ-перфузию выполняли на мультиспиральном компьютерном томографе Revolution 128 (Philips, Голландия) путем передне-заднего сканирования с толщиной среза 2,5 мм. Исследования проводили в частной клинике «Медион» г. Ташкента. Всем пациентам выполняли запись ЭЭГ на 19-канальной системе «Нейрон-Спектр-3» (ООО «Нейрософт», Россия).
Формулировку диагноза ИИ и его последствий осуществляли в соответствии с Международной классификацией болезней 10-го пересмотра (МКБ-10) (код I69.3 для последствий ИИ), общепринятыми рекомендациями, такими как руководящие документы Европейской организации инсульта (англ. European Stroke Organisation, ESO) [28] и Международной Противоэпилептической Лиги (МПЭЛ; англ. International League Against Epilepsy, ILAE) [29][30].
Для классификации эпилептических приступов и эпилепсии использовали рабочую классификацию типов приступов и дефиницию эпилепсии, представленные ILAE в 2017 г. [29][30]. Также для установления диагноза эпилепсии применяли МКБ-10, где эпилепсия обозначена кодом G40.
Методы оценки / Assessment methods
Для оценки степени тяжести ИИ использовали шкалу инсульта Национальных институтов здравоохранения США (англ. National Institutes of Health Stroke Scale, NIHSS), степени инвалидизации – модифицированную шкалу Рэнкина (англ. modified Rankin Scale, mRS), эффективности ухода и базовой функциональной активности пациента – индекс Бартела (англ. Barthel Index, BI).
С целью прогнозирования поздних приступов после ИИ применяли шкалу SeLECT (англ. SEverity of stroke, Large artery atherosclerosis, Early seizure, Cortical involvement, Territory of the middle cerebral artery) [31]. Этот инструмент может помочь в профилактике поздних эпилептических приступов после инсульта. В оценке учитываются ранние приступы, тяжесть инсульта (11 баллов и выше по NIHSS), а также поражение корковых зон и артериальных бассейнов, включая кору головного мозга, зону средней мозговой артерии и атеросклеротическое поражение крупных артерий. Шкала позволяет оценить вероятность того, что перенесшие инсульт пациенты будут испытывать приступы в течение 5 лет. Ранний приступ, который не классифицируется как эпилепсия, не указывает на ПИЭ. Хотя существует связь между ранними приступами и повышенным риском развития эпилепсии в будущем, это не является основанием для постановки диагноза ПИЭ [31]. Исследования E. Beghi et al. (2011 г.) [32] и M. Holtkamp et al. (2017 г.) [33] показали, что эпилептический приступ, возникший более чем через 1 нед после инсульта, классифицируется как поздний и неспровоцированный и значительно повышает вероятность повторных приступов (более чем на 60%).
Для оценки степени тяжести течения эпилепсии использовали классификацию K. Lühdorf et al. (1986 г.): мягкое течение (легкая степень тяжести) – 3 и менее эпилептических приступов в год, средняя степень – 12 и менее приступов в год, тяжелое течение (тяжелая степень тяжести) – 13 и более приступов в год [34].
Иммуноферментный анализ / Enzyme-linked immunosorbent assay
Помимо стандартных анализов в образцах сыворотки крови всех наблюдавшихся пациентов основной группы и группы сравнения, перенесших ИИ более 6 мес назад, а также контрольной группы с помощью иммуноферментного анализа (ИФА) определяли уровни NSE с использованием набора реагентов «HCE-ИФА» (ООО «Хема», Россия) и VEGF с использованием набора реагентов VEGF-ИФА-БЕСТ (АО «Вектор-Бест», Россия) по инструкции производителей.
Статистический анализ / Statistical analysis
Сначала данные были занесены в регистрационные карты каждого пациента, а затем перенесены в электронную базу данных Excel 2010 (Microsoft, США). Для анализа использовали традиционные методы вариационной статистики. Результаты представлены с помощью среднего значения и стандартного отклонения (M±SD), возраст – дополнительно в виде медианы и диапазона значений. После проверки нормальности распределения данных количественные показатели оценены с применением t-критерия Стьюдента, а качественные – с помощью критерия χ2. Расчет коэффициента корреляции Пирсона (r) использовали для оценки взаимосвязи между двумя выборочными совокупностями. Статистически значимую разницу определяли как не менее 95% (p<0,05).
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Оценка по шкалам / Assessment by scales
Результаты применения оценочных шкал в обеих группах больных с ИИ представлены в таблице 1.
Таблица 1. Результаты оценки состояния пациентов по различным шкалам в группах исследования, баллы
Table 1. Results of patient assessments according to various scales in the study groups, score
|
Шкала / Scale |
Основная группа / Main group (n=70) |
Группа сравнения / Comparison group (n=70) |
р |
|
NIHSS |
20,10±4,00 |
19,37±4,46 |
0,300 |
|
mRS |
3,00±1,00 |
2,27±0,96 |
<0,001 |
|
BI |
65,00±12,65 |
65,60±9,32 |
0,700 |
|
SeLECT |
3,41±1,30 |
2,94±1,30 |
0,030 |
Примечание. NIHSS (англ. National Institutes of Health Stroke Scale) – шкале оценки тяжести инсульта Национальных институтов здравоохранения США; mRS (англ. modified Rankin Scale) – модифицированная шкала Рэнкина; BI (англ. Barthel Index) – индекс Бартела; SeLECT (англ. SEverity of stroke, Large artery atherosclerosis, Early seizure, Cortical involvement, Territory of the middle cerebral artery) – шкала для прогнозирования поздней эпилепсии, связанной с ишемическим инсультом (учитывает тяжесть инсульта, атеросклероз крупных артерий, ранние приступы, поражение коры головного мозга, область средней мозговой артерии).
Note. NIHSS – National Institutes of Health Stroke Scale; mRS – modified Rankin Scale; BI – Barthel Index; SeLECT (SEverity of stroke, Large artery atherosclerosis, Early seizure, Cortical involvement, Territory of the middle cerebral artery) – a scale for predicting late epilepsy associated with ischemic stroke.
Тяжесть инсульта
В основной группе значение по шкале NIHSS достигло 20,1±4,0 балла, что в 1,04 раза выше, чем в группе сравнения, в которой суммарный балл составил 19,37±4,46 (р=0,3) (табл. 2). В 1-й группе у 22,86% пациентов был диагностирован легкий ИИ (средний балл по шкале NIHSS 9,69±2,90), у 35,71% – среднетяжелый (средний балл 18,36±1,65), у 41,43% – тяжелый (средний балл 27,46±5,93). Во 2-й группе у 27,14% больных отмечен легкий ИИ (средний балл 12,00±2,93), у 45,72% – среднетяжелый (средний балл 19,00±1,30), у 27,14% – тяжелый (средний балл 24,68±4,07). Таким образом, тяжелый ИИ чаще встречался у пациентов с ПИЭ (р<0,05).
Таблица 2. Распределение больных в зависимости от степени тяжести инсульта по шкале инсульта Национальных институтов здравоохранения США (англ. National Institutes of Health Stroke Scale, NIHSS)
Table 2. Distribution of patients according to stroke severity level based on the National Institutes of Health Stroke Scale (NIHSS)
|
Степень тяжести инсульта / Stroke severity |
Основная группа / Main group (n=70) |
Группа сравнения / Comparison group (n=70) |
p |
||
|
n (%) |
Средний балл / Mean score |
n (%) |
Средний балл / Mean score |
||
|
Легкий / Mild |
16 (22,86) |
9,69±2,90 |
19 (27,14) |
12,00±2,93 |
0,001 |
|
Среднетяжелый / Moderate |
25 (35,71) |
18,36±1,65 |
32 (45,72) |
19,00±1,30 |
>0,050 |
|
Тяжелый / Severe |
29 (41,43) |
27,46±5,93 |
19 (27,14) |
24,68±4,07 |
<0,050 |
|
Итого / Total |
70 (100,00) |
20,10±4,00 |
70 (100,00) |
19,37±4,46 |
0,300 |
Степень инвалидизации
При использовании шкалы mRS больные с ИИ и ПИЭ показали следующие результаты по уровню инвалидизации по сравнению с пациентами без ПИЭ: 3,00±1,00 и 2,27±0,96 балла соответственно (р<0,001) (см. табл. 1). У больных с ПИЭ определена значимо более высокая балльная оценка по mRS, чем у пациентов без ПИЭ. Пациенты без ПИЭ не нуждались в постороннем уходе (<3 баллов по mRS), в то время как пациенты с ПИЭ - нуждались (≥3 баллов по mRS). Таким образом, можно сделать вывод, что эпилепсия ухудшает состояние больных с инсультом.
Активность в повседневной жизни
Показатели индекса Бартела для оценки активности в повседневной жизни составили в среднем 65,0±12,65 балла в 1-й группе и 65,6±9,32 балла во 2-й группе (см. табл. 1), что свидетельствует об умеренной зависимости от окружающих в повседневной жизни. Исследуемые группы по данному критерию статистически значимо не отличались (р=0,7).
Риск развития поздних приступов
По шкале SeLECT до лечения средний балл в 1-й группе составил 3,41±1,30, во 2-й группе – 2,94±1,30 (р=0,03) (см. табл. 1). Исследуемые группы по данному критерию значимо отличались в 1,16 раза, что может свидетельствовать о более высоком риске развития поздних приступов при ИИ с учетом наличия вышеперечисленных критериев.
Степень развития эпилепсии
У 32 (45,71%) пациентов была легкая степень тяжести ПИЭ, у 12 (17,14%) – средняя (р<0,001), у 26 (37,15%) – тяжелая (р<0,05) (рис. 1). Принимая во внимание то, что классификация K. Lühdorf et al. учитывает только частоту и не учитывает форму эпилептических приступов (простые парциальные, сложные парциальные, генерализованные или вторично-генерализованные), безусловно, более тяжелое течение ПИЭ отмечалось у больных с высокой частотой, в первую очередь, генерализованных форм приступов и эпилептического статуса. Итак, среди данной выборки пациентов с ПИЭ наиболее часто регистрировались легкая и тяжелая степени тяжести течения ПИЭ, зависящие от частоты и формы эпилептических приступов.
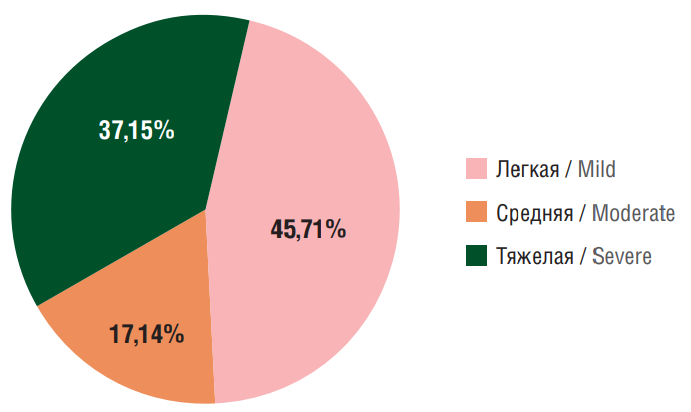
Рисунок 1. Распределение больных с постинсультной эпилепсией по степени тяжести течения эпилепсии
Figure 1. Distribution of patients with post-stroke epilepsy stratified by epilepsy severity level
Иммуноферментный анализ / Enzyme-linked immunosorbent assay
Уровень NSE
На следующем этапе изучали уровень NSE в сыворотке крови больных. В исследованном периоде ИИ выявлено увеличение концентрации NSE. Показатели составили в среднем 18,42±3,00 нг/мл в 1-й группе и 17,34±3,37 нг/мл во 2-й группе, т.е. по сравнению с контрольной группой (3,9±1,3 нг/мл) – повышение в 4,72 и 4,45 раза соответственно (р<0,001) (табл. 3).
Таблица 3. Уровни нейронспецифической енолазы (англ. neuron-specific enolase, NSE) и фактора роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF) в сыворотке крови пациентов
Table 3. Levels of patient serum neuron-specific enolase (NSE) and vascular endothelial growth factor (VEGF)
|
Биомаркер / Biomarker |
Основная группа / Main group (n=70) |
Группа сравнения / Comparison group (n=70) |
Контроль / Control (n=30) |
р |
|
NSE, нг/мл // NSE, ng/ml |
18,42±3,00 |
17,34±3,37 |
3,9±1,3 |
<0,001 |
|
VEGF, пг/мл // VEGF, pg/ml |
286,75±17,40 |
278,20±12,08 |
180,1±12,1 |
<0,001 |
При этом уровень NSE в 1-й группе превышал таковой во 2-й группе в 1,06 раза (р=0,04) (рис. 2). Максимальные значения NSE наблюдались у больных со среднетяжелым и тяжелым ИИ в обеих группах (р<0,05). Это свидетельствует о том, что данный биомаркер является предвестником неврологического дефицита и развития эпилепсии после перенесенного ИИ.
В результате проведенного корреляционного анализа уровней NSE и баллов по оценочным шкалам у больных с ПИЭ выявлена прямая сильная связь между показателями NSE и баллами по шкале NIHSS (r=0,71) (рис. 3а). Это может означать, что повышение уровня NSE является маркером тяжелого течения ИИ и неблагоприятного прогноза у пациентов с ПИЭ.
У больных с ПИЭ может наблюдаться умеренная прямая связь между концентрацией NSE и баллами по шкале mRS (r=0,50) (рис. 3b), и ее дальнейший рост может негативно влиять на реабилитационный период.
Выявлена слабая корреляционная связь между показателями NSE и баллами по индексу Бартела (r=0,31) (рис. 3с), который указывает на активность и зависимость больного в повседневной жизни. Следовательно, высокий уровень NSE может опосредованно влиять на активность больных с ПИЭ за счет тяжести неврологического дефицита. Наши результаты согласуются с данными других исследователей [18][35].
Коэффициент корреляции между уровнем NSE и баллами по шкале SeLECT составил r=0,88, т.е. определена прямая сильная связь (рис. 3d). Принимая во внимание, что наименьшее значение шкалы может предсказывать риск поздних приступов в течение 1 года после инсульта 0,7%, риск в течение 5 лет – 1,3%, тогда как наивысшее значение (9 баллов) означает риск поздних приступов в течение 1 года 63%, в течение 5 лет – 83% [31], а также то, что чем выше баллы по шкале, тем выше уровень NSE, и наоборот, можно сделать вывод о валидности данной шкалы и исследованного биомаркера как предикторов риска развития поздних эпилептических приступов после ИИ.
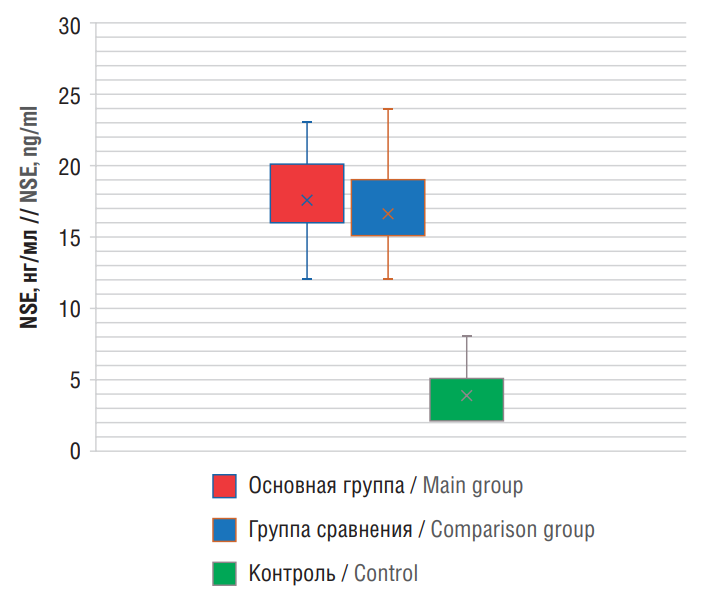
Рисунок 2. Уровни нейронспецифической енолазы (англ. neuron-specific enolase, NSE) в сыворотке крови пациентов
Figure 2. Levels of patient serum neuron-specific enolase (NSE)
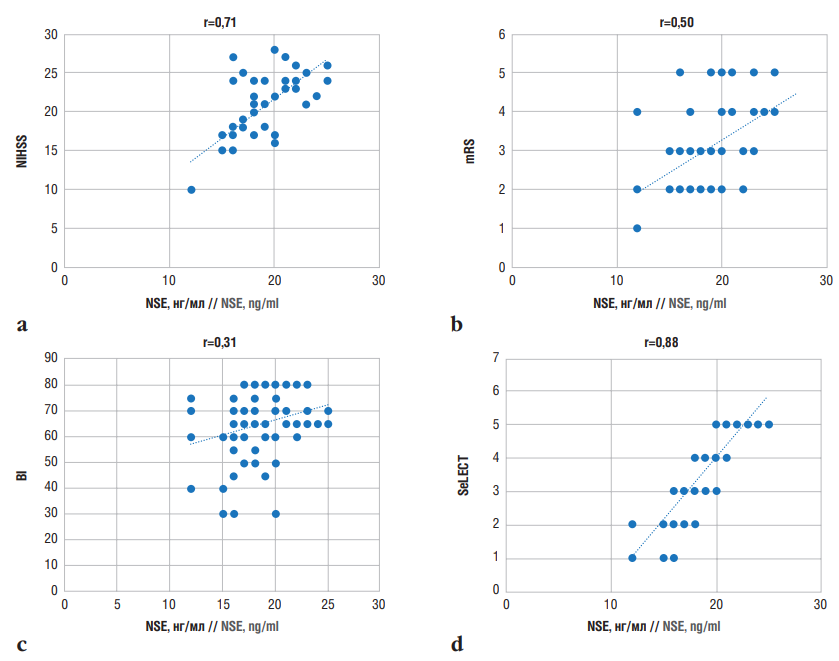
Рисунок 3. Корреляционные взаимосвязи между уровнем нейронспецифической енолазы (англ. neuron-specific enolase, NSE) при постинсультной эпилепсии и баллами по оценочным шкалам: а – шкала оценки тяжести инсульта Национальных институтов здравоохранения США (англ. National Institutes of Health Stroke Scale, NIHSS); b – модифицированная шкала Рэнкина (англ. modified Rankin Scale, mRS); с – индекс Бартела (англ. Barthel Index, BI); d – шкала SeLECT (англ. SEverity of stroke, Large artery atherosclerosis, Early seizure, Cortical involvement, Territory of the middle cerebral artery)
Figure 3. Correlations between neuron-specific enolase (NSE) levels in post-stroke epilepsy and assessment scale scores: a – National Institutes of Health Stroke Scale (NIHSS); b – modified Rankin Scale (mRS); c – Barthel Index (BI); d – SeLECT (SEverity of stroke, Large artery atherosclerosis, Early seizure, Cortical involvement, Territory of the middle cerebral artery) score
NSE относится к внутриклеточным энзимам ЦНС и представляет собой изоформу фермента енолазы, который необходим для гликолиза. Этот маркер используется для оценки дифференцированности ЦНС и является одним из наиболее специфичных индикаторов повреждения нейронов. Начиная с синаптогенеза, т.е. после 22-й недели беременности, NSE начинает проявляться на более поздних стадиях нейрональной дифференциации. Этот уникальный сывороточный маркер также может использоваться для выявления новообразований нервной ткани и нейроэндокринных опухолей [35]. При ишемическом повреждении, травме мозга, эпилепсии и в результате субарахноидального кровоизлияния наблюдается повышение уровня NSE в сыворотке крови [36][37].
Таким образом, у пациентов с последствиями инсульта и эпилептическими приступами отмечается повышенная в 1,06 раза концентрация NSE в сыворотке крови в сравнении с больными с ИИ без эпилепсии и в 4,72 раза – в сравнении с контрольной группой, что свидетельствует о более значительном разрушении нервной ткани у пациентов с ПИЭ. Следовательно, использование NSE как маркера повреждения мозга может улучшить диагностику и прогнозирование исхода ПИЭ.
Уровень VEGF
ИФА-исследование концентрации VEGF в сыворотке крови больных показало его статистически значимое повышение в 1,59 раза в основной группе (286,75±17,40 пг/мл) и в 1,54 раза в группе сравнения (278,20±12,08 пг/мл) относительно контрольных значений (180,1±2,1 пг/мл) (р<0,001) (см. табл. 3).
При этом уровень VEGF в 1-й группе статистически значимо превышал таковой во 2-й группе – в 1,03 раза (p<0,001) (рис. 4). Также показано, что гиперэкспрессия VEGF чаще встречается у пациентов с эпилепсией и энцефалопатией. Это означает, что VEGF участвует не только в ангиогенезе (формировании новых сосудов из уже существующих), но и в эпилептогенезе. Сосудистая эпилепсия связана с его гиперэкспрессией. На роль VEGF в патогенезе эпилепсии указывают также другие авторы [21][22].
Корреляционный анализ показал слабую прямую связь (r=0,47) между уровнем VEGF и баллами по шкале NIHSS (рис. 5а), что говорит о незначительной связи гиперэкспрессии VEGF с тяжестью ИИ. О двойственной роли VEGF в патогенезе ИИ сообщают также другие авторы, в работах которых гиперэкспрессия VEGF имеет компенсаторный характер в остром периоде заболевания, способствуя росту новых сосудов [16][24].
Установлено, что показатели степени инвалидизации по шкале mRS у пациентов с ПИЭ имеют слабую положительную корреляционную взаимосвязь (r=0,44) с уровнем VEGF (рис. 5b), что может указывать на то, что данный маркер слабо взаимосвязан со степенью инвалидизации и реабилитационным потенциалом больных с ПИЭ.
Доказана слабая корреляционная связь между показателями VEGF и баллами по индексу Бартела (r=0,33) (рис. 5с) и шкале SeLECT (r=0,40) (рис. 5d). Так, высокий уровень VEGF не взаимосвязан с развитием поздней эпилепсии после ИИ, а также с активностью больных в повседневной жизни. Кроме того, этот показатель не имеет никакой значимости для прогнозирования развития или усугубления эпилепсии в исследуемый период после инсульта.
Для изучения взаимосвязи уровней VEGF и NSE при ПИЭ проведен корреляционный анализ, показавший слабую прямую корреляционную связь (r=0,38) (рис. 6).
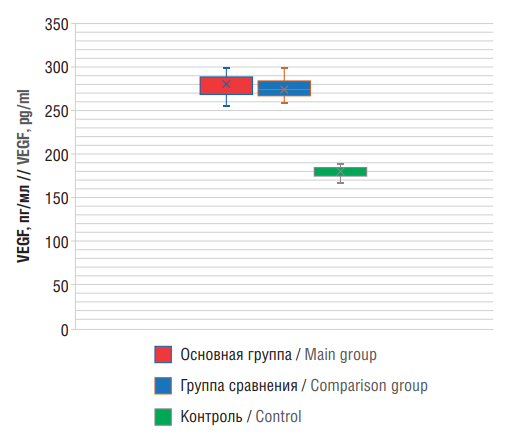
Рисунок 4. Уровни фактора роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF) в сыворотке крови пациентов
Figure 4. Levels of patient serum vascular endothelial growth factor (VEGF)
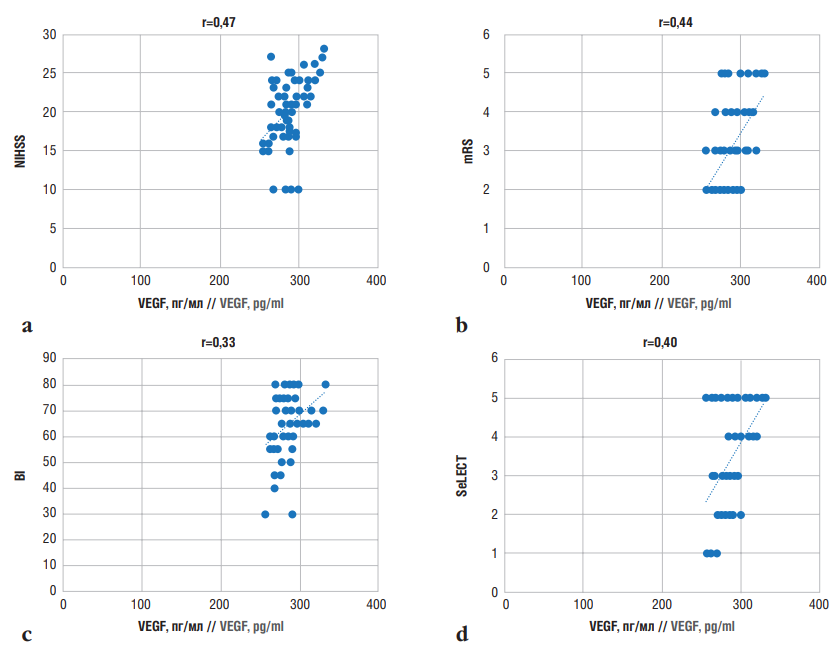
Рисунок 5. Корреляционные взаимосвязи между уровнем фактора роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF) при постинсультной эпилепсии и баллами по оценочным шкалам: а – шкала оценки тяжести инсульта Национальных институтов здравоохранения США (англ. National Institutes of Health Stroke Scale, NIHSS); b – модифицированная шкала Рэнкина (англ. modified Rankin Scale, mRS); с – индекс Бартела (англ. Barthel Index, BI); d – шкала SeLECT (англ. SEverity of stroke, Large artery atherosclerosis, Early seizure, Cortical involvement, Territory of the middle cerebral artery)
Figure 5. Correlations between vascular endothelial growth factor (VEGF) levels in post-stroke epilepsy and assessment scale scores: a – National Institutes of Health Stroke Scale (NIHSS); b – modified Rankin Scale (mRS); c –Barthel Index (BI); d – SeLECT (SEverity of stroke, Large artery atherosclerosis, Early seizure, Cortical involvement, Territory of the middle cerebral artery) score
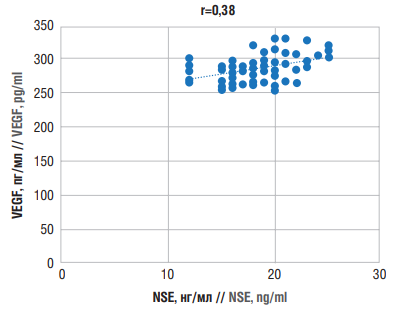
Рисунок 6. Корреляционные взаимосвязи между уровнями нейронспецифической енолазы (англ. neuron-specific enolase, NSE) и фактора роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF) при постинсультной эпилепсии
Figure 6. Correlations between neuron-specific enolase (NSE) and vascular endothelial growth factor (VEGF) levels in post-stroke epilepsy
Гиперэкспрессия VEGF лежит в основе формирования и прогрессирования таких сосудистых пороков, как артериовенозные мальформации (АВМ) [25]. При АВМ гиперэкспрессия VEGF обнаруживается в астроцитах, нейронах и эндотелиальных клетках. Следовательно, эти клетки могут секретировать VEGF для поддержки ангиогенеза и формирования АВМ [21][25], хотя прямые доказательства, подтверждающие эту гипотезу, отсутствуют.
Ангиогенез в мозге больного эпилепсией коррелирует с дисфункцией ГЭБ, связанной с VEGF [21]. Матричные РНК VEGF и его рецептора 2 (англ. vascular endothelial growth factor receptor 2, VEGFR2) были активированы, а ZO-1, который является белком, связанным с плотным соединением, был понижен в культурах срезов, обработанных каиновой кислотой [26]. Лечение антителами против VEGF ослабляло увеличение плотности сосудов и числа сосудистых ветвей, а также снижение экспрессии ZO-1. Кроме того, обнаружено, что передача сигналов VEGF/VEGFR2, вероятно, индуцирует ангиогенез и дисфункцию ГЭБ через протоонкоген-тирозинкиназный путь Src [21][26].
Эндотелиальные клетки экспрессируют VEGFR, и в нескольких источниках высказано предположение, что матриксная металлопротеиназа активирует сигнальный путь VEGF/VEGFR в ангиогенезе при патологических состояниях [21][26][27]. Однако вопрос о том, способствуют ли эти системы ангиогенезу в мозге пациента с эпилепсией и каким образом, еще предстоит изучить.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Таким образом, нами доказано, что гиперэкспрессия NSE, являющегося маркером повреждения мозга, имеет значение в диагностике и прогнозировании исхода ПИЭ. Гиперэкспрессия VEGF играет двойственную роль в патогенезе ПИЭ в зависимости от периода ИИ и наличия эпилепсии, с компенсаторным характером в остром периоде ИИ и неблагоприятным показателем в периоде отдаленных последствий, особенно при развитии сосудистой и структурной эпилепсии, что может указывать на его роль в эпилептогенезе.
Определены корреляционные взаимосвязи между показателями, которые характеризуют повреждение нервной ткани и процесс ангиогенеза, и степенью тяжести, инвалидизации, реабилитационного потенциала, активности пациентов в повседневной жизни. Также показана прогностическая значимость гиперэкспрессии NSE и VEGF в развитии и ухудшении течения эпилепсии у пациентов с эпилептическими приступами и последствиями инсульта. Можно предсказать развитие или прогрессирование эпилепсии, опираясь на уровни этих биомаркеров после инсульта.
Список литературы
1. Pezzini A., Tarantino B., Zedde M., еt al. Early seizures and risk of epilepsy and death after intracerebral haemorrhage: The MUCH Italy. Eur Stroke J. 2024; 9 (3): 630–8. https://doi.org/10.1177/23969873241247745.
2. Tanaka T., Ihara M., Fukuma K., et al. Pathophysiology, diagnosis, prognosis, and prevention of poststroke epilepsy: clinical and research implications. Neurology. 2024; 102 (11): e209450. https://doi.org/10.1212/WNL.0000000000209450.
3. Liang M., Zhang L., Geng Z. Advances in the development of biomarkers for poststroke epilepsy. Biomed Res Int. 2021; 2021: 5567046. https://doi.org/10.1155/2021/5567046.
4. Stefan H., Michelson G. Late onset epilepsy and stroke: diagnosis, pathogenesis and prevention. Seizure. 2024: S1059–1311(24)00168-7. https://doi.org/10.1016/j.seizure.2024.06.011.
5. Григолашвили М.А., Жуанышева Э.М. Факторы риска развития постинсультной эпилепсии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2021; 121 (8-2): 35–40. https://doi.org/10.17116/jnevro202112108235.
6. Xu M.Y. Poststroke seizure: optimising its management. Stroke Vasc Neurol. 2018; 4 (1): 48–56. https://doi.org/10.1136/SVN-2018-000175.
7. Barolin G.S., Sherzer E. Epileptic seizures in apoplectic patients. Wein Nervenh. 1962; 20: 35–47 (in German).
8. Маджидова Ё.Н., Рахимбаева Г.С., Азизова Р.Б. Нейроиммунопатогенетические механизмы эпилепсии. Эпилепсия и пароксизмальные состояния. 2014; 6 (1): 15–8.
9. Vezzani A., Balosso S., Ravizza T. Neuroinflammatory pathways as treatment targets and biomarkers in epilepsy. Nat Rev Neurol. 2019; 15 (8): 459–72. https://doi.org/10.1038/s41582-019-0217-x.
10. Wang M., Yu J., Xiao X., et al. Changes of biochemical biomarkers in the serum of children with convulsion status epilepticus: a prospective study. BMC Neurol. 2022; 22 (1): 196. https://doi.org/10.1186/s12883-022-02686-2.
11. Abraira L., Santamarina E., Cazorla S., еt al. Blood biomarkers predictive of epilepsy after an acute stroke event. Epilepsia. 2020; 61 (10): 2244–53. https://doi.org/10.1111/epi.16648.
12. Abraira L., López-Maza S., Quintana M., еt al. Exploratory study of blood biomarkers in patients with post-stroke epilepsy. Eur Stroke J. 2024; 9 (3): 763–71. https://doi.org/10.1177/23969873241244584.
13. Расулова Х.А., Расулова М.А. Иммуноанализ естественных нейротропных аутоантител в сыворотке крови больных с COVID-19-ассоциированными ишемическими инсультами. Медицинская иммунология. 2024; 26 (6): 1257–68. https://doi.org/10.15789/1563-0625-IAO-2888.
14. Расулова Х.А., Азизова Р.Б. Естественные нейротропные аутоантитела в сыворотке крови больных, страдающих эпилепсией. Вестник Российской академии медицинских наук. 2014; 69 (5–6): 111–6. https://doi.org/10.15690/vramn.v69i5-6.1054.
15. Bronisz E., Kurkowska-Jastrzębska I. Matrix metalloproteinase 9 in epilepsy: the role of neuroinflammation in seizure development. Mediators Inflamm. 2016; 2016: 7369020. https://doi.org/10.1155/2016/7369020.
16. Croll S.D., Ransohoff R.M., Cai N., et al. VEGF-mediated inflammation precedes angiogenesis in adult brain. Exp Neurol. 2004; 187 (2): 388–402. https://doi.org/10.1016/j.expneurol.2004.02.010.
17. Tröscher A.R., Gruber J., Wagner J.N., et al. Inflammation mediated epileptogenesis as possible mechanism underlying ischemic post-stroke epilepsy. Front Aging Neurosci. 2021; 13: 781174. https://doi.org/10.3389/fnagi.2021.781174.
18. Рахимбаева Г.С., Рашидова Н.С. Нейрон-специфическая енолаза в сыворотке крови как диагностический маркер эпилепсии. Международный неврологический журнал. 2011; 2: 123–8.
19. Bai X., Zhang L., Li H., et al. A cross-sectional study of early-onset epilepsy of intracerebral hemorrhage and construction of a risk prediction model. Zhonghua Wei Zhong Bing Ji Jiu Yi Xue. 2022; 34 (12): 1273–9 (in Chinese). https://doi.org/10.3760/cma.j.cn121430-20221008-00878.
20. Eriksson H., Banote R.K., Larsson D., et al. Brain injury markers in new-onset seizures in adults: a pilot study. Seizure. 2021; 92: 62–7. https://doi.org/10.1016/j.seizure.2021.08.012.
21. Ogaki A., Ikegaya Y., Koyama R. Vascular abnormalities and the role of vascular endothelial growth factor in the epileptic brain. Front Pharmacol. 2020; 11: 20. https://doi.org/10.3389/fphar.2020.00020.
22. Rigau V., Morin M., Rousset M.C., et al. Angiogenesis is associated with blood-brain barrier permeability in temporal lobe epilepsy. Brain. 2007; 130 (Pt 7): 1942–56. https://doi.org/10.1093/brain/awm118.
23. Zabrodskaya Y., Paramonova N., Litovchenko A., et al. Neuroinflammatory dysfunction of the blood-brain barrier and basement membrane dysplasia play a role in the development of drug-resistant epilepsy. Int J Mol Sci. 2023; 24 (16): 12689. https://doi.org/10.3390/ijms241612689.
24. Расулова Х.А. Ангиогенез в норме и патологии. Роль эндотелиального фактора роста сосудов. Неврология. 2016; 3: 47–9.
25. Park S.J., Park S.H. Systemic expression of vascular endothelial growth factor in patients with cerebral cavernous malformation treated by stereotactic radiosurgery. J Korean Neurosurg Soc. 2016; 59 (5): 442–8. https://doi.org/10.3340/jkns.2016.59.5.442.
26. Li P., Zhang L., Chen D., et al. Focal neurons: another source of vascular endothelial growth factor in brain arteriovenous malformation tissues? Neurol Res. 2018; 40 (2): 122–9. https://doi.org/10.1080/01616412.2017.1405574.
27. Guo D., Zhang B., Han L., et al. Cerebral vascular and blood brain-barrier abnormalities in a mouse model of epilepsy and tuberous sclerosis complex. Epilepsia. 2024; 65 (2): 483–96. https://doi.org/10.1111/epi.17848.
28. European Stroke Organisation (ESO) Executive Committee; ESO Writing Committee. Guidelines for management of ischaemic stroke and transient ischaemic attack 2008. Cerebrovasc Dis. 2008; 25 (5): 457–507. https://doi.org/10.1159/000131083.
29. Fisher R.S., Acevedo C., Arzimanoglou A., et al. ILAE official report: a practical clinical definition of epilepsy. Epilepsia. 2014; 55 (4): 475–82. https://doi.org/10.1111/epi.12550.
30. Fisher R.S., Cross J.H., D'Souza C., et al. Instruction manual for the ILAE 2017 operational classification of seizure types. Epilepsia. 2017; 58 (4): 531–42. https://doi.org/10.1111/epi.13671.
31. Galovic M., Döhler N., Erdélyi-Canavese B., et al. Prediction of late seizures after ischaemic stroke with a novel prognostic model (the SeLECT score): a multivariable prediction model development and validation study. Lancet Neurol. 2018; 17 (2): 143–52. https://doi.org/10.1016/S1474-4422(17)30404-0.
32. Beghi E., D'Alessandro R., Beretta S., et al. Incidence and predictors of acute symptomatic seizures after stroke. Neurology. 2011; 77 (20): 1785–93. https://doi.org/10.1212/WNL.0b013e3182364878.
33. Holtkamp M., Beghi E., Benninger F., et al. European Stroke Organisation guidelines for the management of post-stroke seizures and epilepsy. Eur Stroke J. 2017; 2 (2): 103–15. https://doi.org/10.1177/2396987317705536.
34. Lühdorf K., Jensen L.K., Plesner A.M. Epilepsy in the elderly: incidence, social function, and disability. Epilepsia. 1986; 27 (2): 135–41. https://doi.org/10.1111/j.1528-1157.1986.tb03516.x.
35. Rundgren M., Karlsson T., Nielsen N., et al. Neuron specific enolase and S-100B as predictors of outcome after cardiac arrest and induced hypothermia. Resuscitation. 2009; 80 (7): 784–9. https://doi.org/10.1016/j.resuscitation.2009.03.025.
36. Kaca-Oryńska M., Tomasiuk R., Friedman A. Neuron-specific enolase and S 100B protein as predictors of outcome in ischaemic stroke. Neurol Neurochir Pol. 2010; 44 (5): 459–63. https://doi.org/10.1016/s0028-3843(14)60136-5.
37. Куракина А.С., Семенова Т.Н., Гузанова Е.В. и др. Прогностическое значение исследования нейронспецифической енолазы у пациентов с ишемическим инсультом. Современные технологии в медицине. 2021; 13 (2): 68–72. https://doi.org/10.17691/stm2021.13.2.08.
Об авторах
Г. С. РахимбаеваУзбекистан
Рахимбаева Гульнора Саттаровна - д.м.н., проф.
ул. Шифокорлар, д. 2, Ташкент 100109, Узбекистан)
Scopus Author ID 37122562300
Д. С. Собирова
Узбекистан
Собирова Донохон Саидаскархановна.
ул. Шифокорлар, д. 2, Ташкент 100109; ул. Гайрати, д. 24, Ташкент 100099
Рецензия
Для цитирования:
Рахимбаева Г.С., Собирова Д.С. Клинико-нейроиммунологические корреляции при постинсультной эпилепсии на примере нейронспецифической енолазы и фактора роста эндотелия сосудов. Эпилепсия и пароксизмальные состояния. 2024;16(4):316-326. https://doi.org/10.17749/2077-8333/epi.par.con.2024.205
For citation:
Rakhimbaeva G.S., Sobirova D.S. Сlinical and neuroimmunological correlations in post-stroke epilepsy illustrated by analyzing serum neuron-specific enolase and vascular endothelial growth factor. Epilepsy and paroxysmal conditions. 2024;16(4):316-326. https://doi.org/10.17749/2077-8333/epi.par.con.2024.205
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.







































