Перейти к:
Роль нейропептида Y в развитии вальпроат-индуцированного расстройства пищевого поведения
https://doi.org/10.17749/2077-8333/epi.par.con.2024.207
Аннотация
Актуальность. Индуцированное вальпроевой кислотой (ВК) расстройство пищевого поведения (РПП) является одной из составных частей патогенеза такого серьезного осложнения терапии ВК и ее солями, как ВК-индуцированный метаболический синдром (МетС). Около 20% пациентов, получающих ВК, имеют увеличение веса, которое также обусловлено изменением пищевого поведения у таких больных. В регуляции пищевого поведения участвуют такие вещества, как нейропептид Y (англ. neuropeptide Y, NPY), лептин, орексин и грелин. В последние годы особое внимание уделяется NPY, поскольку он представляет собой один из самых мощных орексигенных пептидов головного мозга, а уровень его экспрессии непосредственно влияет на количество и качество потребляемой пищи. Гиперэкспрессия NPY ассоциирована с РПП, пищевыми предпочтениями, развитием ожирения и МетС.
Цель: провести обзор результатов доклинических и клинических исследований роли NPY как потенциального чувствительного и специфического сывороточного биомаркера ВК-РПП, вторичного увеличения веса и развития ВК-МетС у детей и взрослых с эпилепсией.
Материал и методы. Проанализированы отечественные и зарубежные публикации, поступившие в базы данных eLibrary, PubMed/MEDLINE, Scopus, Google Scholar за период 2014–2024 гг. Рассматривали полнотекстовые статьи на русском и английском языках (оригинальные исследования, систематические обзоры, метаанализы, кокрейновские обзоры, клинические случаи). После процедуры отбора из 1105 публикаций, найденных по ключевым словам, в анализ вошли 53.
Результаты. ВК-РПП относится к мультифакторным заболеваниям, при оценке риска развития которых необходимо учитывать аддитивный вклад внешних (пищевое воспитание, пищевые привычки у пациента и членов семьи) и внутренних (ключевые гормоны и нейропептиды регуляции аппетита и пищевых предпочтений, доза и длительность приема ВК, скорость метаболизма ВК) факторов. NPY-ассоциированное ВК-РПП влияет на пищевые предпочтения в пользу высококалорийных пищи и напитков, увеличения частоты приемов пищи, повышает риски инсулинорезистентности, гипергликемии как одних из основных доменов патогенеза МетС.
Заключение. ВК-РПП требует своевременной диагностики, поскольку может стать причиной ВК-МетС. NPY является важным биомаркером ВК-РПП, поскольку исследования последних лет убедительно продемонстрировали, что этот нейропептид участвует в регуляции пищевого поведения у больных эпилепсией.
Ключевые слова
Для цитирования:
Шнайдер Н.А., Гречкина В.В., Киссин М.Я., Дмитренко Д.В., Насырова Р.Ф. Роль нейропептида Y в развитии вальпроат-индуцированного расстройства пищевого поведения. Эпилепсия и пароксизмальные состояния. 2024;16(4):349-361. https://doi.org/10.17749/2077-8333/epi.par.con.2024.207
For citation:
Shnayder N.A., Grechkina V.V., Kissin M.Ya., Dmitrenko D.V., Nasyrova R.F. Role of neuropeptide Y in development of valproate-induced eating behaviour disorder. Epilepsy and paroxysmal conditions. 2024;16(4):349-361. https://doi.org/10.17749/2077-8333/epi.par.con.2024.207
ВВЕДЕНИЕ / INTRODUCTION
«Пищевое поведение» – это широкий термин, который включает выбор пищи и мотивацию, практику питания, диеты и проблемы, связанные с питанием (ожирение, расстройства пищевого поведения (РПП) и нарушения кормления) [1]. На формирование пищевого поведения влияют многочисленные генетические, физиологические, психологические, культурные, социальные и ситуационные факторы [2].
Пищевое поведение у людей не является стереотипным, обусловленным только необходимостью компенсировать острые изменения энергетического статуса. Понятно, что эмоциональные [3][4], когнитивные [5][6] и культуральные факторы [7][8], а также прием некоторых лекарственных средств [9] играют важную роль в инициировании и прекращении акта приема пищи. Хотя отрицательного энергетического баланса достаточно, он не обязателен для начала приема пищи.
Различные виды контроля пищевого поведения (гомеостатический, гедонический и когнитивный) в реальной жизни тесно переплетены. Их разделение на дискретные механизмы по большей мере поддерживается теоретическими доводами, а не эмпирическими доказательствами [10]. Голод и сытость находятся на перекрестке сложного взаимодействия между метаболическими и неметаболическими факторами, регулирующими пищевое поведение у детей и взрослых. Баланс энергии в организме человека постоянно контролируется головным мозгом с помощью множества эндокринных и нейронных механизмов, которые включают долгосрочные и краткосрочные сигналы об изменениях в запасах энергии (энергетической «валюте»). На этом динамическом фоне, который стимулирует человека к принятию решения о том, начать есть или нет, прекратить есть или нет, информация из внешней среды – сенсорная (зрение, запах или вкус пищи) или социальная (наличие запланированного перерыва на обед) – может выступать в качестве триггерного фактора [10].
Пока недостаточно изученным является РПП, ассоциированное с приемом лекарственных средств, включая противоэпилептические препараты (ПЭП), и развитием абдоминального (центрального) ожирения как одного из ключевых компонентов ПЭП-индуцированного метаболического синдрома (МетС) [11]. К сожалению, большинство эпилептологов (неврологов и психиатров) не диагностируют РПП на фоне длительного приема ПЭП у детей и взрослых с эпилепсией, что приводит к потере терапевтического окна, когда профилактика развития ПЭП-индуцированного МетС наиболее эффективна.
ПЭП разных фармакологических групп могут оказывать вариабельный негативный эффект на изменение пищевого поведения, повышать риск развития ожирения и МетС у пациентов с эпилепсией. К числу ПЭП с наибольшим риском этих нежелательных реакций относится вальпроевая кислота (ВК) и ее соединения [11][12]. Несмотря на большое число наблюдений, свидетельств о том, что ВК значительно повышает риск развития ВК-индуцированного РПП (ВК-РПП), ожирения и МетС (ВК-МетС) [11], биомаркеры ВК-РПП пока недостаточно изучены. В последние годы наблюдается повышение интереса исследователей к изучению роли нейропептидов головного мозга, участвующих в регуляции пищевого поведения у здоровых людей и больных эпилепсией, включая пациентов, длительно получающих ВК.
Цель – провести обзор результатов доклинических и клинических исследований роли нейропептида Y (NPY) как потенциального чувствительного и специфического сывороточного биомаркера ВК-РПП, вторичного увеличения веса и развития ВК-МетС у детей и взрослых с эпилепсией.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Стратегия поиска / Search strategy
Проведен поиск полнотекстовых публикаций в базах данных eLibrary, PubMed/MEDLINE, Scopus, Google Scholar по ключевым словам на русском и английском языках: «нейропептид Y», «пищевое поведение», «расстройство пищевого поведения», «метаболический синдром», «вальпроевая кислота», «вальпроаты», «нежелательная реакция», «вальпроат-индуцированные нежелательные реакции», «вальпроат-индуцированное расстройство пищевого поведения», “neuropeptide Y”, “eating behavior”, “eating disorder”, “metabolic syndrome”, “valproic acid”, “valproates”, “adverse reaction”, “valproate-induced adverse reactions”, “valproate-induced eating disorder”. Поиск выполняли в течение года (с 10 июля 2024 г. по 20 июля 2024 г.)
Рассматривали плацебо-контролируемые и кросс-секционные исследования, исследования типа «случай – контроль», тематические исследования, систематические обзоры, метаанализы и кокрейновские обзоры, поступившие в базы данных с 2014 по 2024 гг. Кроме того, в обзор включены более ранние публикации, представляющие исторический интерес.
Отбор публикаций / Selection of publications
Отбор осуществляли путем двойного независимого рецензирования. Исключали статьи, в которых данные не были статистически значимыми или были сомнительными, а также дублирующие тексты. Всего по ключевым словам было найдено 1105 публикаций, после процедуры отбора в анализ вошли 53 статьи, которые соответствовали цели настоящего обзора.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Факторы риска изменения пищевого поведения у пациентов с эпилепсией / Risk factors for altering eating behavior in epilepsy patients
Внешнесредовые факторы риска
Эпилепсия является не только распространенным социально значимым неврологическим заболеванием, но и социальной проблемой для детей/подростков и их родителей, а также взрослых пациентов.
На пищевое поведение больных, получающих ВК, могут влиять такие внешние факторы риска, как модель пищевого поведения у членов семьи. Родители детей и подростков с эпилепсией, а также члены семьи взрослых пациентов опасаются непредсказуемости эпилептических приступов, переживают по поводу физического и психического здоровья своих родных (буллинг среди сверстников и пробандов), трудностей в обучении, снижения способности к самообслуживанию и независимости от посторонней помощи в будущем [13]. Кроме того, пищевое поведение родителей (членов семьи) может способствовать формированию у детей пищевых привычек, которые также могут влиять на изменение массы тела [13]. Родительское поведение – это общая поведенческая структура, определяющая эмоциональный контекст, в котором взаимодействуют родители и дети, и отражающая эмоциональный климат, в котором воспитываются дети с эпилепсией [14]. Возможно использование трех основных методов в пищевом воспитании детей и подростков, страдающих эпилепсией [15]: структура, принудительный контроль, поддержка автономии.
Структура пищевого воспитания связана с правилами и границами и включает распорядок приема пищи и перекусов, факторы наличия и доступности еды. Принудительный контроль относится к методам, связанным с негативным отношением, в т.ч. ограничение, принуждение к еде, угрозы и вознаграждения. Напротив, поддержка автономии пациентов с эпилепсией подразумевает использование методов поощрения и просвещения по вопросам питания и связана с более здоровым потреблением пищи [15].
Разнообразная еда дома, регулярное знакомство ребенка, страдающего эпилепсией, с новыми продуктами, словесное поощрение и родительское моделирование приема пищи являются успешными родительскими стратегиями для повышения комплаентности к правилам пищевого поведения. Однако такие родительские методы, как контроль за потреблением пищи, его подавление, ограничение продуктов и использование поощрений, могут оказывать негативное влияние на пищевое поведение детей и подростков, приводить к снижению преемственности пищевых привычек и отвращению к продуктам питания, которые дети должны есть и приема которых следует избегать [14]. К сожалению, негативный аддитивный эффект неадекватного пищевого воспитания пациентов с эпилепсией в детском возрасте и РПП редко учитывается при оценке риска развития ВК-индуцированного ожирения и ВК-МетС.
Гормональные факторы риска
NPY представляет собой белок, состоящий из 36 аминокислот, который принадлежит к семейству полипептидов поджелудочной железы и участвует в различных физиологических и гомеостатических процессах как в центральной (ЦНС), так и в периферической нервной системе (ПНС), включая регуляцию когнитивных и исполнительских функций, пищевого поведения и энергетического баланса, секрецию половых гормонов, модуляцию функционирования сердечно-сосудистой и нейроэндокринной систем, реакцию на стресс, эмоциональное поведение, возбудимость нейронов, эпилептогенез, приверженность к употреблению этанола [16][17]. Впервые NPY был выделен в 1982 г. K. Tatemoto et al. [18] из гипоталамуса свиньи и сразу привлек пристальное внимание исследователей из различных областей нейронаук [19].
NPY является одним из наиболее распространенных нейропептидов в ЦНС, где он преимущественно экспрессируется в коре, гиппокампе, заднем мозге и гипоталамусе [16]. Свое действие NPY опосредует через нейропептидные Y-рецепторы, в основном Y1-, Y2-, Y4- и YS-типов [20]. Рецепторы NPY широко представлены в ЦНС и ПНС, а также в постганглионарных симпатических волокнах, надпочечниках, мегакариоцитах и тромбоцитах [21]. Рецепторы Y1- и Y5-типов играют важную роль в повышении аппетита, в то время как рецепторы Y2- и Y4-типов, вероятно, участвуют в подавлении аппетита (появлении ощущения сытости). Показано, что NPY оказывает свое действие через модуляцию активности подтипов гуанидиннуклеотида (G) [22].
Система NPY, участвующая в регуляции пищевого поведения, в основном расположена в гипоталамусе, включая дугообразное ядро (англ. arcuate core, ARC), где синтезируется NPY и агути-родственный пептид (англ. аgouti-related peptide, AgRP), который также участвует в повышении аппетита и снижении уровня обмена веществ и энергозатрат, паравентрикулярное (англ. paraventricular nucleus, PVN), дорсомедиальное (англ. dorsomedial nucleus, DMN) и вентромедиальное (англ. ventromedial nucleus, VMN) ядра в префронтальной области [16][23]. Нейроны ARC направляют свои аксоны к PVN, а также к DMN и медиальной преоптической области [16].
Биологическое действие NPY исследовано на мышиных моделях, при этом показано, что он сокращает время до начала следующего приема пищи. Напротив, отсутствие NPY у мышей с нокаутом гена NPY связано с заметной задержкой начала приема пищи. NPY также задерживает чувство насыщения, вследствие чего увеличиваются размер порции, время, проведенное за едой, и продолжительность приема пищи. Эти эффекты NPY не зависят от типа пищи, поскольку наблюдаются при кормлении экспериментальных животных как твердой сухой пищей, так и подслащенным сгущенным молоком [16]. NPY также участвует в пищевом поведении, включая регуляцию мотивации к еде, – этот эффект NPY сопоставим с 36–48-часовым голоданием [16]. Интрацеребральное введение NPY изменяет мотивацию к качественным компонентам принимаемой пищи в дополнение к увеличению количества потребляемых продуктов питания [16][24].
Тип углеводов играет важную роль в стимулирующем орексигенном эффекте NPY. Когда экспериментальные животные могут выбирать между диетами с высоким содержанием углеводов и высоким содержанием жиров, они предпочитают первую [16][25]. Такой выбор может быть обусловлен изменением вкусности потребляемой пищи из-за повышенной сладости сахарозных или поликозных диет по сравнению с кукурузным крахмалом. Это подтверждается экспериментом, в котором различные растворы, подслащенные сахарозой или сахарином, были протестированы на сытых крысах: NPY увеличил потребление различных растворов сахарозы (2–10%), а также предпочитаемого раствора сахарина [16][26].
Одним из важных внешнесредовых факторов, влияющих на уровень экспрессии NPY в гипоталамусе, является голодание. Когда крысы лишены пищи на 24–96 ч, экспрессия NPY в ARC значительно увеличивается [16]. Хроническое голодание также повышает экспрессию NPY в ARC, но дополнительно увеличивает экспрессию NPY в заднем мозге, чего не наблюдается после короткого периода голодания [27]. Параллельно с этим после хронического голодания наблюдается увеличение экспрессии NPY в PVN. Возобновление нормального питания быстро возвращает уровень NPY в ARC к исходным значениям, но в PVN экспрессия NPY остается повышенной даже после 6 ч возобновления питания, что может быть связано с тем, что масса тела крыс за этот период еще не вернулась к норме (в среднем вес экспериментального животного нормализуется примерно через 24 ч) [16][27].
Гипогликемия – один из факторов регуляции экспрессии NPY в ЦНС [28]. Глюкозочувствительные нейроны, содержащие NPY, присутствуют в ARC и могут играть интегративную роль в регуляции пищевого поведения и энергетического баланса [16]. Глюкопривация, вызванная инъекцией метаболического блокатора 2-дезоксиглюкозы (англ. 2-deoxyglucose, 2DG) приводит к увеличению аппетита за счет активации гипоталамических нейронов NPY и увеличения экспрессии NPY в ARC и заднем мозге. Более того, аппетит, вызванный введением 2DG, снижается после инъекции антител к NPY в PVN и нокаута гена NPY [16]. Подтверждена важная роль доступности глюкозы в регуляции экспрессии NPY в ЦНС [28]. Так, после внутривенной инъекции глюкозы стимуляция приема пищи посредством NPY меньше, чем после внутривенной инъекции физиологического раствора хлорида натрия [16].
NPY-индуцированное РПП влияет и на уровень инсулина в плазме крови [29], который снижается во время голодания, а также может быть подавлен введением стрептозоцина, вызывающего гибель β-клеток поджелудочной железы. На животной модели сахарного диабета показано, что чувствительность к NPY в ЦНС сокращается, в то время как экспрессия и высвобождение NPY увеличиваются в гипоталамусе и ARC-PVN. Кроме того, число рецепторов к NPY уменьшается у стептозоциновых крыс. Экспрессия NPY нормализуется после введения инсулина [16].
Важные эндогенные факторы, участвующие в NPY-индуцированном РПП, включают глюкокортикоиды и лептин [30]. Рецепторы лептина экспрессируются в нейронах NPY, локализованных в ARC. Экспрессия лептина в жировой ткани и его уровень в плазме снижаются при голодании, что приводит к повышению регуляции системы NPY с увеличенной экспрессией мРНК и синтеза NPY в ARC, усиленным высвобождением NPY в PVN. С другой стороны, хроническое интрацеребральное введение NPY приводит к росту количества мРНК лептина в адипоцитах [16].
При ожирении очень редко встречается мутация только гена LEP, кодирующего лептин, или гена NPY, т.к. центральное ожирение и МетС являются мультифакторными заболеваниями, при которых окружающая среда и условия питания пациента с эпилепсией играют большую роль. Множество исследований показали, что центральное ожирение может быть вызвано употреблением несбалансированных диет с высоким содержанием углеводов и жиров или высококалорийных диет [16].
Известно, что (как у детей, так и у взрослых) центральная и периферическая регуляция массы тела осуществляется с участием различных нейропептидов и цитокинов, включая адипонектин, лептин, грелин, висфатин и NPY. При этом адипонектин и лептин относятся к потенциальным регуляторам метаболизма глюкозы и липидов, которые изменяются на фоне длительной терапии ВК [31], а лептин и грелин могут активировать рецепторы в ARC через модуляции эффектов гамма-аминомасляной кислоты, что приводит к РПП и нарушению энергетического гомеостаза [32][33]. Изменение уровня лептина у детей и взрослых с ВК-индуцированным увеличением веса показано во многих исследованиях [32][34–36]. В большинстве работ эта нежелательная реакция ассоциировалась с повышением аппетита и ненормальной жаждой, которая утолялась сладкими или высокоэнергетическими напитками, а в ряде исследований продемонстрировано, что ВК-индуцированное увеличение веса у пациентов с эпилепсией может быть обратимо с помощью поведенческой психотерапии без прекращения приема ВК [36].
ВК может напрямую ингибировать экспрессию гена, кодирующего адипонектин дифференцированных адипоцитов [37], но клинических данных относительно того, изменяет ли ВК экспрессию этого гена у людей с эпилепсией, пока недостаточно, хотя изменение сывороточного уровня адипонектина и инсулинорезистентность были обнаружены у пациентов с биполярным аффективным расстройством на фоне терапии ВК [38][39].
Висфатин является гормоном, который оказывает инсулино-миметическое действие и снижает уровень глюкозы в крови. В свою очередь, гипергликемия может стимулировать прием пищи за счет воздействия на глюкозочувствительные нейроны в медиальном гипоталамусе и последующего снижения продукции эфферентного ингибитора висфатина в латеральном гипоталамусе [40].
Кроме этих нейропептидов к кандидатным гормонам, ассоциированным с ВК-РПП, увеличением веса и ВК-МетС, относятся грелин, глюкагоноподобный пептид 1 (англ. glucagon-like peptide-1, GLP-1) и пептид YY [11]. Известно, что повышение экспрессии грелина стимулирует аппетит и повышает потребление пищи [41]. Напротив, GLP-1 и пептид YY угнетают аппетит и уменьшают количество приемов пищи [42]. Однако пока не доказано влияние изменения сывороточного уровня грелина у пациентов с эпилепсией, получающих ВК, на изменение их веса, а эффекты ВК на сывороточные уровни GLP-1 и пептида YY продолжают изучаться [43].
Также ВК может изменять микроструктуру приема пищи (например, скорость ее приема), что влияет на скорость продукции и уровень экспрессии гормонов насыщения в ЦНС. При этом показано, что при растяжении желудка может активизироваться синтез GLP-1 [44]. Постепенное увеличение порций у пациентов с ВК-РПП может быть скорректировано посредством ингибирования этого пептида. Наконец, длительный прием ВК может привести к тому, что организм пациентов с эпилепсией потеряет способность распознавать сигналы насыщения, связанные с воздействием гормонов насыщения, а это делает их неэффективными [32].
NPY КАК БИОМАРКЕР ВК-РПП / NPY AS BIOMARKER OF VPA-EBD
ВК относится к ПЭП первого поколения, часто назначаемым детям, подросткам и взрослым с эпилепсией, хотя механизм ее действия по-прежнему остается недостаточно изученным [45]. Широкое применение ВК и ее соединений (вальпроатов) в неврологии и психиатрии может приводить к развитию серьезных нежелательных реакций (особенно при длительной терапии), в группу которых входит ВК-МетС [11].
Механизмы, с помощью которых ВК увеличивает массу тела, пока до конца не ясны. Возможные пути патогенеза развития ВК-индуцированного ожирения и ВК-МетС могут включать гипергликемию, инсулинорезистентность, а также влияние ВК на баланс между потреблением энергии и ее расходом. Изменения в потреблении или расходе энергии, вероятно, связаны с влиянием ВК на биологические механизмы, которые участвуют в изменении метаболизма различных гормонов и нейропептидов, включая NPY [43]. Способность ВК и ее активных метаболитов [45] влиять на нейроны гипоталамуса, а именно на экспрессию NPY, может быть одним из ключевых звеньев в патогенезе развития ВК-МетС в целом и ВК-индуцированного увеличения веса в частности, поскольку гиперэкспрессия NPY в результате приема ВК увеличивает аппетит и тягу к продуктам с высоким содержанием углеводов и жиров у пациентов, страдающих эпилепсией.
Механизм действия ВК может детерминировать изменения в активности определенных факторов транскрипции, регулирующих экспрессию ключевых нейропептидов, в т.ч. NPY [46]. Хотя хроническая терапия ВК не влияла на высвобождение NPY в PVN, которая играет важную роль в регуляции пищевого поведения, экспрессия NPY или его рецепторов может изменяться в других гипоталамических ядрах, связанных с пищевым поведением, но этот механизм нуждается в дальнейшем изучении [47].
В работе C.K. Martin et al. (2008 г.) сообщается об увеличении чувства голода у больных, получающих ВК, в отличие от контрольной группы наивных пациентов, которое сопровождалось повышенной тягой к продуктам с высоким содержанием жиров, что и способствовало увеличению веса в группе ВК [44]. В систематическом обзоре M.B. Torlasco и M.A. Estrin (2023 г.) [48] также продемонстрирована взаимосвязь между терапией ВК, повышением экспрессии NPY и увеличением массы тела.
A. Cansu et al. [49] в исследовании с участием 18 детей в возрасте от 3,4 до 15,8 года и группы из 18 здоровых детей сопоставимого пола и возраста продемонстрировали, что через 18 мес лечения в группе ВК средний прирост веса был на 2,3 кг больше, чем у детей контрольной группы. Уровни инсулина, лептина, NPY и галанина в крови в группе ВК статистически значимо повысились, а уровень грелина, напротив, снизился по сравнению с группой контроля [49].
В исследовании K. Aydin et al. [35], в которое было включено 20 пациентов (10 мальчиков и 10 девочек) с впервые диагностированной эпилепсией в возрасте от 4 до 12 лет, измеряли индекс массы тела (ИМТ), сывороточные уровни NPY, глюкозы, инсулина, кортизола и лептина до начала приема ВК и через 3 и 6 мес после старта терапии. По окончании 3 мес терапии ИМТ и сывороточные уровни инсулина и NPY статистически значимо увеличились, а уровень глюкозы снизился. Через 6 мес приема ВК наблюдалось повышение сывороточных концентраций лептина и кортизола. Кроме того, показатель лептина был выше у девочек, чем у мальчиков, а уровни глюкозы, инсулина, кортизола и NPY в сыворотке крови не зависели от пола пациентов. Важно, что содержание ВК в сыворотке крови у наблюдаемых детей с эпилепсией был в пределах референсного терапевтического коридора (83,94±21,85 мкг/мл). Не найдено корреляции между уровнем ВК в крови и ИМТ, а также сывороточными концентрациями глюкозы, инсулина, кортизола, лептина и NPY. Сывороточные биомаркеры функции печени у пациентов во время лечения ВК были в норме [35].
Исследование H. Tokgoz et al. [50] включало 20 детей (8 девочек и 12 мальчиков, средний возраст 8,75±1,62 года), из них 10 страдали генетической фокальной эпилепсией, а 10 – генетической генерализованной эпилепсией. Пациенты получали монотерапию ВК. Авторы оценивали вес, рост, ИМТ, сывороточные уровни глюкозы, инсулина, лептина, NPY, грелина, адипонектина и кортизола до лечения, а также через 6 и 12 мес после его начала. Показано статистически значимое увеличение ИМТ и роста в конце 6-го и 12-го месяцев наблюдения: ИМТ значительно повысился в конечных точках исследования, причем через 12 мес монотерапии ВК он был выше, чем через 6 мес. Концентрация глюкозы в сыворотке крови статистически значимо не изменилась, но уровень инсулина имел тенденцию к неуклонному росту в конце 6-го и 12-го месяцев. По сравнению с исходными показателями значительно повысились сывороточные уровни NPY и лептина на фоне длительной монотерапии ВК. Содержание кортизола повышалось в первые 6 мес, но не через 12 мес. Однако уровни грелина и адипонектина статистически значимо не изменялись в течение всего периода наблюдения по сравнению с исходными показателями. Не было выявлено статистически значимых изменений в плазменных концентрациях классических маркеров метаболического синдрома (общего холестерина, триглицеридов (ТГ), липопротеинов низкой плотности (ЛПНП) и липопротеинов высокой плотности (ЛПВП)) ни в одном из измерений. Также не было значительных различий между изучаемыми показателями у мальчиков и девочек и зависимости от формы эпилепсии [50].
В исследование влияния ВК и топирамата (TПM) на уровни инсулина, лептина, NPY и грелина было включено 45 детей с эпилепсией, из которых 25 получали ВК и 23 – TПM. Возраст участников варьировался от 6 до 15,5 года. Длительность монотерапии ВК или TПM составляла не менее 6 мес. В контрольную группу вошли 25 здоровых детей. Образцы крови были взяты в основной и контрольной группах после голодания в течение не менее 10–12 ч и через 1 и 2 ч после приема пищи. Возраст, рост, вес и ИМТ в начале исследования были сопоставимы в основной и контрольной группах. Значительное увеличение веса наблюдалось на протяжении всего лечения в группе ВК по сравнению с группой TПM. Высокие сывороточные уровни инсулина натощак и после приема пищи отмечен в группе ВК. Концентрации лептина и NPY в группе ВК также были статистически значимо выше, чем в группах TПM и контроля. Не найдено существенных различий сывороточного содержания грелина в основной группе по сравнению с контрольной [51].
Помимо исследований роли ВК в изменении уровня NPY и увеличении массы тела у больных эпилепсией показано, что ВК оказывает клинически значимое негативное влияние на частоту встречаемости ВК-РПП и ожирения, особенно у пациентов женского пола в препубертатном (17–19 лет) и постпубертатном (>19 лет) возрастах [32]. При этом в постпубертатном возрасте увеличение веса в диапазоне от 1 до 10 кг зарегистрировано в 57% случаев на монотерапии ВК по сравнению с 25% случаев у пациенток, получавших монотерапию ламотриджином [32]. Этот негативный эффект ВК был взаимосвязан как с изменением пищевого поведения, так и с развитием инсулинорезистентности, включая увеличение индекса HOMA-IR1 (>2,5) в среднем через 3,2 года от старта терапии [32]. Повышение сывороточной концентрации инсулина и нарастание степени тяжести ожирения у взрослых пациентов с эпилепсией ассоциировалось с незначительными изменениями липидного профиля сыворотки крови, включая ВК-индуцированное изменение других биомаркеров МетС – снижение уровня ЛПВП и повышение уровня ТГ [32].
ДИАГНОСТИКА ВК-РПП / VPA-EBD DIAGNOSTICS
ВК-РПП у пациентов с эпилепсией может быть ассоциировано с модифицируемыми и немодифицируемыми факторами риска (табл. 1) [33], протекает тяжело и часто носит хронический характер, приводя к развитию ВК-МетС, особенно если не принимать надлежащих мер. Своевременная идентификация факторов риска ВК-РПП может помочь понять закономерности психосоциальной, биологической и генетической предрасположенности к неупорядоченному питанию у детей, подростков и взрослых, страдающих эпилепсией, даже при отсутствии каких-либо явных проблем с весом или питанием. Повышение осведомленности эпилептологов о ВК-РПП и ВК-МетС является важным путем обеспечения безопасности применения ПЭП в эпилептологии.
РПП, связанное с перееданием, характеризуется рецидивирующими эпизодами переедания, т.е. эпизодами пищевого поведения, происходящими в дискретный период времени (≤2 ч) и включающими потребление количества пищи, которое определенно больше, чем большинство людей потребляли бы в аналогичных обстоятельствах). Другими основными особенностями РПП, связанного с перееданием, являются чувство отсутствия контроля над едой во время эпизодов переедания, значительный психологический стресс (например, стыд, чувство вины) из-за переедания и отсутствие повторяющегося неадекватного компенсаторного поведения [52]. Согласно Диагностическому и статистическому руководству по психическим расстройствам (англ. Diagnostic and Statistical Manual of Mental Disorders, DSM) 4-го и 5-го пересмотров диагностика РПП, связанного с перееданием, основывается на пяти критериях (табл. 2) [52].
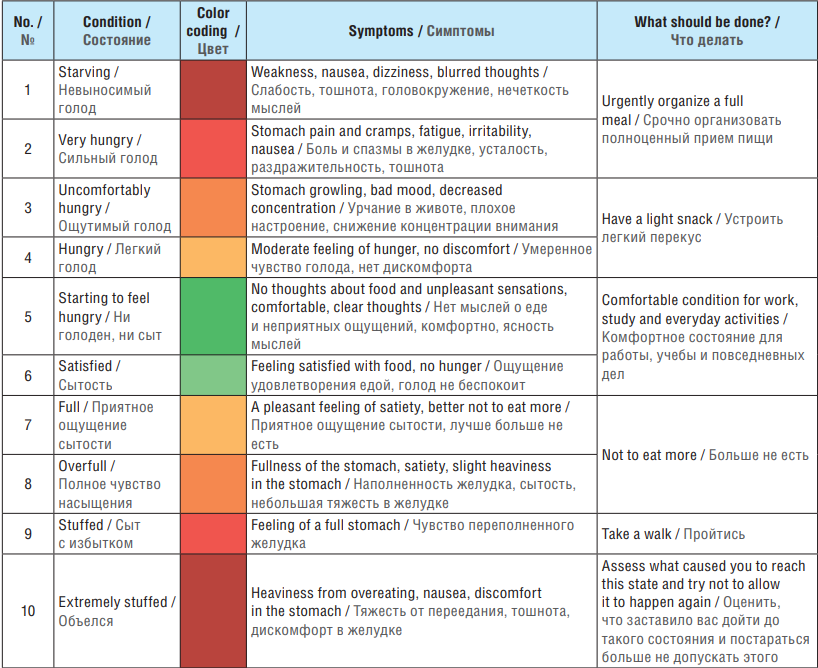
В практике эпилептолога для скрининга и ведения пациентов с ВК-РПП могут использоваться 10-балльная шкала голода и насыщения (сытости) [53][54] (рис. 1), таблица интуитивного питания2 (табл. 3) и чек-лист здорового пищевого поведения3.
Таблица 1. Модифицируемые и немодифицируемые факторы риска вальпроат-индуцированного расстройства пищевого поведения (адаптировано с изменениями из [33])
Table 1. Modifiable and non-modifiable risk factors for valproate-induced eating behaviour disorder (adapted with changes from [33])
|
Модифицируемые факторы риска / Modifiable risk factors |
Немодифицируемые факторы риска / Non-modifiable risk factors |
|
Возраст начала терапии ВК или ее соединениями / Age of onset for VPA or its compounds therapy |
Возраст (дети и подростки) / Age (children and adolescents) |
|
Высокая доза препаратов ВК или ее соединений / High-dose VPA or its compounds therapy |
Пол (женский) / Sex (female) |
|
Длительный прием ВК или ее соединений / Long-term VPA or its compounds therapy |
Раса (этнос) / Race (ethnicity) |
|
Политерапия (одновременный прием ≥2 ПЭП) / Polytherapy (simultaneous use of ≥2 AEDs) |
Генетическая предрасположенность (полиморфизмы генов NPY, GHRL, LEP, MC4R, DRD2, DRD4, ANKK1, DAT1, SLC6A4, OPRM1, BNDF, FTO, GR, NTRK2, COMT, ESR1, CNR1 и др.) / Genetic predisposition (gene polymorphisms: NPY, GHRL, LEP, MC4R, DRD2, DRD4, ANKK1, DAT1, SLC6A4, OPRM1, BNDF, FTO, GR, NTRK2, COMT, ESR1, CNR1, etc.) |
|
Полипрагмазия (одновременный прием ≥5 ЛС) / Polypragmasy (simultaneous use of ≥5 drugs) |
Внутриутробное воздействие высокого уровня кортизола в результате материнского стресса / In utero exposure to high cortisol levels due to maternal stress |
|
Питание (кратность питания, объем порций, пищевые предпочтения) / Nutrition (frequency of meals, portion sizes, food preferences) |
Раннее половое созревание / Precocious puberty |
|
Низкая физическая активность и длительный постельный режим / Low physical activity and prolonged bed rest |
Задержка интеллектуального развития, когнитивные расстройства, низкий уровень образования / Retarded intellectual development, cognitive impairment, low education level |
|
Микробиота кишечника (дисбиоз кишечных микроорганизмов) / Gut microbiota (dysbiosis of intestinal microorganisms) |
Личностные особенности больного эпилепсией (перфекционизм, одержимость, импульсивность) / Personality traits of epilepsy patient (perfectionism, obsession, impulsiveness) |
|
Взаимоотношения больного эпилепсией с членами семьи (мнение членов семьи о том, что у пациента низкий вес, давление с их стороны в отношении питания пациента) / Relationships between a patient with epilepsy and family members (family members' opinion that a patient is underweight, pressure from them regarding a patient's diet) |
Коморбидные заболевания эндокринной системы (сахарный диабет, гипотиреоз, гипертиреоз) / Endocrine comorbidities (diabetes mellitus, hypothyroidism, hyperthyroidism) |
|
Социально-экономический статус (отсутствие продуктовой безопасности, приводящее к перееданию, привычки питания в семье, приводящие к перееданию, гиперопека со стороны членов семьи) / Socioeconomic status (food insecurity leading to overeating, family eating habits leading to overeating, overprotectiveness by family members) |
Коморбидные психические расстройства (компульсивно-импульсивное расстройство, посттравматическое стрессовое расстройство, социальное тревожное расстройство, пограничное расстройство личности, биполярное расстройство, депрессивное расстройство) / Mental comorbidities (compulsive-impulsive disorder, post-traumatic stress disorder, social anxiety disorder, borderline personality disorder, bipolar disorder, depressive disorder) |
|
Эмоциональное насилие (опыт детских травм и жестокого обращения) / Emotional abuse (experience of childhood trauma and abuse) |
Коморбидные аутоиммунные заболевания (воспалительные заболевания желудочно-кишечного тракта) / Autoimmune comorbidities (gastrointestinal tract inflammatory diseases) |
Примечание. ВК – вальпроевая кислота; ПЭП – противоэпилептический препарат; ЛС – лекарственное средство.
Note. VPA – valproic acid; AEDs – antiepileptic drugs.
Таблица 2. Критерии диагностики расстройства пищевого поведения, связанного с перееданием [52]
Table 2. Diagnostic criteria for eating behaviour disorder associated with overeating [52]
|
Критерий / Criteria |
Характеристики / Characteristics |
|
Критерий 1 / Criterion 1 |
Повторяющиеся эпизоды переедания. Эпизод переедания характеризуется следующим / Recurrent episodes of binge eating. An episode of binge eating is characterized by both of the following: а) еда в дискретный период времени (например, в течение любого 2-часового периода); количество пищи, которое больше, чем большинство людей ели бы в аналогичный период времени при аналогичных обстоятельствах / eating in a discrete period of time (e.g., within any 2-hour period), an amount of food that is definitely larger than most people would eat in a similar period of time under similar circumstances; b) чувство отсутствия контроля над едой во время эпизода (например, ощущение, что нельзя перестать есть или контролировать, что или сколько пациент ест) / the sense of lack of control over eating during the episode (e.g., a feeling that one cannot stop eating or control what or how much one is eating) |
|
Критерий 2 / Criterion 2 |
Эпизоды переедания связаны с тремя (или более) следующими критериями / Binge-eating episodes are associated with three (or more) of the following: а) употребление пищи гораздо быстрее, чем обычно / eating much more rapidly than normal; b) употребление пищи до тех пор, пока пациент не почувствует себя некомфортно сытым (переедание) / eating until feeling uncomfortably full; c) употребление большого количества пищи, когда пациент не чувствует физического голода / eating large amounts of food when not feeling physically hungry; d) употребление пищи в одиночестве из-за того, что пациенту стыдно за то, сколько он ест / eating alone because of being embarrassed by how much one is eating; e) чувство отвращения к себе, депрессия или чувство вины после переедания / feeling disgusted with oneself, depressed, or very guilty after overeating |
|
Критерий 3 / Criterion 3 |
Отмечаются неприятные чувства (стыд, грусть, вина и т.д.), связанные с перееданием / Marked distress regarding binge eating is present |
|
Критерий 4 / Criterion 4 |
В среднем происходит переедание / The binge eating occurs, on average: а) не менее 2 дней в неделю в течение 6 мес (критерии частоты и продолжительности DSM-4) / at least 2 days a week for 6 months (DSM-4 frequency and duration criteria); b) не менее 1 дня в неделю в течение 3 мес (критерии частоты и продолжительности DSM-5) / at least 1 day a week for 3 months (DSM-5 frequency and duration criteria) |
|
Критерий 5 / Criterion 5 |
Регулярное употребление пищи не связано с регулярным использованием ненадлежащего компенсаторного поведения (например, чистка, голодание, чрезмерные физические упражнения) и не происходит исключительно во время эпизода нервной анорексии или нервной булимии / The binge eating is not associated with the regular use of inappropriate compensatory behavior (e.g., purging, fasting, excessive exercise) and does not occur exclusively during the course of anorexia nervosa or bulimia nervosa |
|
Оценка / Severity grading |
DSM-4 не включает Шкалу оценки тяжести расстройства пищевого поведения / DSM-4 does not include a binge-eating disorder severity grading scale. Применимо только к DSM-5, тяжесть расстройства пищевого поведения оценивается следующим образом / Applicable to DSM-5 only, binge-eating disorder severity is graded as follows: – легкое: от 1 до 3 эпизодов в неделю / mild: 1 to 3 episodes per week; – умеренное: от 4 до 7 эпизодов в неделю / moderate: 4 to 7 episodes per week; – тяжелое: от 8 до 13 эпизодов в неделю / severe: 8 to 13 episodes per week; – экстремальное: 14 и более эпизодов в неделю / extreme: 14 or more episodes per week |
Примечание. DSM (англ. Diagnostic and Statistical Manual of Mental Disorders) – Диагностическое и статистическое руководство по психическим расстройствам.
Note. DSM – Diagnostic and Statistical Manual of Mental Disorders.
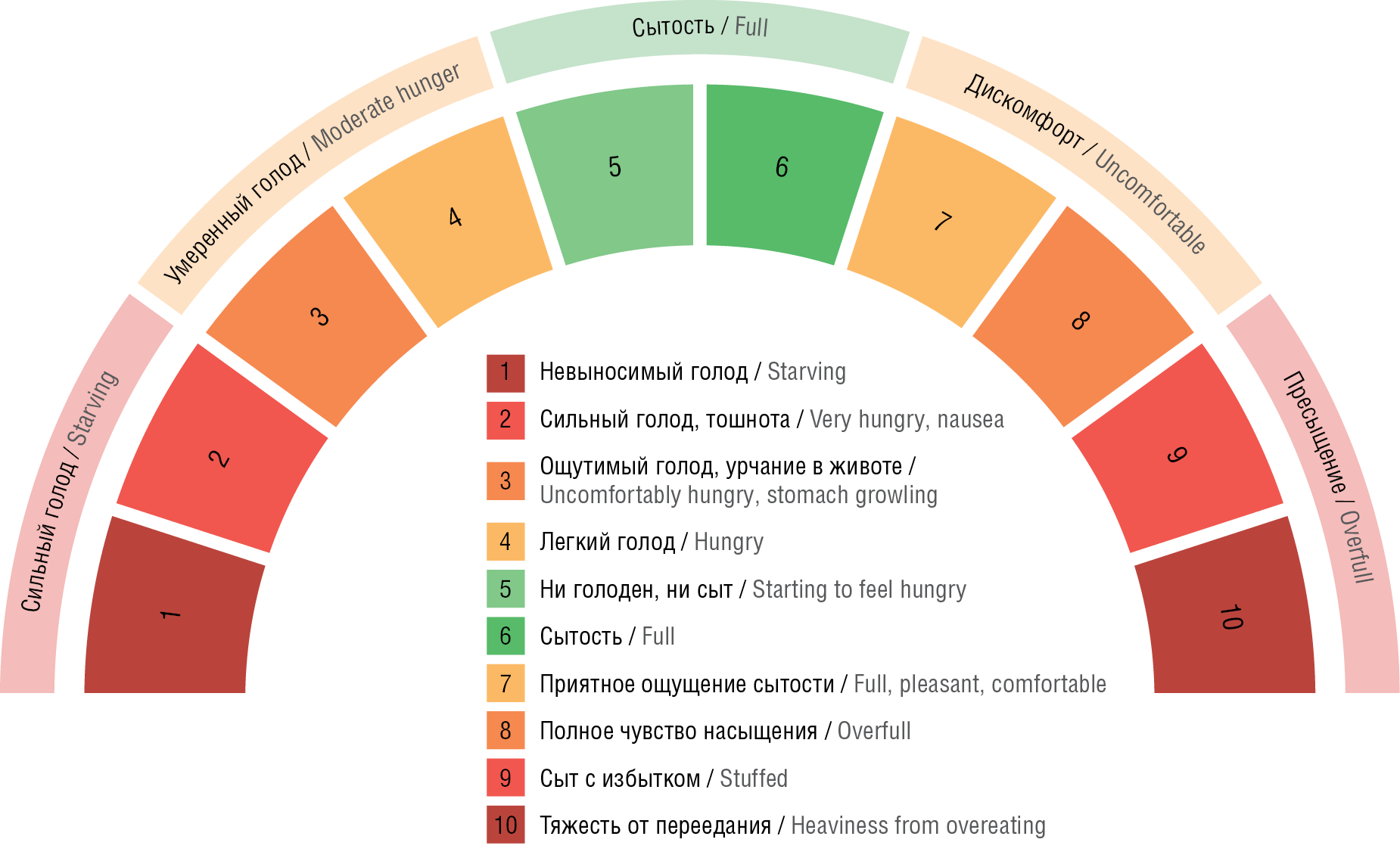
Рисунок 1. Шкала голода и насыщения (сытости) [53][54]
Figure 1. Hunger-Satiety Scale [53][54]
Таблица 3. Таблица интуитивного питания
Table 3. Intuitive Eating Chart
Важность ранней диагностики и своевременной коррекции ВК-РПП у пациентов, страдающих эпилепсией, заключается в прогнозировании и снижении риска развития ВК-МетС. Известные критерии МетС (согласно Консенсусу Экспертов по междисциплинарному подходу к ведению, диагностике и лечению больных с метаболическим синдромом) у взрослых включают [55]:
А) основной признак – центральный (абдоминальный) тип ожирения (окружность талии >80 см у женщин и >94 см у мужчин);
Б) дополнительные критерии:
– артериальная гипертония (артериальное давление ≥140/90 мм рт. ст.),
– повышение уровня ТГ (≥1,7 ммоль/л),
– снижение уровня холестерина, связанного с ЛПВП (<1,0 ммоль/л у мужчин, <1,2 ммоль/л у женщин),
– повышение уровня холестерина, связанного с ЛПНП (>3,0 ммоль/л),
– гипергликемия натощак (глюкоза в плазме крови натощак ≥6,1 ммоль/л),
– нарушение толерантности к глюкозе (глюкоза в плазме крови через 2 ч после нагрузки глюкозой в пределах ≥7,8 и ≤11,1 ммоль/л).
В свою очередь, критерии МетС международной группы экспертов по выявлению, оценке и лечению повышенного уровня холестерина в крови у взрослых (англ. Adult Treatment Panel III), а также Американской ассоциации кардиологов (англ. American Heart Association) и Национального института сердца, легких и крови (англ. National Heart, Lung, and Blood Institute) включают [56][57]:
– окружность талии >102 см для мужчин, >88 см для женщин4;
– уровень артериального давления ≥130/85 мм рт. ст.;
– лабораторные показатели ЛПВП <1,04 ммоль/л, ТГ ≥1,7 ммоль/л, глюкозы ≥5,6 ммоль/л.
В Консенсусе Экспертов по междисциплинарному подходу к ведению, диагностике и лечению больных с метаболическим синдромом [55] указано, что наличие у пациента центрального ожирения и двух из дополнительных критериев (лабораторные показатели и/или артериальная гипертония) является основанием для диагностирования у него МетС. Однако в проанализированных нами исследованиях авторы не учитывали критерий абдоминального ожирения, который служит главной составляющей в диагностике МетС в целом и ВК-МетС в частности у пациентов с ВК-РПП. Вместо этого использовался ИМТ, который не включен ни в российские, ни в зарубежные критерии МетС [58].
CONCLUSION / ЗАКЛЮЧЕНИЕ
Представленный обзор демонстрирует, что ВК-РПП у пациентов с эпилепсией требует своевременной диагностики, поскольку может стать причиной ВК-МетС. Важно формирование правильных привычек питания у детей, подростков и взрослых, страдающих эпилепсией, что может повысить их комплаентность к терапии ВК и снизить вероятность развития ВК-РПП, увеличения веса и ВК-МетС.
Наряду с известными клиническими и лабораторными критериями диагностики ВК-РПП и ВК-МетС NPY является важным биомаркером, поскольку исследования последних лет убедительно продемонстрировали, что этот нейропептид участвует в регуляции пищевого поведения у больных эпилепсией. В частности, в проанализированных нами исследованиях показана взаимосвязь между монотерапией ВК, повышением сывороточного уровня NPY и увеличением массы тела у пациентов с эпилепсией. Дальнейшие исследования взаимосвязи NPY как биологического маркера ВК-РПП и ВК-индуцированного увеличения веса будут способствовать улучшению качества ранней диагностики и профилактики ВК-МетС у взрослых и детей, страдающих эпилепсией.
1. НОМА-IR (англ. Homeostasis Model Assessment of Insulin Resistance) – модель гомеостаза для оценки инсулинорезистентности.
2. https://in.pinterest.com/pin/535576580688560597/.
3. https://online.synchronize.ru/check-list.
4. Для сравнения: критерии Управления по контролю качества пищевых продуктов и лекарственных средств США (англ. US Food and Drug Administration): >94 см для мужчин, >80 см для женщин.
Список литературы
1. LaCaille L. Eating behavior. In: Gellman M.D., Turner J.R. (Eds.) Encyclopedia of behavioral medicine. Springer; 2013: 641–2. https://doi.org/10.1007/978-1-4419-1005-9_1613.
2. Stubbs R.J. Controlling appetite and food intake by regulating eating frequency and timing. In: Gill T. (Ed.) Managing and preventing obesity: behavioural factors and dietary interventions. Woodhead Publishing; 2014: 149–65. https://doi.org/10.1533/9781782420996.3.149.
3. Reichenberger J., Schnepper R., Arend A.K., Blechert J. Emotional eating in healthy individuals and patients with an eating disorder: evidence from psychometric, experimental and naturalistic studies. Proc Nutr Soc. 2020; 79 (3): 290–9. https://doi.org/10.1017/S0029665120007004.
4. Ha O.R., Lim S.L. The role of emotion in eating behavior and decisions. Front Psychol. 2023; 14: 1265074. https://doi.org/10.3389/fpsyg.2023.1265074.
5. Aoun C., Nassar L., Soumi S., et al. The cognitive, behavioral, and emotional aspects of eating habits and association with impulsivity, chronotype, anxiety, and depression: a cross-sectional study. Front Behav Neurosci. 2019; 13: 204. https://doi.org/10.3389/fnbeh.2019;00204.
6. Kakoschke N., Aarts E., Verdejo-García A. The cognitive drivers of compulsive eating behavior. Front Behav Neurosci. 2019; 12: 338. https://doi.org/10.3389/fnbeh.2018.00338.
7. Becuţ A.G., Puerto K.L. Introduction. Food history and identity: food and eating practices as elements of cultural heritage, identity and social creativity. Int Rev Soc Res. 2017; 7 (1): 1–4. https://doi.org/10.1515/irsr-2017-0001.
8. Asamane E.A., Greig C.A., Aunger J.A., Thompson J.L. Perceptions and factors influencing eating behaviours and physical function in community-dwelling ethnically diverse older adults: a longitudinal qualitative study. Nutrients. 2019; 11 (6): 1224. https://doi.org/10.3390/nu11061224.
9. Marzola E., Musso M., Abbate-Daga G. Psychotropic drug-induced disordered eating behaviors. In: Manzato E., Cuzzolaro M., Donini M.L. (Eds.) Hidden and lesser-known disordered eating behaviors in medical and psychiatric conditions. Springer; 2021: 77–86. https://doi.org/10.1007/978-3-030-81174-7_8.
10. Del Parigi A. Chapter 20 – Neuroanatomical correlates of hunger and satiaty in lean and obese individuals. In: Dube L., Bechara A., Dagher A., et al. (Eds.) Obesity prevention: the role of brain and society on individual behavior. Academic Press; 2010: 253–9. https://doi.org/10.1016/B978-0-12-374387-9.00020-9.
11. Shnayder N.A., Grechkina V.V., Trefilova V.V., et al. Valproate-induced metabolic syndrome. Biomedicines. 2023; 11 (5): 1499. https://doi.org/10.3390/biomedicines11051499.
12. Шнайдер Н.А., Гречкина В.В., Архипов В.В., Насырова Р.Ф. Фармакогенетически-информированная фармакометаболомика как инновационный подход к оценке безопасности и риска фармакотерапии препаратами вальпроевой кислоты. Безопасность и риск фармакотерапии. 2023; 11 (4): 450–62. https://doi.org/10.30895/2312-7821-2023-386.
13. Balcı T., Çakır Biçer N., Gazeteci Tekin H., Edem P. Evaluation of the effect of parenting style and parental mealtime actions on the eating behavior of children with epilepsy. Nutrients. 2024; 16 (9): 1384. https://doi.org/10.3390/nu16091384.
14. Podlesak A.K., Mozer M.E., Smith-Simpson S., et al. Associations between parenting style and parent and toddler mealtime behaviors. Curr Dev Nutr. 2017; 1 (6): e000570. https://doi.org/10.3945/cdn.117.000570.
15. Vaughn A.E., Ward D.S., Fisher J.O., et al. Fundamental constructs in food parenting practices: a content map to guide future research. Nutr Rev. 2016; 74 (2): 98–117. https://doi.org/10.1093/nutrit/nuv061.
16. Beck B. Neuropeptide Y in normal eating and in genetic and dietary-induced obesity. Philos Trans R Soc Lond B Biol Sci. 2006; 361 (1471): 1159–85. https://doi.org/10.1098/rstb.2006.1855.
17. Shende P., Desai D. Physiological and therapeutic roles of neuropeptide Y on biological functions. Adv Exp Med Biol. 2020; 1237: 37–47. https://doi.org/10.1007/5584_2019_427.
18. Tatemoto K., Carlquist M., Mutt V. Neuropeptide Y – a novel brain peptide with structural similarities to peptide YY and pancreatic polypeptide. Nature. 1982; 296 (5858): 659–60. https://doi.org/10.1038/296659a0.
19. Allen Y.S., Adrian T.E., Allen J.M., et al. Neuropeptide Y distribution in the rat brain. Science. 1983; 221 (4613); 877–9. https://doi.org/10.1126/science.6136091.
20. Mörl K., Beck-Sickinger A.G. Intracellular trafficking of neuropeptide Y receptors. Prog Mol Biol Transl Sci. 2015; 132: 73–96. https://doi.org/10.1016/bs.pmbts.2015.02.011.
21. Болотова Н.В., Курдиян М.С., Филина Н.Ю. Нейроэндокринные механизмы регуляции пищевого поведения (обзор). Саратовский научно-медицинский журнал. 2020; 16 (3): 707–13.
22. Kienast С., Gunga H.C., Steinach M. Neuropeptide Y – its role in human performance and extreme environments. Reach. 2019; 14–15: 100032. https://doi.org/10.1016/j.reach.2019.100032.
23. Загоскин П.П., Загоскина И.П., Савельева Н.А., Ляляев В.А. Современные подходы к проблеме регуляции массы тела (обзор). Современные технологии в медицине. 2014; 6 (3): 104–17.
24. Chen G., Yang F., Wu T., et al. The stimulatory effect of cerebral intraventricular injection of cNPY on precocial feeding behavior in neonatal chicks (Gallus domesticus). PLoS One. 2016; 11 (4): e0153342. https://doi.org/10.1371/journal.pone.0153342.
25. Levens N., Félétou M., Galizzi J., et al. NPY effects on food intake and metabolism. In: Michel M.C. (Ed.) Neuropeptide Y and related peptides. Springer; 2004: 283–325. https://doi.org/10.1007/978-3-642-18764-3_10.
26. Rafiei N., Mitchell C.S., Tedesco C.R., et al. Chemogenetic activation of arcuate nucleus NPY and NPY/AgRP neurons increases feeding behaviour in mice. Neuropeptides. 2024; 107: 102454. https://doi.org/10.1016/j.npep.2024.102454.
27. Senthilkumaran M., Koch C., Herselman M.F., Bobrovskaya L. Role of the adrenal medulla in hypoglycaemia-associated autonomic failure – a diabetic perspective. Metabolites. 2024; 14 (2): 100. https://doi.org/10.3390/metabo14020100.
28. Kumari R., Pascalau R., Wang H., et al. Sympathetic NPY controls glucose homeostasis, cold tolerance, and cardiovascular functions in mice. bioRxiv. 2023: 2023.07.24.550381. https://doi.org/10.1101/2023.07.24.550381.
29. Schwetz T.A., Ustione A., Piston D.W. Neuropeptide Y and somatostatin inhibit insulin secretion through different mechanisms. Am J Physiol Endocrinol Metab. 2013; 304 (2): E211–21. https://doi.org/10.1152/ajpendo.00374.2012.
30. Lee N.J., Oraha J., Qi Y., et al. Altered function of arcuate leptin receptor expressing neuropeptide Y neurons depending on energy balance. Mol Metab. 2023; 76: 101790. https://doi.org/10.1016/j.molmet.2023.101790.
31. Rauchenzauner M., Haberlandt E., Scholl-Bürgi S., et al. Adiponectin and visfatin concentrations in children treated with valproic acid. Epilepsia. 2008; 49 (2): 353–7. https://doi.org/10.1111/j.1528-1167.2007.01460.x.
32. Sidhu H.S., Srinivas R., Sadhotra A. Evaluate the effects of long-term valproic acid treatment on metabolic profiles in newly diagnosed or untreated female epileptic patients: a prospective study. Seizure. 2017; 48: 15–21. https://doi.org/10.1016/j.seizure.2017.03.007.
33. Barakat S., McLean S.A., Bryant E., et al. Risk factors for eating disorders: findings from a rapid review. J Eat Disord. 2023; 11 (1): 8. https://doi.org/10.1186/s40337-022-00717-4.
34. Brennan A.M., Mantzoros C.S. Drug insight: the role of leptin in human physiology and pathophysiology – emerging clinical applications. Nat Clin Pract Endocrinol Metab. 2006; 2 (6): 318–27. https://doi.org/10.1038/ncpendmet0196.
35. Aydin K., Serdaroglu A., Okuyaz C., et al. Serum insulin, leptin, and neuropeptide Y levels in epileptic children treated with valproate. J Child Neurol. 2005; 20 (10): 848–51. https://doi.org/10.1177/08830738050200101501.
36. Rauchenzauner M., Haberlandt E., Scholl-Bürgi S., et al. Effect of valproic acid treatment on body composition, leptin and the soluble leptin receptor in epileptic children. Epilepsy Res. 2008; 80 (2–3): 142–9. https://doi.org/10.1016/j.eplepsyres.2008.03.017.
37. Kanemura H., Sano F., Maeda Y., et al. Valproate sodium enhances body weight gain in patients with childhood epilepsy: a pathogenic mechanisms and open-label clinical trial of behavior therapy. Seizure. 2012; 21 (7): 496–500. https://doi.org/10.1016/j.seizure.2012.05.001.
38. Qiao L., Schaack J., Shao J. Suppression of adiponectin gene expression by histone deacetylase inhibitor valproic acid. Endocrinology. 2006; 147 (2): 865–74. https://doi.org/10.1210/en.2005-1030.
39. Elmslie J.L., Porter R.J., Joyce P.R., et al. Comparison of insulin resistance, metabolic syndrome and adiponectin in overweight bipolar patients taking sodium valproate and controls. Aust N Z J Psychiatry. 2009; 43 (1): 53–60. https://doi.org/10.1080/00048670802534341.
40. Aly R.H., Amr N.H., Saad W.E., Megahed A.A. Insulin resistance in patients on valproic acid: relation to adiponectin. Acta Neurol Scand. 2015; 131 (3): 169–75. https://doi.org/10.1111/ane.12313.
41. Abdalla M.M.I. Role of visfatin in obesity-induced insulin resistance. World J Clin Cases. 2022; 10 (30): 10840–51. https://doi.org/10.12998/wjcc.v10.i30.10840.
42. Abdalla I.M.M. Ghrelin – physiological functions and regulation. Eur Endocrinol. 2015; 11 (2): 90–5. https://doi.org/10.17925/EE.2015.11.02.90.
43. Wang L., Su Z., Li Y.C., et al. Relationship of glucagon-like peptide 1 and peptide YY with catch-up growth in children born small for gestational age. J Clin Res Pediatr Endocrinol. 2024; 16 (1): 69–75. https://doi.org/10.4274/jcrpe.galenos.2023.2023-5-21.
44. Martin C.K., Han H., Anton S.D., et al. Effect of valproic acid on body weight, food intake, physical activity and hormones: results of a randomized controlled trial. J Psychopharmacol. 2009; 23 (7): 814–25. https://doi.org/10.1177/0269881108091595.
45. Salehi M., Purnell J.Q. The role of glucagon-like peptide-1 in energy homeostasis. Metab Syndr Relat Disord. 2019; 17 (4): 183–91. https://doi.org/10.1089/met.2018.0088.
46. Shnayder N.A., Grechkina V.V., Khasanova A.K., et al. Therapeutic and toxic effects of valproic acid metabolites. Metabolites. 2023; 13 (1): 134. https://doi.org/10.3390/metabo13010134.
47. Lagrange A.H. Valproate enhances neuropeptide y expression: modulating the modulators. Epilepsy Curr. 2007; 7 (4): 107–9. https://doi.org/10.1111/j.1535-7511.2007.00167.x.
48. Torlasco M.B., Estrin M.A. Valproic acid and weight gain in patients receiving antiepileptic treatment: a systematic review. Rev Inform Cientif. 2023; 102: 1–16 (in Spanish). https://doi.org/10.5281/zenodo.7843532.
49. Cansu A., Serdaroglu A., Camurdan O., et al. Serum insulin, cortisol, leptin, neuropeptide Y, galanin and ghrelin levels in epileptic children receiving valproate. Horm Res Paediatr. 2011; 76 (1): 65–71. https://doi.org/10.1159/000327367.
50. Tokgoz H., Aydin K., Oran B., Kiyici A. Plasma leptin, neuropeptide Y, ghrelin, and adiponectin levels and carotid artery intima media thickness in epileptic children treated with valproate. Childs Nerv Syst. 2012; 28 (7): 1049–53. https://doi.org/10.1007/s00381-012-1788-7.
51. Çiçek N.P., Kamaşak T., Serin M., et al. The effects of valproate and topiramate use on serum insulin, leptin, neuropeptide Y and ghrelin levels in epileptic children. Seizure. 2018; 58: 90–5. https://doi.org/10.1016/j.seizure.2018.03.013.
52. Berkman N.D., Brownley K.A., Peat C.M., et al. Management and outcomes of binge-eating disorder. Rockville (MD): Agency for Healthcare Research and Quality (US); 2015. Available at: https://www.ncbi.nlm.nih.gov/books/NBK338301/ (accessed 15.07.2024).
53. The hunger-satiety scale. Available at: https://uhs.berkeley.edu/sites/default/files/wellness-hungersatietyscale.pdf (accessed 15.07.2024).
54. Paravidino V.B., Mediano M.F.F., Silva I.C.M., et al. Effect of physical exercise on spontaneous physical activity energy expenditure and energy intake in overweight adults (the EFECT study): a study protocol for a randomized controlled trial. Trials. 2018; 19 (1): 167. https://doi.org/10.1186/s13063-018-2445-6.
55. Консенсус Экспертов по междисциплинарному подходу к ведению, диагностике и лечению больных с метаболическим синдромом. Кардиоваскулярная терапия и профилактика. 2013; 12 (6): 41–81.
56. Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults. Executive Summary of the Third Report of the National Cholesterol Education Program (NCEP) Expert Panel on Detection, Evaluation, and Treatment of High Blood Cholesterol in Adults (Adult Treatment Panel III). JAMA. 2001; 285 (19): 2486–97. https://doi.org/10.1001/jama.285.19.2486.
57. Grundy S.M., Cleeman J.I., Daniels S.R., et al. Diagnosis and management of the metabolic syndrome: an American Heart Association/National Heart, Lung, and Blood Institute Scientific Statement. Circulation. 2005; 112 (17): 2735–52. https://doi.org/10.1161/CIRCULATIONAHA.105.169404.
58. Neznanov N.G. A paradigm shift to treat psychoneurological disorders. Personalized Psychiatry and Neurology. 2021; 1 (1): 1–2.
Об авторах
Н. А. ШнайдерРоссия
Шнайдер Наталья Алексеевна - д.м.н., проф.
ул. Бехтерева, д. 3, Санкт-Петербург, 192019; ул. Партизана Железняка, д. 1, Красноярск, 660022
WoS ResearcherID M-7084-2014, Scopus Author ID 24503222300
В. В. Гречкина
Россия
Гречкина Виолетта Владимировна.
ул. Бехтерева, д. 3, Санкт-Петербург, 192019; наб. Обводного канала, д. 9И, Санкт-Петербург, 191167
Scopus Author ID 58076147700
М. Я. Киссин
Россия
Киссин Михаил Яковлевич - д.м.н., проф.
наб. Обводного канала, д. 9И, Санкт-Петербург, 191167; ул. Льва Толстого, д. 6-8, Санкт-Петербург, 197022
Д. В. Дмитренко
Россия
Дмитренко Диана Викторовна - д.м.н.
ул. Партизана Железняка, д. 1, Красноярск, 660022
WoS ResearcherID H-7787-2016
Р. Ф. Насырова
Россия
Насырова Регина Фаритовна - д.м.н.
ул. Бехтерева, д. 3, Санкт-Петербург, 192019; пр-т Ленина, д. 92, Тула, 300012
WoS ResearcherID H-7787-2016
Рецензия
Для цитирования:
Шнайдер Н.А., Гречкина В.В., Киссин М.Я., Дмитренко Д.В., Насырова Р.Ф. Роль нейропептида Y в развитии вальпроат-индуцированного расстройства пищевого поведения. Эпилепсия и пароксизмальные состояния. 2024;16(4):349-361. https://doi.org/10.17749/2077-8333/epi.par.con.2024.207
For citation:
Shnayder N.A., Grechkina V.V., Kissin M.Ya., Dmitrenko D.V., Nasyrova R.F. Role of neuropeptide Y in development of valproate-induced eating behaviour disorder. Epilepsy and paroxysmal conditions. 2024;16(4):349-361. https://doi.org/10.17749/2077-8333/epi.par.con.2024.207
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.







































