Перейти к:
Систематический анализ молекулярных механизмов действия эссенциальных макро- и микронутриентов на нейротрансмиттерную и вазодилататорную молекулу оксида азота (NO)
https://doi.org/10.17749/2077-8333/epi.par.con.2024.208
Аннотация
Поддержание надлежащих уровней оксида азота (NO) в крови и других тканях организма необходимо для регуляции тонуса сосудов, артериального давления, обеспечения обмена кислорода и функции эндотелия. NO также участвует в регуляции баланса возбуждающей (глутамат) и тормозящей (гамма-аминомасляная кислота) нейротрансмиссии. Нутриентные факторы оказывают существенное влияние на обмен NO. Систематический компьютерный анализ 26 103 публикаций с применением топологического подхода к распознаванию позволил выделить наиболее важные направления клинических исследований взаимосвязей между обменом NO и нутриентами: выработка NO из аргинина посредством NO-синтетазы, нитратосодержащие продукты, фолаты и витамин В12 в гомеостазе NO (включая эффекты модификаций молекулы витамина В12), другие витамины группы В (В1, В2, В7), витамины-антиоксиданты (С и Е), гормоноподобные витамины D3 и А, электролиты магний и кальций, участие микробиома в выработке NO.
Ключевые слова
Для цитирования:
Громова О.А., Торшин И.Ю. Систематический анализ молекулярных механизмов действия эссенциальных макро- и микронутриентов на нейротрансмиттерную и вазодилататорную молекулу оксида азота (NO). Эпилепсия и пароксизмальные состояния. 2024;16(4):385-401. https://doi.org/10.17749/2077-8333/epi.par.con.2024.208
For citation:
Gromova O.A., Torshin I.Yu. Systematic analysis of molecular mechanisms of action of essential macro- and micronutrients on the neurotransmitter and vasodilator molecule nitric oxide (NO). Epilepsy and paroxysmal conditions. 2024;16(4):385-401. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2024.208
ВВЕДЕНИЕ / INTRODUCTION
Оксид азота (NO) – сигнальная молекула, которая играет важную роль во множестве физиологических процессов, включая регуляцию сосудистого тонуса, нейротрансмиссию, митохондриальное дыхание и сократительную функцию скелетных мышц [1]. Молекулы NO поддерживают приток крови к скелетным мышцам при физической нагрузке, проявляют нейромедиаторные свойства, защищают от вирусной и бактериальной агрессии, регулируют хроническое воспаление при ожирении, сахарном диабете 2-го типа (СД2). Продукция NO макрофагами обусловливает неспецифический иммунный ответ, регулирует процессы апоптоза, ферроптоза, аутофагии и функции митохондрий, необходима для посттрансляционного нитрозилирования ряда белков протеома [2].
Кроме того, NO как сигнальная молекула, участвующая в атипичных формах межклеточных коммуникаций, способна осуществлять сильную функциональную модуляцию нескольких нейротрансмиттерных систем. В частности, NO сильно влияет на поддержание баланса между возбуждающим нейротрансмиттером глутаматом (в основном через рецепторы N-метил-D-аспартата (англ. N-methyl-D-aspartate, NMDA) и тормозящим нейротрансмиттером гамма-аминомасляной кислотой (ГАМК) (рецепторы ГАМКA). Тонкий баланс между глутаматом и ГАМК, обусловливающий нормофизиологическое состояние нервных клеток, нарушается как при избытке, так и при недостатке выработки NO, стимулируя развитие гипервозбудимости [3]. Поэтому диетические, фармакологические и нутрицевтические подходы, нормализующие гомеостаз NO, весьма перспективны не только для лечения эндотелиопатии, но и для восстановления нарушений нейротрансмиттерного баланса при гипервозбудимости.
После того как молекулы NO вырабатываются в крови, в течение миллисекунд они, взаимодействуя с гемоглобином, проникают в сосудистые гладкомышечные клетки и аллостерически связываются с гуанилатциклазой, которая синтезирует сигнальную молекулу циклического гуанинмонофосфата (цГМФ). В свою очередь, цГМФ активирует протеинкиназу G, которая модулирует расслабление гладких мышц посредством: активации калиевых каналов, снижения внутриклеточной концентрации ионов кальция и активации фосфатазы легкой цепи миозина [4].
В норме организм быстро откликается на внутренние и внешние стимулы и быстро производит необходимое и достаточное для жизнедеятельности количество NO в нужные моменты времени. Эндогенный синтез NO обеспечен работой семейства NO-синтаз из аргинина при участии ряда микронутриентных кофакторов, а также путем последовательного восстановления нитрата до нитрита и затем NO. Экзогенная поддержка NO происходит путем употребления в пищу нитрато- и нитритосодержащих продуктов. Цикл превращений «NO → нитрат → нитрит → NO → нитрат» происходит в организме постоянно, и запасы нитрата в организме могут быть увеличены посредством употребления продуктов, богатых нитратом (в частности, зеленых листовых овощей). Нитрат-ион (NO3–), содержащийся в широком спектре продуктов, служит физиологическим субстратом для синтеза NO [5].
Разграничение источников поступления экзогенных нитратов на «полезные» (овощи и фрукты, богатые антиоксидантами, флавоноидами и клетчаткой) и «вредные» (мясные деликатесы и копчености) достаточно сомнительно с научной точки зрения [5]. Очевидно, что в копченых и консервированных продуктах, попкорне, картофельных чипсах и т.д. содержатся сопутствующие вещества, никак не связанные с нитратом или нитритом: акриламиды, нитрозамины, бисфенол A, гидрогенизированные масла и пр., которые и повышают риск онкологических заболеваний. Поэтому утверждения о якобы «канцерогенности нитратов и нитритов» не выдерживают критики, особенно при принятии во внимание данных многочисленных исследований, указывающих на явные преимущества средиземноморского типа питания. Напомним, что такая разновидность диеты отличается обилием овощей, среди которых значительную долю занимают зеленолистные салаты, свекла, морковь, богатые нитратами [6].
В целом регуляция тонуса сосудов и артериального давления (АД) подразумевает необходимость интенсивного высвобождения необходимых количеств NO в определенные моменты времени. Для этого организм должен быть обеспечен всеми макро- и микронутриентами, важными для биосинтеза молекул NO: аргинином, нитратами, кофакторами ферментов биосинтеза NO и др. На фоне дефицита тех или иных нутриентных факторов высвобождение NO будет происходить в недостаточном количестве или недостаточно быстро, что и соответствует формированию эндотелиальной дисфункции.
Цель – систематизация информации об использовании микронутриентов и фармаконутрицевтиков как способа модуляции уровней NO на фоне патологии различных органов и систем организма.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Поиск публикаций / Search for publications
По запросу “nitric oxide” в базе биомедицинских публикаций PubMed/MEDLINE было найдено 198 480 статей, а по запросу “nitric oxide AND (vitamin OR vitamins OR magnesium OR zinc OR folate OR folic OR iron OR selenium OR copper OR calcium OR pyridoxine OR cyanocobalamin OR thiamine OR riboflavin OR niacin OR myoinositol OR D-chiroinositol OR PUFA OR polyunsaturated OR biotin OR coenzyme Q10 OR Dietary Supplements [MeSH Terms] OR Fruit and Vegetable Juices [MeSH Terms])” – 26 103 статьи по фундаментальным и клиническим исследованиям влияния микронутриентов на уровни NO.
Анализ публикаций / Analysis of publications
Для нахождения наиболее информативных ключевых слов проведено сравнение с контрольной выборкой из 26 103 текстов, случайно выбранных из 381 145 публикаций, найденных по запросу “Dose-Response Relationship, Drug [MeSH Terms] AND (Animals [MeSH Terms] OR Humans [MeSH Terms] OR Rats [MeSH Terms] OR Cells, Cultured [MeSH Terms]) NOT nitric NOT oxide”. Эти массивы публикаций анализировались с использованием комбинаторной теории разрешимости [7][8], топологического [9] и метрического подходов к анализу данных [10], которые были детально описаны в предыдущих работах [11].
Коротко, множества прецедентов включают описания объектов (текстов научной публикации), состоящие из признакового описания (слов и словосочетаний текста) и информации о принадлежности этого объекта к тому или иному классу (например, класс К1 – «публикации по теме», класс К2 – «контрольная выборка» и т.д.). Затем исследуется разрешимость поставленной задачи классификации текстов (т.е. непротиворечивость множеств прецедентов при заданном признаковом описании). Для эффективного установления выполнимости условия (1) вводится некоторый функционал информативности каждого признака относительно классов К1/К2 [12]. Вычисление условия разрешимости на множестве прецедентов и лежит в основе использованного метода классификации текстов.
В результате вычисления отбираются наиболее информативные признаки, гарантирующие разрешимость задачи классификации. Посредством вычисления расстояний Колмогорова между признаками получается метрическая конфигурация (матрица попарных расстояний между признаками), которая проецируется на плоскость методом многомерного шкалирования с получением метрической диаграммы. Затем проводится анализ метрической диаграммы, на которой отображены эти признаки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Кластеры терминов / Тerm сlusters
В результате проведенного анализа выделено 65 информативных биомедицинских терминов, отличающих публикации по NO и нутриентам от публикаций в контроле. Аннотация полученных терминов в соответствии с международной номенклатурой молекулярно-биологических процессов (англ. Gene Ontology, GO) позволила сформулировать комплекс молекулярных и физиологических эффектов влияния микронутриентов на NO (рис. 1).
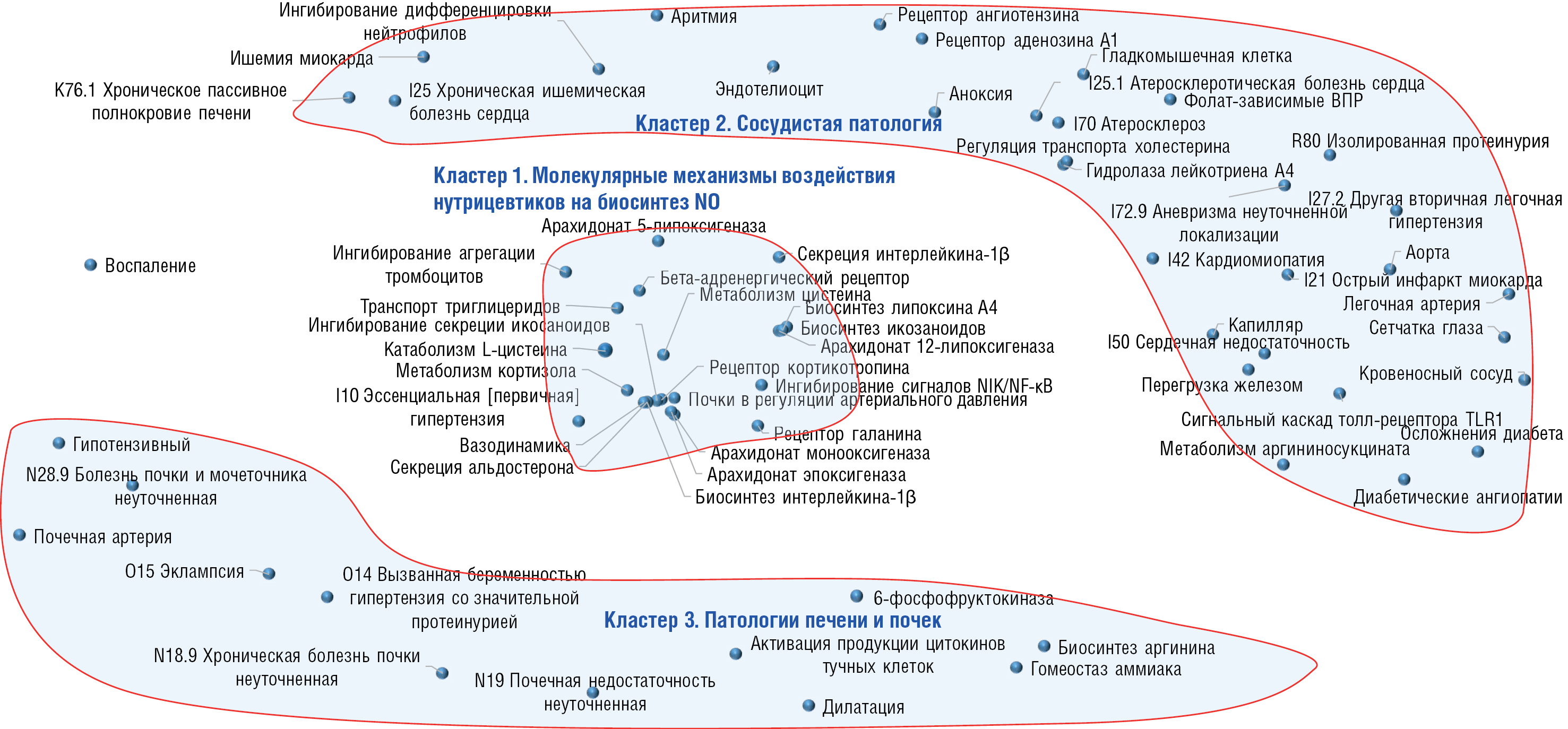
Рисунок 1. Метрическая диаграмма, отражающая карту взаимосвязей между микронутриентами и оксидом азота и терминами, описывающими клинические состояния пациентов. Диаграмма получена в результате систематического компьютерного анализа 26 103 публикаций как оптимальная проекция многомерной метрической конфигурации на плоскость. Расстояние между парой любых точек, соответствующей паре терминов, обратно пропорционально «взаимодействию» терминов, т.е. их совместной встречаемости в исследованной выборке публикаций (чем ближе две произвольные точки, тем чаще встречается совместное употребление терминов). Биологические активности по международной номенклатуре Gene Ontology (GO) приведены на рисунке без кодов
Figure 1. Metric diagram depicting a map of relationships between micronutrients and nitric oxide and terms describing patients’ clinical conditions. The diagram was obtained based on systematic computer analysis of 26,103 publications as an optimally projecting a multidimensional metric configuration onto a plane. The distance between any pair of points corresponding to a pair of terms is inversely proportional to the “interaction” of the terms – i.e., their joint occurrence in the studied sample of publications (the closer two arbitrary points, the more often the joint use of terms occurs). Biological activities according to the international Gene Ontology (GO) nomenclature are shown in the figure without codes
С помощью анализа метрических сгущений точек на диаграмме выделено три кластера терминов: центральный кластер 1 «Молекулярные механизмы воздействия нутрицевтиков на биосинтез NO» и два периферических кластера: кластер 2 «Сосудистая патология» и кластер 3 «Патологии печени и почек».
Кластер 1
В кластере 1 «Молекулярные механизмы воздействия нутрицевтиков на биосинтез NO» представлены наиболее информативные термины, связанные с регуляцией воспаления посредством простагландиновых, лейкотриеновых и хемокиновых механизмов (GO:0004051 Арахидонат 5-липоксигеназа, GO:0004052 Арахидонат 12-липоксигеназа, GO:0008391 Арахидонат монооксигеназа, GO:0008392 Арахидонат эпоксигеназа, GO:0046456 Биосинтез икозаноидов, GO:2001303 Биосинтез липоксина А4, GO:0050702 Секреция интерлейкина-1β, GO:0050720 Биосинтез интерлейкина-1β, GO:1901223 Ингибирование сигналов NIK/NF-κB), механизмами регуляции сосудистого тонуса (GO:1990029 Вазодинамика, GO:0003071 Почки в регуляции АД, GO:0004939 Бета-адренергический рецептор, GO:0004978 Рецептор кортикотропина, GO:0034650 Метаболизм кортизола, GO:0035932 Секреция альдостерона), обменом аминокислот и жиров (GO:0006534 Метаболизм цистеина, GO:0019448 Катаболизм L-цистеина, GO:0034197 Транспорт триглицеридов), гемодинамикой (GO:0090331 Ингибирование агрегации тромбоцитов) и нейропротекцией (GO:0004966 Рецептор галанина). Воздействие микронутриентов на NO может быть полезно в терапии гипертонии (I10 Эссенциальная [первичная] гипертензия).
Кластер 2
В кластер 2 «Сосудистая патология» входят термины, описывающие разнообразные молекулярные механизмы участия NO в регуляции АД и функции эндотелия сосудов (GO:0000053 Метаболизм аргининосукцината, GO:0001595 Рецептор ангиотензина, GO:0004463 Гидролаза лейкотриена А4, GO:0031686 Рецептор аденозина А1, GO:0032374 Регуляция транспорта холестерина, GO:0034130 Сигнальный каскад толл-рецептора TLR1, GO:0045659 Ингибирование дифференцировки нейтрофилов, перегрузка железом, фолаты), посредством которых микронутриенты могут влиять на кровеносные сосуды (гладкомышечная клетка, эндотелиоцит, аорта, сетчатка глаза, капилляр, легочная артерия). Соответственно, микронутриентные дефициты, нарушая обмен NO, будут приводить к тем или иным нарушениям сердечно-сосудистой системы (аноксия, аритмия, диабетические ангиопатии, I21 Острый инфаркт миокарда, I25 Хроническая ишемическая болезнь сердца, I42 Кардиомиопатия, I50 Сердечная недостаточность, I70 Атеросклероз, I25.1 Атеросклеротическая болезнь сердца, I72.9 Аневризма неуточненной локализации, I27.2 Другая вторичная легочная гипертензия).
Кластер 3
В кластере 3 «Патологии печени и почек» находятся термины, описывающие молекулярные механизмы дисфункции этих систем выведения на фоне нарушений обмена NO и микронутриентов (GO:0003872 6-фосфофруктокиназа, GO:0006526 Биосинтез аргинина, GO:0032765 Активация продукции цитокинов тучных клеток, GO:0097272 Гомеостаз аммиака), которые приводят к нарушениям вазодилатации почечных артерий, воспалению, патологиям печени (O14 Вызванная беременностью гипертензия со значительной протеинурией, O15 Эклампсия) и почек (N19 Почечная недостаточность неуточненная, N18.9 Хроническая болезнь почки неуточненная, N28.9 Болезнь почки и мочеточника неуточненная).
Направления клинических исследований / Directions of clinical research
Экспертный анализ терминов, представленных на рисунке 1, позволил выделить наиболее интересные, на наш взгляд, направления клинических исследований участия микронутриентов в гомеостазе оксида азота:
– выработка NO из аргинина посредством NO-синтетазы;
– нитратосодержащие продукты;
– фолаты и витамин В12 в гомеостазе NO, в т.ч. эффекты химических модификаций витамина В12 на NO;
– эффекты других витаминов группы В (В1, В2, В7), витаминов-антиоксидантов С и Е, гормоноподобных витаминов D3 и А;
– эффекты магния и кальция;
– участие микробиома в выработке NO.
Выработка NO из аргинина посредством NO-синтетазы
Прием аминокислоты L-аргинина пациентами с астмой приводит к увеличению концентрации NO (FeNO) в выдыхаемом воздухе на 5,5 ppb (англ. parts per billion – частица на 1 млрд) (95% доверительный интервал (ДИ) 3,5–7,5; р<0,001) через 60 мин после приема [12]. Дотации аргинина способствуют облегчению эндотелиальной дисфункции и снижению риска сосудистых осложнений СД2. Эпидемиологические данные свидетельствуют о том, что изменения биодоступности аргинина связаны с кардиометаболическим риском [13].
Принципиальная важность аргинина в обмене NO обусловлена тем, что данная аминокислота является субстратом одного из важнейших ферментов в биосинтезе NO – эндотелиальной NO-синтетазы (англ. endothelial NO synthetase, eNOS). Синтез NO в эндотелиоцитах сосудов регулируется прямым взаимодействием синтазы окиси азота с кальций-зависимым белком кальмодулином, что стимулирует биосинтез NO из L-аргинина. NO-синтетаза необычна тем, что требует сразу шести кофакторов, необходимых для синтеза NO (рис. 2):
– флавинадениндинуклеотид (ФАД) – производное витамина В2;
– флавинмононуклеотид (ФМН) – производное витамина В2;
– железосодержащий гем;
– никотинамидадениндинуклеотидфосфат (НАДФ) – производное витамина РР;
– тетрагидробиоптерин (BH4);
– кальций в составе кальмодулина.
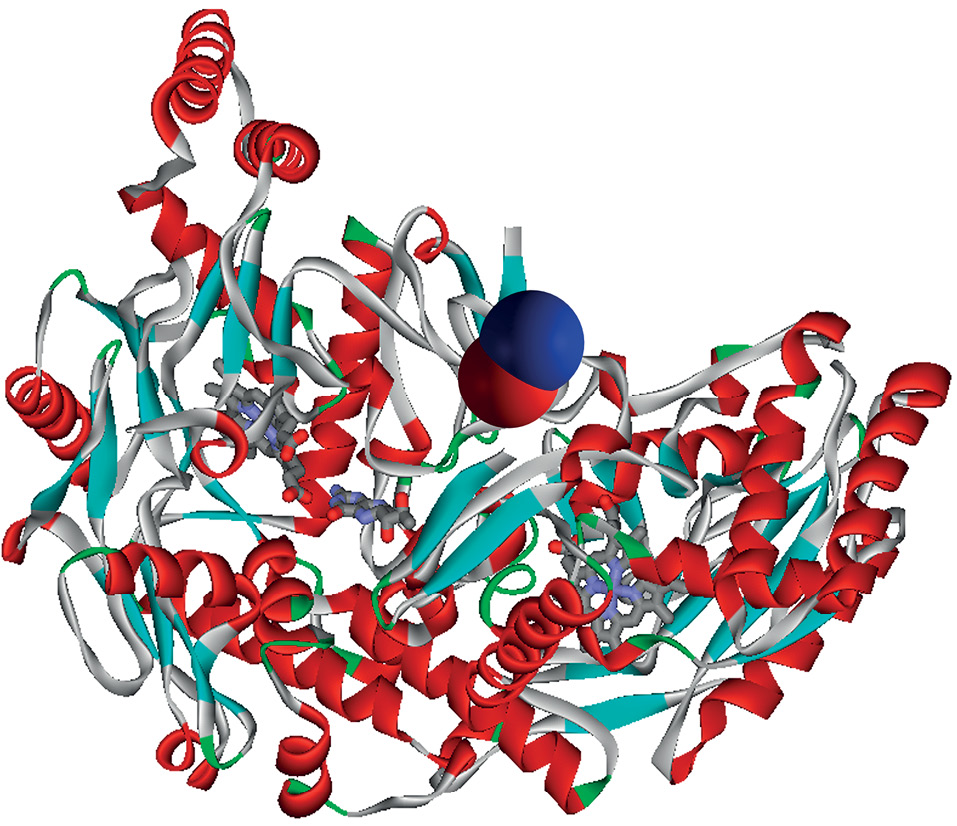
Рисунок 2. Пространственная структура синтетазы оксида азота с кофакторами (файл PDB 1nsi). В центре рисунка показана молекула оксида азота (синяя и красная сферы)
Figure 2. Spatial structure of nitric oxide synthetase with cofactors (PDB file 1nsi). The nitric oxide molecule is shown in the center of the figure (blue and red spheres)
Метаанализ 21 клинического исследования подтвердил связь между аргинином и фолатным метаболизмом, в котором участвуют витамины B6 и B12. У пациентов с хронической обструктивной болезнью легких (ХОБЛ) наблюдались значительно более низкие уровни фолатов (p=0,009) и более высокие уровни гомоцистеина (p<0,001), асимметричного диметиларгинина (p=0,037), симметричного диметиларгинина (p=0,014) и орнитина (p=0,015) на фоне окислительного стресса и нарушения регуляции NO [14].
Поддержание достаточной активности NO-синтетазы следует сочетать с ингибированием избыточной активности фермента аргиназы. Экспериментальные исследования показали роль избыточной активности аргиназы в патофизиологии эндотелиальной дисфункции. Аргиназа, превращая L-аргинин в мочевину и L-орнитин, ингибирует выработку NO путем удаления L-аргинина (субстрата NO-синтетазы), стимулирования образования супероксида и пероксинитрита (которые нейтрализуют NO), ингибирования биосинтеза белка NOS и сенсибилизации NOS к его эндогенному ингибитору, асимметричному диметил-L-аргинину. Повышение активности аргиназы способствует эндотелиальной дисфункции при гипертонии, старении, ишемической болезни сердца (ИБС) и СД2. Поэтому ингибиторы аргиназы представляют собой перспективное направление фармакотерапии эндотелиальной дисфункции [15].
Следует также отметить, что аминокислоты оказывают дифференцированное воздействие на биосинтез NO. В то время как аргинин принципиально необходим для этого процесса, дотации L-лейцина, наоборот, снижают синтез NO эндотелиоцитами, способствуя повышению сердечно-сосудистого риска [16].
Нитратосодержащие продукты
Увеличение концентраций NO3– и NO2– в крови позволяет генерировать NO либо ферментативными (нитрат- и нитритредуктазы, ксантиноксидоредуктаза, ферменты дыхательной цепи, альдегидоксидаза), либо неферментативными методами (особенно в условиях гипоксии и низкого pH). Иначе говоря, помимо активности eNOS NO может также вырабатываться путем восстановления неорганического нитрата до нитрита, а затем до NO. Содержание нитратов в пище влияет на общий метаболизм NO и переносимость физических нагрузок. Было обнаружено, что NO из неорганического нитрата обладает теми же кардиопротекторными свойствами, что и NO, вырабатываемый из аргинина посредством eNOS, и тем самым компенсирует дефицит активности eNOS [17] (рис. 3).
Сок свеклы, являясь источником нитратов и других вазоактивных молекул, снижает АД у пациентов с гипертонией, улучшает функцию эндотелия сосудов и тормозит атеросклероз крупных артерий [18]. Рандомизированное плацебо-контролируемое исследование продемонстрировало положительное воздействие свекольного сока на АД, гемостаз и маркеры сосудистого воспаления у здоровых пожилых добровольцев [19].
Свекольный сок влияет на доставку кислорода к гладким и скелетным мышцам, тем самым способствуя улучшению спортивных результатов [20]. Обзор 11 исследований подтвердил, что он может снижать АД через нитрат/нитрит/NO-зависимые пути и другие механизмы, связанные с компонентами метаболома свеклы (Beta vulgaris) (рис. 4) [4].
Метаанализ 27 рандомизированных исследований подтвердил положительное влияние сока свеклы на снижение сердечно-сосудистого риска: уменьшение жесткости артерий (скорость пульсовой волны –0,27 м/с; p=0,04) и повышение эндотелиальной функции (опосредованная потоком вазодилатация +0,62%; p=0,002) [21], что способствует достоверному снижению АД (рис. 5).

Рисунок 3. Пути биосинтеза оксида азота (NO) [17]. Показаны два маршрута образования NO: во-первых, посредством эндотелиальной NO-синтетазы при окислении L-аргинина с образованием L-цитруллина, во-вторых, при восстановлении нитратов из пищи до нитритов, а затем до NO. Нитрат восстанавливается во рту бактериями микробиома до нитрита. Нитрит, поступающий в желудочно-кишечный тракт, преобразуется в NO путем кислотного восстановления при участии витамина С и полифенолов. Большая часть нитрита всасывается в кровеносную систему, где он восстанавливается до NO дезоксигемоглобином, редуктазами, ксантиноксидазой, цепью переноса электронов и т.д. NO может быть преобразован обратно в нитрит и нитрат путем окисления церулоплазмином и оксигемоглобином. НАДФ – никотинамидадениндинуклеотидфосфат; eNOS (англ. endothelial NO synthetase) – эндотелиальная NO-синтетаза
Figure 3. Nitric oxide (NO) biosynthetic pathways [17]. Two routes of NO formation are shown: first, by endothelial NO synthetase during L-arginine oxidation to L-citrulline form; second, by nutrient nitrate reduction to nitrites followed by NO. Nitrate is reduced in the mouth by microbiome bacteria to nitrite. Nitrite entering the gastrointestinal tract is converted to NO by acid reduction involving vitamin C and polyphenols. Most of the nitrite is absorbed into the bloodstream, where it is reduced to NO by deoxyhemoglobin, reductases, xanthine oxidase, the electron transport chain, etc. NO can be converted back to nitrite and nitrate via oxidation by ceruloplasmin and oxyhemoglobin. NADP – nicotinamide adenine dinucleotide phosphate; eNOS – endothelial NO synthetase
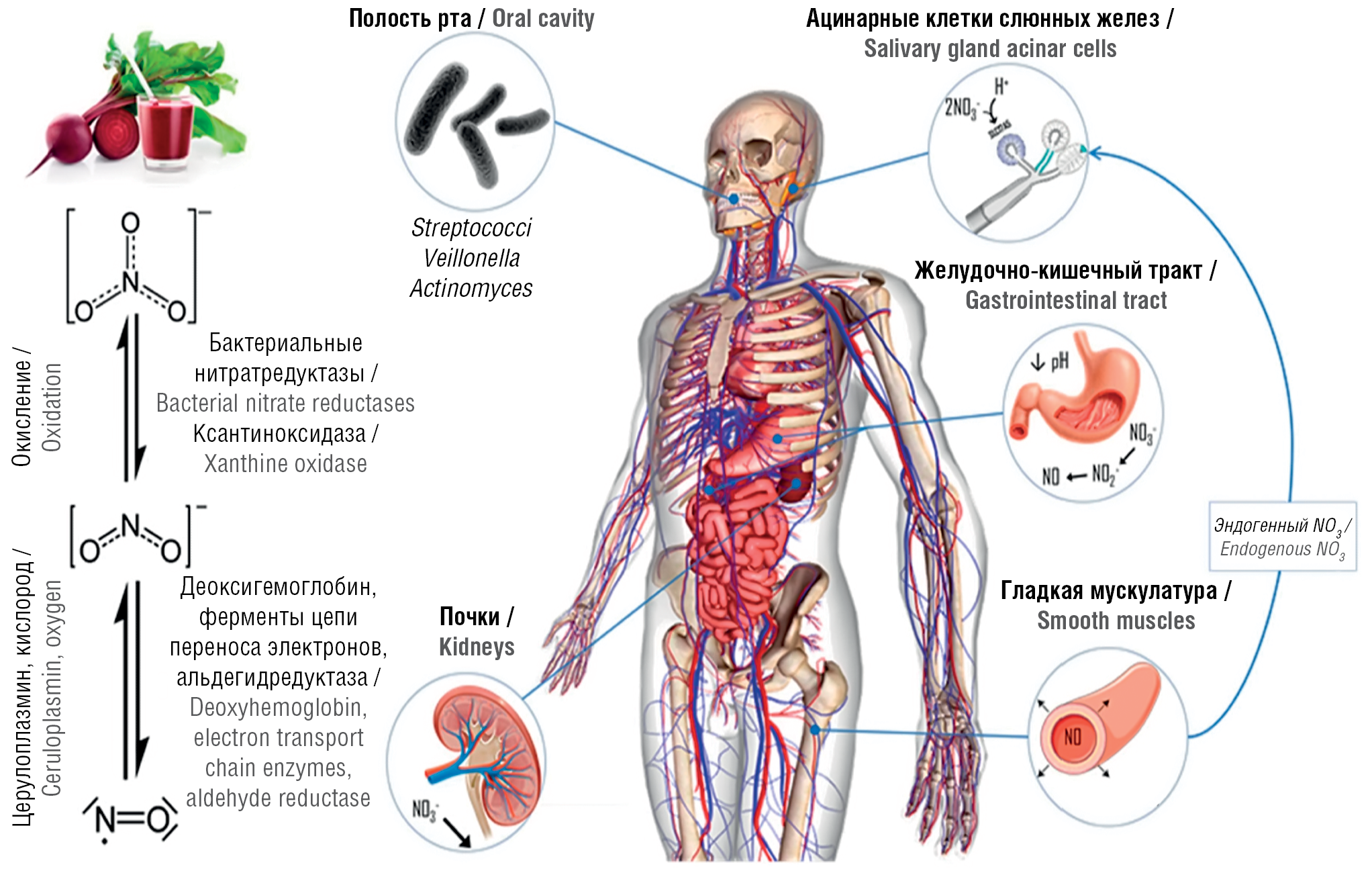
Рисунок 4. Активация пути «нитрат – нитрит – оксид азота (NO)» после приема свекольного сока [4]. В микробиоте полости рта происходит восстановление NO3– до NO2– посредством бактерий родов Veillonella, Actinomyces, Rothia, Prevotella и Neisseria. В желудке вследствие кислой среды также вырабатывается NO и происходит всасывание NO3– при участии симпортера NO3–/H+ (SLC17A5, сиалин)
Figure 4. Beetroot juice-driven activation of the “nitrate – nitrite – nitric oxide (NO)” pathway [4]. In the oral microbiota, NO3– is reduced to NO2– by bacteria of the genera Veillonella, Actinomyces, Rothia, Prevotella and Neisseria. In the stomach, NO is also produced due to the acidic environment and NO3– to be absorbed with the participation of the NO3–/H+ symporter (SLC17A5, sialin)
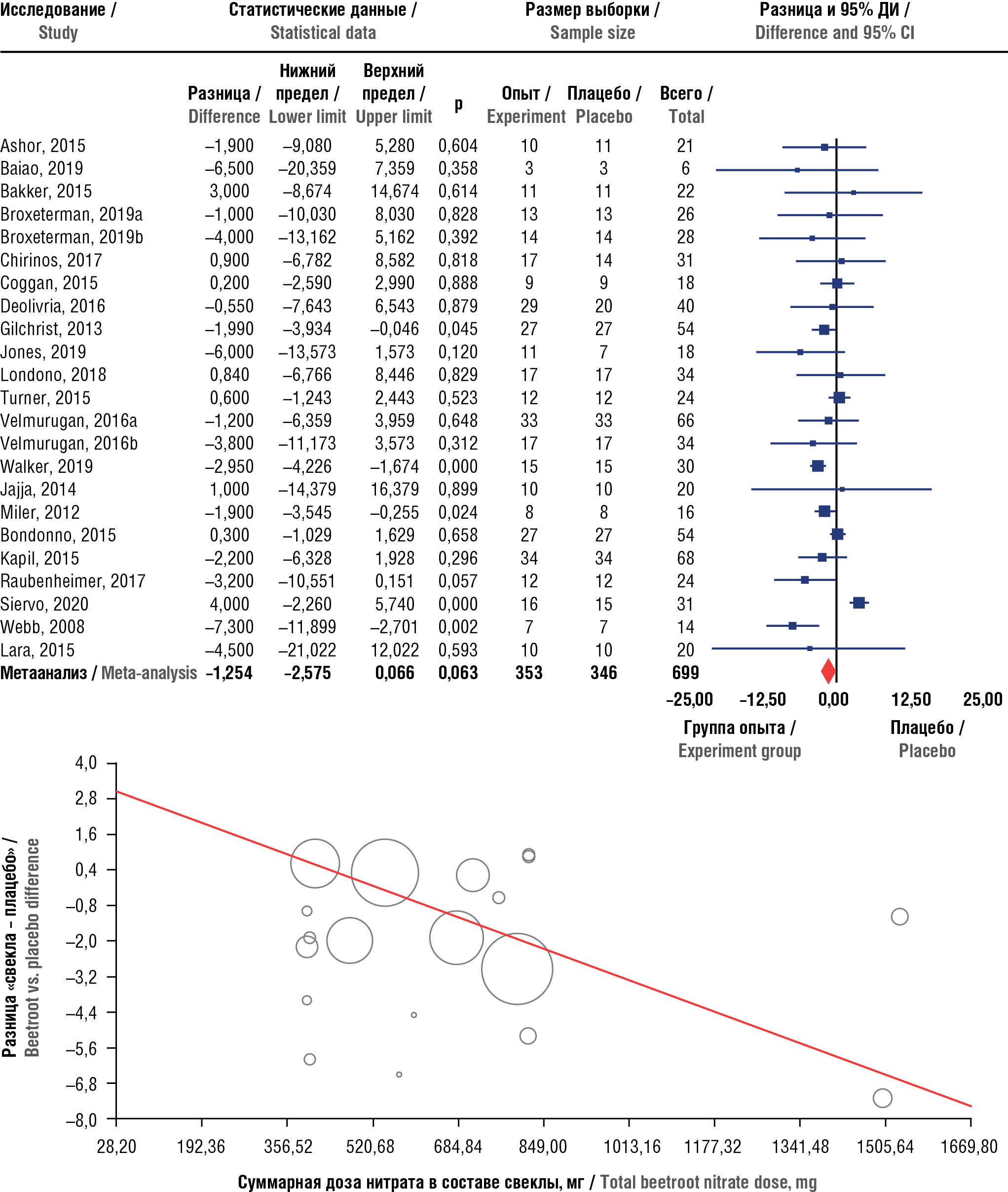
Рисунок 5. Результаты метаанализа эффектов сока свеклы на снижение диастолического артериального давления [21]: а – метаанализ; b – метарегрессия между дозировкой нитрата (мг/д) и средней разницей в диастолическом артериальном давлении. ДИ – доверительный интервал
Figure 5. Results of a meta-analysis assessing beetroot juice effects on lowering diastolic blood pressure [21]: а – meta-analysis, b – meta-regression between nitrate dosage (mg/d) and the mean difference in diastolic blood pressure. СI – confidence interval
Фолаты и витамин В12 в гомеостазе NO
Фолиевая кислота и ее метаболиты важны в рециркуляции BH4, входящего в состав эндотелиальной NO-синтетазы [22]. Кроме того, гипергомоцистеинемия, возникающая на фоне дефицитов фолатов, витамина B12 и витамина В6, связана с окислительным стрессом, тромбообразованием, воспалительной реакцией макрофагов [23], эндотелиальной дисфункцией и нарушением чувствительности сосудов к NO [24]. Курение, способствуя снижению концентрации фолатов и витамина B12, повышает уровень гомоцистеина и тормозит выработку NO [25]. Эти фундаментальные факты биохимии указывают на важность фолатов и их синергиста витамина В12 для обмена NO.
Действительно, прогрессирование эндотелиальной дисфункции при различных заболеваниях или в процессе старения связано со сложными взаимодействиями между гомоцистеином, NO, окислительным стрессом, воспалением, обменом липидов фолатами и витамином В12. В частности, дефицит фолатов (прежде всего, активной формы – тетрагидрофолата) способствует тому, что NO-синтетаза начинает участвовать в избыточном образовании супероксид- и пероксинитрит-анионов [26].
В эксперименте у крыс с гиперхолестеринемией прием фолиевой кислоты (0,003% в воде) снижал нарушения ангиогенеза, что было связано с повышением уровня фолатов в сыворотке крови, уровней NO и цГМФ в тканях. Воздействие ингибитора NO-синтетазы (N-нитро-L-аргинин метилэстера) блокировало полезное действие фолатов на ангиогенез [27].
В эксперименте фолиевая кислота защищала от пренатального повреждения сердца и эндотелия сосудов никотином, снижая уровни фактора некроза опухоли альфа (англ. tumour necrosis factor alpha, TNF-α) и циклооксигеназы-2, улучшая функцию эндотелия (повышение уровней NO и общей антиоксидантной способности крови) [28].
В исследовании «случай – контроль» дотации фолиевой кислоты нормализовали транскриптом эндотелиальных клеток-предшественников у пациентов с сахарным диабетом 1-го типа (СД1). Наличие СД1 по сравнению со здоровыми лицами модулировало экспрессию 1591 гена, участвующего в процессах межклеточной коммуникации, адгезии и миграции (рис. 6). Терапия фолиевой кислотой приближала профиль экспрессии генов эндотелиальных клеток-предшественников у пациентов с СД1 к транскриптомному профилю здоровых контролей. Гены, которые нормализовались фолиевой кислотой, играли важную роль в развитии эндотелия (факторы транскрипции ID1 и MAFF) [29].
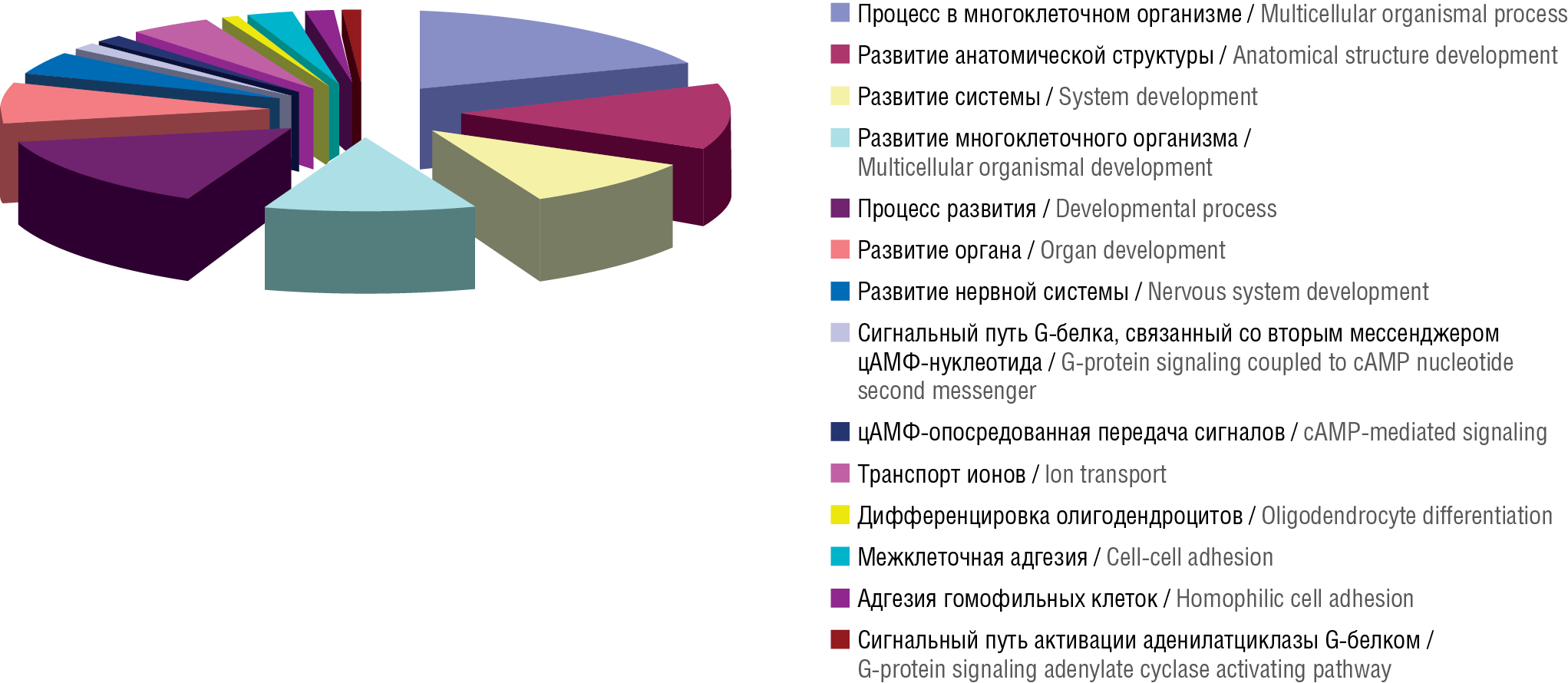
Рисунок 6. Классификации 513 генов (термины Gene Ontology), на экспрессию которых воздействовали дотации фолиевой кислоты у пациентов с сахарным диабетом 1-го типа (СД1) [29]. Перечислены биологические процессы, определяемые генами, которые достоверно (р<0,01) нормализуются при лечении пациентов с СД1 фолиевой кислотой. цАМФ – циклический аденозинмонофосфат
Figure 6. Classifications of 513 genes (Gene Ontology terms) whose expression was affected by folic acid supplementation in patients with type 1 diabetes mellitus (T1DM) [29]. The biological processes determined by the genes that are significantly (р<0,01) normalized by treatment of T1DM patients with folic acid are listed. cAMP – cyclic adenosine monophosphate
В клиническом исследовании дотации витамина B12 (1000 мкг/сут) и фолиевой кислоты (5000 мкг/сут) в течение 12 нед снижали уровень асимметричного диметиларгинина (АДМА) в плазме у пациентов с острым ишемическим инсультом. АДМА является метаболическим побочным продуктом процессов модификации белков в цитоплазме всех клеток человека. Вследствие структурного сходства с L-аргинином метаболит АДМА ингибирует еNOS, тем самым подавляя выработку NO. Концентрации АДМА существенно повышаются при участии окисленной формы липопротеинов низкой плотности (ЛПНП) [30].
Лечение пациентов с гипергомоцистеинемией посредством приема витамина В12 и фолатов влияет на эндотелий-зависимую вазодилатацию и продукты обмена NO. По сравнению со здоровыми контролями у пациентов с гипергомоцистеинемией наблюдались значительно более низкие средние уровни продуктов NO (нитраты, нитриты) в плазме крови (12,1±9 мкМ; контроль: 24,6±10 мкМ; р<0,001), ослабленный вазодилататорный ответ на пробу с ацетилхолином (р<0,01). Лечение данных пациентов фолатами (5 мг/сут, 12 мес) увеличило уровень конечных продуктов NO на +121% (95% ДИ 72–170), а вазодилататорный ответ на ацетилхолин – на +124% (95% ДИ 36–212) [31].
Терапия фолиевой кислотой (5 мг/сут, 4 нед) нормализовало NO-зависимость тонуса сосудов у пациентов с метаболическим синдромом (n=49) по сравнению со здоровым контролем (n=26). NO-зависимость тонуса сосудов сетчатки и почек оценивали с помощью ретинальной сканирующей лазерной допплеровской флоуметрии и метода почечного клиренса. Дотации фолиевой кислоты увеличили соотношение глутатиона и окисленного глутатиона почти в 3 раза (р=0,04), что свидетельствует о снижении окислительного стресса. После курса лечения NO-зависимость тонуса сосудов сетчатки и почек была одинаковой у пациентов и в контрольной группе здоровых добровольцев [32].
Фолиевая кислота (5 мг/сут) улучшает эндотелиальную функцию у пациентов с ИБС, снижая уровень гомоцистеина. При этом эффект от ее приема может наблюдаться в течение 2–4 ч после первой дозы (что, естественно, практически не влияет на уровень гомоцистеина в крови). Введение 5-метилтетрагидрофолата непосредственно в плечевую артерию заметно улучшает функцию эндотелия. Данный эффект блокировался монометиларгинином, ингибирующим NO-синтетазу, что подтверждает NO-зависимые механизмы в реализации эндотелиопротекторных эффектов фолатов [33].
Химические модификации витамина В12 и NO
Следует подчеркнуть, что молекула NO весьма специфично взаимодействует с кобириновым ядром молекулы витамина В12. NO координируется с кобаламином (II) при всех значениях pH, а кобаламин (III) не реагирует с NO при нейтральном pH. При низком pH кобаламин (III) реа- гирует с NO посредством двухэтапного процесса, в котором восстанавливается до кобаламина (II). Исследования реакций с кобинамидом показали, что как кобинамид (II), так и кобинамид (III) легко реагируют с NO при всех значениях pH. Сродство кобинамида (II) к NO настолько велико, что данная химическая модификация витамина В12 может иметь важное биомедицинское применение в качестве сенсора NO [34].
Однако влияние витамина В12 на биосинтез NO практически не связано с прямым взаимодействием молекул NO и различных модификаций витамина В12, а обусловлено незаменимым участием витамина В12 в цикле обмена фолатов. Кобаламины потенциально могут быть полезными агентами для выработки NO, контроля активации провоспалительного ядерного фактора каппа В (англ. nuclear factor kappa B, NF-κB), фагоцитоза и др. (рис. 7). Фармакотерапия, включающая внутривенное введение высоких доз различных форм витамина B12, может быть полезна для пациентов с полиорганной патологией в критическом состоянии [35].
В эксперименте на крысах синергидный эффект витамина B12 и фолатов в воздействии на эндотелий был продемонстрирован, в частности, как снижение воспалительно-окислительного повреждения эндотелия поджелудочной железы, индуцированного мышьяком. Мышьяк вызывал значительное увеличение образования малонового диальдегида в ткани поджелудочной железы крыс на фоне снижения активности супероксиддисмутазы, каталазы, глутатиона и повышения TNF-α и интерлейкина-6 (англ. interleukin, IL). Совместное введение витамина B12 и фолиевой кислоты было более эффективно, чем действие этих компонентов по отдельности [36], на что указывают результаты и биохимических, и гистологических анализов (рис. 8).
Ранее нами было проведено сравнительное хемореактомное исследование различных форм витамина В12 (цианокобаламина, аквакобаламина, гептаметилового эфира цианоаквакобириновой кислоты, гептаметилового эфира дицианокобириновой кислоты и стабильного желтого корриноида) [37–39]. Найдены достоверные различия в свойствах исследованных веществ по отношению к оксидативному стрессу. В тест-системах, основанных на оксиданте 1,1-дифенил-2-пикрилгидразиле, при различном времени воздействия молекул (15–60 мин) в различных концентрациях (10–125 мкМ, 50–3000 мкг/мл) аквакобаламин проявлял наиболее выраженные антиоксидантные свойства при более низких концентрациях (до 100 мкМ). При более высоких концентрациях веществ (125 мкМ) антиоксидантная активность других производных витамина В12 была выше [37]. Хемонейроцитологический анализ этой группы соединений показал, что цианокобаламин и аквакобаламин могут обладать наибольшими нейропротекторными эффектами: увеличение концентрации веществ на 1 ммоль/л приводит к увеличению оценки выживаемости нейронов на 25% [38][39].
Проведено экспериментальное исследование, указывающее на то, что нейропротекторные свойства производных витамина В12 могут быть связаны с функцией фолатов и осуществляться при участии NO. Так, были показаны нейропротекторные эффекты производного витамина В12 метилкобаламина при использовании клеточной модели глутаматного стресса на кортикальных нейронах. Цитотоксичность глутамата также предотвращалась воздействием S-аденозилметионина, который образуется в метаболическом пути метаболизма фолат/В12/B6 (рис. 9). Воздействие метилкобаламина и S-аденозилметионина также подавляло цитотоксичность, вызванную нитропруссидом, который вмешивается в физиологический гомеостаз NO [40].
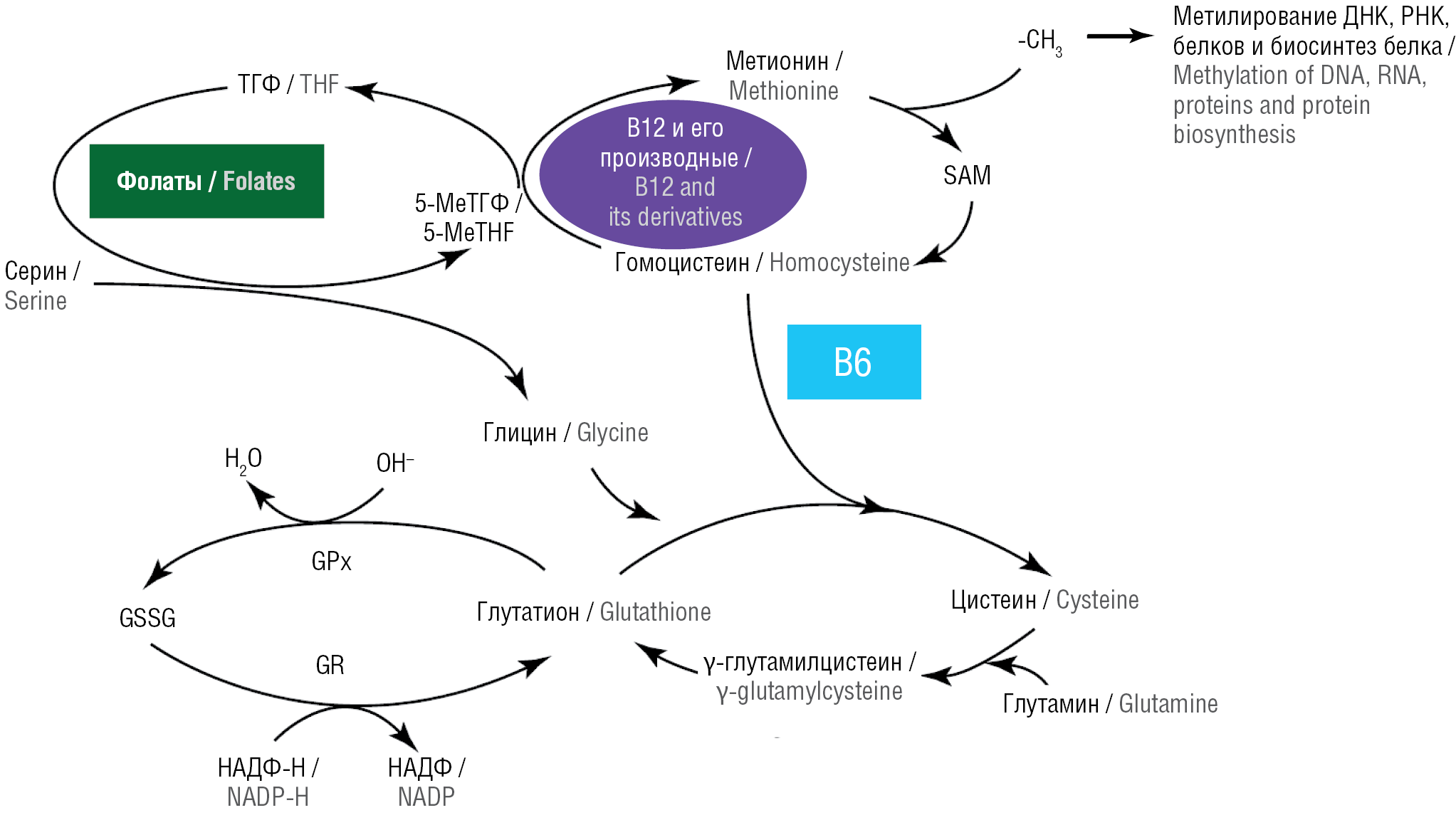
Рисунок 7. Потенциальная роль витамина B12 и других витаминов группы B в обмене фолатов и антиоксидантных системах [35]. ТГФ – тетрагидрофолат; 5-MeТГФ – 5-метилтетрагидрофолат; GSSG (англ. oxidized glutathione) – окисленный глутатион; GPx (англ. glutathione peroxidase) – глутатионпероксидаза; GR (англ. glutathione reductase) – глутатионредуктаза; НАДФ – никотинамидадениндинуклеотидфосфат; B12 – кобаламин; B6 – пиридоксин; SAM (англ. S-adenosylmethionine) – S-аденозилметионин; ДНК – дезоксирибонуклеиновая кислота; РНК – рибонуклеиновая кислота
Figure 7. Potential roles of vitamin B12 and other B vitamins in folate metabolism and antioxidant systems [35]. THF – tetrahydrofolate; 5-MeTHF – 5-methyltetrahydrofolate; GSSG – oxidized glutathione; GPx – glutathione peroxidase; GR – glutathione reductase; NADP – nicotinamide adenine dinucleotide phosphate; B12 – cobalamin; B6 – pyridoxine; SAM – S-adenosylmethionine; DNA – deoxyribonucleic acid; RNA – ribonucleic acid
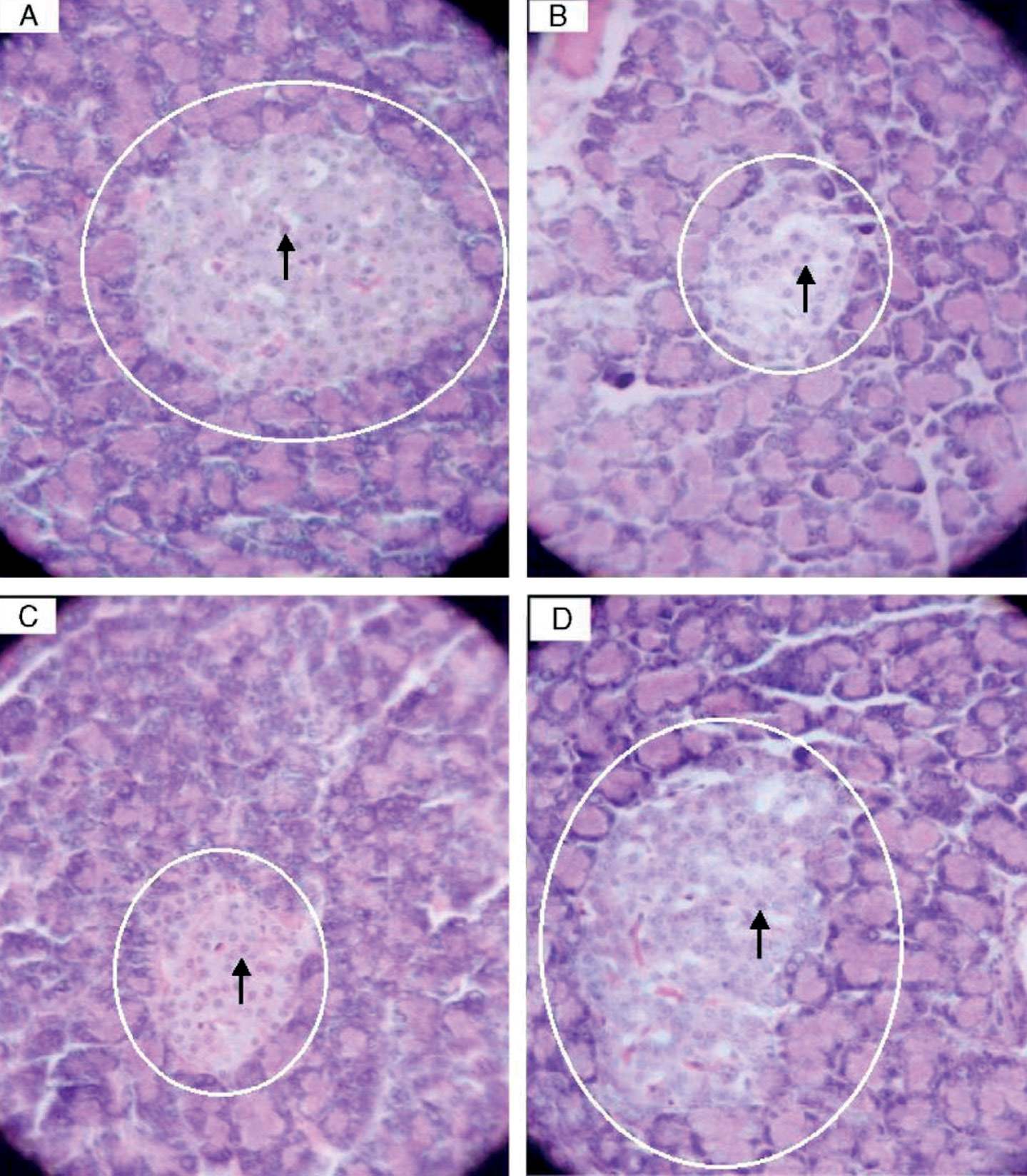
Рисунок 8. Типичные микрофотографии срезов поджелудочной железы, окрашенных гематоксилином и эозином, показывающие морфологию и популяцию клеток в островках [36]: а – контрольной крысы (никаких патологических изменений не наблюдается, яркая нормальная архитектура островков поджелудочной железы и окружающих ацинусов (выделена овалом), размер островков и популяция клеток нормальные (стрелка)); b – крысы, обработанной мышьяком в дозе 3 мг/кг/cут в течение 30 дней (присутствуют типичные характеристики повреждения клеток островков, островок сморщен (выделен овалом), количество клеток уменьшено (стрелка)); c – крысы, получавшей мышьяк и фолиевую кислоту; d – крысы, получавшей мышьяк, фолиевую кислоту и витамин B12 (выраженное восстановление изменений в результате повреждения клеток соответственно при применении только фолиевой кислоты и фолиевой кислоты и витамина B12)
Figure 8. Representative photomicrographs of hematoxylin and eosin-stained pancreatic sections showing the morphology and cell population in islets from [36]: а – control rat (no pathological changes are observed; bright normal architecture of the pancreatic islets and surrounding acini (highlighted by oval); islet size and cell population are normal (arrow)); b – arsenic-treated rat at dose of 3 mg/kg/day for 30 days (typical characteristics of islet cell injury are present; the islet is shrunken (highlighted by oval); the number of cells is decreased (arrow)); c – an arsenic + folic acid-treated rat; d – an arsenic + folic acid + vitamin B12-treated rat (marked reversal of changes following cell injury, respectively, with folate alone and folate and vitamin B12)

Рисунок 9. Эффекты метилкобаламина в глутаматной нейротоксичности [40]: а – интактный контроль; b – клетки, инкубированные с 1 мМ глутамата в течение 10 мин; c – клетки, выращиваемые на среде с метилкобаламином (10–5 М), затем подвергнутые действию 1 мМ глутамата (масштабная планка 50 мкМ); d – морфометрические дозозависимые оценки нейропротекторных эффектов метилкобаламина
Figure 9. Methylcobalamin effects on glutamate neurotoxicity [40]: а – intact control; b – cells incubated with 1 mM glutamate for 10 min; c – cells grown in medium with methylcobalamin (10–5 M), followed by exposure to 1 mM glutamate (scale bar 50 μM); d – morphometric dose-dependent assessments of methylcobalamin neuroprotective effects
Другие витамины
Витамины группы В
Как было отмечено выше, витамин В2 (рибофлавин) необходим для биосинтеза двух коферментов NO-синтетазы: ФАД и ФМН. В клиническом исследовании беременных (n=154) дефицит рибофлавина был связан с повышенным риском преэклампсии. Дефицит увеличивался к концу беременности (27,3% на 29-й неделе беременности и 53,3% после 36-й недели), в группе пациенток с дефицитом рибофлавина достоверно чаще встречались случаи преэклампсии (29%), чем в группе с достаточным количеством рибофлавина (8%; р<0,001), что соответствует 5-кратному возрастанию риска (отношение шансов 4,7; 95% ДИ 1,8–12,2) [41].
Витамин В1 участвует в регуляции синтеза NO в эндотелиоцитах. В клетках тиамин фосфорилируется тиаминпирофосфокиназой и превращается в активную форму витамина В1 – тиаминпирофосфат (ТПФ). Кофермент ТПФ необходим для ферментов метаболизма глюкозы: транскетолазы, кетоглутаратдегидрогеназы и пируватдегидрогеназы, поэтому введение тиамина оказывает положительное влияние на пациентов с СД2 (в частности, профилактика нейропатии и нефропатии). Например, экзогенное введение ТПФ влияет на активность митохондрий и биосинтез NO [42].
Продемонстрирован NO-зависимый нейропротекторный потенциал витамина В7 (биотина) в высоких дозах (100 мг/сут и выше) в контексте торможения прогрессирования рассеянного склероза. Эффект биотина связан c противовоспалительным действием и стимуляцией активности растворимой гуанилатциклазы (синтезирует цГМФ) при участии NO. Нейротрофически-миметическое действие, оказываемое цГМФ, влечет за собой активацию путей PI3K-Akt и Ras-ERK, которые способствуют выживанию и пластичности нейронов. NO/цГМФ подавляет выработку β-амилоида в мозге, ингибируя экспрессию белка-предшественника амилоида и проапоптотического фермента BACE1 [43].
Инактивация NO в пероксинитрит супероксидными анионами снижается при участии коэнзима Q10 (англ. сoenzyme Q10, CoQ10), защищающего эндотелий от нитрозативного повреждения. CoQ10 также влияет на эндотелиальную функцию через ингибирование окислительного повреждения ЛПНП [44].
Витамины-антиоксиданты
Избыточное образование супероксид-аниона – фактор патогенеза эндотелиальной дисфункции, приводящий к ингибированию эндотелиальной активности NO и образованию пероксинитрита (нитрозативный стресс). Образующиеся из супероксида и других активных форм кислорода (АФК) соединения ингибируют диметиларгинин диметиламиногидролазу (англ. dimethylaminohydrolase, DDAH), окисляют BH4, что повышает концентрации химических производных аргинина (АДМА и др.), ингибирующих NO-синтетазу. Неблагоприятное воздействие дефицита активности фермента DDAH на выработку NO можно компенсировать дотациями аргинина, а повысить активность eNOS при дефиците BH4 возможно дотациями фолатов [45].
Избыток АФК может адсорбироваться витаминами-антиоксидантами. Так, BH4 может окисляться посредством одно- или двухэлектронных реакций, образуя радикал BH4 или BH3 и BH2 соответственно. Исследования показывают, что аскорбиновая кислота (также известная как аскорбат или витамин C) может восстанавливать радикал BH3 до BH4 [46], предотвращая реакцию радикала BH3 с другими свободными радикалами (в частности, супероксидом и пероксинитритом). Без этого процесса рециркуляции происходят разъединение фермента eNOS и снижение биодоступности вазодилататора NO, что создает форму эндотелиальной дисфункции [47].
Витамин С усиливает активность NO, вырабатываемого эндотелием, и нормализует сосудистую функцию у пациентов с ИБС, также оказывая патофизиологическое действие на гиперхолестеринемию, гипергомоцистеинемию, гипертонию и инсулинорезистентность [48]. Он повышает биодоступность NO с участием BH4, фолат-зависимого кофактора eNOS. Аскорбат увеличивает биодоступность NO через снижение окисления кофактора BH4, повышение экспрессии eNOS, регуляцию фосфорилирования и S-нитрозилирования NOS [49]. Витамин С (1 г/сут, 6 мес) снижал дисфункцию эндотелия сосудов у пациентов с гомоцистинурией вследствие дефицита цистатионин-β-синтетазы, приводящего к раннему атеротромбозу. NO-опосредованная вазодилатация улучшилась в группе витамина С (p<0,001) и не изменилась в контрольной группе (p=0,526) [50].
Витамин E – жирорастворимый антиоксидантный витамин. Окисленный ЛПНП стимулирует эндотелиальные клетки к производству воспалительных маркеров, оказывает цитотоксическое действие на эндотелиальные клетки, подавляет подвижность тканевых макрофагов и ингибирует вазодилатацию, вызванную NO. Витамин E противодействует этим процессам и предотвращает образование атеросклеротических бляшек [51]. У пациентов 20–60 лет с легкой гипертензией дотации витамина Е (200 МЕ/сут, 27 нед) вызвали значительное снижение систолического АД (–24%, плацебо: –1,6%) и диастолического АД (–12,5%; плацебо: –6,2%), влияя, в частности, на секрецию NO [52].
В эксперименте на хомячках, омега-3 полиненасыщенные жирные кислоты (400 мг/100 г массы тела) улучшали микрососудистую реактивность посредством активации калиевых каналов и увеличения продукции NO [53].
Антиоксидантный биофлавоноид дельфинидин (содержится в красном винограде) ингибирует апоптоз эндотелиальных клеток при участии молекул NO: антиапоптотический эффект дельфинидина устранялся ингибиторами NO-синтетазы, гуанилатциклазы и митоген-активируемой протеинкиназы [54].
Витамин D3, генерация NO и эндотелий
В эндотелиоцитах витамин D3 регулирует синтез NO, воздействуя на активность eNOS. Дефицит витамина D3 приводит к активации ренин-ангиотензин-альдостероновой системы, цитокиновых воспалительных путей, окислительному стрессу и дисрегуляции биосинтеза NO [55]. При патогенезе эндотелиальной дисфункции окислительный стресс, вызванный избыточной продукцией АФК, способствует деградации NO, формированию пероксинитритов и подавляет синтез NO, в результате чего снижается биодоступность NO. Витамин D3 противодействует формированию АФК и улучшает антиоксидантную способность, усиливая активность антиоксидантных ферментов (супероксиддисмутазы, каталазы и др.) и снижая уровни медиаторов воспаления (TNF-α, IL-1β, IL-6), в т.ч. посредством ингибирования каскада NF-κB [56].
Витамин А
Дефицит витамина А усиливает воспалительные реакции, тем самым усугубляя эндотелиальную дисфункцию и снижая выработку NO [57]. Эффект ингаляционной терапии NO у недоношенных новорожденных (масса тела при рождении 500–1250 г) с дыхательной недостаточностью, находящихся на искусственной вентиляции легких (n=793), может быть улучшен путем добавления витамина А. По сравнению только с ингаляциями NO комбинированная терапия (ингаляции NO и прием витамина А) способствовала достоверному снижению бронхолегочной дисплазии (р=0,01) и улучшению индекса психомоторного развития (по шкале Бейли II) в возрасте 1 года [58].
Магний, кальций, NO и эндотелий
Потребление магния с пищей (зеленолистные растения, водоросли) и уровень магния в сыворотке крови влия- ют на риск гипертонии. В крупномасштабном исследовании показано, что более высокие концентрации магния в сыворотке соответствуют снижению:
– сосудистого риска по Фрамингемской шкале;
– толщины комплекса «интима – медиа» сонной артерии;
– смертности от сердечно-сосудистых заболеваний.
Достаточная внеклеточная концентрация магния способствует устранению эндотелиальной дисфункции посредством увеличения продукции NO [59], NO-зависимой вазодилатации и других молекулярных механизмов (ингибирование NMDA-рецепторов, кальциевых каналов N-типа, высвобождения катехоламинов из симпатических нервных синапсов, калийсберегающих свойств магния и т.д.) [60].
Уровни магния в сыворотке крови связаны с фракционным выдыхаемым NO у пациентов с хронической астмой и ХОБЛ (n=42). При более легком течении заболевания наблюдались значительно более высокие концентрации магния и железа, концентрации выдыхаемого NO (FeNO; p=0,005) и реже встречались поражения легких, выявленные на компьютерной томографии (p=0,011) и/или магнитно-резонансной томографии (p=0,008). Группа с низким уровнем FeNO имела значительно более низкую концентрацию магния в крови, чем группа с высоким содержанием FeNO (p=0,03) [61].
Уровень диетарного потребления кальция влияет на выработку NO и частоту преэклампсии. Результаты трех проспективных рандомизированных двойных слепых плацебо-контролируемых исследований по изучению эффекта дотаций кальция у беременных (2 г/сут элементарного кальция) показали снижение риска гипертонии беременных и преэклампсии. Ион кальция необходим, в частности, для синтеза NO в эндотелиоцитах [62], т.к. входит в состав кальмодулина, взаимодействующего с eNOS.
Участие микробиома в выработке NO
Как было отмечено выше, биодоступность NO повышается при участии определенных родов бактерий микробиома полости рта, восстанавливающих нитрат до нитрита и затем до NO [18].
Взаимосвязь между микробиомом полости рта и биодоступностью NO изучалась после добавления нитрата (12 ммоль/д) у молодых (18–22 года) и пожилых (70–79 лет) участников (n=18). Прием нитратов изменял микробиом слюны по сравнению с плацебо, увеличивая относительное количество Proteobacteria (+225%) и уменьшая относительное количество Bacteroidetes (–46%; р<0,05). После добавления нитрата относительное количество Rothia (+127%) и Neisseria (+351%) было выше, а Prevotella (–60%) и Veillonella (–65%) – ниже, чем в условиях плацебо (все р<0,05). Дотации нитрата увеличили концентрацию NO2– в плазме и снизили системное артериальное давление у пожилых (70–79 лет), но не у молодых (18–22 года) участников. Высокая численность Rothia и Neisseria и низкая численность Prevotella и Veillonella коррелировали с существенным увеличением уровня NO2– в плазме в ответ на дотации нитрата [63].
В результате приема нитратов изменялись относительные количества 52 таксонов бактерий. Показана тенденция к снижению относительной численности Firmicutes вследствие сокращения Veillonella (–65%), в т.ч. Veillonella parvula (оба р<0,05), в то время как Lactobacilliales и Streptococcus не были затронуты (р>0,05). В пределах типа Bacteroidetes нитраты приводили к снижению рода Prevotella (–60%; р<0,05), в частности P. melaninogenica (–67%, р<0,05). Повышение количества Proteobacteria произошло посредством увеличения Neisseriales (+348%). Наблюдался рост бактерий рода Rothia (+127%; р<0,05) и R. mucilaginosa (+234%; р<0,05). Концентрации NO3– и NO2– в плазме крови были прямо пропорциональны относительной численности бактерий Rothia и Neisseria и обратно – численности Prevotella и Veillonella [63].
Метаанализ 12 клинических исследований (n=894) подтвердил, что лечебные пробиотические штаммы бактерий и вещества-пребиотики влияют на выработку NO и могут быть использованы в профилактике сосудистых осложнений гестационного диабета. Прием пробиотиков/пребиотиков увеличивал выработку NO (+2,31; 95% ДИ 0,91–3,70), общую антиоксидантную емкость крови (+0,74; 95% ДИ 0,21–1,27), снижал уровни высокочувствительного С-реактивного белка (–1,23; 95% ДИ –1,97…–0,49) и липопротеинов очень низкой плотности (–5,0; 95% ДИ –8,3…–1,8) [64].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Обеспеченность организма NO зависит от качества питания. Если раньше считалось, что диетическая коррекция биосинтеза NO заключается в основном в приеме аминокислоты аргинина, то в настоящее время стало очевидно, что ряд витаминов (А, С, E, D3, фолаты, В1, В2, В6, В7 и В12) принимают непосредственное участие в регулировании биосинтеза NO.
Перспективно исследование эффектов разных модификаций витамина В12 на обмен азота, оксидативный и нитрозативный стресс и сохранность различных органов животных в условиях оксидативно-нитрозативного стресса. Следует подчеркнуть особую роль таких NO-продуцентов, как зеленолистные салаты, водоросли, хлорелла, свекла, морковь и ряд пробиотических штаммов бактерий, которые позволяют эффективно усваивать нитраты из этих продуктов. Поддерживая эндотелиальную функцию, такое питание тормозит развитие полиорганной патологии и старения.
Список литературы
1. Cyr A.R., Huckaby L.V., Shiva S.S., Zuckerbraun B.S. Nitric oxide and endothelial dysfunction. Crit Care Clin. 2020; 36 (2): 307–21. https://doi.org/10.1016/j.ccc.2019.12.009.
2. Bahadoran Z., Mirmiran P., Ghasemi A. Adipose organ dysfunction and type 2 diabetes: role of nitric oxide. Biochem Pharmacol. 2024; 221: 116043. https://doi.org/10.1016/j.bcp.2024.116043.
3. Ferraro G., Sardo P. Nitric oxide and brain hyperexcitability. In Vivo. 2004; 18 (3): 357–66.
4. Bonilla Ocampo D.A., Paipilla A.F., Marín E., et al. Dietary nitrate from beetroot juice for hypertension: a systematic review. Biomolecules. 2018; 8 (4): 134. https://doi.org/10.3390/biom8040134.
5. Гуманова Н.Г. Оксид азота, его циркулирующие метаболиты NOx и их роль в функционировании человеческого организма и прогнозе риска сердечно-сосудистой смерти (часть I). Профилактическая медицина. 2021; 24 (9): 102–9. https://doi.org/10.17116/profmed202124091102.
6. Liu W., Hu B., Dehghan M., et al. Fruit, vegetable, and legume intake and the risk of all-cause, cardiovascular, and cancer mortality: a prospective study. Clin Nutr. 2021; 40 (6): 4316–23. https://doi.org/10.1016/j.clnu.2021.01.016.
7. Torshin I.Y. On solvability, regularity, and locality of the problem of genome annotation. Pattern Recognit Image Anal. 2010; 20: 386395. https://doi.org/10.1134/S1054661810030156.
8. Рудаков К.В., Торшин И.Ю. Вопросы разрешимости задачи распознавания вторичной структуры белка. Информатика и ее применения. 2010; 4 (2): 25–35.
9. Торшин И.Ю. О задачах оптимизации, возникающих при применении топологического анализа данных к поиску алгоритмов прогнозирования с фиксированными корректорами. Информатика и еe применения. 2023; 17 (2): 2–10. https://doi.org/10.14357/19922264230201.
10. Торшин И.Ю. О формировании множеств прецедентов на основе таблиц разнородных признаковых описаний методами топологической теории анализа данных. Информатика и еe применения. 2023; 17 (3): 2–7. https://doi.org/10.14357/19922264230301.
11. Торшин И.Ю., Громова О.А., Стаховская Л.В. и др. Анализ 19,9 млн публикаций базы данных PubMed/MEDLINE методами искусственного интеллекта: подходы к обобщению накопленных данных и феномен “fake news”. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020; 13 (2): 146–63. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.021.
12. Abuzayan I., Turner S.W. Changes in exhaled nitric oxide after ingestion of L-arginine in children: a pilot study. Pediatr Pulmonol. 2010; 45 (3): 236–40. https://doi.org/10.1002/ppul.21110.
13. Mariotti F. Arginine supplementation and cardiometabolic risk. Curr Opin Clin Nutr Metab Care. 2020; 23 (1): 29–34. https://doi.org/10.1097/MCO.0000000000000612.
14. Zinellu A., Mangoni A.A. Arginine, transsulfuration, and folic acid pathway metabolomics in chronic obstructive pulmonary disease: a systematic review and meta-analysis. Cells. 2023; 12 (17): 2180. https://doi.org/10.3390/cells12172180.
15. Durante W., Johnson F.K., Johnson R.A. Arginase: a critical regulator of nitric oxide synthesis and vascular function. Clin Exp Pharmacol Physiol. 2007; 34 (9): 906–11. https://doi.org/10.1111/j.1440-1681.2007.04638.x.
16. Tekwe C.D., Luan Y., Meininger C.J., et al. Dietary supplementation with L-leucine reduces nitric oxide synthesis by endothelial cells of rats. Exp Biol Med. 2023; 248 (18): 1537–49. https://doi.org/10.1177/15353702231199078.
17. Ivy J.L. Inorganic nitrate supplementation for cardiovascular health. Methodist Debakey Cardiovasc J. 2019; 15 (3): 200–6. https://doi.org/10.14797/mdcj-15-3-200.
18. Jones A.M., Vanhatalo A., Seals D.R., et al. Dietary nitrate and nitric oxide metabolism: mouth, circulation, skeletal muscle, and exercise performance. Med Sci Sports Exerc. 2021; 53 (2): 280–94. https://doi.org/10.1249/MSS.0000000000002470.
19. Raubenheimer K., Hickey D., Leveritt M., et al. Acute effects of nitrate-rich beetroot juice on blood pressure, hemostasis and vascular inflammation markers in healthy older adults: a randomized, placebo-controlled crossover study. Nutrients. 2017; 9 (11): 1270. https://doi.org/10.3390/nu9111270.
20. Zamani H., de Joode M.E.J.R., Hossein I.J., et al. The benefits and risks of beetroot juice consumption: a systematic review. Crit Rev Food Sci Nutr. 2021; 61 (5): 788–804. https://doi.org/10.1080/10408398.2020.1746629.
21. Bahrami L.S., Arabi S.M., Feizy Z., Rezvani R. The effect of beetroot inorganic nitrate supplementation on cardiovascular risk factors: a systematic review and meta-regression of randomized controlled trials. Nitric Oxide. 2021; 115: 8–22. https://doi.org/10.1016/j.niox.2021.06.002.
22. Gori T., Burstein J.M., Ahmed S., et al. Folic acid prevents nitroglycerin-induced nitric oxide synthase dysfunction and nitrate tolerance: a human in vivo study. Circulation. 2001; 104 (10): 1119–23. https://doi.org/10.1161/hc3501.095358.
23. Kolb A.F., Petrie L. Folate deficiency enhances the inflammatory response of macrophages. Mol Immunol. 2013; 54 (2): 164–72. https://doi.org/10.1016/j.molimm.2012.11.012.
24. Haloul M., Vinjamuri S.J., Naquiallah D., et al. Hyperhomocysteinemia and low folate and vitamin B12 are associated with vascular dysfunction and impaired nitric oxide sensitivity in morbidly obese patients. Nutrients. 2020; 12 (7): 2014. https://doi.org/10.3390/nu12072014.
25. Ozerol E., Ozerol I., Gökdeniz R., et al. Effect of smoking on serum concentrations of total homocysteine, folate, vitamin B12, and nitric oxide in pregnancy: a preliminary study. Fetal Diagn Ther. 2004; 19 (2): 145–8. https://doi.org/10.1159/000075139.
26. Stanger O., Weger M. Interactions of homocysteine, nitric oxide, folate and radicals in the progressively damaged endothelium. Clin Chem Lab Med. 2003; 41 (11): 1444–54. https://doi.org/10.1515/CCLM.2003.222.
27. Sasaki K., Duan J., Murohara T., et al. Rescue of hypercholesterolemia-related impairment of angiogenesis by oral folate supplementation. J Am Coll Cardiol. 2003; 42 (2): 364–72. https://doi.org/10.1016/s0735-1097(03)00629-6.
28. Ahmed M.A., Kamal H.M., Taha A.M., Abd-Allateef S.F. Folic acid protects against experimental prenatal nicotine-induced cardiac injury by decreasing inflammatory changes, serum TNF and COX-2 expression. Pathophysiology. 2018; 25 (2): 151–6. https://doi.org/10.1016/j.pathophys.2018.04.001.
29. van Oostrom O., de Kleijn D.P., Fledderus J.O., et al. Folic acid supplementation normalizes the endothelial progenitor cell transcriptome of patients with type 1 diabetes: a case-control pilot study. Cardiovasc Diabetol. 2009; 8: 47. https://doi.org/10.1186/1475-2840-8-47.
30. Xia X.S., Li X., Wang L., et al. Supplementation of folic acid and vitamin B12 reduces plasma levels of asymmetric dimethylarginine in patients with acute ischemic stroke. J Clin Neurosci. 2014; 21 (9): 1586–90. https://doi.org/10.1016/j.jocn.2013.11.043.
31. Holven K.B., Holm T., Aukrust P., et al. Effect of folic acid treatment on endothelium-dependent vasodilation and nitric oxide-derived end products in hyperhomocysteinemic subjects. Am J Med. 2001; 110 (7): 536–42. https://doi.org/10.1016/s0002-9343(01)00696-9.
32. Schneider M.P., Schlaich M.P., Harazny J.M., et al. Folic acid treatment normalizes NOS-dependence of vascular tone in the metabolic syndrome. Obesity. 2011; 19 (5): 960–7. https://doi.org/10.1038/oby.2010.210.
33. Doshi S., McDowell I., Moat S., et al. Folate improves endothelial function in patients with coronary heart disease. Clin Chem Lab Med. 2003; 41 (11): 1505–12. https://doi.org/10.1515/CCLM.2003.231.
34. Sharma V.S., Pilz R.B., Boss G.R., Magde D. Reactions of nitric oxide with vitamin B12 and its precursor, cobinamide. Biochemistry. 2003; 42 (29): 8900–8. https://doi.org/10.1021/bi034469t.
35. Manzanares W., Hardy G. Vitamin B12: the forgotten micronutrient for critical care. Curr Opin Clin Nutr Metab Care. 2010; 13 (6): 662–8. https://doi.org/10.1097/MCO.0b013e32833dfaec.
36. Mukherjee S., Das D., Mukherjee M., et al. Synergistic effect of folic acid and vitamin B12 in ameliorating arsenic-induced oxidative damage in pancreatic tissue of rat. J Nutr Biochem. 2006; 17 (5): 319–27. https://doi.org/10.1016/j.jnutbio.2005.08.003.
37. Торшин И.Ю., Громова О.А., Майорова Л.А. Хемореактомный анализ антиоксидантных свойств производных витамина В12. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024; 17 (3): 358–67. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.239.
38. Торшин И.Ю., Громова О.А., Деревеньков И.А., Майорова Л.А. Хемопротеомный анализ фармакологических свойств производных витамина В12. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2024; 17 (3): 345–57. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.214.
39. Громова О.А., Фролова Д.Е., Торшин И.Ю. и др. Противоопухолевые эффекты витамина В12 in vitro, in vivo, in silico. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. https://doi.org/10.17749/2070-4909/farmakoekonomika.2024.231.
40. Akaike A., Tamura Y., Sato Y., Yokota T. Protective effects of a vitamin B12 analog, methylcobalamin, against glutamate cytotoxicity in cultured cortical neurons. Eur J Pharmacol. 1993; 241 (1): 1–6. https://doi.org/10.1016/0014-2999(93)90925-8.
41. Wacker J., Frühauf J., Schulz M., et al. Riboflavin deficiency and preeclampsia. Obstet Gynecol. 2000; 96 (1): 38–44. https://doi.org/10.1016/s0029-7844(00)00847-4.
42. Alcázar-Leyva S., Alvarado-Vásquez N. Could thiamine pyrophosphate be a regulator of the nitric oxide synthesis in the endothelial cell of diabetic patients? Med Hypotheses. 2011; 76 (5): 629–31. https://doi.org/10.1016/j.mehy.2011.01.015.
43. McCarty M.F., DiNicolantonio J.J. Neuroprotective potential of high-dose biotin. Med Hypotheses. 2017; 109: 145–9. https://doi.org/10.1016/j.mehy.2017.10.012.
44. Belardinelli R., Tiano L., Littarru G.P. Oxidative stress, endothelial function and coenzyme Q10. Biofactors. 2008; 32 (1-4): 129–33. https://doi.org/10.1002/biof.5520320115.
45. McCarty M.F. Coping with endothelial superoxide: potential complementarity of arginine and high-dose folate. Med Hypotheses. 2004; 63 (4): 709–18. https://doi.org/10.1016/j.mehy.2002.11.006.
46. Kuzkaya N., Weissmann N., Harrison D.G., Dikalov S. Interactions of peroxynitrite, tetrahydrobiopterin, ascorbic acid, and thiols: implications for uncoupling endothelial nitric-oxide synthase. J Biol Chem. 2003; 278 (25): 22546–54. https://doi.org/10.1074/jbc.M302227200.
47. Muller-Delp J.M. Ascorbic acid and tetrahydrobiopterin: looking beyond nitric oxide bioavailability. Cardiovasc Res. 2009; 84 (2): 178–9. https://doi.org/10.1093/cvr/cvp307.
48. Frei B. On the role of vitamin C and other antioxidants in atherogenesis and vascular dysfunction. Proc Soc Exp Biol Med. 1999; 222 (3): 196–204. https://doi.org/10.1046/j.1525-1373.1999.d01-136.x.
49. Mortensen A., Lykkesfeldt J. Does vitamin C enhance nitric oxide bioavailability in a tetrahydrobiopterin-dependent manner? In vitro, in vivo and clinical studies. Nitric Oxide. 2014; 36: 51–7. https://doi.org/10.1016/j.niox.2013.12.001.
50. Pullin C.H., Bonham J.R., McDowell I.F., et al. Vitamin C therapy ameliorates vascular endothelial dysfunction in treated patients with homocystinuria. J Inherit Metab Dis. 2002; 25 (2): 107–18. https://doi.org/10.1023/a:1015672625913.
51. Saremi A., Arora R. Vitamin E and cardiovascular disease. Am J Ther. 2010; 17 (3): e56–65. https://doi.org/10.1097/MJT.0b013e31819cdc9a.
52. Boshtam M., Rafiei M., Sadeghi K., Sarraf-Zadegan N. Vitamin E can reduce blood pressure in mild hypertensives. Int J Vitam Nutr Res. 2002; 72 (5): 309–14. https://doi.org/10.1024/0300-9831.72.5.309.
53. Conde C.M., Cyrino F.Z., Bottino D.A., et al. Longchain n-3 polyunsaturated fatty acids and microvascular reactivity: observation in the hamster cheek pouch. Microvasc Res. 2007; 73 (3): 237–47. https://doi.org/10.1016/j.mvr.2006.11.002.
54. Martin S., Giannone G., Andriantsitohaina R., Martinez M.C. Delphinidin, an active compound of red wine, inhibits endothelial cell apoptosis via nitric oxide pathway and regulation of calcium homeostasis. Br J Pharmacol. 2003; 139 (6): 1095–102. https://doi.org/10.1038/sj.bjp.0705347.
55. de la Guía-Galipienso F., Martínez-Ferran M., Vallecillo N., et al. Vitamin D and cardiovascular health. Clin Nutr. 2021; 40 (5): 2946–57. https://doi.org/10.1016/j.clnu.2020.12.025.
56. Kim D.H., Meza C.A., Clarke H., et al. Vitamin D and endothelial function. Nutrients. 2020; 12 (2): 575. https://doi.org/.3390/nu12020575.
57. Wiedermann U., Chen X.J., Enerbäck L., et al. Vitamin A deficiency increases inflammatory responses. Scand J Immunol. 1996; 44 (6): 578–84. https://doi.org/10.1046/j.1365-3083.1996.d01-351.x.
58. Gadhia M.M., Cutter G.R., Abman S.H., Kinsella J.P. Effects of early inhaled nitric oxide therapy and vitamin A supplementation on the risk for bronchopulmonary dysplasia in premature newborns with respiratory failure. J Pediatr. 2014; 164 (4): 744–8. https://doi.org/10.1016/j.jpeds.2013.11.040.
59. Banjanin N., Belojevic G. Relationship of dietary magnesium intake and serum magnesium with hypertension: a review. Magnes Res. 2021; 34 (4): 166–71. https://doi.org/10.1684/mrh.2021.0492.
60. Громова О.А., Торшин И.Ю. Магний и «болезни цивилизации». М.: ГЭОТАР-Медиа; 2018: 800 с.
61. Ye M., Li Q., Xiao L., Zheng Z. Serum magnesium and fractional exhaled nitric oxide in relation to the severity in asthma-chronic obstructive pulmonary disease overlap. Biol Trace Elem Res. 2021; 199 (5): 1771–7. https://doi.org/10.1007/s12011-020-02314-5.
62. López-Jaramillo P. Calcium, nitric oxide, and preeclampsia. Semin Perinatol. 2000; 24 (1): 33–6. https://doi.org/10.1016/s0146-0005(00)80052-x.
63. Vanhatalo A., Blackwell J.R., L'Heureux J.E., et al. Nitrate-responsive oral microbiome modulates nitric oxide homeostasis and blood pressure in humans. Free Radic Biol Med. 2018; 124: 21–30. https://doi.org/10.1016/j.freeradbiomed.2018.05.078.
64. Zhou L., Ding C., Wu J., et al. Probiotics and synbiotics show clinical efficacy in treating gestational diabetes mellitus: a meta-analysis. Prim Care Diabetes. 2021; 15 (6): 937–47. https://doi.org/10.1016/j.pcd.2021.08.005.
Об авторах
О. А. ГромоваРоссия
Громова Ольга Алексеевна - д.м.н., проф.
ул. Вавилова, д. 44, корп. 2, Москва, 119333
WoS ResearcherID J-4946-2017, Scopus Author ID 7003589812
И. Ю. Торшин
Россия
Торшин Иван Юрьевич - к.ф-м.н., к.х.н.
ул. Вавилова, д. 44, корп. 2, Москва, 119333
WoS ResearcherID C-7683-2018, Scopus Author ID 7003300274
Рецензия
Для цитирования:
Громова О.А., Торшин И.Ю. Систематический анализ молекулярных механизмов действия эссенциальных макро- и микронутриентов на нейротрансмиттерную и вазодилататорную молекулу оксида азота (NO). Эпилепсия и пароксизмальные состояния. 2024;16(4):385-401. https://doi.org/10.17749/2077-8333/epi.par.con.2024.208
For citation:
Gromova O.A., Torshin I.Yu. Systematic analysis of molecular mechanisms of action of essential macro- and micronutrients on the neurotransmitter and vasodilator molecule nitric oxide (NO). Epilepsy and paroxysmal conditions. 2024;16(4):385-401. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2024.208
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.







































