Перейти к:
Приступы с билатеральными тонико-клоническими судорогами и эпилептический статус при аутоиммунном энцефалите
https://doi.org/10.17749/2077-8333/epi.par.con.2025.215
Аннотация
Актуальность. Эпилептические приступы входят в диагностические критерии аутоиммунных энцефалитов (АЭ). Сроки развития эпилептических приступов с переходом в билатеральные тонико-клонические судороги (БТКС) и эпилептического статуса (ЭС) при АЭ изучены недостаточно.
Цель: сопоставить сроки развития эпилептических приступов с БТКС и ЭС с течением АЭ.
Материал и методы. Проведено обследование больных с АЭ, включавшее сбор анамнеза, лабораторное исследование крови и цереброспинальной жидкости, магнитно-резонансную томографию, продолженный электроэнцефалографический видеомониторинг. Обследован 41 пациент: 22 (54%) с диагнозом «возможный АЭ» и 19 (46%) с диагнозом «достоверный АЭ». У 36 (88%) больных в анамнезе отмечались эпилептические приступы с переходом в БТКС, в т.ч. с последующим развитием ЭС в 12 (29%) случаях.
Результаты. У 8 (22%) больных, включая 1 пациента с антителами к глутаматдекарбоксилазе (англ. glutamate decarboxylase 65, GAD65), единичный приступ с БТКС/ЭС являлся первым симптомом АЭ. В 8 (22%) наблюдениях АЭ манифестировал с фокальных приступов, приступы с БТКС и/или ЭС присоединялись позже. Этот вариант течения АЭ чаще всего наблюдался среди пациентов с анти-GAD65-ассоциированным энцефалитом (в 4 из 9 случаев). У 5 (14%) больных, у 2 из которых обнаружены антитела к миелиновому олигодендроцитарному гликопротеину, приступы с БТКС и ЭС наблюдались только в дебюте и при обострениях иммунного процесса.
Заключение. Эпилептические приступы с БТКС и ЭС наиболее часто возникают в дебюте АЭ. Анти-GAD65- ассоциированный энцефалит проявляется в виде длительно текущей фармакорезистентной эпилепсии с поздним присоединением приступов с БТКС и ЭС. В редких случаях АЭ с антителами к GAD65 эпилептические приступы случаются только в дебюте заболевания.
Ключевые слова
Для цитирования:
Максимова М.Ю., Головнёва Е.А., Брутян А.Г., Чеканова Е.О., Захарова М.Н. Приступы с билатеральными тонико-клоническими судорогами и эпилептический статус при аутоиммунном энцефалите. Эпилепсия и пароксизмальные состояния. 2025;17(1):40-47. https://doi.org/10.17749/2077-8333/epi.par.con.2025.215
For citation:
Maximova M.Yu., Golovneva E.A., Broutian A.G., Chekanova E.O., Zakharova M.N. Bilateral tonic-clonic seizures and status epilepticus in autoimmune encephalitis. Epilepsy and paroxysmal conditions. 2025;17(1):40-47. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2025.215
ВВЕДЕНИЕ / INTRODUCTION
Аутоиммунные энцефалиты (АЭ) представляют актуальную медико-социальную проблему [1]. В последние годы разработаны критерии, шкалы и предсказательные модели для диагностики АЭ [2–5].
Эпилептические приступы являются неотъемлемой частью клинической картины и входят в диагностические критерии АЭ. Эпилептические приступы с переходом в билатеральные тонико-клонические судороги (БТКС) у больных с АЭ возникают с частотой 25–77% от общего числа наблюдений, а эпилептический статус (ЭС) развивается в 18–53% случаев [6–12]. Согласно ранее проведенным исследованиям, к предрасполагающим факторам ЭС относятся изменения головного мозга, выявляемые при магнитно-резонансной томографии (МРТ) и электроэнцефалографии (ЭЭГ) [9]. При этом развитие ЭС длительностью более 30 мин ассоциируется с неблагоприятным прогнозом заболевания [8][13][14].
В работах других авторов установлено, что помимо ЭС прогностическое значение в развитии аутоиммунно-ассоциированной эпилепсии имеют приступы с переходом в БТКС [7]. Отмечено, что при АЭ предрасположенность к развитию эпилептических приступов с переходом в БТКС и ЭС зависит от типа антител (АТ). При АЭ с АТ к богатой лейцином инактивированной глиоме 1 (англ. leucine-rich glioma-inactivated 1, LGI1) приступы с переходом в БТКС возникают нечасто, но имеют тенденцию к статусному течению. Напротив, при аутоиммунно- ассоциированной эпилепсии с АТ к глутаматдекарбоксилазе (англ. glutamate decarboxylase 65, GAD65) развитие ЭС нехарактерно [10].
Ряд вопросов, в частности таких, как сама возможность появления эпилептических приступов с БТКС и ЭС в дебюте АЭ или после других типов приступов на фоне развернутой клинической картины АЭ, остаются не изученными до сих пор.
Цель – сопоставить сроки развития эпилептических приступов с БТКС и ЭС с течением АЭ.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
В одномоментное (поперечное) исследование включен 41 больной с АЭ в возрасте от 18 до 81 года (средний возраст 41,9±17 лет). Расчет объема выборки не проводился, поскольку исследование не являлось эпидемиологическим или экспериментальным. Анализировали данные анамнеза, лабораторных и инструментальных методов исследования больных с диагнозом «возможный АЭ» и «достоверный АЭ» [2].
Критерии включения и исключения / Incluson and exclusion criteria
Критерии включения пациентов в исследование были основаны на диагностических критериях «возможного АЭ»:
– подострое развитие (менее 3 мес) нарушений кратковременной памяти, когнитивных и психических расстройств, стволовой или мозжечковой симптоматики;
– наличие одного из следующих факторов: вновь возникшая очаговая симптоматика, впервые возникший эпилептический приступ, лимфоцитарный плеоцитоз в цереброспинальной жидкости (ЦСЖ) (более 5 клеток в 1 мкл), МРТ-признаки, характерные для АЭ.
Из исследования исключались пациенты с «возможным АЭ» или «достоверным АЭ» при отсутствии эпилептических приступов в анамнезе, а также больные с последствиями перенесенных острых нарушений мозгового кровообращения, объемными образованиями, аномалиями развития коры головного мозга.
Методы обследования / Examination methods
Сбор анамнеза
На основании анамнеза были уточнены сведения о развитии ЭС и эпилептических приступов с переходом в БТКС, сроках их возникновения в зависимости от дебюта АЭ и других типов приступов (согласно классификации Международной Противоэпилептической Лиги (англ. International League Against Epilepsy, ILAE) [15–17], а также о переходе острых симптоматических приступов в аутоиммунно-ассоцированную эпилепсию [18].
Лабораторные исследования
Лабораторные исследования включали общий анализ ЦСЖ, анализ крови и ЦСЖ на антинейрональные АТ, оценку типа синтеза олигоклональных АТ. Определяли АТ к GAD65, антигенам клеточной поверхности, миелиновому олигодендроцитарному гликопротеину (англ. myelin oligodendrocyte glycoprotein, МОG), внутриклеточным структурам.
Инструментальные исследования
МРТ проводили на аппаратах с индукцией магнитного поля не менее 1,5 Тл. При наличии показаний выполнялась МРТ на аппарате Magnetom Prisma (3 Тл) (Siemens, Германия) по эпилептологическому протоколу (англ. HARmoNising Brain Imaging MEthodS for VaScular Contributions to Neurodegeneration, HARNESS), при необходимости – с введением контрастного вещества. Во всех случаях АЭ оценивали наличие патологических изменений в ткани мозга: гиперинтенсивность медиальных отделов височных долей, очаговые или многоочаговые изменения серого и/или белого вещества [2], а также признаки склероза гиппокампа в случаях доказанной иммунной этиологии [18].
Видео-ЭЭГ-мониторинг длительностью от 10 до 24 ч выполняли на системах XLTEK (Natus, США) и BePlus LTM (EBNeuro, Италия) с наложением дополнительных электродов в области скуловой дуги. В ряде случаев видео-ЭЭГ-мониторинг проводили повторно, при этом для анализа были выбраны записи, сделанные в наиболее короткий срок по отношению ко времени манифестации АЭ. На ЭЭГ определяли наличие эпилептиформной активности и ее локализацию.
Статистический анализ / Statistical analysis
Статистический анализ полученных данных проводили с помощью компьютерной программы Microsoft Excel 2013 для Windows (Microsoft, США). Данные представлены в виде абсолютных (количество наблюдений) и относительных (проценты) значений.
РЕЗУЛЬТАТЫ / RESULTS
Общая характеристика пациентов с АЭ, включенных в исследование, представлена в таблице 1.
Таблица 1. Характеристика пациентов с аутоиммунным энцефалитом (n=41)
Table 1. Characteristics of patients with autoimmune encephalitis (n=41)
|
Параметр / Parameter |
Число пациентов, n (%) / Number of patients, n (%) |
|
Пол / Gender |
|
|
мужской / male |
13 (32) |
|
женский / female |
28 (68) |
|
Диагноз / Diagnosis |
|
|
возможный АЭ / suspected AE |
22 (54) |
|
достоверный АЭ / verified AE |
19 (46) |
|
Антитела / Antibodies |
|
|
к GAD65 / anti-GAD65 |
9 (47) |
|
к антигенам клеточной поверхности / anti-cell surface antigens |
5 (26) |
|
к MOG / anti-MOG |
4 (21) |
|
к внутриклеточным антигенам / anti-intracellular antigens |
1 (6) |
|
Данные МРТ / MRI data |
|
|
в медиальных отделах височных долей определяются области гиперинтенсивного сигнала в режиме FLAIR / FLAIR medial temporal lobe hyperintensity detected |
17 (41) |
|
в медиальных отделах левой височной доли определяется область гиперинтенсивного сигнала в режиме FLAIR / FLAIR left medial temporal lobe hyperintensity detected |
5 (12) |
|
многоочаговые изменения белого и/или серого вещества полушарий большого мозга // multifocal changes in cerebral hemisphere white and/or gray matter detected |
3 (7) |
|
гиперинтенсивный сигнал в режиме FLAIR от коры головного мозга / FLAIR cortical hypersensitivity detected |
2 (6) |
|
изменения в ткани мозга отсутствуют / no cerebral tissue changes detected |
14 (34) |
|
Эпилептиформная активность на ЭЭГ / EEG epileptic activity |
23 (56) |
|
в височной области / in temporal lobe |
20 (87) |
|
за пределами височной области / outside temporal lobe |
3 (13) |
|
Приступы с переходом в БТКС и/или ЭС в анамнезе // Focal-to-BTCS and/or SE in history |
36 (88) |
|
БТКС/ЭС в дебюте АЭ с последующим присоединением других типов приступов // BTCS/SE at AE onset followed by other seizure types |
15 (42) |
|
БТКС/ЭС после возникновения фокальных приступов без БТКС // BTCS/SE post-focal BTCS-free seizure |
8 (22) |
|
БТКС/ЭС только в дебюте АЭ без последующего присоединения приступов другой семиологии // BTCS/SE at AE onset only followed by no other seizure types |
8 (22) |
|
БТКС/ЭС в дебюте и при обострениях АЭ // BTCS/ES at AE onset and exacerbation |
5 (14) |
|
Отсутствие приступов с переходом в БТКС и/или ЭС // No focal-to-BTCS and/or SE |
5 (12) |
Лабораторные исследования / Laboratory tests
У 19 (46,3%) больных был верифицирован диагноз «достоверный АЭ»: при обнаружении АТ к GAD65 – у 9 (47%), к антигенам клеточной поверхности – у 5 (26%), к МОG – у 4 (21%), к внутриклеточным структурам – у 1 (6%). В 22 случаях диагноз «возможный АЭ» был основан на клинических данных при отсутствии патологических АТ. Длительность АЭ к моменту обследования составляла от 12 дней до 23 лет.
В 80% случаев проводилась люмбальная пункция. У 52% больных отсутствовали изменения в общем анализе ЦСЖ и выявлялся поликлональный тип синтеза АТ (1-й тип). Повышенный уровень белка и/или плеоцитоз в 48% случаев не ассоциировались с обнаружением АТ.
МРТ головного мозга / Brain MRI
Воспалительные изменения при МРТ были обнаружены у 27 (66%) больных. В 17 (41%) случаях при МРТ в режиме FLAIR выявлены области гиперинтенсивного сигнала в медиальных отделах обеих височных долей, в 5 (12%) – в медиальных отделах левой височной доли. У 3 (7%) анти-МОG-позитивных пациентов визуализированы множественные очаги демиелинизации в белом веществе полушарий большого мозга. Большинство из них имели типичную перивентрикулярную локализацию.
У 1 больного с АТ к МОG при МРТ в режиме FLAIR зарегистрирован гиперинтенсивный сигнал от коры левой теменной и затылочной долей. Этому пациенту был поставлен диагноз «МОG-ассоциированный энцефалит с односторонними корковыми FLAIR-гиперинтенсивными очагами и эпилептическими приступами» (англ. unilateral cortical FLAIR hyperintense Lesions in Anti-MOG-associated Encephalitis with Seizures, FLAMES). Поражение коры головного мозга также выявлено у 1 больного с серонегативным АЭ. У 14 (34%) пациентов изменений в ткани мозга по данным МРТ не выявлено.
В 4 из 5 случаев АЭ с АТ к антигенам клеточной поверхности, а также в 1 случае с АТ к внутриклеточным структурам при МРТ в режиме FLAIR выявлены области гиперинтенсивного сигнала в обеих височных долях. У больных с серонегативным АЭ при МРТ в 13 (59,1%) случаях определяли признаки одно- или двустороннего воспалительного процесса в медиальных отделах височных долей, в 8 (36,4%) случаях изменения мозга не были выявлены.
Видео-ЭЭГ-мониторинг / Video-EEG monitoring
У 36 (88%) больных в анамнезе отмечались приступы с переходом в БТКС, в т.ч. с последующим развитием ЭС в 12 (29%) случаях. В большинстве наблюдений (28 из 36) судорожные приступы являлись первым симптомом заболевания. У 15 (42%) пациентов, у которых АЭ манифестировал приступами с БТКС, впоследствии наблюдались другие фокальные приступы различной семиологии (моторные с автоматизмами, моторные тонические, немоторные сенсорные, немоторные вегетативные и др.).
У 8 (22%) больных единичный приступ с БТКС/ЭС являлся первым симптомом АЭ. Среди них мы наблюдали 1 пациента с анти-GAD65-энцефалитом и катамнезом более 5 лет. У 5 (14%) пациентов, 2 из которых являлись анти-МОG-позитивными, эпилептические приступы с переходом в БТКС возникали как в дебюте, так и в период обострения иммунного процесса.
У 8 (22%) больных АЭ манифестировал с фокальных приступов. Приступы с БТКС и/или ЭС присоединялись значительно позже. Данный вариант течения АЭ часто наблюдался среди пациентов с анти-GAD65-энцефалитом (в 4 из 9 случаев) (рис. 1). В 5 (12%) случаях эпилептических приступов с переходом в БТКС и/или ЭС не отмечено.
Эпилептические приступы с развитием БТКС и ЭС не были связаны со структурными изменениями при МРТ (табл. 2) и развитием аутоиммунно-ассоциированной эпилепсии (p>0,5) (табл. 3).
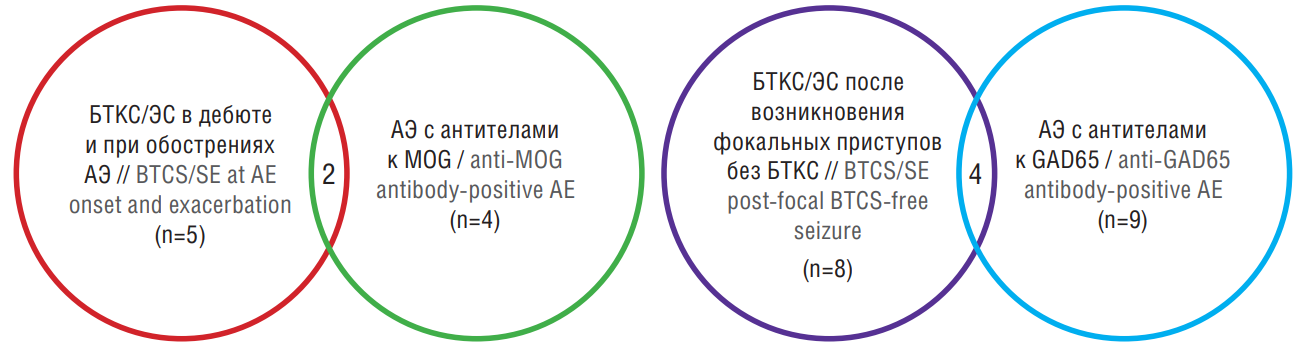
Рисунок 1. Сроки развития билатеральных тонико-клонических судорог (БТКС) или эпилептического статуса (ЭС) в клинической картине аутоиммунного энцефалита (АЭ) с антителами к миелиновому олигодендроцитарному гликопротеину (англ. myelin oligodendrocyte glycoprotein, МОG) и глутаматдекарбоксилазе (англ. glutamate decarboxylase 65, GAD65)
Figure 1. Timing of bilateral tonic-clonic seizure (BTCS) or status epilepticus (SE) development in clinical picture of anti-myelin oligodendrocyte glycoprotein (MOG) and anti-glutamate decarboxylase 65 (GAD65) antibody-positive autoimmune encephalitis (AE)
Таблица 2. Изменения при магнитно-резонансной томографии у пациентов с билатеральными тонико-клоническими судорогами (БТКС) или эпилептическим статусом (ЭС)
Table 2. Magnetic resonance imaging changes in patients with bilateral tonic-clonic seizures or status epilepticus
|
Изменения / Changes |
Количество больных, n / Number of patients, n |
Больные с БТКС/ЭС, n (%) // Patients with BTCS/SE, n (%) |
|
Область гиперинтенсивного сигнала в режиме FLAIR в медиальных отделах височных долей / FLAIR medial temporal lobe hyperintensity |
17 |
14 (82,3) |
|
Область гиперинтенсивного сигнала в режиме FLAIR в медиальных отделах левой височной доли / FLAIR left medial temporal lobe hyperintensity |
5 |
5 (100) |
|
Многоочаговые изменения белого и/или серого вещества полушарий большого мозга // Multifocal changes in cerebral hemisphere white and/or gray matter |
3 |
3 (100) |
|
Гиперинтенсивный сигнал в режиме FLAIR от коры головного мозга / FLAIR cortical hyperintensity |
2 |
1 (50) |
|
Всего / Total |
27 |
23 (85,2) |
|
Изменения в ткани мозга отсутствуют / No cerebral tissue changes |
14 |
13 (92,8) |
Примечание. FLAIR (англ. fluid attenuated inversion recovery) – режим восстановления с инверсией и ослаблением сигнала жидкости.
Note. FLAIR – fluid attenuated inversion recovery.
Таблица 3. Билатеральные тонико-клонические судороги (БТКС) или эпилептический статус (ЭС) у пациентов с аутоиммунно-ассоциированными эпилептическими приступами
Table 3. Bilateral tonic-clonic seizures or status epilepticus in patients with autoimmune-related seizures
|
Диагноз / Diagnosis |
Количество больных, n / Number of patients, n |
Больные с БТКС/ЭС, n (%) // Patients with BTCS/SE, n (%) |
|
Аутоиммунно-ассоциированная эпилепсия / Autoimmune-related epilepsy |
27 |
22 (81,5) |
|
Острые симптоматические приступы / Acute symptomatic seizures |
14 |
14 (100) |
Терапия / Therapy
Патогенетическое лечение иммуносупрессивными препаратами и/или плазмаферезом к моменту осмотра было проведено 28 (68%) пациентам.
Противоэпилептические препараты получали 37 (90%) больных. Исключение составляли 4 пациента:
– у 1 больного приступы возникали только при обострениях патологического процесса;
– 2 пациентов, несмотря на сохранение приступов, самостоятельно отменили терапию;
– у 1 пациента длительно после манифестации АЭ приступы отсутствовали, дозы препаратов были постепенно снижены и отменены врачом-эпилептологом.
ОБСУЖДЕНИЕ / DISCUSSION
Частота развития ЭС при АЭ варьирует от 18% до 53%, а эпилептические приступы с переходом в БТКС при различных серологических подтипах АЭ возникают с разной вероятностью, достигая 100% при выявлении АТ к рецептору гамма-аминомасляной кислоты [6–12].
В проведенном исследовании группы пациентов с БТКС и ЭС были объединены по ряду причин. Для нас имело особое значение то обстоятельство, что информация о наличии БТКС и ЭС в клинической картине АЭ в большинстве случаев уточнялась по анамнестическим сведениям. Это уже априорно не позволяет отграничить приступ с БТКС от судорожного ЭС и объясняет более высокий процент больных с БТКС/ЭС (88%) в нашем исследовании.
D. Dubey et al. (2018 г.) [4] и L. Cousyn et al. (2021 г.) [10] установили, что наиболее распространенными среди серопозитивных АЭ являются АТ к GAD65 и МОG. Наше исследование АЭ с эпилептическими приступами также свидетельствует о высокой частоте встречаемости анти-GAD65-энцефалита, который составил почти половину (47%) случаев серопозитивных АЭ.
L. Cousyn et al. (2021 г.) показали, что структурные изменения при МРТ у больных с АЭ ассоциируются с развитием ЭС [10]. В нашей работе подобная связь не обнаружена. Столь противоречивые результаты можно объяснить различием методических подходов. В исследование зарубежных авторов включались только серопозитивные пациенты с АЭ. Кроме того, не указаны сроки выполнения МРТ после перенесенного ЭС – возможно, выявленные изменения являлись постиктальными и носили временный, обратимый характер [10].
МРТ-картина пациентов с серонегативным подтипом АЭ отличалась значительным разнообразием (односторонняя/двусторонняя гиперинтенсивность медиальных отделов височных долей и области коры мозга в режиме FLAIR, отсутствие каких-либо изменений). Патологические АТ у пациентов с воспалительными изменениями при МРТ выявлены в анти-MOG-позитивных случаях АЭ, что согласуется с критериями диагностики анти-MOG-энцефаломиелитов [19]. При этом в 4 из 5 случаев серопозитивного подтипа АЭ с АТ к клеточной поверхности и внутриклеточным антигенам наблюдались билатеральные воспалительные изменения в медиальных отделах височных долей. Сходные данные получены M. de Mruijn et al. (2021 г.), установившими, что двусторонняя FLAIR-гиперинтенсивность медиальных отделов височных долей более характерна для пациентов с серопозитивным АЭ [20].
В большинстве случаев БТКС/ЭС наблюдались у пациентов в начале АЭ (28 из 36; 78%). Возобновление в дальнейшем приступов не зависело от обнаружения патологических АТ в дебюте АЭ. Среди 5 больных с БТКС/ЭС, возникающих только при обострении заболевания, у 2 обнаружены АТ к МОG. По данным J. Wang et al. (2021 г.) [21], Y. Wu et al. (2023 г.) [22], T. Yao et al. (2022 г.) [23], эпилептические приступы с переходом в БТКС являются одним из характерных симптомов анти-МОG-энцефалита. Однако отсутствие эпилептических приступов в период ремиссий свидетельствует об их остром симптоматическом характере. Что касается терапевтических стратегий, следует отметить, что основой терапии является воздействие на иммунную систему иммуносупрессорами. Длительное лечение противоэпилептическими препаратами в этих случаях не является обоснованным.
Отдельного обсуждения по результатам нашего исследования заслуживает следующий факт. При анти-GAD65-энцефалите эпилептические приступы с БТКС и ЭС в 4 из 9 случаев развивались спустя длительное время после манифестации АЭ с фокальных приступов. Диагностика АЭ у таких пациентов может быть отсрочена по нескольким причинам. Во-первых, больной может не знать о наличии у него приступов вследствие постприступной амнезии. Во-вторых, нередко имеет место несвоевременное обращение к неврологу в связи с немоторным характером фокальных приступов, интерпретирующихся пациентом и родственниками как неэпилептические состояния. Наличие в дебюте заболевания изолированных эпилептических приступов при отсутствии очаговой и общемозговой неврологической симптоматики также значительно затрудняет предположение об аутоиммунной этиологии заболевания. В более ранних публикациях описаны случаи АЭ с АТ к GAD65 и фенотипом фармакорезистентной эпилепсии в сочетании с умеренным снижением когнитивных функций [24][25]. При этом подчеркивается низкая эффективность не только противоэпилептических, но и иммуносупрессивных препаратов [26][27].
В соответствии с современными рекомендациями по диагностике аутоиммунно-ассоциированной эпилепсии обнаружение АТ к GAD65 дает возможность установить диагноз «эпилепсия» на ранних стадиях АЭ, т.к. при данном серологическом подтипе АЭ прогноз в отношении полного регресса пароксизмальных состояний является сомнительным. Описанные случаи благоприятного течения анти-GAD65-энцефалита с отсутствием эпилептических приступов при раннем начале патогенетического лечения предложено рассматривать в рамках аутоиммунно-ассоциированной эпилепсии с удовлетворительным ответом на терапию [18]. В нашей группе больных с анти-GAD65-эпилепсией также наблюдался пациент с однократно развившимся в дебюте заболевания ЭС и длительным катамнезом отсутствия пароксизмальных состояний в течение 5 лет. По нашему мнению, к постановке диагноза «эпилепсия» даже при наличии таких неблагоприятных прогностических факторов, как обнаружение АТ к GAD65, следует подходить осторожно.
Ограничения исследования / Limitations of the study
Настоящее исследование имеет некоторые ограничения. В анализ не включались пациенты с угнетенным сознанием и жизнеугрожающими состояниями, возникшими вследствие АЭ. МРТ, люмбальная пункция и ЭЭГ проводились в разные сроки от манифестации АЭ. Влияние патогенетической терапии на развитие аутоиммунно-ассоциированной эпилепсии не учитывалось, т.к. значительно различался период от дебюта АЭ до обследования (от 12 дней до 23 лет), а спустя менее 2 лет после появления острых симптоматических приступов оценить вероятность развития аутоиммунно-ассоциированной эпилепсии затруднительно. Оценка стойкой предрасположенности к эпилептическим приступам осложнялась тем, что большинству больных (37 из 41; 90%) даже после однократного приступа назначались противоэпилептические препараты, прием которых продолжался в момент исследования. Поскольку выборка является небольшой (n=41), оценки относительных частот остаются неопределенными.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Приступы с переходом в БТКС и ЭС могут быть одним из первых симптомов АЭ, а также развиваться на фоне развернутой клинической картины. В случаях длительного течения фармакорезистентной эпилепсии с поздним присоединением эпилептических приступов с БТКС и ЭС следует исключить иммунную этиологию заболевания, в частности анти-GAD65-энцефалит. Необходим взвешенный подход к постановке диагноза «аутоиммунно-ассоциированная эпилепсия» даже при выявлении АТ к GAD65 с учетом большого количества социальных и правовых ограничений, накладываемых болезнью на пациента.
Список литературы
1. Dubey D., Pittock S.J., Kelly C.R., et al. Autoimmune encephalitis epidemiology and a comparison to infectious encephalitis. Ann Neurol. 2018; 83 (1): 166–77. https://doi.org/10.1002/ana.25131.
2. Graus F., Titulaer M.J., Balu R., et al. A clinical approach to diagnosis of autoimmune encephalitis. Lancet Neurol. 2016; 15 (4): 391–404. https://doi.org/10.1016/S1474-4422(15)00401-9.
3. Dubey D., Singh J., Britton J.W., et al. Predictive models in the diagnosis and treatment of autoimmune epilepsy. Epilepsia. 2017; 58 (7): 1181–9. https://doi.org/10.1111/epi.13797.
4. Dubey D., Kothapalli N., McKeon A., et al. Predictors of neuralspecific autoantibodies and immunotherapy response in patients with cognitive dysfunction. J Neuroimmunol. 2018; 323: 62–72. https://doi.org/10.1016/j.jneuroim.2018.07.009.
5. Chang Y.C., Nouri M.N., Mirsattari S., et al. “Оbvious” indications for neural antibody testing in epilepsy or seizures: The ONES checklist. Epilepsia. 2022; 63 (7): 1658–70. https://doi.org/10.1111/epi.17238.
6. Lv R.J., Ren H.T., Guan H.Z., et al. Seizure semiology: an important clinical clue to the diagnosis of autoimmune epilepsy. Ann Clin Transl Neurol. 2018; 5 (2): 208–15. https://doi.org/10.1002/acn3.520.
7. Steriade C., Moosa A.N.V., Hantus S., et al. Electroclinical features of seizures associated with autoimmune encephalitis. Seizure. 2018; 60: 198–204. https://doi.org/10.1016/j.seizure.2018.06.021.
8. Zhang W., Wang X., Shao N., et al. Seizure characteristics, treatment, and outcome in autoimmune synaptic encephalitis: a long-term study. Epilepsy Behav. 2019; 94: 198–203. https://doi.org/10.1016/j.yebeh.2018.10.038.
9. Zhang Y., Deng C., Zhu L., Ling L. Predisposing factors and prognosis of status epilepticus in patients with autoimmune encephalitis. Medicine. 2020; 99 (13): e19601. https://doi.org/10.1097/MD.0000000000019601.
10. Cousyn L., Lambrecq V., Houot M., et al. Seizures in autoimmune encephalitis: specific features based on a systematic comparative study. Epileptic Disord. 2021; 23 (6): 879–92. https://doi.org/10.1684/epd.2021.1355.
11. Moise A.M., Karakis I., Herlopian A., et al. Continuous EEG findings in autoimmune encephalitis. J Clin Neurophysiol. 2021; 38 (2): 124–9. https://doi.org/10.1097/WNP.0000000000000654.
12. Langenbruch L., Spalke J., Krähling H., et al. Bilaterality of temporal EEG findings in limbic encephalitis compared to other mesiotemporal epilepsies – a retrospective cohort study. Seizure. 2022; 96: 98–101. https://doi.org/10.1016/j.seizure.2022.02.005.
13. Trinka E., Cock H., Hesdorffer D., et al. A definition and classification of status epilepticus – report of the ILAE Task Force on Classification of Status Epilepticus. Epilepsia. 2015; 56 (10): 1515–23. https://doi.org/10.1111/epi.13121.
14. Liu W.P., Wang M., Zhang C., et al. Application of the APE2-CHN and RITE2-CHN scores for autoimmune seizures and epilepsy in Chinese patients: a retrospective study. Seizure. 2020; 81: 63–70. https://doi.org/10.1016/j.seizure.2020.07.021.
15. Fisher R.S., Cross J.H., French J.A., et al. Operational classification of seizure types by the International League Against Epilepsy: Position Paper of the ILAE Commission for Classification and Terminology. Epilepsia. 2017; 58 (4): 522–30. https://doi.org/10.1111/epi.13670.
16. Scheffer I.E., Berkovic S., Capovilla G., et al. ILAE classification of the epilepsies: Position Paper of the ILAE Commission for Classification and Terminology. Epilepsia. 2017; 58 (4): 512–21. https://doi.org/10.1111/epi.13709.
17. Beniczky S., Tatum W.O., Blumenfeld H., et al. Seizure semiology: ILAE glossary of terms and their significance. Epileptic Disord. 2022; 24 (3): 447–95. https://doi.org/10.1684/epd.2022.1430.
18. Rada A., Bien C.G. What is autoimmune encephalitis-associated epilepsy? Proposal of a practical definition. Epilepsia. 2023; 64 (9): 2249–55. https://doi.org/10.1111/epi.17699.
19. Jarius S., Paul F., Aktas O., et al. MOG encephalomyelitis: international recommendations on diagnosis and antibody testing. J Neuroinflammation. 2018; 15 (1): 134. https://doi.org/10.1186/s12974-018-1144-2.
20. de Bruijn M.A.A.M., Bastiaansen A.E.M., Mojzisova H., et al. Antibodies contributing to focal epilepsy signs and symptoms score. Ann Neurol. 2021; 89 (4): 698–710. https://doi.org/10.1002/ana.26013.
21. Wang J., Qiu Z., Li D., et al. Clinical and imaging features of patients with encephalitic symptoms and myelin oligodendrocyte glycoprotein antibodies. Front Immunol. 2021; 12: 722404. https://doi.org/10.3389/fimmu.2021.722404.
22. Wu Y., Zhou H., Ci X., et al. Clinical characteristic of myelin oligodendrocyte glycoprotein antibody associated cortical encephalitis in adults and outcomes following glucocorticoid therapy. Front Aging Neurosci. 2023; 14: 1076361. https://doi.org/10.3389/fnagi.2022.1076361.
23. Yao T., Zeng Q., Xie Y., et al. Clinical analysis of adult MOG antibodyassociated cortical encephalitis. Mult Scler Relat Disord. 2022; 60: 103727. https://doi.org/10.1016/j.msard.2022.103727.
24. Daif A., Lukas R.V., Issa N.P., et al. Antiglutamic acid decarboxylase 65 (GAD65) antibody-associated epilepsy. Epilepsy Behav. 2018; 80: 331–6. https://doi.org/10.1016/j.yebeh.2018.01.021.
25. Errichiello L., Perruolo G., Pascarella A., et al. Autoantibodies to glutamic acid decarboxylase (GAD) in focal and generalized epilepsy: a study on 233 patients. J Neuroimmunol. 2009; 211 (1–2): 120–3. https://doi.org/10.1016/j.jneuroim.2009.04.010.
26. Cabezudo-García P., Mena-Vázquez N., Villagrán-García M., SerranoCastro P.J. Efficacy of antiepileptic drugs in autoimmune epilepsy: a systematic review. Seizure. 2018; 59: 72–6. https://doi.org/10.1016/j.seizure.2018.05.004.
27. Zhu F., Shan W., Lv R., et al. Clinical characteristics of GAD 65-associated autoimmune encephalitis. Acta Neurol Scand. 2020; 142 (3): 281–93. https://doi.org/10.1111/ane.13281.
Об авторах
М. Ю. МаксимоваРоссия
Максимова Марина Юрьевна, д.м.н., проф.
WoS Researcher ID: C-7408-2012. Scopus Author ID: 7003900736
Волоколамское ш., д. 80, Москва 125367
Е. А. Головнёва
Россия
Головнёва Евгения Алексеевна
Scopus Author ID: 57985980600
Волоколамское ш., д. 80, Москва 125367
А. Г. Брутян
Россия
Брутян Амаяк Грачевич, к.м.н.
Scopus Author ID: 57214245733
Волоколамское ш., д. 80, Москва 125367
Е. О. Чеканова
Россия
Чеканова Екатерина Олеговна
Scopus Author ID: 57214245733
Волоколамское ш., д. 80, Москва 125367
М. Н. Захарова
Россия
Захарова Мария Николаевна, д.м.н., проф.
Scopus Author ID: 57214245733
Волоколамское ш., д. 80, Москва 125367
Рецензия
Для цитирования:
Максимова М.Ю., Головнёва Е.А., Брутян А.Г., Чеканова Е.О., Захарова М.Н. Приступы с билатеральными тонико-клоническими судорогами и эпилептический статус при аутоиммунном энцефалите. Эпилепсия и пароксизмальные состояния. 2025;17(1):40-47. https://doi.org/10.17749/2077-8333/epi.par.con.2025.215
For citation:
Maximova M.Yu., Golovneva E.A., Broutian A.G., Chekanova E.O., Zakharova M.N. Bilateral tonic-clonic seizures and status epilepticus in autoimmune encephalitis. Epilepsy and paroxysmal conditions. 2025;17(1):40-47. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2025.215

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































