Перейти к:
Гипотезы развития и стратегии преодоления фармакорезистентности при эпилепсии. Часть II: Стратегии преодоления
https://doi.org/10.17749/2077-8333/epi.par.con.2025.211
Аннотация
На сегодняшний день единственным эффективным решением проблемы фармакорезистентности при эпилепсии, несмотря на сложность и риски отсутствия освобождения от приступов, является хирургическое лечение. За последнее время накоплен значительный массив данных о механизмах формирования фармакорезистентности, что позволяет разрабатывать инновационные стратегии ее преодоления. Появляются новые противоэпилептические препараты, активность которых направлена на непосредственную этиологию заболевания (многие из них находятся на стадии клинических испытаний). Интенсивно внедряются методы таргетной терапии, что в сочетании с инструментами прецизионной медицины потенциально позволит находить персонализованный подход к каждому отдельному пациенту. Создание моделей также выходит на качественно новый уровень, предоставляя исследователям возможность разработки высокоэффективных систем идентификации ранее неизвестных компонентов заболевания, оценки действия новых лекарственных средств. Целью настоящей статьи стало изучение существующих инновационных стратегий терапии эпилепсии и преодоления фармакорезистентности.
Ключевые слова
Для цитирования:
Якимов А.М., Тимечко Е.Е., Парамонова А.И., Васильева А.А., Рыбаченко Ф.К., Рыбаченко А.Д., Дмитренко Д.В. Гипотезы развития и стратегии преодоления фармакорезистентности при эпилепсии. Часть II: Стратегии преодоления. Эпилепсия и пароксизмальные состояния. 2025;17(1):59-70. https://doi.org/10.17749/2077-8333/epi.par.con.2025.211
For citation:
Yakimov A.M., Timechko E.E., Paramonova A.I., Vasilieva A.A., Rybachenko F.K., Rybachenko A.D., Dmitrenko D.V. Hypotheses of development and strategies for overcoming drug resistance in epilepsy. Рart II: Overcoming strategies. Epilepsy and paroxysmal conditions. 2025;17(1):59-70. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2025.211
ВВЕДЕНИЕ / INTRODUCTION
Фармакорезистентность представляет собой серьезную проблему для здравоохранения. Около 30% пациентов, страдающих эпилепсией, до сих пор не могут получить качественного лечения, подразумевающего избавление от приступов. Фармакорезистентная эпилепсия характеризуется высокой тяжестью заболевания и оказывает существенное влияние на качество жизни людей [1]. Помимо физических и социальных последствий повторяющихся приступов лекарственная устойчивость может привести к более высокому риску внезапной неожиданной смерти при эпилепсии (англ. sudden unexpected death in epilepsy, SUDEP) [2]. Таким образом, поиск эффективных стратегий лечения для преодоления лекарственной устойчивости при эпилепсии является одной из важнейших областей исследований в неврологии и эпилептологии.
На данный момент исследования по избавлению от фармакорезистентности при эпилепсии проводятся в множестве различных областей, начиная от повышения эффективности хирургических методов и заканчивая внедрением и разработкой персонализованных подходов к лечению для каждого пациента [3]. Масштабные профилирующие эксперименты демонстрируют высокий уровень экспрессионной изменчивости и проливают свет на патогенетические механизмы эпилептогенеза и формирования фармакорезистентности. Получаемые в ходе подобных исследований данные используются для разработки инновационных и комплексных терапевтических средств и подходов [4]. Развитие различных областей биологии привело к возможности создания различного рода моделей, отражающих различные существующие черты патологических фенотипов, а также к появлению сложных тест-систем поиска и оценки потенциальных терапевтических агентов [5].
Цель – изучение существующих инновационных стратегий терапии эпилепсии и преодоления фармакорезистентности.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Стратегия поиска / Search strategy
Проведен поиск литературы в базах данных PubMed/MEDLINE, Elsevier, Scopus и Google Scholar за последние 10 лет. Для запросов использовали следующие термины и связанные с ними синонимы: “drug resistant epilepsy”, “refractory epilepsy”, “pharmacoresistant epilepsy” в сочетании с отдельными ключевыми терминами: “treatment”, “overcome strategies”, “therapeutic strategies”. Также проанализированы некоторые более ранние работы, отобранные вручную из списков литературы обзорных статей. Все статьи опубликованы на английском и русском языках.
Отбор публикаций / Selection of publications
Рассмотрены оригинальные исследования, научные и систематические обзоры. В настоящий обзор включены публикации, основной темой которых являлось исследование стратегий преодоления фармакорезистентности при эпилепсии. Исключены дублирующие тексты, а также статьи, к которым отсутствовал полный доступ и не относящиеся к теме исследования. Процесс отбора был аналогичен таковому из первой части данных обзоров [6]. После процедуры отбора (рис. 1) в обзор вошла 81 публикация.
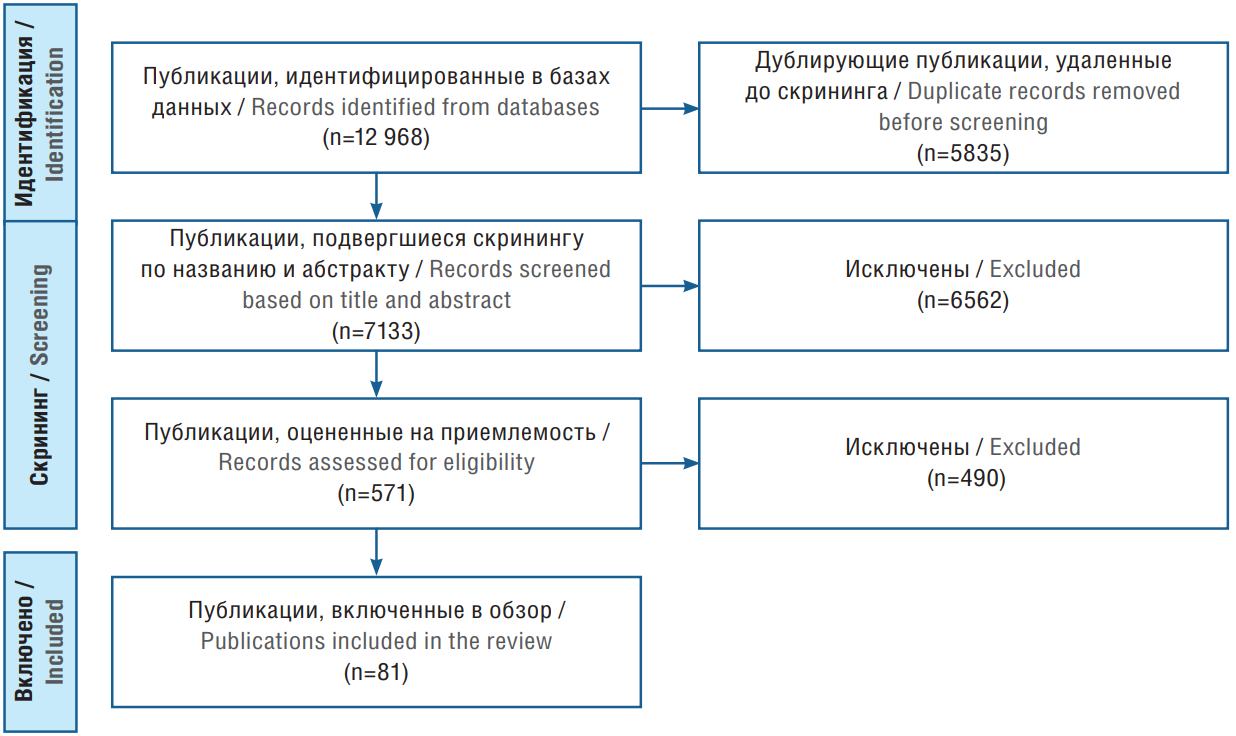
Рисунок 1. Блок-схема PRISMA (англ. Preferred Reporting Items for Systematic reviews and Meta-Analyses) отбора публикаций
Figure 1. PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses) flowchart for selection of publications
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Стратегии преодоления фармакорезистентности / Strategies for overcoming pharmacoresistance
На данный момент известно, что явление фармакорезистентности при эпилепсии может быть сопряжено с различного рода этиологией, отличаясь высокой вариабельностью и мультифакторностью [7]. При этом описанные в литературе механизмы фармакорезистентности не взаимоисключают друг друга, и вполне возможно наличие у одного пациента нескольких форм рефрактерности [3]. Соответственно имеющимся гипотезам подходы к избавлению от фармакорезистентности будут различаться от случая к случаю.
Хирургическое лечение
Резекция эпилептогенного очага
В настоящее время, несмотря на разработку большого количества новых противоэпилептических препаратов (ПЭП), 30% больных сталкиваются с фармакорезистентностью при височной эпилепсии [8]. При этом по эффективности хирургическое лечение превосходит медикаментозную терапию: за 1 год наблюдения избавиться от приступов в первом случае удалось у 58% пациентов против 8% во втором [9].
Наиболее эффективной процедурой в отношении избавления от эпилептических приступов является хирургическая резекция эпилептогенного очага [10]. Суть операции заключается в нарушении образовавшихся патологических нейронных сетей, вызванных эпилептогенезом [11]. Однако возможны сложности, связанные с возникновением множественных очагов, невозможностью определить зону начала приступа, а также с отказом пациентов от хирургического вмешательства [12].
Для преодоления части таких проблем в последнее время разрабатываются in silico методы моделирования эпилептических связей для выявления целевых регионов хирургического воздействия [13][14]. Они основаны на гипотезе возникновения эпилепсии в результате нарушения работы нейронный сетей головного мозга. Например, сетевой подход, представленный V.K. Jirsa et al. [13] включает следующие шаги:
– построение сетевой структуры на основе неинвазивной нейровизуализации с помощью магнитно-резонансной томографии (МРТ) или диффузионной МРТ для реконструкции топографии сети головного мозга и топологии соединений;
– функциональное сетевое моделирование установлением модели нейронной популяции на каждом узле сети;
– постановка гипотезы за счет идентификации структурных аномалий, которые могут быть ответственны за возникновение приступов;
– оценка виртуальной модели головного мозга путем моделирования, подбора данных и математического анализа, результатом чего будут являться наиболее вероятные закономерности эпилептического приступа [15].
К сильным преимуществам использования виртуального моделирования также относится возможность обнаружения скрытых и тяжело идентифицируемых эпилептогенных поражений, позволяющая снизить вероятность ошибки, обусловленной человеческим фактором, повысить объективность оценки и облегчить задачи врачей [16][17].
При этом существует некоторое количество различных подходов к моделированию резекции [16]. В настоящее время недостаточно данных для валидации эффекта от использования компьютерного моделирования. Существуют как исследования, дающие положительную оценку [18][19], так и вовсе противоположные данные [20].
Методы нейромодуляции
Другим методом хирургического лечения фармакорезистентной эпилепсии является имплантация нейромодуляционного аппарата. В основном нейромодуляция назначается неоперабельным пациентам [21]. Выделяется три основных подхода: стимуляция блуждающего нерва, глубокая стимуляция головного мозга в переднем ядре таламуса и замкнутая ответная нейростимуляция эпилептогенной зоны [22]. Все они основаны на электрической стимуляции мозга для снижения его возбудимости, что уменьшает частоту и тяжесть приступов [23].
Не до конца известно, как именно нейромодуляция позволяет контролировать приступы. Известно, по крайней мере, что стимуляция блуждающего нерва модулирует связность сети, способствуя реорганизации сети в однородное состояние и позволяя подавлять чрезмерную активацию при приступах [24].
Имплантация устройств для нейромодуляции имеет несколько преимуществ по сравнению с резекционной хирургией и медикаментозным лечением [25]:
– почти полное отсутствие системных или побочных эффектов;
– меньшая инвазивность по сравнению с резекционной хирургией;
– растущая эффективность с течением времени.
Главным минусом данной стратегии является обратимость результатов. Хотя многим удается достичь эффективного снижения частоты и тяжести приступов, освобождения от них обычно не происходит [26].
Медикаментозная терапия
Относительно медикаментозной терапии следует уточнить, что сам термин «противоэпилептический препарат» не в полной мере точен. Проблема заключается в том, что существующие на данный момент ПЭП являются симптоматическими противосудорожными средствами, которые борются с эпилептической активностью мозга, не модифицируя само заболевание [27][28]. При прекращении приема ПЭП может наблюдаться ситуация, при которой пациент не только не избавился от приступов, но и вернулся к изначальным показателям эпилептической активности мозга [29].
Еще одной проблемой нынешнего подхода к медикаментозному лечению является недостаток знаний относительно механизмов действия ПЭП вследствие случайности их открытия [28][30]. Причем характерно это как для старых препаратов [31], так и для новых [32]. Знание механизмов действия ПЭП необходимо для правильного выбора схемы медикаментозной терапии. Например, некоторые мутации в гене KCNQ2 могут приводить не к потере функции канала, а к ее усилению. В таком случае прием препаратов, активирующих калиевые каналы, может вызвать ухудшение состояния пациента [33].
Соответственно, преодоление фармакорезистентности с помощью медикаментозной терапии не должно ограничиваться только данными об эффективности конкретного препарата. На положительный исход лечения может влиять несколько факторов: возраст и пол пациента, риск взаимодействия «препарат – препарат» или «препарат – молекула не препарата», а также сопутствующие заболевания, к которым необходимо добавить все риски, описанные выше, связанные с механизмом действия препарата, этиологией заболевания, характером изменения биологической функции основной патологической мишени [34][35].
Для повышения эффективности разработки новых ПЭП вводятся новые программы скрининга химических соединений – например, Epilepsy Therapy Screening Program, основанная на поиске потенциальных препаратов с широким фармакологическим профилем [36].
В области медикаментозной терапии хорошим вариантом представляется разработка препаратов с таргетным действием. Например, в случае мутаций в определенных генах ионных каналов удачным терапевтическим подходом является идентификация и разработка селективных модуляторов ионных каналов. Так, уже существуют некоторые потенциальные терапевтические соединения (XEN901 [37], Prax330 [38]), которые обладают способностью специфической модуляции активности натриевых каналов при мутации в гене SCN8A, усиливающей функцию и вызывающей эпилептическую энцефалопатию.
Основным преимуществом XEN901 является его селективность. Известно, что зрелые нейроны центральной нервной системы преимущественно экспрессируют натриевые каналы Nav1.1 (SCN1A), Nav1.2 (SCN2A) и Nav1.6 (SCN8A). Первый является доминантной изоформой в тормозных интернейронах, и его блокада может провоцировать эпилептические приступы, а два последних специфичны для возбуждающих нейронов. К тому же нокаут изоморфы Nav1.6 подавляет судороги в каиновой модели эпилепсии. Таким образом, особенность XEN901 связана с селективным нацеливанием соединения на сайт связывания с Nav1.6 (в 100 раз более селективен относительно остальных изоморф натриевого канала), находящийся в потенциал-сенсорном домене IV (англ. voltage sensor domain IV). Это обеспечивает повышенную точность, воздействие на конкретный источник заболевания и меньшую эффективную концентрацию в плазме крови [37].
Клинические испытания проходят и другие таргетные медикаментозные препараты, модулирующие экспрессию гамма-аминомасляной кислоты (ГАМК), – ГАМКины. Среди таковых выделяется KRM-II-81, доклинический профиль которого показывает эффективность при лечении фармакорезистентных эпилепсий [39]. Список всех доступных в открытом доступе препаратов, проходящих клинические испытания, представлен в обзоре P. Klein et al. [40].
В случае повышенной экспрессии P-гликопротеина (англ. P-glycoprotein, P-gp) существует подход введения ингибиторов вместе с ПЭП. Комбинированное применение ПЭП и ингибиторов P-gp (например, тариквидара) позволяет увеличить концентрацию ПЭП до терапевтических уровней, улучшая контроль над приступами [41].
В целом существует определенный набор свойств, которыми должен обладать ингибитор для использования его в клинических целях [42][43]:
– необходимо высокое значение коэффициента разделения липид/вода для образования гидрофобных/ван-дер-ваальсовых взаимодействий лиганда с сайтом связывания P-gp;
– молекула должна иметь значительный молекулярный вес и иметь более 18 атомов для покрытия всех сайтов связывания;
– лиганд должен обеспечивать нуклеофильное взаимодействие с P-gp;
– необходимо включение хотя бы одного атома третичного азота, который генерирует катион при физиологическом pH и обусловливает ионное связывание.
Исследования по ингибированию P-gp осложнены тем, что изоферменты CYP450 имеют схожие структурные черты. Это делает ингибиторы неселективными по отношению к P-gp, что может приводить к нежелательным побочным эффектам [44]. Помимо прямого ингибирования P-gp эффективными являются варианты ингибирования модуляторов его экспрессии. Так, ингибирование COX-2 вызывает снижение экспрессии P-gp, что, в свою очередь, приводит к восстановлению противоэпилептической активности фенобарбитала [45]. Нестероидные противовоспалительные препараты также эффективны в преодолении повышенной экспрессии P-gp [46].
Генная терапия
Неврологические заболевания могут быть вызваны носительством генетических вариантов или приобретенными генетическими изменениями, причинами которых становятся влияние окружающей среды, травмы, события, связанные с патогенезом, воспалительные процессы. Эти факторы приводят к аномальному развитию нервной системы, нейродегенерации или нарушению функций нейронов [47].
Эпилептогенез – комплексный процесс, приводящий к повреждению головного мозга за счет патогенных механизмов гибели клеток, прорастания аксонов, нейрогенезу, реорганизации нейронных сетей, модуляции высвобождения тормозных и возбуждающих нейротрансмиттеров [48]. Причина возникновения таких процессов заключается в измененном экспрессионном профиле эпилептогенных тканей [49]. Одним из методов модуляции экспрессии генов является генная терапия.
Вектор-опосредованная генная терапия
Основной потенциальной стратегией генной терапии, опосредованной вирусными векторами, в настоящее время является использование векторов на основе аденоассоциированного вируса (англ. аdeno-associated virus, AAV) [50]. Для нужд генной терапии используется рекомбинантный вариант AVV, в котором отсутствует вирусная ДНК (rAAV). rAAV, несущие в себе целевой трансген, фланкированный инвертированными концевыми повторами, образуют конкатемеры, персистирующие в ядрах трансдуцированных клеток в виде эписом, не интегрируясь при этом в геном клетки [51]. Основными преимуществами AAV при генной терапии неврологических заболеваний являются высокая трансдукционная способность некоторых из них в отношении нейрональных тканей и отсутствие токсичности для клеток [52]. Описано множество серотипов AAV, которые отличаются как минимум свойствами капсида, что обеспечивает их тропическую дифференциацию. Специфичность в отношении центральной нервной системы имеют следующие серотипы AAV: AAV1, AAV2, AAV4, AAV5, AAV7, AAV9, AAV10, AAV11 [53].
Также помимо AAV в качестве вирусного вектора могут использоваться лентивирусы и вирус простого герпеса. Они применяются реже в сравнении с AAV по нескольким причинам. Несмотря на значительно более высокий объем вектора, большие размеры лентивирусной частицы ограничивают ее обширную тканевую трансдукцию до локальной области, что, однако, в некоторых случаях может оказаться и плюсом. Но большую обеспокоенность вызывает то, что лентивирус способен инициировать инсерционный мутагенез. А вирус простого герпеса, хоть и обладает нейтротропизмом, может иметь побочные эффекты, такие как нейротоксичность и иммунный ответ [54].
Есть исследования, подтверждающие высокую эффективность терапевтического подхода к лечению фармакорезистентной эпилепсии путем генной терапии с помощью вирусных векторов. Так, существует подход доставки вирусным вектором AAV9 интерферирующего агента на основе микроРНК, направленного на специфичную репрессию гена GluK2, кодирующего субъединицу каинатного рецептора, одного из типов глутаматных рецепторов. Отмечена высокая трансдукционная способность клеток центральной нервной системы в общем и нейронов в частности, что в результате позволило снизить уровень содержания белков GluK2 и эпилептиформную активность in vivo на пилокарпиновой модели мышей, а также на срезах гиппокампа пациентов с фармакорезистентной височной эпилепсией [55].
Помимо прямого влияния на ассоциированные с эпилепсией каналы существует и подход ингибирования экспрессии регуляторов естественных противосудорожных веществ – например, подавление экспрессии аденозинкиназы (регулятора эндогенного противосудорожного вещества аденозина) с помощью доставки антисмысловых олигонуклеотидов, вызывающих РНК-интерференцию гена ADK, вирусным вектором на основе AAV8. Так, у трансгенных мышей ADK-tg со спонтанными рецидивирующими эпилептическими приступами в результате инъекции вирусного вектора было достигнуто полное избавление от приступов [56].
Терапевтического эффекта также можно добиться доставкой с помощью векторов и прямых ингибирующих агентов, например нейропептидов. Достаточно хорошо изучен нейропептид Y (англ. neuropeptide Y, NPY). Он экспрессируется в центральной и периферической нервных системах, но, что наиболее важно, действует в качестве противоэпилептического химического агента, ингибируя возбудимость нейронов и подавляя судороги [57]. Так, в каиновой модели крыс односторонняя инъекция rAAV с комбинированным трансгеном NPY и его рецептора Y2 (NPY/Y2) в эпилептический очаг повышала уровень NPY в клетках гиппокампа, что позволяло эффективно снижать частоту спонтанных приступов до 80% [58]. Такие данные по противоэпилептическому эффекту при доставке NPY и Y2 вместе или изолированно многократно подтверждаются [59].
Еще одним примером эффективности нейропептидов является доставка динорфина, действующего как эндогенный модулятор возбудимости нейронов, опосредованная AAV. При гиперстимуляции, характерной для приступов, динорфины высвобождаются из нейронов и связываются каппа-опиоидными рецепторами нейронов, подавляя возбуждающую нейротрансмиссию. Инъекция в эпилептический очаг и последующая сверхэкспрессия динорфина в каиновой мышиной модели позволила не только снизить частоту приступов в течение нескольких дней, но и полностью избавить от них модельных животных спустя 2 мес. Также у мышей со сверхэкспрессией динорфина в гиппокампе наблюдались сохранение функций обучения и памяти в процессе эпилептогенеза и восстановление этих функций при хронической эпилепсии, в т.ч. с клиническими проявлениями. Эффективность была подтверждена и на человеческой ткани, полученной после резекции гиппокампа у пациентов с фокальной височной эпилепсией [60]. Преимуществом такого подхода является возможность воздействия на целевые клетки, находящиеся на удалении от места высвобождения нейропептида [61].
Несмотря на то что векторная доставка терапевтических препаратов выглядит перспективной областью развития подходов к лечению эпилепсии, она все же имеет ряд ограничений [62][63]:
– ограниченная емкость вирусного вектора;
– сложности обеспечения нормального сплайсинга и посттранскрипционного процессинга;
– потенциальный иммунный ответ на вирусный вектор;
– мультифакторность эпилепсии;
– недостаточная трансдукционная способность.
CRISPR/Cas9-опосредованная терапия
Появление технологий генного редактирования подтолкнуло научное сообщество к разработке методов изменения генома для достижения терапевтического эффекта [64]. Одним из наиболее популярных и привлекающих к себе внимание методов редактирования генов является использование прокариотической адаптивной иммунной системы CRISPR/Cas9 [65], которая относительно недавно была адаптирована для редактирования генома эукариотических клеток [66].
Механизм такого способа редактирования генома основан на действии комплекса гид-РНК и белка Cas9. Гид-РНК выступает в качестве наводящей молекулы, которая комплементарно соединяется со специфичной последовательностью ДНК, после чего белок Cas9, обладая эндонуклеазной активностью, совершает двуцепочечный разрыв и происходит вставка желаемого фрагмента ДНК [67]. Однако в отношении нейронов и постмитотических клеток существует вероятность нецелевого встраивания [68], что является одной из проблем использования данного метода при лечении неврологических заболеваний [69].
Помимо метода CRISPR/Cas9 в качестве системы точного генного редактирования могут использоваться другие комплексы, несущие в своей основе сайт-специфические нуклеазы, например нуклеазы, содержащие мотив цинкового пальца (англ. zinc-finger nuclease, ZNF), или эффекторные нуклеазы, подобные активатору транскрипции (англ. transcription activator-like effector nuclease, TALEN) [70]. Однако система CRISPR/Cas9 имеет существенные преимущества перед другими: ZNF и TALEN требуют гораздо более сложной процедуры для нацеливания на таргетные сайты, имеют значительно больший размер, они могут вызывать цитотоксичность, а также нецелевые эффекты [71].
Помимо прямого изменения интересующей последовательности ДНК система CRISPR/Cas9 может являться инструментом модуляции транскрипции генов за счет воздействия на промоторную область (такой подход называется CRISPR-активацией (CRISPRa)), а также ингибитором экспрессии генов на уровне трансляции (CRISPR-интерференция (CRISPRi)) [72]. Достигаются подобные эффекты за счет использования в комплексе специально сконструированного варианта Cas9 с дефицитом нуклеазной активности (dCas9), что позволяет нацеливать систему на специфичный участок ДНК, но без ее расщепления [73].
Технология CRISPR/Cas9 может рассматриваться в качестве потенциальной терапии в лечении неврологических заболеваний. Мутация в гене APP, ассоциированная с болезнью Альцгеймера, приводит к повышенному протеолизу белка – предшественника амилоида в бета-амилоид (Aβ). Человеческие фибробласты с такой мутацией в гене трансфекцировались плазмидой, содержащей систему CRISPR/Cas9, нацеленную на указанный мутантный сайт. После трансфекции клетки геном клеток успешно редактировался, что приводило к снижению образования Aβ40 и Aβ42 [74].
На данный момент существуют исследования на экспериментальных моделях эпилепсии, показывающие эффективность использования систем на основе CRISPR/Cas9. Так, в модели синдрома Драве (тяжелой эпилептической энцефалопатии, обусловленной потерей функции гена SCN1A в результате мутации в нем) была использована система CRISPRa, активирующая дефектный ген. В результате удалось повысить уровни экспрессии гена SCN1A, что значительно увеличило уровни мембраносвязанного канала Nav1.1 и позволило восстановить нормальную функцию тормозных интернейронов [75]. Схожие результаты получены и при использовании системы CRISPRa для модуляции экспрессии гена KCNA1, кодирующего белок Kv1.1. В данном случае интерес представляла возможность терапии приобретенных негенетических заболеваний. Показано, что активировать транскрипцию можно и in vitro, и in vivo, тем самым значительно модулируя возбудимость нейронов [62].
Также генное редактирование потенциально крайне эффективно в случае каналопатий, что может позволять воздействовать на мутированные генетические варианты, приводящие к фармакорезистентности [61].
Терапия стволовыми клетками
Стволовые клетки – клетки, обладающие способностью дифференциации в специфичные постмитотические клеточные линии, что позволяет формировать определенные типы клеток и тканей. Потенциальная эффективность стволовых клеток в качестве терапевтического агента обусловлена регенерацией тканей, способствующей восстановлению и интеграции дисфункциональных нейронных цепей в физиологически нормальное состояние [76].
Одним из подходов терапии стволовыми клетками является трансплантация в эпилептический очаг клеток, способных высвобождать тормозной нейромедиатор ГАМК, компенсируя усиленную возбуждающую активность и производя противосудорожное действие. Существует ряд исследований, подтверждающих эффективность данного подхода, однако сообщается лишь о временном эффекте [77]. Помимо статистически значимой терапевтической пользы, клеточная терапия выглядит безопасной, т.к. на данный момент отсутствуют свидетельства серьезных побочных явлений [78].
Однако применение стволовых клеток не ограничивается только терапевтическим потенциалом. Большим прорывом в области исследований патогенетических механизмов эпилепсии и фармакорезистентности является использование стволовых клеток в качестве моделей эпилепсии. В сочетании с методами редактирования генома стало возможным создавать тест-системы как для поиска генов, участвующих в патогенетических путях, так и для испытания новых методов терапии [5]. Например, из плюрипотентных стволовых клеток успешно получены нейроны и мозаичные нейросферы для идентификации синаптической дисрегуляции и эффективности фармакологических соединений при синдроме Рекка [79].
Прецизионная медицина
Термин «прецизионная медицина» не имеет единой дефиниции, но подразумевает следующие обязательные аспекты [80]:
– персонализованная стратегия лечения, заключающаяся в лечении, направленном на выявление у пациентов генетических, биомаркерных, фенотипических и психосоциальных характеристик, которые могли бы отличить его от других пациентов со схожими клиническими проявлениями;
– сбор и анализ данных пациентов для разделения их на новые подгруппы с целью поиска общих компонентов восприимчивости и течения заболевания, что позволяет находить более точные терапевтические подходы.
Одним из основных методов прецизионной медицины является секвенирование нового поколения [81], которое может обеспечить диагноз у 30% пациентов с генетической эпилепсией [82] (при этом 70% всех эпилепсий имеют генетический компонент [83]). Важным аспектом является то, что такой анализ позволяет как упростить постановку диагноза, так и уточнить этиологию заболевания и выработать персонализованный подход к лечению. Это возможно посредством аннотации генома пациента на молекулярном уровне, благодаря чему можно воздействовать не только на симптоматику, но и на непосредственную причину заболевания [84][85].
Необходимость внедрения методов прецизионной медицины обусловлена потребностью в комплексной оценке и структурировании получаемой информации, в учете не только эффектов одного патогенного варианта, но и функциональных изменений во всем организме, которые этот патогенный вариант несет [86]. Показательным примером являются онкологические заболевания. Так, международный проект Американской ассоциации раковых заболеваний Genomics Evidence Neoplasia Information Exchange (AACR Project GENIE) оценивает в 30% вероятность того, что после секвенирования будет найдена мутация, воздействие на которую возможно с помощью существующей таргетной терапии [87].
На данный момент уже известны некоторые гены, ассоциированные с фармакорезистентной эпилепсией [88], обнаружение которых, например, в случае мутаций в ионных каналах, позволяет выбрать наиболее эффективный терапевтический подход [89]. Таким примером прецизионной медицины в терапии трудноизлечимых эпилепсий может быть синдром Драве. Мутация в гене субъединицы альфа-1 потенциал-зависимого кальциевого канала (SCN1A) приводит к снижению активности тормозных нейронов вследствие потери функции белка, в результате повышая общую возбудимость коры головного мозга [90–91]. А препараты, блокирующие натриевые каналы (ламотриджин, карбамазепин, окскарбазепин, фенобарбитал, фенитоин, вигабатрин, руфинамид), наоборот, вызывают усиление эпилептиформной активности [92]. Однако единственным до недавнего времени эффективным подходом к терапии было назначение стирипентола в сочетании с вальпроевой кислотой и клобазамом [93, 94]. В настоящее время используется фенфлурамин, показывающий долгосрочный эффект освобождения от приступов [95].
Перспективы и нерешенные проблемы / Prospects and unresolved issues
На сегодняшний день тема механизмов фармакорезистентности, а также стратегий преодоления данных состояний вызывает большой интерес в научном сообществе. Ведущаяся работа позволяет разрабатывать новейшие методы, способствующие решению вышеописанных проблем. Некоторые из существующих на данный момент подходов к преодолению фармакорезистентности с основными патогенетическими механизмами представлены на рисунке 2.
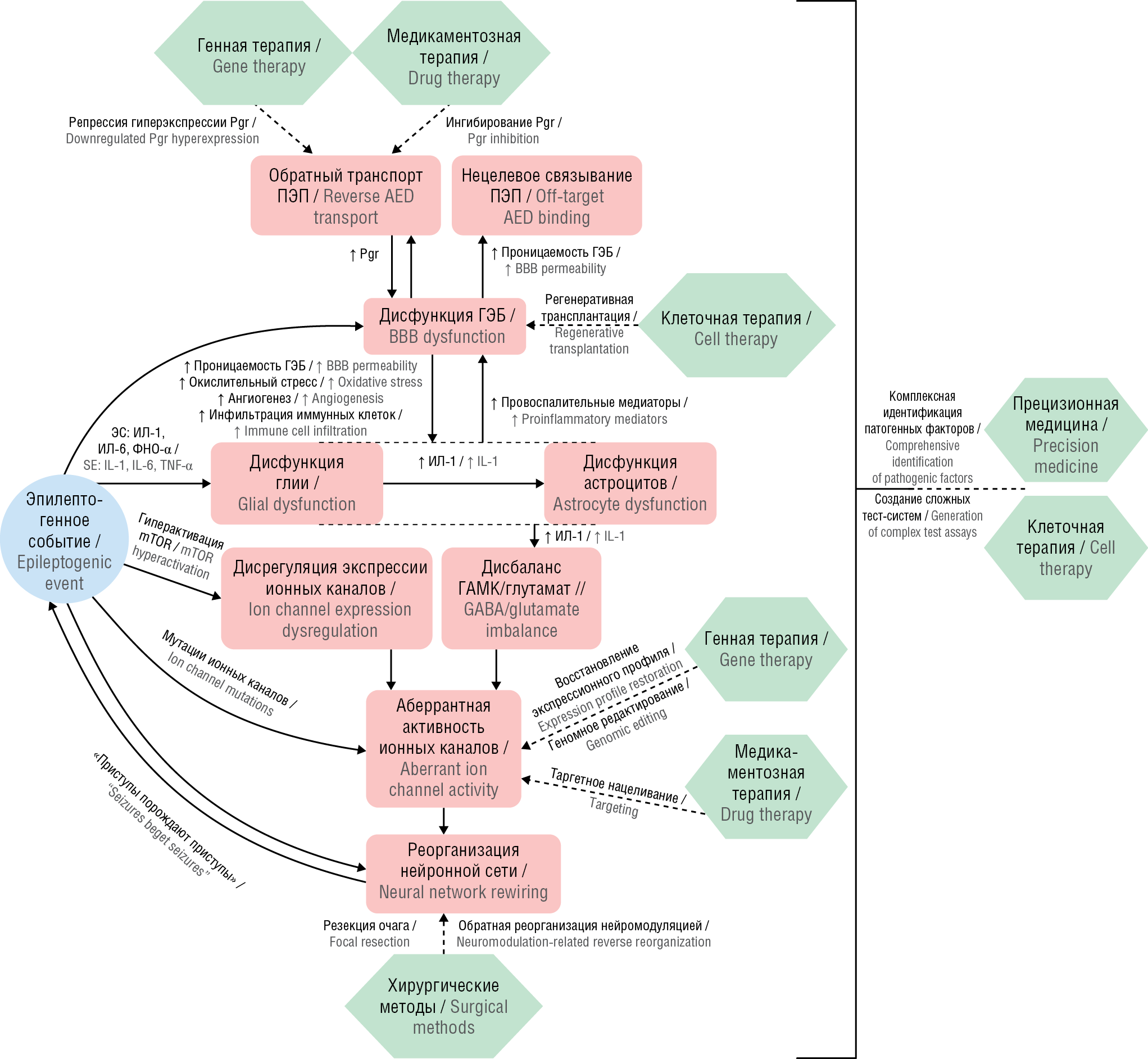
Рисунок 2. Патогенетические пути фармакорезистентности при эпилепсии и потенциальные механизмы их преодоления. Pgr (англ. P-glycoprotein) – P-гликопротеин; ПЭП – противоэпилептический препарат; ГЭБ – гематоэнцефалический барьер; ЭС – эпилептический статус; ИЛ – интерлейкин, ФНО-α – фактор некроза пухоли альфа; mTOR (англ. mammalian target of rapamycin) – мишень рапамицина у млекопитающих; ГАМК – гамма-аминомасляная кислота
Figure 2. Pathogenetic pathways of epilepsy-related drug resistance and potential overcoming mechanisms. Pgr – P-glycoprotein; AED – antiepileptic drug; BBB – blood-brain barrier; SE – status epilepticus; IL – interleukin, TNF-α – tumor necrosis factor alpha; mTOR – mammalian target of rapamycin; GABA – gamma-aminobutyric acid
В качестве одного из таких методов можно выделить секвенирование нового поколения, которое потенциально решает, по сути, обе важные задачи, стоящие перед терапией рефрактерной эпилепсии: объяснение механизмов ее появления и обеспечение персонализованного подхода к лечению. Действительно, тот факт, что фармакорезистентность носит гетерогенный характер, по своей природе не позволяет подобрать универсальный терапевтический подход к избавлению от приступов при трудноизлечимых формах эпилепсии. Благодаря секвенированию становится возможным анализировать панели генов, выявляя истинную этиологию заболевания.
Но остается еще несколько нерешенных проблем: в массе медикаментозные препараты способны действовать на одну определенную мишень, а их множественные эффекты (если они присутствуют) неясны [28]; все существующие препараты никак не модулируют заболевание. В этом отношении благодаря прогрессу в понимании молекулярных механизмов патогенеза и совершенствованию дизайна векторов, поиску терапевтических мишеней и методов доставки генная терапия становится потенциально высокоэффективным подходом к лечению неврологических заболеваний [47].
Генная терапия на основе векторной доставки способна решить указанные проблемы. Уже существуют исследования, демонстрирующие способность специфично доставлять трансгены сразу нескольких белков, – например, доставка NPY и его рецептора [58]. А использование, к примеру, системы CRISPR/dCas9 дает возможность непосредственно модулировать этиологию некоторых форм эпилепсии, как в случае модуляции экспрессии гена SCN1A [74]. Кроме того, генно-терапевтический подход позволяет восстанавливать утраченные функции и заменять потерянные в процессе заболевания клетки [47].
Вирусные векторы представляются достаточно эффективными агентами генной терапии, однако имеют ряд ограничений и недостатков [54]:
– различия в цикле (начиная от производства и заканчивая применением вектора) создают неопределенность в итоговых эффектах;
– возможен иммунный ответ, что влечет за собой риски для здоровья и снижение эффективности трансдукции;
– при применении в клинической практике потребуются бо́льшие концентрации вирусного вектора, чем при применении в модели на мелких животных;
– существуют риски инсерционного мутагенеза;
– генная терапия с применением вирусных векторов ограничена локальностью трансдукционного эффекта.
Система CRISPR/Cas9 имеет очевидные преимущества. Так, например, платформа CRISPRa:
– является универсальной, поскольку для выбора целевого гена требуется только изменение последовательности одноцепочечной направляющей РНК;
– не оказывает влияния на сплайсинг и последующий биогенез белков [96];
– за счет правильного подбора вирусных векторов позволяет нацеливаться на специфические нейроны;
– не вызывает побочных эффектов при применении, т.к. воздействует только на промоторную область специфичных клеток [97].
Подход к регуляции генов на основе dCas9 также имеет ряд преимуществ, обеспечивая высокую специфичность модуляции экспрессии, отсутствие риска расщепления ДНК, а также решает проблему утраты способности постмитотических нейронов к гомологичной рекомбинации [75].
Таким образом, складывается своеобразный конвейер, который включает методы из разных существующих подходов преодоления фармакорезистентности. Начав с подходов прецизионной медицины, можно классифицировать пациентов в специфичные по форме заболевания подгруппы. Собранные данные предоставят значительную информацию, на основе которой возможно более прицельное исследование механизмов патологии интересующих пациентов. После этого можно разрабатывать таргетные препараты на основе химических веществ либо доставки векторных вакцин.
Однако такой подход связан с большим количеством трудностей. Внедрение секвенирования в массовую клиническую практику осложнено необходимостью знания самими клиницистами патологических геномных вариантов и понимания технологии, используемой для генетического анализа [98]. Сам по себе анализ больших биологических и клинических данных сопряжен с массой собственных проблем, которые включают стандартизацию данных, клинических определений, обучение медицинского персонала и создание больших сетей с возможностью обмена опытом [99]. Также имеется много сложностей с векторными препаратами, основными из которых являются высокая стоимость и отсутствие гарантии безопасности [100].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Проблемы фармакорезистентности при эпилепсии и ее преодоления очень актуальны для современной медицинской науки. Появление и развитие таких технических средств, как, например, секвенирование нового поколения, способствуют качественному и высокопроизводительному исследованию причин и механизмов патогенеза заболевания. Технический прогресс позволяет как разрабатывать инновационные стратегии лечения (к примеру, таргетная генная терапия), так и модернизировать уже существующие способы медикаментозной терапии.
Однако данный процесс идет не так быстро, как хотелось бы, вследствие высокой гетерогенности заболевания и большого количества механизмов патогенеза как самой эпилепсии, так и ее фармакорезистентной формы. Несмотря на это, усилия, прилагаемые к исследованиям, разработке и внедрению стратегий преодоления фармакорезистентности, открывают многообещающие перспективы терапии не только в случае новых механизмов действия медикаментозных препаратов, но и в случае подходов, направленных на конкретные механизмы патогенеза заболевания.
Список литературы
1. Lerche H. Drug-resistant epilepsy – time to target mechanisms. Nat Rev Neurol. 2020; 16 (11): 595–6. https://doi.org/10.1038/s41582-020-00419-y.
2. Devinsky O., Hesdorffer D.C., Thurman D.J., et al. Sudden unexpected death in epilepsy: epidemiology, mechanisms, and prevention. Lancet Neurol. 2016; 15 (10): 1075–88. https://doi.org/10.1016/S1474-4422(16)30158-2.
3. Löscher W., Potschka H., Sisodiya S.M., Vezzani A. Drug resistance in epilepsy: clinical impact, potential mechanisms, and new innovative treatment options. Pharmacol Rev. 2020; 72 (3): 606–38. https://doi.org/10.1124/pr.120.019539.
4. Dhureja M., Chaturvedi P., Choudhary A., et al. Molecular insights of drug resistance in epilepsy: multi-omics unveil. Mol Neurobiol. 2025; 62 (1): 1–17. https://doi.org/10.1007/S12035-024-04220-6.
5. Noebels J. Pathway-driven discovery of epilepsy genes. Nat Neurosci. 2015; 18 (3): 344–50. https://doi.org/10.1038/NN.3933.
6. Якимов А.М., Тимечко Е.Е., Парамонова А.И. и др. Гипотезы развития и стратегии преодоления фармакорезистентности при эпилепсии. Часть I: Гипотезы развития. Эпилепсия и пароксизмальные состояния. 2024; 16 (4): 375–84. https://doi.org/10.17749/2077-8333/epi.par.con.2024.210.
7. Mesraoua B., Brigo F., Lattanzi S., et al. Drug-resistant epilepsy: definition, pathophysiology, and management. J Neurol Sci. 2023; 452: 120766. https://doi.org/10.1016/j.jns.2023.120766.
8. Kalilani L., Sun X., Pelgrims B., et al. The epidemiology of drugresistant epilepsy: a systematic review and meta-analysis. Epilepsia. 2018; 59 (12): 2179–93. https://doi.org/10.1111/EPI.14596.
9. Wiebe S., Blume W.T., Girvin J.P., Eliasziw M. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 2001; 345 (5): 311–8. https://doi.org/10.1056/NEJM200108023450501.
10. Rugg-Gunn F., Miserocchi A., McEvoy A. Epilepsy surgery. Pract Neurol. 2020; 20 (1): 4–14. https://doi.org/10.1136/practneurol-2019-002192.
11. Prakash C., Sharma D., Kumar P., et al. Epilepsy networks and their surgical relevance. Brain Sci. 2023; 14 (1): 31. https://doi.org/10.3390/brainsci14010031.
12. Jobst B.C., Cascino G.D. Resective epilepsy surgery for drug-resistant focal epilepsy: a review. JAMA. 2015; 313 (3): 285–93. https://doi.org/10.1001/jama.2014.17426.
13. Jirsa V.K., Proix T., Perdikis D., et al. The Virtual Epileptic Patient: individualized whole-brain models of epilepsy spread. Neuroimage. 2017; 145 (Pt B): 377–88. https://doi.org/10.1016/j.neuroimage.2016.04.049.
14. Bassett D.S., Zurn P., Gold J.I. On the nature and use of models in network neuroscience. Nat Rev Neurosci. 2018; 19 (9): 566–78. https://doi.org/10.1038/S41583-018-0038-8.
15. Kramer M.A., Cash S.S. Epilepsy as a disorder of cortical network organization. Neuroscientist. 2012; 18 (4): 360–72. https://doi.org/10.1177/1073858411422754.
16. Kini L.G., Bernabei J.M., Mikhail F., et al. Virtual resection predicts surgical outcome for drug-resistant epilepsy. Brain. 2019; 142 (12): 3892–905. https://doi.org/10.1093/brain/awz303.
17. Müller M., Rummel C., Schindler K., Steimer A. Virtual resection for predicting the outcome of epilepsy surgery. Epileptologie. 2018; 35: 162–70.
18. Nissen I.A., Millán A.P., Stam C.J., et al. Optimization of epilepsy surgery through virtual resections on individual structural brain networks. Sci Rep. 2021; 11 (1): 19025. https://doi.org/10.1038/s41598-021-98046-0.
19. Kalitzin S., Petkov G., Demuru M., Widman G. Prospecting epilepsy surgery outcome using virtual resection paradigm. Computationalmodel validation. In: 2020 IEEE Conference on Computational Intelligence in Bioinformatics and Computational Biology (CIBCB). https://doi.org/10.1109/CIBCB48159.2020.9277710.
20. Demuru M., Zweiphenning W., van Blooijs D., et al. Validation of virtual resection on intraoperative interictal data acquired during epilepsy surgery. J Neural Eng. 2020; 17 (6). https://doi.org/10.1088/1741-2552/abc3a8.
21. Davis P., Gaitanis J. Neuromodulation for the treatment of epilepsy: a review of current approaches and future directions. Clin Ther. 2020; 42 (7): 1140–54. https://doi.org/10.1016/j.clinthera.2020.05.017.
22. Ryvlin P., Rheims S., Hirsch L.J., et al. Neuromodulation in epilepsy: state-of-the-art approved therapies. Lancet Neurol. 2021; 20 (12): 1038–47. https://doi.org/10.1016/S1474-4422(21)00300-8.
23. Rincon N., Barr D., Velez-Ruiz N. Neuromodulation in drug resistant epilepsy. Aging Dis. 2021; 12 (4): 1070–80. https://doi.org/10.14336/AD.2021.0211.
24. Wang D., Wei P., Shan Y., et al. Optimized stereoelectroencephalography-guided radiofrequency thermocoagulation in the treatment of patients with focal epilepsy. Ann Transl Med. 2020; 8 (1): 15. https://doi.org/10.21037/atm.2019.10.112.
25. Nune G., DeGiorgio C., Heck C. Neuromodulation in the treatment of epilepsy. Curr Treat Options Neurol. 2015; 17 (10): 375. https://doi.org/10.1007/s11940-015-0375-0.
26. Kwon C.S., Ripa V., Al-Awar O., et al. Epilepsy and neuromodulation – randomized controlled trials. Brain Sci. 2018; 8 (4): 69. https://doi.org/10.3390/brainsci8040069.
27. Brodie M.J., Covanis A., Gil-Nagel A., et al. Antiepileptic drug therapy: does mechanism of action matter? Epilepsy Behav. 2011; 21 (4): 331– 41. https://doi.org/10.1016/j.yebeh.2011.05.025.
28. Sills G.J., Rogawski M.A. Mechanisms of action of currently used antiseizure drugs. Neuropharmacology. 2020; 168: 107966. https://doi.org/10.1016/j.neuropharm.2020.107966.
29. Trinka E., Brigo F. Antiepileptogenesis in humans: disappointing clinical evidence and ways to move forward. Curr Opin Neurol. 2014; 27 (2): 227–35. https://doi.org/10.1097/WCO.0000000000000067.
30. Löscher W., Schmidt D. Modern antiepileptic drug development has failed to deliver: ways out of the current dilemma. Epilepsia. 2011; 52 (4): 657–78. https://doi.org/10.1111/J.1528-1167.2011.03024.x.
31. Temkin N.R., Jarell A.D., Anderson G.D. Antiepileptogenic agents: how close are we? Drugs. 2001; 61 (8): 1045–55. https://doi.org/10.2165/00003495-200161080-00002.
32. Schmidt D. Efficacy of new antiepileptic drugs. Epilepsy Curr. 2011; 11 (1): 9–11. https://doi.org/10.5698/1535-7511-11.1.9.
33. Millichap J.J., Miceli F., De Maria M., et al. Infantile spasms and encephalopathy without preceding neonatal seizures caused by KCNQ2 R198Q, a gain-of-function variant. Epilepsia. 2017; 58 (1): e10–5. https://doi.org/10.1111/epi.13601.
34. Guery D., Rheims S. Clinical management of drug resistant epilepsy: a review on current strategies. Neuropsychiatr Dis Treat. 2021; 17: 2229–42. https://doi.org/10.2147/NDT.S256699.
35. Насырова Р.Ф., Сивакова Н.А., Липатова Л.В. и др. Биологические маркеры эффективности и безопасности противоэпилептических препаратов: фармакогенетика и фармакокинетика. Сибирское медицинское обозрение. 2017; 1: 17–25. https://doi.org/10.20333/2500136-2017-1-17-25.
36. Kehne J.H., Klein B.D., Raeissi S., Sharma S. The National Institute of Neurological Disorders and Stroke (NINDS) Epilepsy Therapy Screening Program (ETSP). Neurochem Res. 2017; 42 (7): 1894–903. https://doi.org/10.1007/s11064-017-2275-z.
37. Bialer M., Johannessen S.I., Koepp M.J., et al. Progress report on new antiepileptic drugs: a summary of the Fourteenth Eilat Conference on New Antiepileptic Drugs and Devices (EILAT XIV). I. Drugs in preclinical and early clinical development. Epilepsia. 2018; 59 (10): 1811–41. https://doi.org/10.1111/epi.14557.
38. Wengert E.R., Saga A.U., Panchal P.S., et al. Prax330 reduces persistent and resurgent sodium channel currents and neuronal hyperexcitability of subiculum neurons in a mouse model of SCN8A epileptic encephalopathy. Neuropharmacology. 2019; 158: 107699. https://doi.org/10.1016/j.neuropharm.2019.107699.
39. Witkin J.M., Lippa A., Smith J.L., et al. The imidazodiazepine, KRMII-81: an example of a newly emerging generation of GABAkines for neurological and psychiatric disorders. Pharmacol Biochem Behav. 2022; 213: 173321. https://doi.org/10.1016/j.pbb.2021.173321.
40. Klein P., Kaminski R.M., Koepp M., Löscher W. New epilepsy therapies in development. Nat Rev Drug Discov. 2024; 23 (9): 682–708. https://doi.org/10.1038/S41573-024-00981-w.
41. Le A., Thomas M., Stallman B., et al. Refractory epilepsy: mechanisms of pharmacoresistance. Georgetown Sci Res J. 2021; 1: 99–110. https://doi.org/10.48091/UWYG8998.
42. Mollazadeh S., Sahebkar A., Hadizadeh F., et al. Structural and functional aspects of P-glycoprotein and its inhibitors. Life Sci. 2018; 214: 118–23. https://doi.org/10.1016/j.lfs.2018.10.048.
43. Prajapati R., Singh U., Patil A., et al. In silico model for P-glycoprotein substrate prediction: Insights from molecular dynamics and in vitro studies. J Comput Aided Mol Des. 2013; 27 (4): 347–63. https://doi.org/10.1007/s10822-013-9650-x.
44. Elmeliegy M., Vourvahis M., Guo C., Wang D.D. Effect of P-glycoprotein (P-gp) inducers on exposure of P-gp substrates: review of clinical drug–drug interaction studies. Clin Pharmacokinet. 2020; 59 (6): 699–714. https://doi.org/10.1007/S40262-020-00867-1.
45. Schlichtiger J., Pekcec A., Bartmann H., et al. Celecoxib treatment restores pharmacosensitivity in a rat model of pharmacoresistant epilepsy. Br J Pharmacol. 2010; 160 (5): 1062–71. https://doi.org/10.1111/j.1476-5381.2010.00765.x.
46. Radu B.M., Epureanu F.B., Radu M., et al. Nonsteroidal antiinflammatory drugs in clinical and experimental epilepsy. Epilepsy Res. 2017; 131: 15–27. https://doi.org/10.1016/j.eplepsyres.2017.02.003.
47. Simonato M., Bennett J., Boulis N.M., et al. Progress in gene therapy for neurological disorders. Nat Rev Neurol. 2013; 9 (5): 277–91. https://doi.org/10.1038/nrneurol.2013.56.
48. Engel J., Pitkänen A. Biomarkers for epileptogenesis and its treatment. Neuropharmacology. 2020; 167: 107735. https://doi.org/10.1016/j.neuropharm.2019.107735.
49. Conboy K., Henshall D.C., Brennan G.P. Epigenetic principles underlying epileptogenesis and epilepsy syndromes. Neurobiol Dis. 2021; 148: 105179. https://doi.org/10.1016/j.nbd.2020.105179.
50. Pupo A., Fernández A., Low S.H., et al. AAV vectors: the Rubik’s cube of human gene therapy. Mol Ther. 2022; 30 (12): 3515–41. https://doi.org/10.1016/j.ymthe.2022.09.015.
51. Naso M.F., Tomkowicz B., Perry W.L. 3rd, Strohl W.R. Adenoassociated virus (AAV) as a vector for gene therapy. BioDrugs. 2017; 31 (4): 317–34. https://doi.org/10.1007/s40259-017-0234-5.
52. Liu D., Zhu M., Zhang Y., Diao Y. Crossing the blood-brain barrier with AAV vectors. Metab Brain Dis. 2021; 36 (1): 45–52. https://doi.org/10.1007/s11011-020-00630-2.
53. Issa S.S., Shaimardanova A.A., Solovyeva V.V., Rizvanov A.A. Various AAV serotypes and their applications in gene therapy: an overview. Cells. 2023; 12 (5): 785. https://doi.org/10.3390/cells12050785.
54. Zhang L., Wang Y. Gene therapy in epilepsy. Biomed Pharmacother. 2021; 143: 112075. https://doi.org/10.1016/j.biopha.2021.112075.
55. Boileau C., Deforges S., Peret A., et al. GluK2 Is a target for gene therapy in drug-resistant temporal lobe epilepsy. Ann Neurol. 2023; 94 (4): 745–61. https://doi.org/10.1002/ana.26723.
56. Theofilas P., Brar S., Stewart K.A., et al. Adenosine kinase as a target for therapeutic antisense strategies in epilepsy. Epilepsia. 2011; 52 (3): 589–601. https://doi.org/10.1111/j.1528-1167.2010.02947.x.
57. Wickham J., Ledri M., Bengzon J., et al. Inhibition of epileptiform activity by neuropeptide Y in brain tissue from drug-resistant temporal lobe epilepsy patients. Sci Rep. 2019; 9 (1): 19393. https://doi.org/10.1038/S41598-019-56062-1.
58. Nikitidou Ledri L., Melin E., Christiansen S.H., et al. Translational approach for gene therapy in epilepsy: model system and unilateral overexpression of neuropeptide Y and Y2 receptors. Neurobiol Dis. 2016; 86: 52–61. https://doi.org/10.1016/j.nbd.2015.11.014.
59. Cattaneo S., Verlengia G., Marino P., et al. NPY and gene therapy for epilepsy: how, when, ... and Y. Front Mol Neurosci. 2021; 13: 608001. https://doi.org/10.3389/fnmol.2020.608001.
60. Agostinho A.S., Mietzsch M., Zangrandi L., et al. Dynorphin-based “release on demand” gene therapy for drug-resistant temporal lobe epilepsy. EMBO Mol Med. 2019; 11 (10): e9963. https://doi.org/10.15252/emmm.201809963.
61. Wykes R.C., Lignani G. Gene therapy and editing: novel potential treatments for neuronal channelopathies. Neuropharmacology. 2018; 132: 108–17. https://doi.org/10.1016/j.neuropharm.2017.05.029.
62. Colasante G., Qiu Y., Massimino L., et al. In vivo CRISPRa decreases seizures and rescues cognitive deficits in a rodent model of epilepsy. Brain. 2020; 143 (3): 891–905. https://doi.org/10.1093/brain/awaa045.
63. Simonato M. Gene therapy for epilepsy. Epilepsy Behav. 2014; 38: 125–30. https://doi.org/10.1016/j.yebeh.2013.09.013.
64. Maeder M.L., Gersbach C.A. Genome-editing technologies for gene and cell therapy. Mol Ther. 2016; 24 (3): 430–46. https://doi.org/10.1038/mt.2016.10.
65. Wang J.Y., Doudna J.A. CRISPR technology: a decade of genome editing is only the beginning. Science. 2023; 379 (6629): eadd8643. https://doi.org/10.1126/science.add8643.
66. Straub C., Granger A.J., Saulnier J.L., Sabatini B.L. CRISPR/Cas9- mediated gene knock-down in post-mitotic neurons. PLoS One. 2014; 9 (8): e105584. https://doi.org/10.1371/journal.pone.0105584.
67. Anzalone A.V., Koblan L.W., Liu D.R. Genome editing with CRISPRCas nucleases, base editors, transposases and prime editors. Nat Biotechnol. 2020; 38 (7): 824–44. https://doi.org/10.1038/s41587-020-0561-9.
68. Cox D.B.T., Platt R.J., Zhang F. Therapeutic genome editing: prospects and challenges. Nat Med. 2015; 21 (2): 121–31. https://doi.org/10.1038/nm.3793.
69. Lee H.B., Sundberg B.N., Sigafoos A.N., Clark K.J. Genome engineering with TALE and CRISPR systems in neuroscience. Front Genet. 2016; 7: 47. https://doi.org/10.3389/fgene.2016.00047.
70. Heidenreich M., Zhang F. Applications of CRISPR-Cas systems in neuroscience. Nat Rev Neurosci. 2015; 17 (1): 36–44. https://doi.org/10.1038/nrn.2015.2.
71. Kolli N., Lu M., Maiti P., et al. Application of the gene editing tool, CRISPR-Cas9, for treating neurodegenerative diseases. Neurochem Int. 2018; 112: 187–96. https://doi.org/10.1016/j.neuint.2017.07.007.
72. Dominguez A.A., Lim W.A., Qi L.S. Beyond editing: repurposing CRISPR-Cas9 for precision genome regulation and interrogation. Nat Rev Mol Cell Biol. 2016; 17 (1): 5–15. https://doi.org/10.1038/nrm.2015.2.
73. Cai R., Lv R., Shi X., et al. CRISPR/dCas9 tools: epigenetic mechanism and application in gene transcriptional regulation. Int J Mol Sci. 2023; 24 (19): 14865. https://doi.org/10.3390/ijms241914865.
74. György B., Ingelsson M., Loov C., Takeda S., et al. 567. CRISPR-Cas9 mediated gene editing in a monogenic form of Alzheimer’s disease. Mol Ther. 2016; 24 (1): S226–7. https://doi.org/10.1016/S1525-0016(16)33375-5.
75. Colasante G., Lignani G., Brusco S., et al. dCas9-based Scn1a gene activation restores inhibitory interneuron excitability and attenuates seizures in dravet syndrome mice. Mol Ther. 2020; 28 (1): 235–53. https://doi.org/10.1016/j.ymthe.2019.08.018.
76. Chang B.L., Chang K.H. Stem cell therapy in treating epilepsy. Front Neurosci. 2022; 16: 934507. https://doi.org/10.3389/fnins.2022.934507.
77. Shetty A.K., Upadhya D. GABA-ergic cell therapy for epilepsy: advances, limitations and challenges. Neurosci Biobehav Rev. 2016; 62: 35–47. https://doi.org/10.1016/j.neubiorev.2015.12.014.
78. Ramos-Fresnedo A., Perez-Vega C., Domingo R.A., et al. Mesenchymal stem cell therapy for focal epilepsy: a systematic review of preclinical models and clinical studies. Epilepsia. 2022; 63 (7): 1607–18. https://doi.org/10.1111/epi.17266.
79. Trujillo C.A., Adams J.W., Negraes P.D., et al. Pharmacological reversal of synaptic and network pathology in human MECP2-KO neurons and cortical organoids. EMBO Mol Med. 2021; 13 (1): e12523. https://doi.org/10.15252/emmm.202012523.
80. National Research Council (US) Committee on a Framework for Developing a New Taxonomy of Disease. Toward precision medicine: building a knowledge network for biomedical research and a new taxonomy of disease. Washington (DC): National Academies Press (US); 2011. https://doi.org/10.17226/13284.
81. Yadav D., Patil-Takbhate B., Khandagale A., et al. Next-generation sequencing transforming clinical practice and precision medicine. Clin Chim Acta. 2023; 551: 117568. https://doi.org/10.1016/J.CCA.2023.117568.
82. Weber Y.G., Biskup S., Helbig K.L., et al. The role of genetic testing in epilepsy diagnosis and management. Expert Rev Mol Diagn. 2017; 17 (8): 739–50. https://doi.org/10.1080/14737159.2017.1335598.
83. Goodspeed K., Bailey R.M., Prasad S., et al. Gene therapy: novel approaches to targeting monogenic epilepsies. Front Neurol. 2022; 13: 805007. https://doi.org/10.3389/fneur.2022.805007.
84. Delanty N., Cavallleri G. Genomics-guided precise anti-epileptic drug development. Neurochem Res. 2017; 42 (7): 2084–8. https://doi.org/10.1007/s11064-017-2312-y.
85. Schoonjans A.S., Lagae L., Ceulemans B. Low-dose fenfluramine in the treatment of neurologic disorders: experience in Dravet syndrome. Ther Adv Neurol Disord. 2015; 8 (6): 328–38. https://doi.org/10.1177/1756285615607726.
86. Sisodiya S.M. Precision medicine and therapies of the future. Epilepsia. 2021; 62 (Suppl. 2): S90–105. https://doi.org/10.1111/epi.16539.
87. AACR Project GENIE Consortium. AACR Project GENIE: Powering Precision Medicine through an International Consortium. Cancer Discov. 2017; 7 (8): 818–31. https://doi.org/10.1158/2159-8290.CD-17-0151.
88. Parrini E., Marini C., Mei D., et al. Diagnostic targeted resequencing in 349 patients with drug-resistant pediatric epilepsies identifies causative mutations in 30 different genes. Hum Mutat. 2017; 38 (2): 216–25. https://doi.org/10.1002/humu.23149.
89. Mahdiannasser M., Rashidi-Nezhad A., Badv R.S., Akrami S.M. Exploring the genetic etiology of drug-resistant epilepsy: incorporation of exome sequencing into practice. Acta Neurol Belg. 2022; 122 (6): 1457–68. https://doi.org/10.1007/s13760-022-02095-9.
90. Anwar A., Saleem S., Patel U.K., et al. Dravet syndrome: an overview. Cureus. 2019; 11 (6): e5006. https://doi.org/10.7759/cureus.5006.
91. Fan H.C., Yang M.T., Lin L.C., et al. Clinical and genetic features of Dravet syndrome: a prime example of the role of precision medicine in genetic epilepsy. Int J Mol Sci. 2023; 25 (1): 31. https://doi.org/10.3390/ijms25010031.
92. Wirrell E.C. Treatment of Dravet syndrome. Can J Neurol Sci. 2016; 43 (Suppl. 3): S13–8. https://doi.org/10.1017/cjn.2016.249.
93. Wilmshurst J.M., Gaillard W.D., Vinayan K.P., et al. Summary of recommendations for the management of infantile seizures: Task Force Report for the ILAE Commission of Pediatrics. Epilepsia. 2015; 56 (8): 1185–97. https://doi.org/10.1111/epi.13057.
94. Chiron C., Dulac O. The pharmacologic treatment of Dravet syndrome. Epilepsia. 2011; 52 (Suppl. 2): 72–5. https://doi.org/10.1111/J.1528-1167.2011.03007.x.
95. Ceulemans B., Schoonjans A.S., Marchau F., et al. Five-year extended follow-up status of 10 patients with Dravet syndrome treated with fenfluramine. Epilepsia. 2016; 57 (7): e129–34. https://doi.org/10.1111/epi.13407.
96. Liao H.K., Hatanaka F., Araoka T., et al. In vivo target gene activation via CRISPR/Cas9-mediated trans-epigenetic modulation. Cell. 2017; 171 (7): 1495–507.e15. https://doi.org/10.1016/j.cell.2017.10.025.
97. La Russa M.F., Qi L.S. The new state of the art: Cas9 for gene activation and repression. Mol Cell Biol. 2015; 35 (22): 3800–9. https://doi.org/10.1128/MCB.00512-15.
98. Schwartzberg L., Kim E.S., Liu D., Schrag D. Precision oncology: who, how, what, when, and when not? Am Soc Clin Oncol Educ Book. 2017; 37: 160–9. https://doi.org/10.1200/EDBK_174176.
99. Hulsen T., Jamuar S.S., Moody A.R., et al. From big data to precision medicine. Front Med. 2019; 6: 34. https://doi.org/10.3389/fmed.2019.00034.
100. Bulcha J.T., Wang Y., Ma H., et al. Viral vector platforms within the gene therapy landscape. Signal Transduct Target Ther. 2021; 6 (1): 53. https://doi.org/10.1038/s41392-021-00487-6.
Об авторах
А. М. ЯкимовРоссия
Якимов Алексей Михайлович
WoS ResearcherID: AEW-9605- 2022. Scopus Author ID: 58161933100
ул. Партизана Железняка, д. 1, Красноярск 660022
Е. Е. Тимечко
Россия
Тимечко Елена Евгеньевна
WoS ResearcherID: CAF-2677- 2022
ул. Партизана Железняка, д. 1, Красноярск 660022
А. И. Парамонова
Россия
Парамонова Анастасия Ивановна
WoS ResearcherID: HMP-3496-2023
ул. Партизана Железняка, д. 1, Красноярск 660022
А. А. Васильева
Россия
Васильева Анастасия Александровна
ул. Партизана Железняка, д. 1, Красноярск 660022
Ф. К. Рыбаченко
Россия
Рыбаченко Фёдор Константинович
ул. Партизана Железняка, д. 1, Красноярск 660022
А. Д. Рыбаченко
Россия
Рыбаченко Анастасия Дмитриевна
ул. Партизана Железняка, д. 1, Красноярск 660022
Д. В. Дмитренко
Россия
Дмитренко Диана Викторовна, д.м.н.
WoS ResearcherID: H-7787-2016
ул. Партизана Железняка, д. 1, Красноярск 660022
Рецензия
Для цитирования:
Якимов А.М., Тимечко Е.Е., Парамонова А.И., Васильева А.А., Рыбаченко Ф.К., Рыбаченко А.Д., Дмитренко Д.В. Гипотезы развития и стратегии преодоления фармакорезистентности при эпилепсии. Часть II: Стратегии преодоления. Эпилепсия и пароксизмальные состояния. 2025;17(1):59-70. https://doi.org/10.17749/2077-8333/epi.par.con.2025.211
For citation:
Yakimov A.M., Timechko E.E., Paramonova A.I., Vasilieva A.A., Rybachenko F.K., Rybachenko A.D., Dmitrenko D.V. Hypotheses of development and strategies for overcoming drug resistance in epilepsy. Рart II: Overcoming strategies. Epilepsy and paroxysmal conditions. 2025;17(1):59-70. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2025.211

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































