Перейти к:
Эпилепсия, эпилептиформные разряды и особенности магнитнорезонансной томографии головного мозга при мерозин-дефицитной мышечной дистрофии
https://doi.org/10.17749/2077-8333/epi.par.con.2025.213
Аннотация
Актуальность. Мерозин-дефицитная мышечная дистрофия (МДМД) – это нервно-мышечное заболевание, которое возникает в результате появления биаллельных вариантов в гене LAMA2 и проявляется прогрессирующей мышечной слабостью, диффузной гипотонией, нарушением осанки, контрактурами крупных суставов, респираторной патологией. Эпилепсия является частым симптомом МДМД, однако в настоящий момент клиническое течение эпилепсии при МДМД остается недостаточно изученным.
Цель: определение особенностей эпилепсии, электроэнцефалографических (ЭЭГ) и радиологических характеристик у пациентов с МДМД, выявление взаимосвязи патологических изменений в головном мозге с течением эпилепсии, патологией на ЭЭГ и расположением вариантов нуклеотидной последовательности в гене LAMA2.
Материал и методы. Проанализированы ЭЭГ 63 человек в возрасте от 6 мес до 29 лет с генетически подтвержденным диагнозом МДМД. В Научно-исследовательском клиническом институте педиатрии и детской хирургии им. академика Ю.Е. Вельтищева межприступная ЭЭГ проведена 29 пациентам, у 34 больных изучены нативные данные межприступной ЭЭГ, выполненной по месту жительства. Во всех случаях оценивались клинический и неврологический статусы, 55 пациентам проведена магнитно-резонансная томография (МРТ) головного мозга.
Результаты. Эпилепсия наблюдалась у 12 из 63 (19%) пациентов с МДМД и характеризовалась относительно поздним дебютом – 11,5 года. Отмечен преимущественно фокальный характер приступов: у 7 из 12 (58,4%) больных. Доля случаев фармакорезистентности была сопоставима с эпилепсией в целом и составила 33,3% (4 из 12). У 12 из 51 человека (23,5%) без эпилептических приступов зарегистрирована эпилептиформная активность на ЭЭГ. Изменения на МРТ головного мозга были представлены лейкопатией, которая подтверждена у всех пациентов старше 1 года, а также двусторонней затылочной пахигирией в 4 из 63 случаев (6,3%). В представленной выборке не было установлено статистически значимой взаимосвязи между формой заболевания, изменениями на ЭЭГ, патологией центральной нервной системы и наличием вариантов нуклеотидной последовательности в LG-домене. Отсутствие корреляции может быть связано с относительно небольшим числом пациентов.
Заключение. Наше исследование вносит вклад в понимание течения эпилепсии при МДМД. Учитывая наличие соматических осложнений, маскирующих эпилептические приступы, для своевременной установки диагноза и оказания помощи необходимо проявлять настороженность в отношении эпилепсии у данной группы пациентов.
Ключевые слова
Для цитирования:
Монахова А.В., Белоусова Е.Д., Горчханова З.К. Эпилепсия, эпилептиформные разряды и особенности магнитнорезонансной томографии головного мозга при мерозин-дефицитной мышечной дистрофии. Эпилепсия и пароксизмальные состояния. 2025;17(2):142-152. https://doi.org/10.17749/2077-8333/epi.par.con.2025.213
For citation:
Monakhova A.V., Belousova E.D., Gorchkhanova Z.K. Epilepsy, epileptiform discharges and features of brain magnetic resonance imaging in merosin-deficient muscular dystrophy. Epilepsy and paroxysmal conditions. 2025;17(2):142-152. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2025.213
ВВЕДЕНИЕ / INTRODUCTION
Мерозин-дефицитная мышечная дистрофия (МДМД) возникает в результате мутаций в гене LAMA2, который кодирует α2-субъединицу мерозина (ламинина-α2, или ламинина-211). В зависимости от дебюта выделяют две формы заболевания: врожденную (ВМД 1А; OMIM 607855) и поясно-конечностную (ПКМД аутосомно-рецессивная 23, ПКМД Р23; OMIM 618138). Помимо двигательных нарушений, составляющих ядро клинической картины, для МДМД характерна также патология центральной нервной системы (ЦНС): эпилепсия, расстройство аутистического спектра (РАС), снижение интеллекта, пороки развития головного мозга [1–3].
По данным литературы, при ВМД 1А распространенность эпилепсии составляет 5–8% [4][5], тогда как при ПКМД Р23 приступы отмечаются у 20–36,8% пациентов [5][6]. Их феноменология может быть различной. Встречаются фокальные приступы с нарушением сознания [6], при которых нередко фиксируются зрительные и вегетативные феномены, связанные с преобладанием межприступных разрядов на электроэнцефалограмме (ЭЭГ) в задних отделах головного мозга. Также наблюдаются двусторонние тонико-клонические приступы, атипичные абсансы, дроп-атаки (приступы с падением) и эпилептические спазмы у некоторых пациентов [7]. Эпилепсия чаще встречается у пациентов с пороками развития коры головного мозга, и было обнаружено, что мальформации головного мозга в значительной степени связаны с большей частотой фокальных и генерализованных приступов [8].
Патогенез развития неврологических нарушений ассоциирован с дефицитом ламинина. Ламинин-α2 экспрессируется преимущественно в мышечной ткани, но также присутствует в шванновских клетках, внутримозговых микрососудах и является важной составляющей глиоваскулярной базальной пластинки гематоэнцефалического барьера [9][10]. Потеря мерозина не только вызывает деградацию миоцитов, но и может приводить к серьезным порокам развития коры головного мозга и, вероятно, связана с повышенной частотой эпилепсии [11]. Белок ламинин-α2 состоит из нескольких доменов: спиральных доменов I и II, стержневидных доменов IIIa, IIIb, V, глобулярных N-терминальных доменов IVa, IVb, VI и С-терминального региона (LG-домен), содержащего пять глобулярных доменов (LG1–LG5). LG-домен включает крайне важные сайты узнавания для мембранных рецепторов, α-дистрогликана и интегрина α7β1 [12], которые, по-видимому, влияют на адгезию, дифференцировку, рост, форму и миграцию нейронов [13][14]. Было показано, что мутации в LG-домене гена LAMA2 (экзоны 45–65) чаще приводят к проявлениям со стороны ЦНС при МДМД [15].
Учитывая важнейшую роль С-терминального региона в гене LAMA2 и более высокую вероятность возникновения патологии ЦНС у пациентов с мутациями в LG-домене, мы решили проанализировать неврологический статус, доступные нам данные ЭЭГ и МРТ головного мозга пациентов и уточнить эту взаимосвязь.
Цель – определение особенностей эпилепсии, электроэнцефалографических и радиологических характеристик у пациентов с МДМД, выявление взаимосвязи патологических изменений в головном мозге с течением эпилепсии, патологией на ЭЭГ и расположением вариантов нуклеотидной последовательности в гене LAMA2.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Задачи и дизайн исследования / Study tasks and design
Для достижения цели исследования были поставлены следующие задачи:
– определить частоту эпилепсии, снижения интеллекта, РАС у пациентов с МДМД;
– описать семиологию приступов у пациентов с МДМД и эпилепсией;
– определить особенности МРТ головного мозга у больных МДМД;
– изучить ЭЭГ-характеристики больных МДМД с патологией ЦНС (снижением интеллекта, аутизмом, эпилепсией, мальформациями коры головного мозга) и без нее;
– оценить особенности ЭЭГ, наличие патологии ЦНС и вариантов нуклеотидной последовательности в LG-домене у пациентов с МДМД с эпилептиформной активностью (ЭА) на ЭЭГ без клинических проявлений эпилепсии и у пациентов с МДМД, имеющих эпилепсию;
– провести анализ эффективности противосудорожной терапии у больных с МДМД, имеющих эпилепсию.
Дизайн исследования: ретроспективное кросс-секционное.
Критерии включения и исключения / Inclusion and exclusion criteria
При включении пациентов в исследование использовали следующие критерии:
– любой возраст и пол;
– диагноз МДМД, подтвержденный данными генетического обследования на основании наличия каузативных вариантов (двух компаунд-гетерозиготных или гомозиготного) в гене LAMA2;
– подписание информированного добровольного согласия.
Критериями исключения являлись:
– наличие других нервно-мышечных заболеваний, не связанных с мутациями в гене LAMA2;
– клинико-диагностическая картина МДМД без генетического подтверждения диагноза.
Пациенты / Patients
В исследование включены 63 человека в возрасте от 6 мес до 29 лет с генетически подтвержденным диагнозом МДМД: 56 пациентов с ВМД 1А, 7 пациентов с ПКМД Р23.
Все пациенты в возрасте до 12 лет были оценены по шкале профиля развития (англ. Development Profile 3, DP-3). Задержку когнитивного развития определяли по результатам данной оценки или на основании заключений психолого-педагогической комиссии в медицинской документации. Диагноз РАС во всех случаях был установлен психиатром.
Инструментальные исследования / Instrumental examinations
Электроэнцефалография
В Научно-исследовательском клиническом институте педиатрии и детской хирургии им. академика Ю.Е. Вельтищева межприступная ЭЭГ проведена у 29 пациентов на системах видео-ЭЭГ-мониторинга «Мицар» (ООО «Мицар», Россия) и ВЕ Plus (EBN, Италия): 16 больным, в т.ч. имеющим патологию ЦНС, был проведен ЭЭГ-мониторинг, 13 пациентам с МДМД без патологии ЦНС – рутинная ЭЭГ. В 34 случаях переанализированы данные межприступной ЭЭГ, выполненной по месту жительства.
Магнитно-резонансная томография
Также у всех больных оценивали клинический и неврологический статусы, 55 пациентам проведена МРТ головного мозга на оборудовании Philips Intera (Philips, Нидерланды) с напряженностью магнитного поля 1,5 Тл и SIGNA Architect 3.0 T (General Electric, США) в трех взаимно перпендикулярных проекциях в режимах Т1- и Т2- взвешенных изображений и FLAIR со стандартным шагом сканирования.
Генетические исследования
Для поиска каузативных вариантов в гене LAMA2 выполняли различные генетические исследования: хромосомный микроматричный анализ, полногеномное секвенирование, полноэкзомное секвенирование, секвенирование по панели генов. Хромосомный микроматричный анализ выполняли на микроматрице, содержащей 2,67 млн маркеров с использованием системы анализа «Геноскан 3000» (ООО «Геномед», Россия, ФСР 2010/08511). Высокопроизводительное секвенирование проводили на секвенаторах Illumina MiSeq, NextSeq500 (Illumina Inc., США), Ion Torrent PGM (Thermo Fisher Scientific, США).
Статистический анализ / Statistical analysis
Статистический анализ проводили с применением программного пакета SPSS Statistics версии 26.0 (IBM, США). Нулевую гипотезу отвергали при уровне значимости р<0,05. Для описания категориальных переменных использовали частоту и долю, количественных переменных с ненормальным распределением – медиану и квартили, дополнительно указывали диапазон значений. Сравнение двух несвязанных групп по категориальным переменным проводили с помощью теста χ² Пирсона, а при наличии ограничений к его применению – точного критерия Фишера. Поскольку у одного и того же пациента наличие патологии ЦНС оценивали однократно, а генетические характеристики (мутация в LG-домене) – двукратно (в двух аллелях), для оценки связи между ними использовали линейную смешанную модель.
РЕЗУЛЬТАТЫ / RESULTS
Характеристика пациентов / Patient characterictics
В исследование включены 63 пациента с МДМД. Медиана возраста составила 11 [ 6; 15] лет. Самому младшему пациенту было 6 мес, самому старшему – 29 лет. Подавляющее большинство (56; 88,9%) имели врожденную форму заболевания и только 7 (11,1%) – поясно-конечностную форму. Распределение больных по полу было практически равным: 32 (50,4%) мужского пола и 31 (49,6%) женского пола (табл. 1). У 30 (47,6%) пациентов регистрировались какие-либо патологические изменения со стороны ЦНС (эпилепсия, ЭА, задержка когнитивного развития, РАС, мальформации коры головного мозга) отдельно или в сочетании.
Таблица 1. Характеристика пациентов, включенных в исследование
Table 1. Characteristics of study patients
|
Параметр / Parameter |
Значение / Value |
|
Вся группа (n=63) / Total (n=63) |
|
|
Пол мужской/женский, n (%) / Gender: male/female, n (%) |
32 (50,4) / 31 (49,6) |
|
Диагноз, n (%) / Diagnosis, n (%) |
|
|
ВМД 1А / CMD 1A |
56 (88,9) |
|
ПКМД Р23 / LGMD23 |
7 (11,1) |
|
Возраст, лет / Age, years |
|
|
Me [ Q1; Q3] |
11,0 [ 6,0; 15,0] |
|
min–max |
0,5–29,0 |
|
Любая патология ЦНС, n (%) / Any CNS pathology, n (%) |
30 (47,6) |
|
Эпилептиформная активность на ЭЭГ, n (%) / EEG epileptiform activity, n (%) |
24 (38,1) |
|
Эпилепсия, n (%) / Epilepsy, n (%) |
12 (19,0) |
|
Задержка когнитивного развития, n (%) / Delayed cognitive development, n (%) |
7 (11,1) |
|
Расстройство аутистического спектра, n (%) / Autistic spectrum disorder, n (%) |
4 (6,3) |
|
Среди лиц с МРТ головного мозга (n=55) / Subjects with brain MRI (n=55) |
|
|
Пахигирия, n (%) / Pachygyria, n (%) |
4 (7,3) |
|
Среди лиц с эпилепсией (n=12) / Subjects with epilepsy (n=12) |
|
|
Фармакорезистентность, n (%) / Pharmacoresistance, n (%) |
4 (33,3) |
|
Возраст диагностики эпилепсии, лет / Age at epilepsy diagnostics, years |
|
|
Me [ Q1; Q3] |
11,5 [ 9,0; 13,0] |
|
min–max |
5,0–16,0 |
Примечание. ВМД 1А – врожденная мышечная дистрофия 1А; ПКМД Р23 – поясно-конечностная мышечная дистрофия 23-го типа; ЦНС – центральная нервная система; ЭЭГ – электроэнцефалография; МТР – магнитно-резонансная томография.
Note. CMD 1A – congenital muscular dystrophy type 1A; LGMD23 – limb-girdle muscular dystrophy type 23; CNS – central nervous system; EEG – electroencephalography; MRI – magnetic resonance imaging.
Особенности эпилепсии / Epilepsy features
Диагноз эпилепсии был поставлен у 12 из 63 (19,0%) пациентов. Эпилепсия при МДМД характеризовалась относительно поздним началом: средний возраст дебюта заболевания составил 11,5 года (диапазон от 5 до 16 лет). Индивидуальные характеристики эпилепсии у пациентов приведены в таблице 2.
Таблица 2. Индивидуальные характеристики пациентов с эпилепсией, страдающих мерозин-дефицитной мышечной дистрофией
Table 2. Individual characteristics of patients with epilepsy and merosin-deficient muscular dystrophy
|
Пациент / Patient |
Возраст дебюта эпилепсии, лет / Epilepsy onset age, years |
Тип приступов / Seizure type |
Особенности ЭЭГ / EEG features |
АЭП / AEDs |
Течение эпилепсии / Epilepsy course |
Задержка когнитивного развития / Delayed cognitive development |
МРТ головного мозга / Brain MRI |
LG-домен / LG domain |
|
Пациент 1 / Patient 1 |
13 |
Фокальные моторные с автоматизмами + генерализованные миоклонические / Focal motor with automatisms + generalized myoclonic |
ГЭА, мульти-РЭА, SWAS во сне / GEA, multi-REA, sleep SWAS |
ЛВТ, ВПА, ТПМ / LVT, VPA, TPM |
Фармакорезистентная / Pharmacoresistance |
Да / Yes |
ЛП / LP |
Да / Yes |
|
Пациент 2 / Patient 2 |
5 |
Фокальные тонические с переходом в атонические / Focal tonic-to-atonic transition |
ГЭА, мульти-РЭА / GEA, multi-REA |
ЛВТ / LVT |
Ремиссия 4,5 года / 4.5-year-long remission |
Нет / No |
ЛП / LP |
Да / Yes |
|
Пациент 3 / Patient 3 |
13 |
Генерализованные (БТКП, миоклонические) / Generalized (BTCS, myoclonic) |
ГЭА, мульти-РЭА / GEA, multi-REA |
ЛТЖ / LTG |
Ремиссия 1 год / 1-year-long remission |
Нет / No |
ЛП / LP |
Да / Yes |
|
Пациент 4 / Patient 4 |
8 |
Фокальные вегетативные / Focal vegetative |
ГЭА / GEA |
ВПА / VPA |
Уменьшение частоты приступов на 50% / Seizure rate reduced by 50% |
Нет / No |
Пахигирия + ЛП / Pachygyria + LP |
Да / Yes |
|
Пациент 5 / Patient 5 |
13 |
Фокальные зрительные / Focal visual |
РЭА / REA |
ВПА, КБМЗ, ЛВТ / VPA, CBMZ, LVT |
Фармакорезистентная / Pharmacoresistance |
Нет / No |
ЛП / LP |
Да / Yes |
|
Пациент 6 / Patient 6 |
6 |
Фокальные вегетативные / Focal vegetative |
Мульти-РЭА / Multi-REA |
ЛВТ / LVT |
Уменьшение частоты приступов на 75% / Seizure rate reduced by 75% |
Нет / No |
ЛП / LP |
Нет / No |
|
Пациент 7 / Patient 7 |
10 |
Генерализованные (абсансы) / Generalized (absences) |
ГЭА / GEA |
ВПА, ЛВТ, ЛТЖ / VPA, LVT, LTG |
Фармакорезистентная / Pharmacoresistance |
Нет / No |
ЛП / LP |
Да / Yes |
|
Пациент 8 / Patient 8 |
10 |
Фокальные зрительные / Focal visual |
РЭА / REA |
ЛВТ / LVT |
Ремиссия 9 мес / 9-month-long remission |
Нет / No |
ЛП / LP |
Нет / No |
|
Пациент 9 / Patient 9 |
13 |
Фокальные эпилептические спазмы / Focal epileptic spasms |
РЭА и ГЭА / REA and GEA |
Не получает / Not received |
Сохранение редких приступов (3–4 раза в год) / Sustained rare seizures (3–4 cases per year) |
Нет / No |
ЛП / LP |
Да / Yes |
|
Пациент 10 / Patient 10 |
13 |
Фокальные тонические, клонические, с автоматизмами / Focal tonic, clonic, with automatisms |
Мульти-РЭА / Multi-REA |
Не получает / Not received |
Самопроизвольная ремиссия 5 лет / Spontaneous 5-year-long remission |
Нет / No |
ЛП / LP |
Да / Yes |
|
Пациент 11 / Patient 11 |
11 |
Генерализованные (БТКП, миоклонические) / Generalized (BTCS, myoclonic) |
ГЭА, мульти-РЭА / GEA, multi-REA |
ВПА, ЛВТ / VPA, LVT |
Фармакорезистентная / Pharmacoresistance |
Да / Yes |
ЛП / LP |
Нет / No |
|
Пациент 12 / Patient 12 |
16 |
Генерализованные атонические / Generalized аtonic |
ГЭА / GEA |
ВПА / VPA |
Ремиссия 8 лет / 8-year-long remission |
Нет / No |
ЛП / LP |
Да / Yes |
Примечание. ЭЭГ – электроэнцефалография; АЭП – антиэпилептические препараты; МРТ – магнитно-резонансная томография; БТКП – билатеральные тонико-клонические приступы; ГЭА – генерализованная эпилептиформная активность; РЭА – региональная эпилептиформная активность; SWAS (англ. spike-and-wave activation in sleep) – синдром спайк-волновой активации во сне; ЛВТ – леветирацетам; ВПА – вальпроаты; ТПМ – топирамат; ЛТЖ – ламотриджин; КБМЗ – карбамазепин; ЛП – лейкопатия.
Note. EEG – electroencephalography; AEDs – antiepileptic drugs; MRI – magnetic resonance imaging; BTCS – bilateral tonic-clonic seizures; GEA – generalized epileptiform activity; REA – regional epileptiform activity; SWAS – spike-and-wave activation in sleep; LVT – levetiracetam; VPA – valproic acid; TPM – topiramate; LTG – lamotrigine; CBMZ – carbamazepine; LP – leukopathy.
Характер приступов
Наиболее частым типом приступов были фокальные – 7 из 12 случаев (58,4%). Приступы с фокальным началом имели разнообразную феноменологию: тонические, клонические с автоматизмами и без них, эпилептические спазмы, вегетативные и зрительные. Практически все фокальные приступы сопровождались нарушением осознанности.
Вегетативные приступы отмечались у 2 пациентов и проявлялись головокружением, тошнотой, позывами к рвоте или рвотой, тахи- и брадикардией, чувством нехватки воздуха. Учитывая особенности проявления вегетативных приступов, данные эпизоды были расценены как осложнения МДМД (гиповентиляция, гастроэзофагеальная рефлюксная болезнь), и у обоих пациентов эпилепсия была диагностирована не сразу.
У трети больных (4 из 12; 33,3%) регистрировались генерализованные приступы, 1 пациент (8,3%) имел сочетание фокальных и генерализованных приступов. Феноменология генерализованных приступов соответствовала абсансам, атоническим, тонико-клоническим и миоклоническим приступам.
Когнитивные нарушения
У 7 из 63 (11,1%) пациентов нашей выборки обнаружены интеллектуальные нарушения, у 3 из них наблюдалась патологическая ЭЭГ. Только у 2 из 7 (28,6%) человек фиксировались эпилептические приступы. Следует отметить, что все пациенты с когнитивными нарушениями страдали врожденной формой заболевания.
Терапия
Наиболее часто назначаемым антиэпилептическим препаратом (АЭП) был леветирацетам (7 из 12 случаев; 58,3%), также применялись вальпроаты (6 из 12; 50%), ламотриджин (2 из 12; 16,6%), карбамазепин (1 из 12; 8,3%), топирамат (1 из 12; 8,3%) в монотерапии и в комбинациях.
Два пациента по собственному решению не принимали АЭП в связи с редкими приступами, у одного из них произошла самопроизвольная ремиссия, в течение 5 лет до настоящего момента новых эпизодов не фиксировалось.
У 2 детей на фоне монотерапии достигнуто урежение приступов на 50% и 75%. В первом случае применялась вальпроевая кислота, во втором – леветирацетам.
Треть больных (4 из 12; 33,3%) имела фармакорезистентную эпилепсию. В нашей выборке не наблюдалось зависимости генерализованной и фокальной эпилепсии от ответа на антиэпилептическую терапию. Пациенты с рефрактерной эпилепсией имели как фокальные (1; 25%), так и генерализованные (2; 50%) приступы, у 1 (25%) человека отмечено их сочетание.
Эпилептиформная активность / Epileptiform activity
Нормальная ЭЭГ наблюдалась у 39 из 63 (61,9%) пациентов, ЭА – у 24 из 63 (38,1%). Из 24 больных с ЭА на ЭЭГ 12 страдали эпилепсией (все имели врожденную форму заболевания).
У всех больных эпилепсией регистрировалась патологическая активность на ЭЭГ. Изменения на ЭЭГ были распределены следующим образом: региональная ЭА – у 2 из 12 (16,7%) пациентов, мультирегиональная ЭА – также у 2 (16,7%), генерализованная ЭА – у 3 (25%), сочетание региональной и генерализованной ЭА – у 1 (8,3%), сочетание мультирегиональной и генерализованной ЭА – у 4 (33,3%). Основной корковый ритм в большинстве случаев соответствовал возрастной норме, исключение составил 1 больной (8,3%). У 2 (16,6%) пациентов ЭА сочеталась с замедлением основной активности.
В группе пациентов с ЭА без эпилепсии (12 из 51; 23,5%) патологические ЭЭГ-изменения были представлены региональной (5 из 12; 41,7%), генерализованной (2; 16,6%) эпилептической активностью, а также их сочетанием (2; 16,6%), у 3 из 12 человек (25%) регистрировался фотопароксизмальный ответ (табл. 3). Основной корковый ритм у всех больных соответствовал возрастной норме, у 1 человека (8,3%) отмечалось сочетание ЭА с замедлением основной активности. Наиболее часто ЭА локализовалась в теменных, задневисочных и затылочных областях независимо от наличия диагноза эпилепсии. Специфических изменений по данным ЭЭГ у пациентов с МДМД выявлено не было.
Таблица 3. Характеристика пациентов с эпилептиформной активностью без эпилепсии
Table 3. Characteristics of patients with epileptiform activity without epilepsy
|
Пациент / Patient |
Возраст проведения ЭЭГ, лет / Patient age at EEG, years |
Особенности ЭЭГ / EEG features |
Задержка когнитивного развития / Delayed cognitive development |
МРТ головного мозга / Brain MRI |
LG-домен / LG domain |
|
Пациент 13 / Patient 13 |
13 |
ГЭА / GEA |
Нет / No |
ЛП / LP |
Да / Yes |
|
Пациент 14 / Patient 14 |
15 |
ФПО 2-го типа по Waltz / Waltz 2 PPR |
Нет / No |
ЛП / LP |
Да / Yes |
|
Пациент 15 / Patient 15 |
5 |
РЭА + ГЭА / REA + GEA |
Нет / No |
Пахигирия + ЛП / Pachygyria + LP |
Нет / No |
|
Пациент 16 / Patient 16 |
6 |
РЭА / REA |
Нет / No |
ЛП / LP |
Да / Yes |
|
Пациент 17 / Patient 17 |
12 |
РЭА + ГЭА / REA + GEA |
Нет / No |
ЛП / LP |
Да / Yes |
|
Пациент 18 / Patient 18 |
6 |
РЭА / REA |
Да / Yes |
ЛП / LP |
Да / Yes |
|
Пациент 19 / Patient 19 |
5 |
РЭА / REA |
Нет / No |
ЛП / LP |
Да / Yes |
|
Пациент 20 / Patient 20 |
5,5 |
РЭА / REA |
Нет / No |
ЛП / LP |
Нет / No |
|
Пациент 21 / Patient 21 |
3,5 |
ФПО 2-го типа по Waltz / Waltz 2 PPR |
Нет / No |
ЛП / LP |
Нет / No |
|
Пациент 22 / Patient 22 |
14 |
ГЭА / GEA |
Нет / No |
ЛП / LP |
Да / Yes |
|
Пациент 23 / Patient 23 |
2 |
ФПО 2–3 типов по Waltz / Waltz 2–3 PPR |
Нет / No |
ЛП / LP |
Нет / No |
|
Пациент 24 / Patient 24 |
6 |
РЭА / REA |
Нет / No |
ЛП / LP |
Нет / No |
Примечание. ЭЭГ – электроэнцефалография; МРТ – магнитно-резонансная томография; ГЭА – генерализованная эпилептиформная активность; ФПО – фотопароксизмальный ответ; РЭА – региональная эпилептиформная активность; ЛП – лейкопатия.
Note. EEG – electroencephalography; MRI – magnetic resonance imaging; GEA – generalized epileptiform activity; PPR – photoparoxysmal response; REA – regional epileptiform activity; LP – leukopathy.
Сопоставление данных МРТ и ЭЭГ / Comparison of MRI and EEG data
МРТ головного мозга проведена 55 больным с МДМД. У 4 из 63 человек (6,3%) отмечалась двусторонняя затылочная пахигирия, причем всего 1 пациентка страдала эпилепсией, 1 пациент имел патологическую ЭЭГ, а в 2 случаях ЭЭГ-характеристики соответствовали норме.
У пациентки с пахигирией и эпилепсией наблюдались фокальные вегетативные приступы частотой 1–2 раза в месяц, а на межприступной ЭЭГ регистрировались генерализованные разряды в виде комплексов «острая – медленная волна», «спайк – полиспайк – медленная волна» и фокальная ЭА в правой лобной и левой теменно-затылочно-задневисочной областях, спровоцированная гипервентиляцией. При приеме вальпроевой кислоты частота приступов сократилась минимум вдвое, дальнейший подбор АЭП не проводился.
У другого пациента с двусторонней затылочной пахигирией (рис. 1), но без эпилепсии регистрировалось умеренное замедление основной ритмики, региональная эпилептическая активность в задневисочно-затылочных областях в сочетании с генерализованной эпилептиформной активностью и пробежками сгруппированных спайков, полиспайков с переменной латерализацией акцента в задневисочно-затылочной областях (рис. 2). Индекс ЭА в бодрствовании был низкий, во сне нарастал до средних значений – около 35–40%. При проведении функциональных проб патологические изменения не увеличивались. Клинических событий у пациента не отмечалось, однако возраст на момент последнего осмотра ребенка составлял 5 лет.
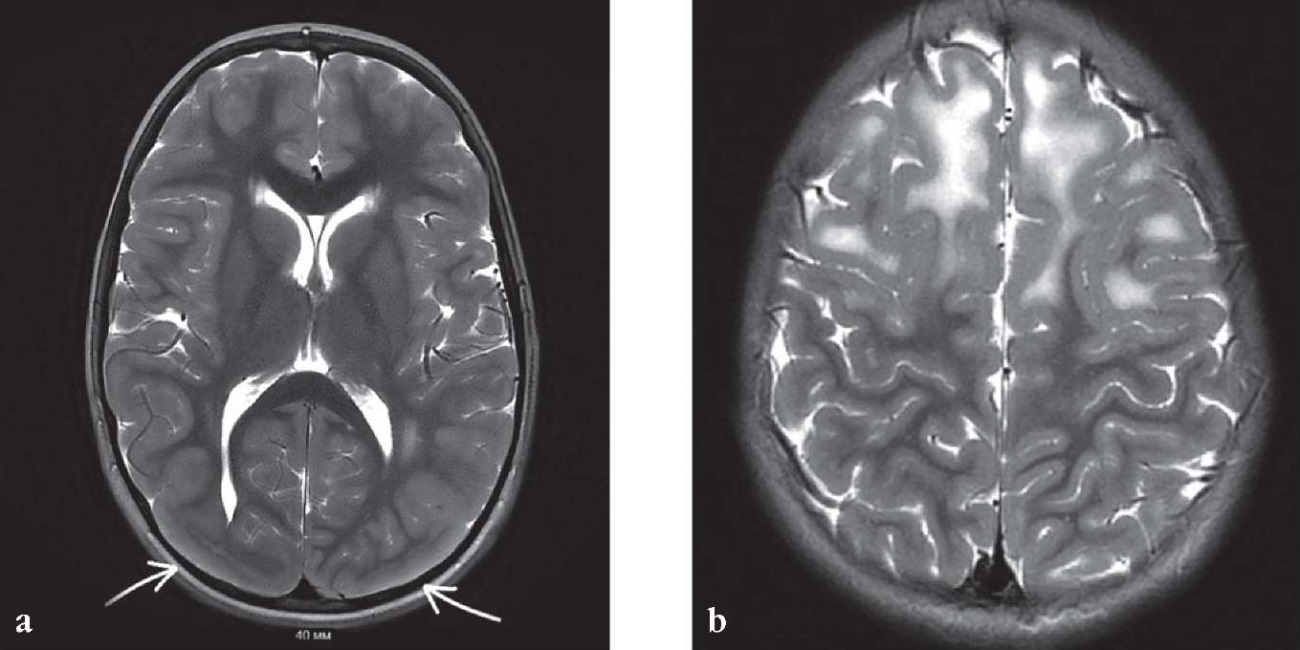
Рисунок 1. Магнитно-резонансные томограммы головного мозга пациента Г. (возраст 5 лет) с поясно-конечностной формой мерозин-дефицитной мышечной дистрофии, Т2-взвешенные изображения:
а – двусторонняя затылочная пахигирия (указана стрелками) и участки повышения сигнала от белого вещества перивентрикулярно; b – повышение сигнала от белого вещества в лобно-теменных долях (лейкопатический паттерн)
Figure 1. Brain magnetic resonance images of Patient G. (aged 5 years) with the limb-girdle merosin-deficient muscular dystrophy, T2-weighted images:
а – bilateral occipital pachygyria (denoted by arrows) and signal increase from periventricular white matter; b – signal increase from white matter in the frontal-parietal lobes (leukopoietic pattern)
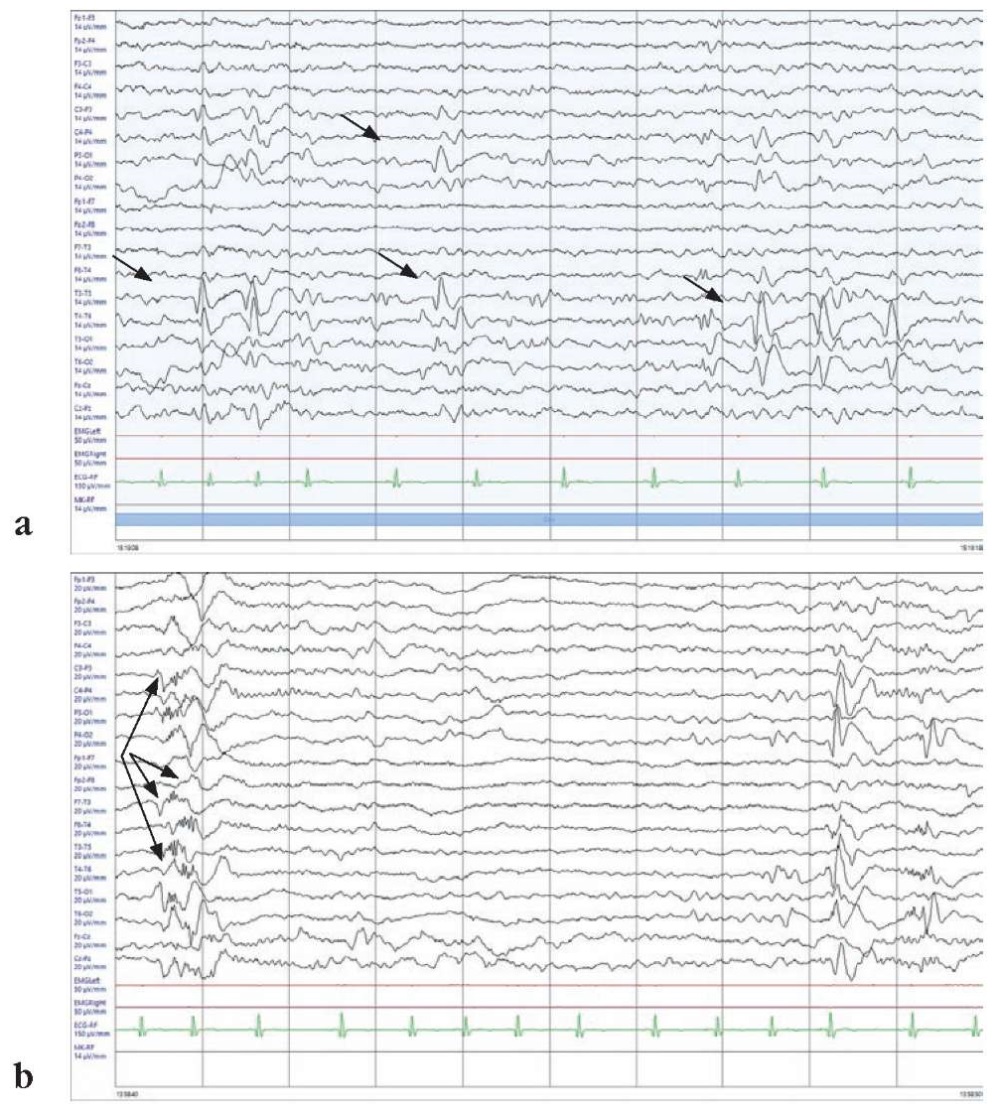
Рисунок 2. Электроэнцефалограммы пациента Г. (возраст 5 лет) с двусторонней затылочной пахигирией:
а – региональная эпилептиформная активность в задневисочно-затылочных областях (указана стрелками) (параметры записи: фильтр низких частот (ФНЧ) 1 Гц, фильтр высоких частот (ФВЧ) 70 Гц, сетевой фильтр 50 Гц, скорость записи 30 мм/с, чувствительность 14 мкВ/мм); b – пробежка сгруппированных спайков, полиспайков с переменной латерализацией акцента в задневисочно-затылочных областях (указаны стрелками) (параметры записи: ФНЧ 1 Гц, ФВЧ 70 Гц, сетевой фильтр 50 Гц, скорость записи 30 мм/с, чувствительность 20 мкВ/мм)
Figure 2. Electroencephalograms of Patient G. (aged 5 years) with bilateral occipital pachygyria.
a – regional epileptiform activity in the posterior temporal and occipital regions (denoted by arrows) (recording parameters: low frequency 1 Hz, high frequency 70 Hz, mains filter 50 Hz, recording speed 30 mm/sec, sensitivity 14 μV/mm); b – a run of grouped spikes, polyspikes with variable lateralization of accentuation in the posterior temporal-occipital regions (denoted by arrows) (recording parameters: low frequency 1 Hz, high frequency 70 Hz, mains filter 50 Hz, recording speed 30 mm/sec, sensitivity 20 μV/mm)
Пахигирия в равной степени встречалась как при врожденной (2; 50%), так и при поясно-конечностной (2; 50%) формах. Практически у всех больных (52; 94,5%) наблюдался так называемый «лейкопатический» паттерн (гиперинтенсивный сигнал в режиме Т2 от белого вещества на МРТ головного мозга), за исключением 3 детей, исследование которым было проведено в возрасте до года, в период незавершенной миелинизации.
В нашей выборке все пациенты с эпилепсией (12; 100%) имели врожденную форму заболевания, и только у 2 (16,6%) больных с патологической активностью на ЭЭГ выявлена поясно-конечностная форма. Однако статистически значимой разницы ни по наличию ЭА (p=0,699), ни по проявлению эпилептических приступов (p=0,329) у пациентов с разными формами МДМД не отмечено.
Мутации в гене LAMA2 / Mutations in the LAMA2 gene
Также мы оценили связь между наличием мутаций в LG-домене гена LAMA2 и патологическими изменениями ЦНС. Минимум один клинически значимый вариант нуклеотидной последовательности в LG-домене гена LAMA2 выявлен у 38 человек, что среди всех пациентов выборки составило: 16 (42,1%) с ЭА, 9 (23,7%) с эпилепсией, 6 (15,8%) со сниженным когнитивным развитием, 4 (10,5%) с РАС, 2 (6,3%) с затылочной пахигирией.
Согласно нашим данным статически значимой разницы между наличием эпилепсии, разрядов на ЭЭГ и наличием вариантов в LG-домене гена LAMA2 не выявлено. Однако у пациентов с МДМД и интеллектуальными нарушениями достоверно чаще отмечались мутации в LG-домене (p=0,028) (табл. 4).
Таблица 4. Сопоставление факта наличия эпилепсии, эпилептиформной активности на электроэнцефалограмме, задержки развития, расстройств аутистического спектра и пахигирии с мутацией в LG-домене гена LAMA2 во всей исследуемой выборке (n=63), n (%)
Table 4. A relation between the presence of epilepsy, epileptiform activity on the electroencephalograms, delayed cognitive development, autism spectrum disorders, pachygyria and mutant LAMA2 gene LG domain in total study group (n=63), n (%)
|
Патология / Pathology |
Мутация LG есть хотя бы в одном аллеле / LG mutation at least in one allele (n=38) |
Мутаций LG нет ни в одном аллеле / No LG mutation in any allele (n=25) |
Уровень значимости р / p-value |
|
|
Эпилептиформная активность / Epileptiform activity |
Да / Yes |
16 (42,1) |
8 (32,0) |
0,442 |
|
Нет / No |
22 (57,9) |
17 (68,0) |
||
|
Эпилепсия / Epilepsy |
Да / Yes |
9 (23,7) |
3 (12,0) |
0,334 |
|
Нет / No |
29 (76,3) |
22 (88,0) |
||
|
Задержка когнитивного развития / Delayed cognitive development |
Да / Yes |
6 (15,8) |
1 (4,0) |
0,028* |
|
Нет / No |
32 (84,2) |
24 (96,0) |
||
|
Расстройство аутистического спектра / Autism spectrum disorder |
Да / Yes |
4 (10,5) |
0 (0,0) |
0,145 |
|
Нет / No |
34 (89,5) |
25 (100,0) |
||
|
Пахигирия / Pachygyria |
Да / Yes |
2 (6,3) |
2 (8,7) |
1,000 |
|
Нет / No |
30 (93,8) |
21 (91,3) |
||
Примечание. * Задержка когнитивного развития достоверно чаще связана с наличием хотя бы одного варианта в домене LG гена LAMA2.
Note. * Delayed cognitive development is significantly more often associated with the presence of at least one variant in the LAMA2 gene LG domain.
ОБСУЖДЕНИЕ / DISCUSSION
В нашем исследовании у пациентов с МДМД распространенность эпилепсии (19%) и ЭА (38,1%) в целом оказалась значительно выше, чем у здоровых людей. Эти данные соотносятся с результатами, опубликованными другими авторами [7].
Ни один пациент с поясно-конечностной формой заболевания не имел диагноза эпилепсии, хотя согласно литературным источникам при ПКМД Р23 ее частота может быть выше, чем при ВМД 1А [5]. Возможно, наши результаты объясняются преимущественно педиатрической выборкой и малым числом больных с ПКМД Р23.
Эпилепсия могла протекать как с фокальными, так и с генерализованными типами приступов, хотя фокальные преобладали. У 2 пациентов наблюдались фокальные вегетативные приступы в виде тошноты, рвоты, нарушения сердечного ритма, чувства нехватки воздуха. Такие эпизоды с учетом мультисистемности заболевания могут быть приняты за острую дыхательную недостаточность, гипогликемический криз, проявления гастроэзофагеальной рефлюксной болезни. Проведение ЭЭГ поможет подтвердить эпилептический характер пароксизмов и вовремя начать терапию.
У всех больных эпилепсией зарегистрирована ЭА. Большинство (8 из 12; 66,7%) имели генерализованную ЭА, в т.ч. в сочетании с региональной и мультирегиональной ЭА. Напротив, в группе лиц с наличием ЭА, но без эпилепсии, преобладала исключительно региональная ЭА (5 из 12 случаев; 41,7%), а также регистрировался фотопароксизмальный ответ (3 из 12 случаев; 25%) без других видов патологической активности.
Практически все пациенты имели лейкопатический паттерн на МРТ, исключение составили 3 ребенка, исследование которым было проведено на первом году жизни и в динамике не повторялось. Отсутствие лейкопатического паттерна в данной возрастной группе может объясняться незавершенной миелинизацией. Наличие изменений в белом веществе головного мозга не коррелировало ни с формой, ни с тяжестью заболевания, ни с патологией ЦНС.
В нашей выборке у 4 (6,3%) пациентов отмечалась пахигирия, у всех – двусторонней затылочной локализации. Однако только у половины из них наблюдались ЭЭГ-изменения и только у 1 пациента – клинические приступы. Второй пациент имел сочетание региональной и генерализованной эпиактивности, а также специфичный паттерн при лиссэнцефалии/пахигирии, регистрируемый на скальповой интериктальной ЭЭГ, – фокальные быстрые эпилептиформные разряды (фокальные спайки-полиспайки с частотой не менее 10 Гц, продолжительностью не менее 3 с), а кроме того, были описаны так называемые щетки (англ. brashes). Отсутствие у этого пациента клинических эпизодов может объясняться ранним возрастом (на момент последнего наблюдения ребенку было 5 лет). Несмотря на наши данные, с учетом того, что структурные изменения головного мозга могут являться фактором развития эпилепсии, мы считаем необходимым всем больным с генетически подтвержденным диагнозом МДМД проводить МРТ головного мозга.
У пациентов с МДМД частично или полностью отсутствует белок ламинин-211 [3], который играет важнейшую роль в миграции нейронов и формировании структуры головного мозга в эмбриональном периоде. Преобладание региональной ЭА преимущественно в заднепроекционных отделах, независимо от наличия мальформаций головного мозга, совпадает со схожей локализацией пахигирии. Можно предположить, что у больных с МДМД имеются микроструктурные изменения, которые не видны при нейровизуализации, но проявляются патологической активностью на ЭЭГ. Эти данные требуют дальнейшего изучения.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Наши результаты показывают высокую распространенность эпилепсии и ЭА у пациентов с МДМД. При этом мы не обнаружили взаимосвязи между наличием какой-либо патологии ЦНС с формой заболевания, что расходится с ранее опубликованными данными. При оценке клинико-генетической корреляции только задержка когнитивного развития при МДМД оказалась достоверно связана с наличием вариантов в LG-домене гена LAMA2. Очевидно, необходимы дальнейшие исследования на эту тему.
Учитывая значительную распространенность эпилепсии, задержки когнитивного развития, структурных изменений коры головного мозга, больные с генетически верифицированным диагнозом МДМД должны проходить тщательное обследование, включающее подробную оценку психического развития, нейрофизиологическое обследование и МРТ головного мозга. Наличие фокальных вегетативных приступов у пациентов требует особой настороженности по эпилепсии со стороны неврологов, поскольку они могут приниматься за соматические осложнения МДМД и не диагностироваться.
Список литературы
1. Messina S., Bruno C., Moroni I., et al. Congenital muscular dystrophies with cognitive impairment. A population study. Neurology. 2010; 75 (10): 898–903. https://doi.org/10.1212/WNL.0b013e3181f11dd5.
2. Jones K.J., Morgan G., Johnston H., et al. The expanding phenotype of laminin alpha2 chain (merosin) abnormalities: case series and review. J Med Genet. 2001; 38 (10): 649–57. https://doi.org/10.1136/jmg.38.10.649.
3. Geranmayeh F., Clement E., Feng L.H., et al. Genotype-phenotype correlation in a large population of muscular dystrophy patients with LAMA2 mutations. Neuromuscul Disord. 2010; 20 (4): 241–50. https://doi.org/10.1016/j.nmd.2010.02.001.
4. Oliveira M.E., Moreira A., Coelho T., et al. LAMA2 gene analysis in a cohort of 26 congenital muscular dystrophy patients. Clin Genet. 2008; 74 (6): 502–12. https://doi.org/10.1111/j.1399-0004.2008.01068.x.
5. Tan D., Ge L., Fan Y., et al. Natural history and genetic study of LAMA2-related muscular dystrophy in a large Chinese cohort. Orphanet J Rare Dis. 2021; 16 (1): 319. https://doi.org/10.1186/s13023-021-01950-x.
6. Huang X., Tan D., Zhang Z., et al. Unique genotype-phenotype correlations within LAMA2-related limb girdle muscular dystrophy in Chinese patients. Front. Neurol. 2023; 14: 1158094. https://doi.org/10.3389/fneur.2023.1158094.
7. Natera-de Benito D., Muchart J., Itzep D., et al. Epilepsy in LAMA2-related muscular dystrophy: an electro-clinico-radiological characterization. Epilepsia. 2020; 61 (5): 971–83. https://doi.org/10.1111/epi.16493.
8. Salvati A., Bonaventura E., Sesso G., et al. Epilepsy in LAMA2-related muscular dystrophy: a systematic review of the literature. Seizure. 2021; 91: 425–36. https://doi.org/10.1016/j.seizure.2021.07.020.
9. Camelo C.G., Artilheiro M.C., Martins Moreno C.A., et al. Brain MRI abnormalities, epilepsy and intellectual disability in LAMA2 related dystrophy – a genotype/phenotype correlation. J Neuromuscul Dis. 2023; 10 (4): 483–92. https://doi.org/10.3233/JND-221638.
10. Menezes M.J., McClenahan F.K., Leiton C.V., et al. The extracellular matrix protein laminin α2 regulates the maturation and function of the blood-brain barrier. J Neurosci. 2014; 34 (46): 15260–80. https://doi.org/10.1523/JNEUROSCI.3678-13.2014.
11. Arreguin A.J., Colognato H. Brain dysfunction in LAMA2-related congenital muscular dystrophy: lessons from human case reports and mouse models. Front Mol Neurosci. 2020; 13: 118. https://doi.org/10.3389/fnmol.2020.00118.
12. Миловидова Т.Б., Булах М.В., Щагина О.А., Поляков А.В. Молекулярно-генетический анализ врожденной мерозин-дефицитной мышечной дистрофии в России. Медицинская генетика. 2018; 17 (7): 38–45.
13. Gawlik K.I., Durbeej M. A family of laminin α2 chain-deficient mouse mutants: advancing the research on LAMA2-CMD. Front Mol Neurosci. 2020; 13: 59. https://doi.org/10.3389/fnmol.2020.00059.
14. Yurchenco P.D., McKee K.K., Reinhard J.R., Rüegg M.A. Laminindeficient muscular dystrophy: molecular pathogenesis and structural repair strategies. Matrix Biol. 2018; 71: 174–87. https://doi.org/10.1016/j.matbio.2017.11.009.
15. Bönnemann C.G., Wang C.H., Quijano-Roy S., et al. Diagnostic approach to the congenital muscular dystrophies. Neuromuscul Disord. 2014; 24 (4): 289–311. https://doi.org/10.1016/j.nmd.2013.12.011.
16. Белоусова Е.Д., Заваденко Н.Н., Холин А.А., Шарков А.А. Новые международные классификации эпилепсий и эпилептических приступов Международной лиги по борьбе с эпилепсией (2017). Журнал неврологии и психиатрии им. С.С. Корсакова. 2017; 117 (7): 99–106. https://doi.org/10.17116/jnevro20171177199-106.
Об авторах
А. В. МонаховаРоссия
Монахова Анастасия Вячеславовна
ул. Талдомская, д. 2, Москва 125412
Е. Д. Белоусова
Россия
Белоусова Елена Дмитриевна, д.м.н., проф.
Scopus Author ID: 24767524000
ул. Талдомская, д. 2, Москва 125412
З. К. Горчханова
Россия
Горчханова Зарета Казбулатовна, к.м.н.
ул. Талдомская, д. 2, Москва 125412
Рецензия
Для цитирования:
Монахова А.В., Белоусова Е.Д., Горчханова З.К. Эпилепсия, эпилептиформные разряды и особенности магнитнорезонансной томографии головного мозга при мерозин-дефицитной мышечной дистрофии. Эпилепсия и пароксизмальные состояния. 2025;17(2):142-152. https://doi.org/10.17749/2077-8333/epi.par.con.2025.213
For citation:
Monakhova A.V., Belousova E.D., Gorchkhanova Z.K. Epilepsy, epileptiform discharges and features of brain magnetic resonance imaging in merosin-deficient muscular dystrophy. Epilepsy and paroxysmal conditions. 2025;17(2):142-152. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2025.213
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































