Перейти к:
Хирургическое лечение МР-негативной фармакорезистентной эпилепсии у детей
https://doi.org/10.17749/2077-8333/epi.par.con.2022.110
Аннотация
Цель: анализ тактики ведения детей с магнитно-резонансно-негативной (МР-негативной) эпилепсией, характеристика морфологических данных и оценка результатов лечения.
Материал и методы. В исследование включен 31 пациент в возрасте до 18 лет с верифицированным диагнозом фармакорезистентной эпилепсии и отсутствием структурного поражения по данным магнитно-резонансной томографии головного мозга по протоколу «эпилепсия» за период 2013–2021 гг. Проанализировано распределение больных по полу, возрасту, длительности заболевания, возрасту дебюта, числу использованных схем противосудорожной терапии, частоте приступов на момент начала лечения, а также стороне и доле зоны генерации приступа. Для оценки этапа предоперационного обследования пациентов в специально разработанной карте исследования были выделены возможные инструментальные методы диагностики с указанием вклада результата отдельного метода в определение эпилептогенной зоны. Также представлено распределение больных по типу хирургического вмешательства и данным гистологического исследования.
Результаты. Резекционные хирургические вмешательства были выполнены у 26 (83,9%) пациентов. В 5 (16,1%) случаях с двусторонней локализацией эпилептического очага проведены паллиативные операции: каллезотомия (3) и стимуляция блуждающего нерва (2). Через 12 мес исходы I класса по J. Engel отмечены у 19 (61,3%) больных, II класса – у 6 (19,4%), III класса – у 5 (16,1%), IV класса – у 1 (3,2%). Оценены отдаленные результаты хирургического лечения через 3 и 5 лет.
Заключение. Хирургический метод лечения МР-негативной эпилепсии может быть эффективным, с полным прекращением припадков у 61,3% пациентов, но требует использования дополнительных диагностических методов по отношению к стандарту предоперационного обследования для локализации эпилептогенной зоны.
Ключевые слова
Для цитирования:
Маматханов М.Р., Ушанов В.В., Герасимов А.П., Хачатрян В.А. Хирургическое лечение МР-негативной фармакорезистентной эпилепсии у детей. Эпилепсия и пароксизмальные состояния. 2022;14(2):195-203. https://doi.org/10.17749/2077-8333/epi.par.con.2022.110
For citation:
Mamatkhanov M.R., Ushanov V.V., Gerasimov A.P., Khachatryan W.A. Surgical treatment of MRI-negative drug resistant epilepsy in children. Epilepsy and paroxysmal conditions. 2022;14(2):195-203. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.110
ВВЕДЕНИЕ / INTRODUCTION
Обнаружение органического поражения головного мозга, которое является причиной генерации эпилептических приступов, позволяет рассмотреть возможность хирургического лечения у пациентов с очаговой фармакорезистентной эпилепсией (ФРЭ) и является дополнительным показанием к интервенционным вмешательствам [1][2].
В настоящее время магнитно-резонансная томография (МРТ) занимает ведущее место в определении эпилептогенного поражения [1]. Однако у части пациентов с очаговой ФРЭ отсутствуют структурные изменения по данным МРТ головного мозга, составляя так называемую МР-негативную форму. На их долю приходится около 30% наблюдений у детей [3], и не существует единого понимания тактики ведения данной группы больных.
Самая частая из обнаруженных морфологических причин, приводящих к развитию МР-негативной эпилепсии, – фокальная корковая дисплазия (ФКД), также причиной может служить мультифокальная патология [1]. Данные метаанализа J.F. Téllez-Zenteno et al. (2010 г.) демонстрируют, что доля МР-негативных форм среди детей больше, чем среди взрослых (31% и 21% соответственно), и они чаще представлены экстратемпоральными формами эпилепсии [4]. Возрастные различия ожидаемы, поскольку экстратемпоральный эпилептогенез связан с мальформациями коркового развития, которые как причина эпилептических приступов чаще выступают у детей [5][6].
Отсутствие структурных изменений по данным МРТ головного мозга у пациентов с ФРЭ является одним из ограничивающих факторов при выборе хирургического [7][ 8], в особенности резекционного, вмешательства, однако следует отметить, что не все структурные поражения (ФКД, мальформации коркового развития) могут быть выявлены по данным МРТ 3.0 и 1.5 Тл [1]. Известно, что МРТ с основными импульсными последовательностями позволяет обнаружить характерные для эпилепсии поражения головного мозга не более чем в 50% случаев, поэтому разработан и введен в практику особый протокол «эпилепсия», выполнение которого повышает вероятность их обнаружения [1].
Большинство исследований послеоперационных исходов у пациентов с МР-негативной ФРЭ в основном проводились у взрослых, опубликованные данные исключительно по детям малочисленны [8]. Таким образом, учитывая тот факт, что самой частой причиной МР-негативной эпилепсии являются кортикальные дисплазии [1], необходимо обращать внимание именно на выборку пациентов детского возраста.
Точность определения и полнота резекции эпилептогенной зоны определяют успешные результаты хирургического лечения ФРЭ [1][7], а меньшая продолжительность неэффективной терапии представляет собой один из основных предикторов благоприятного исхода операции. Не являются исключением и случаи МР-негативной фокальной эпилепсии [1], что побудило нас к исследованию данной проблемы.
Цель – анализ тактики ведения детей с МР-негативной фармакорезистентной эпилепсией, характеристика морфологических данных и оценка результатов лечения.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Дизайн исследования / Study design
Проведено одноцентровое ретроспективное неконтролируемое продольное наблюдательное исследование на базе детского нейрохирургического отделения № 7 ФГБУ «Национальный медицинский исследовательский центр им. В.А. Алмазова» Минздрава России.
Критерии включения и исключения / Inclusion and exclusion criteria
Критериями включения являлись:
- возраст пациентов до 18 лет;
- диагноз «фармакорезистентная эпилепсия»;
- отсутствие по данным МРТ головного мозга (1.5 и 3.0 Тл), выполненной по протоколу «эпилепсия», видимой структурной патологии вещества головного мозга, соответствующей семиологии эпилептических приступов, либо незначительные очаговые изменения (невыраженная асимметрия формы или размера структур головного мозга), либо диффузные изменения с расширением ипсилатерального бокового желудочка и незначительной односторонней гипотрофией полушария (МР-негативная форма).
Критерии исключения:
- возраст 18 лет и старше;
- МР-позитивные формы эпилепсии.
Этические аспекты / Ethical aspects
Исследование проведено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации Всемирной медицинской ассоциации (2013 г., Форталеза, Бразилия) и одобрено этическим комитетом ФГБУ «Национальный медицинский исследовательский центр им. А.В. Алмазова» Минздрава России от 16 мая 2016 г. № 0305-2016. Информированное согласие на использование данных пациентов в научной работе подписано законными представителями детей.
Пациенты / Patients
В выборку включен 31 пациент с верифицированным диагнозом фармакорезистентной эпилепсии за период 2013–2021 гг.
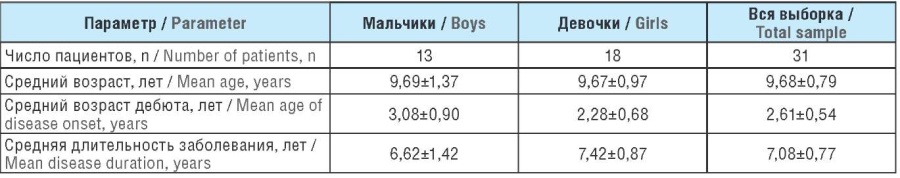
Проанализировано распределение больных по полу, возрасту, длительности заболевания, возрасту дебюта, числу использованных схем противосудорожной терапии, частоте приступов на момент начала лечения, а также стороне и доле зоны генерации приступа. Социально-демографические характеристики пациентов представлены в таблице 1.
Таблица 1. Социально-демографические характеристики пациентов
Table 1. Socio-demographic characteristics of patients
Также учтено распределение больных по типу оперативного вмешательства, данным гистологического исследования (в случае резекционных операций). Определены ближайшие (до 1 года) и отдаленные результаты в соответствии с классификацией послеоперационных исходов лечения эпилепсии по J. Engel (1993 г.) [8].
Инструментальные методы диагностики / Instrumental diagnostic methods
Для оценки этапа предоперационного обследования пациентов в специально разработанной карте исследования были выделены инструментальные методы диагностики:
- неинвазивный и инвазивный видеоэлектроэнцефалографический (ЭЭГ) мониторинг на 19-канальных усилителях (Nihon Kohden, Япония; Nicolet, США) с расположением электродов по системе «10–20»;
- МРТ на аппаратах 3.0 Тл (Excite General Electric, США; Siemens Erlangen, Германия; Gyroscan Philips Medical System, Нидерланды);
- позитронно-эмиссионная томография с компьютерной томографией (ПЭТ/КТ) с 18F-фтордезоксиглюкозой (18F-ФДГ) (Philips Time-of-Flight, Нидерланды).
Обозначен вклад результата отдельного исследования в определение эпилептогенной зоны: факт применения метода диагностики, выявление зоны генерации приступов.
Методы статистического анализа / Methods of statistical analysis
Статистическую обработку данных проводили с использованием прикладной программы jamovi 1.6.23.0 (The Jamovi Project, Австралия). Основным инструментом анализа была описательная статистика. Полученные данные обобщены при помощи дискретных групп. Среднее значение и стандартная ошибка указаны для всех количественных показателей: возраст пациента, возраст дебюта, длительность заболевания. Неколичественные параметры (частота эпилептических приступов, сторона и доля зоны генерации приступов, использование инструментальных методов исследования, тип оперативного вмешательства, результаты гистологического исследования, исходы хирургии) представлены в процентах.
РЕЗУЛЬТАТЫ / RESULTS
Характеристики эпилепсии / Characteristics of epilepsy
Всем пациентам были выполнены клинический анализ симптоматики приступов, неврологическое, нейропсихологическое, нейрофизиологическое (неинвазивный видео-ЭЭГ-мониторинг) обследования, а также непосредственно МРТ головного мозга.
На момент начала лечения у 27 (87,1%) больных эпилептические припадки были частыми (от более 4 раз в месяц до нескольких раз в сутки), у 4 (12,9%) – редкими (2–3 раза в месяц). Среднее число схем противоэпилептической терапии, использованных с целью достижения контроля над приступами, составило 5. При этом в 7 случаях не удалось определить точное число схем по данным медицинской документации, тем не менее все дети были с верифицированным диагнозом фармакорезистентной эпилепсии.
В 16 (51,6%) наблюдениях с целью уточнения или выявления зоны начала приступа прибегали к дополнительным методам диагностики (инвазивный видео-ЭЭГмониторинг путем установки субдуральных электродов, ПЭТ/КТ с 18F-ФДГ), причем в 3 случаях для определения тактики лечения использовались оба метода (рис. 1). Зона начала приступа была выявлена в височной доле у 10 (32,3%) пациентов, в лобной – у 8 (25,8%), в лобновисочной – у 5 (16,1%), в теменной – у 1 (3,2%). При этом эпилептиформная активность с охватом одного полушария большого мозга была зарегистрирована у 2 (6,5%) больных, обоих полушарий – у 5 (16,1%). Что касается правои левосторонней латерализации, приступ генерировался справа у 17 (54,9%) пациентов, слева – у 9 (29%), в 5 (16,1%) случаях была отмечена билатеральная активность.
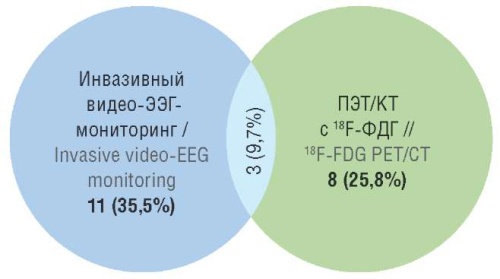
Рисунок 1. Число случаев применения дополнительных методов диагностики в общей выборке (n=31). ЭЭГ – электроэнцефалографический; ПЭТ/КТ – позитронно-эмиссионная томография с компьютерной томографией; ФДГ – фтордезоксиглюкоза
Figure 1. Number of cases of applying additional diagnostic methods in the total sample (n=31). EEG – electroencephalographic; PET/CT – positron emission tomography with computed tomography; FDG – fluorodeoxyglucose
Характеристики оперативного этапа / Surgery stage characteristics
Учитывая полученные данные комплексного обследования, в т.ч. инвазивного мониторинга, у 26 (83,9%) пациентов были выполнены резекционные хирургические вмешательства: блок-резекция передних двух третей височной доли у 10 детей (рис. 2), экстратемпоральные резекции – у 9, мультифокальные резекции – у 4, гемисферотомия – у 3. В 5 (16,1%) случаях двусторонней локализации эпилептического очага выполнены паллиативные операции: каллезотомия (3), стимуляция блуждающего нерва (2).
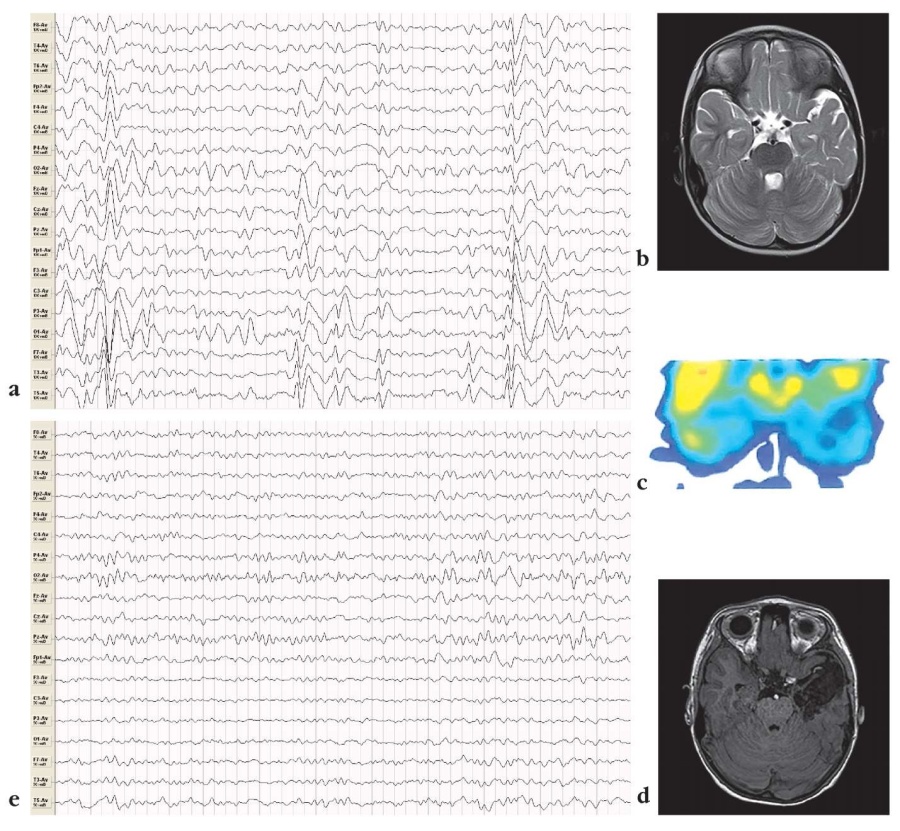
Рисунок 2. Клинический случай пациента С., 5 лет: a – электроэнцефалограмма (ЭЭГ) до операции, эпилептическая активность в левой височной области; b – магнитнорезонансная томограмма (МРТ) головного мозга до операции, патологических изменений нет; с – позитронноэмиссионная томограмма с компьютерной томограммой до операции, гипометаболизм в левой височной доле; d – МРТ головного мозга после операции, состояние после передней височной лобэктомии с амигдалогиппокампэктомией; e – ЭЭГ после операции, эпилептическая активность не регистрируется
Figure 2. Clinical case of patient S., 5 years old: a – electroencephalogram (EEG) before surgery, epileptic activity in the left temporal region; b – magnetic resonance image (MRI) before surgery, no pathological changes, c – positron emission tomogram with computed tomography before surgery, hypometabolism in the left temporal lobe; d – MRI after surgery, image after anterior temporal lobectomy with amygdalohippocampectomy; e – EEG after surgery, epileptic activity is not registered
Данные гистологического исследования операционного материала участков головного мозга представлены на рисунке 3.
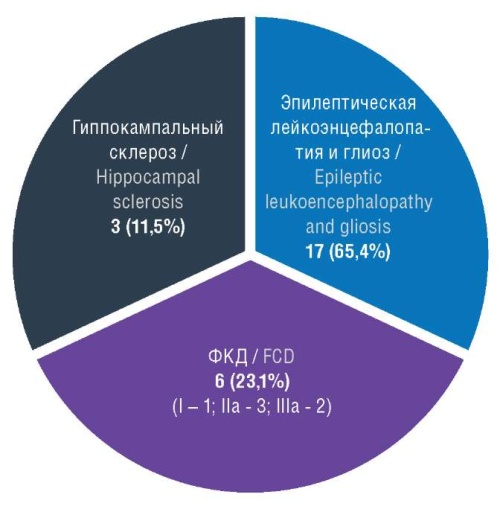
Рисунок 3. Результаты гистологического исследования (26 наблюдений). ФКД – фокальная корковая дисплазия
Figure 3. Histological examination results (26 cases). DCD – focal cortical dysplasia
Исходы лечения / Treatment outcomes
Ближайший результат хирургического лечения через 12 мес оценен у всех детей из выборки. Исходы I класса по J. Engel отмечены у 19 (61,3%) пациентов, II класса – у 6 (19,4%). Исходы III, IV классов зарегистрированы в 6 (19,4%) случаях (III класс – 5 детей, IV класс – 1 ребенок). Среди детей, которым были выполнены резекционные операции, исходы I класса отмечены у 19 (73,1%) пациентов, II класса – у 6 (23,1%), III класса – у 1 (3,8%). Среди случаев, когда были выбраны паллиативные методы лечения, исходов I класса с полным прекращением приступов не наблюдалось. Вместе с тем у 4 (80%) детей достигнут исход III класса и у 1 ребенка (20%) – IV класса.
Отдаленные результаты через 3 года после хирургического вмешательства были отслежены у 23 детей. Среди пациентов после резекционных операций исходы I класса отмечены у 13 (68,5%) больных, II класса – у 4 (21%), III класса – у 2 (10,5%), исходов IV класса не зафиксировано. Среди детей после паллиативных оперативных вмешательств исходов I, II классов не зарегистрировано, исходы III класса наблюдались в 3 (75%) случаях, IV класса – в 1 (25%).
Отдаленные результаты через 5 лет после хирургического лечения оценены у 15 детей. После резекционных операций исходы I класса отмечены в 8 (61,5%) случаях, II класса – в 2 (15,4%), III класса – в 3 (23,1%), исходов IV класса не зарегистрировано. Среди пациентов, для которых были выбраны паллиативные методы лечения, зафиксировано по 1 исходу III и IV классов.
ОБСУЖДЕНИЕ / DISCUSSION
При обсуждении проблемы МР-негативной эпилепсии необходимо понимать, кого относить к этой группе пациентов. По данным многих авторов, считается целесообразным вычленение отдельной когорты больных с МР-негативной формой, у которых по результатам нейровизуализации не обнаружено видимой структурной патологии вещества головного мозга, соответствующей семиологии эпилептических приступов, либо отмечены незначительные очаговые изменения (невыраженная асимметрия формы или размера структур головного мозга), либо визуализированы диффузные изменения с расширением ипсилатерального бокового желудочка и незначительной односторонней гипотрофией полушария [1][7][9]. Число МР-положительных случаев зависит от ряда факторов: опыта врача-специалиста, знания особенностей возможной патологии, величины напряженности магнитного поля аппарата, использования методов морфометрической постобработки [9]. Также в детской популяции значимым является возраст. Так, при определении эпилептогенного поражения у детей до 2 лет возникают объективные сложности ввиду незаконченности процессов миелинизации. Известно, что по этой причине пороки развития, такие как корковые дисплазии, играющие ведущую роль в структуре причин МР-негативной эпилепсии, не могут быть обнаружены методами нейровизуализации [3][10]. Поэтому МРнегативность у детей до 2 лет требует повторного исследования в более позднем возрасте.
Следует также отметить, что технология метода МРТ развивается и, вероятно, пациенты, ранее классифицированные как МР-негативные, на самом деле могут быть МР-позитивными. Следовательно, сравнение между предыдущими и нынешними пациентами с отрицательным результатом МРТ может быть неточным.
Хотя исходы хирургического лечения МР-негативных форм эпилепсии несколько хуже, чем МР-позитивных форм, полученные данные свидетельствуют о достижении полного контроля над приступами у значительной части прооперированных пациентов – до 51,5% [7]. Работы Е. Widjaja et al. (2020 г.) [7] и J.F. Tellez-Zenteno et al. (2010 г.) [4] демонстрируют, что отсутствие эпилептогенного поражения – четкий отрицательный предиктор в отношении достижения полного контроля над приступами. При этом не выявлено существенных отличий между детской и взрослой выборками, и тот факт, что «негативность» была констатирована по данным МРТ или гистопатологии, не был значимым. Исследование J.M. Paolicchi et al. (2000 г.) [11], отражающее только детскую выборку, показало похожие результаты. Однако в работе А. McGonigal et al. (2007 г.) [12] со взрослой и детской выборками были получены сопоставимые результаты в достижении контроля над приступами в группах с МР-позитивной и МР-негативной формами. Это исследование примечательно тем, что пациенты на предоперационном этапе были обследованы с помощью стерео-ЭЭГ.
В отношении МР-негативной эпилепсии с локализацией эпилептического очага в лобной доле нет определенных выводов по исходам хирургического лечения в сравнении с МР-позитивной формой [9].
Корковые дисплазии – наиболее частая морфологическая патология у детей с эпилепсией [9]. Исходы хирургического лечения МР-негативных и МР-позитивных форм с подтвержденной морфологически ФКД сопоставимы в ряде работ [9]. По данным Z.I. Wang et al. [13], результаты гистологического исследования операционного материала 95 пациентов в возрасте 4–64 года с МРнегативной ФРЭ в 45% случаев были представлены ФКД, в 22% – глиозом, в 13% – гамартомой и глиозом, в 9% – гиппокампальным склерозом. Примечательно, что у 7% больных патологических изменений выявлено не было [13]. Отсутствие морфологических изменений в удаленных участках может быть свидетельством того, что этиология эпилепсии представлена патологическими изменениями на уровне протеомики и метаболомики, что объясняет отсутствие эпилептогенного поражения, но, вероятно, обусловливает более сложную и распространенную эпилептическую систему, чем при структурной эпилепсии. Также следует отметить, что отсутствие морфологических изменений может быть и результатом «ошибочной» резекции. По данным нашего исследования, где выборку пациентов составляли исключительно дети, результат гистологического исследования в 65,4% случаев был представлен эпилептической лейкоэнцефалопатией и глиозом, а в 23,1% случаев – ФКД.
В группе пациентов с МР-негативной эпилепсией с морфологическим субстратом лимитирующим фактором диагностики становятся возможности нейровизуализации, в частности МРТ. В случае отсутствия субстрата генез эпилепсии, вероятно, носит функциональный характер, т.е. для диагностики целесообразно использовать мультимодальную функциональную визуализацию (магнитоэнцефалография, однофотонная эмиссионная КТ, ПЭТ, скальповая ЭЭГ, инвазивная ЭЭГ, комбинация методов) [14–16]. На нашем материале при отсутствии структурных изменений на МРТ в качестве дополнительных предоперационных методов обследования применяли скальповую ЭЭГ, инвазивную ЭЭГ, видео-ЭЭГ-мониторинг, ПЭТ и комбинацию этих методов. В 35,5% случаев пациенты с МР-негативной эпилепсией для оценки возможности оперативного лечения подвергаются установке электродов для инвазивного ЭЭГ-мониторинга.
Опубликованы работы о благоприятных исходах хирургии МР-негативной ФРЭ с использованием инвазивного ЭЭГ-мониторинга [9][17][18]. Однако инвазивного способа диагностики можно избежать, используя неинвазивные функциональные методы [6]. Это актуальная проблема, т.к. установка электродов для ЭЭГ является самостоятельной операцией и несет в себе потенциальный риск возникновения всевозможных осложнений. Общая идея в диагностике с использованием функциональных методов такова, что важна согласованность результатов при их комбинации. Это будет определять благоприятный прогноз выявления эпилептогенной зоны и, соответственно, успеха оперативного лечения.
Данные многих авторов свидетельствуют о достижении приемлемых результатов хирургического вмешательства в группе пациентов с МР-негативной ФРЭ [1][4][7][9][14]. Показательна работа C.G. Bien et al. (2009 г.) [14], где выборку представляли дети и взрослые, достижение полного контроля над приступами в случае продолжения консервативного лечения наблюдалось в 16% случаев, а при применении хирургического метода – в 38% случаев. Объем резекции влияет на исход хирургии эпилепсии. Полнота резекции – наиболее значимый прогностический фактор достижения контроля над приступами [1][7][9][11]. Таким образом, наиболее эффективным способом лечения ФРЭ является хирургическое удаление эпилептогенной зоны. Необходимо отметить, что оперативное вмешательство в объеме каллозотомии, хоть и не относится к операциям резекции эпилептического очага, а разъединяет пути распространения эпилептического разряда (как самостоятельно, так и одним из этапов функциональной гемисферотомии), при наличии показаний является эффективным (до 30–70% случаев) выбором в арсенале методов хирургического лечения эпилепсии [1].
По данным систематического обзора и метаанализа 258 исследований Е. Widjaja et al. (2020 г.), общий показатель прекращения приступов составляет 64,8% в 1-й год наблюдения, постепенно уменьшается в течение первых 5 лет и резко снижается через 10 лет. Лучший исход достигается после гемисферэктомий и/или гемисферотомий (74,7%), за ними следуют височные лобэктомии (73,3%) и экстратемпоральные резекции (60,2%), а в случае отсутствия структурных поражений на МРТ – 51,5% [7].
По данным нашего исследования, через 12 мес после оперативного лечения исходы I класса по J. Engel отмечены у 61,3% детей, II класса – у 19,4%, III и IV классов – также у 19,4%. При этом резекционные хирургические вмешательства были выполнены у 83,9% пациентов. Также отмечено постепенное снижение процента исходов I класса при оценке отдаленных результатов хирургического лечения (до 5 лет катамнеза).
Длительность заболевания в нашей работе составила в среднем около 7 лет, что отражает проблему позднего применения хирургического метода лечения, которая является актуальной во всем мире [19][20]. Была доказана эффективность раннего оперативного лечения у пациентов после приема двух противосудорожных препаратов в течение 2 лет с сохранением приступов [19][20]. Продолжительный анамнез эпилепсии определяет ухудшение не только соматического статуса больного, но и нейрофизиологических показателей с увеличением вероятности возникновения таких осложнений, как появление приступов с трансформацией в билатеральные тонико-клонические судороги, а также с тенденцией к серийному течению и развитию эпилептического статуса [19–23].
Однако на длительность заболевания можно повлиять. Она определяется информированием как пациентов, так и врачей об эффективности хирургического лечения эпилепсии, а также психологической готовностью больных и их законных представителей [24][25].
По нашему мнению, целесообразно проведение дальнейших исследований с бóльшим объемом выборки с целью объективного отражения состояния проблемы хирургического лечения больных с МР-негативной фармакорезистентной эпилепсией.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Хотя отсутствие структурных изменений на МРТ является отрицательным прогностическим фактором, оперативное лечение в этой группе пациентов также эффективно (с полным прекращением припадков у 61,3%), но требует использования дополнительных диагностических методов по отношению к стандарту предоперационного обследования.
Проблема позднего нейрохирургического лечения эпилепсии распространена во всем мире, однако длительность заболевания до поступления в стационар является управляемым показателем. Это создает перспективы улучшения исходов лечения пациентов, несмотря на отсутствие эпилептогенного поражения по данным нейровизуализации.
Список литературы
1. Крылов В.В. Хирургия эпилепсии. М.: АБВ-пресс; 2019: 408 с.
2. Карлов В.А. Эпилепсия у детей и взрослых женщин и мужчин. Руководство для врачей. 2-е изд. М.: БИНОМ; 2019: 896 с.
3. Маматханов М.Р., Лебедев К.Э., Себелев К.И. Нейровизуализация при хирургическом лечении медикаментозно-резистентной эпилепсии у детей. Нейрохирургия и неврология детского возраста. 2011; 3: 10–7.
4. Téllez-Zenteno J.F., Hernández Ronquillo L., Moien-Afshari F., Wiebe S. Surgical outcomes in lesional and non-lesional epilepsy: a systematic review and meta-analysis. Epilepsy Res. 2010; 89 (2-3): 310–8. https://doi.org/10.1016/j.eplepsyres.2010.02.007.
5. Blount J.P. Extratemporal resections in pediatric epilepsy surgery – an overview. Epilepsia. 2017; 58 (1): 19–27. https://doi.org/10.1111/epi.13680.
6. Jayakar P., Dunoyer C., Dean P., et al. Epilepsy surgery in patients with normal or nonfocal MRI scans: integrative strategies offer long-term seizure relief. Epilepsia. 2008; 49 (5): 758–64. https://doi.org/10.1111/j.1528-1167.2007.01428.x.
7. Widjaja E., Jain P., Demoe L., et al. Seizure outcome of pediatric epilepsy surgery: systematic review and meta-analyses. Neurology. 2020; 94 (7): 311–21. https://doi.org/10.1212/WNL.0000000000008966.
8. Engel J. Jr. (Ed.) Surgical treatment of the epilepsies. 2nd ed. Raven Press; 1993: 786 pp.
9. Bast T. Outcome after epilepsy surgery in children with MRI-negative non-idiopathic focal epilepsies. Epileptic Disord. 2013; 15 (2): 105–13. https://doi.org/10.1684/epd.2013.0580.
10. Eltze C.M., Chong W.K., Bhate S., et al. Taylor-type focal cortical dysplasia in infants: some MRI lesions almost disappear with maturation of myelination. Epilepsia. 2005; 46 (12): 1988–92. https://doi.org/10.1111/j.1528-1167.2005.00339.x.
11. Paolicchi J.M., Jayakar P., Dean P., et al. Predictors of outcome in pediatric epilepsy surgery. Neurology. 2000; 54 (3): 642–7. https://doi.org/10.1212/wnl.54.3.642.
12. McGonigal A., Bartolomei F., Régis J., et al. Stereoelectroencephalography in presurgical assessment of MRI-negative epilepsy. Brain. 2007; 130 (12): 3169–83. https://doi.org/10.1093/brain/awm218.
13. Wang Z.I., Alexopoulos A.V., Jones S.E., et al. The pathology of magnetic-resonance-imaging-negative epilepsy. Mod Pathol. 2013; 26 (8): 1051–8. https://doi.org/10.1038/modpathol.2013.52.
14. Bien C.G., Szinay M., Wagner J., et al. Characteristics and surgical outcomes of patients with refractory magnetic resonance imaging-negative epilepsies. Arch Neurol. 2009; 66 (12): 1491–9. https://doi.org/10.1001/archneurol.2009.283.
15. Mohamed I.S., Toffa D.H., Robert M., et al. Utility of magnetic source imaging in nonlesional focal epilepsy: a prospective study. Neurosurg Focus. 2020; 48 (4): E16. https://doi.org/10.3171/2020.1.FOCUS19877.
16. Juhász C., John F. Utility of MRI, PET, and ictal SPECT in presurgical evaluation of non-lesional pediatric epilepsy. Seizure. 2020; 77: 15–28. https://doi.org/10.1016/j.seizure.2019.05.008.
17. Хачатрян В.А., Маматханов М.Р., Лебедев К.Э. Инвазивный ЭЭГ-мониторинг в системе хирургического лечения эпилепсии у детей. Российский нейрохирургический журнал им. профессора А.Л. Поленова. 2014; 6 (4): 21–6.
18. Хачатрян В.А., Маматханов М.Р., Шершевер А.С. Мультифокальные резекции в лечении прогредиентных форм эпилепсии у детей. Эпилепсия и пароксизмальные состояния. 2020; 12 (3): 147–57. https://doi.org/10.17749/2077-8333/epi.par.con.2020.031.
19. Engel J. Jr., McDermott M.P., Wiebe S., et al. Early Randomized Surgical Epilepsy Trial (ERSET) Study Group. Early surgical therapy for drug-resistant temporal lobe epilepsy: a randomized trial. JAMA. 2012; 307 (9): 922–30. https://doi.org/10.1001/jama.2012.220.
20. Braun K.P., Cross J.H. Pediatric epilepsy surgery: the earlier the better. Expert Rev Neurother. 2018; 18 (4): 261–3. https://doi.org/10.1080/14737175.2018.1455503.
21. Mula M., Zaccara G., Galimberti C.A., et al. Validated outcome of treatment changes according to International League Against Epilepsy criteria in adults with drug-resistant focal epilepsy. Epilepsia. 2019; 60 (6): 1114–23. https://doi.org/10.1111/epi.14685.
22. Kim D.W., Lee S.K., Jung K.Y., et al. Surgical treatment of nonlesional temporal lobe epilepsy. Seizure. 2021; 86: 129–34. https://doi.org/10.1016/j.seizure.2021.02.012.
23. Trinka E., Cock H., Hesdorffer D., et al. A definition and classification of status epilepticus – Report of the ILAE Task Force on Classification of Status Epilepticus. Epilepsia. 2015; 56 (10): 1515–23. https://doi.org/10.1111/epi.13121.
24. Ушанов В.В., Одинцова Г.В., Герасимов А.П. и др. Хирургическое лечение эпилепсии: субъективная готовность пациентов. Российский нейрохирургический журнал им. профессора А.Л. Поленова. 2020; 12 (3): 31–6.
25. Карлов В.А., Бурд С.Г., Миронов М.Б. и др. Эпилептологическая служба в России сегодня. Эпилепсия и пароксизмальные состояния. 2021; 13 (1): 6–20. https://doi.org/10.17749/2077-8333/epi.par.con.2021.060.
Об авторах
М. Р. МаматхановРоссия
Маматханов Магомед Рамазанович – д.м.н., старший научный сотрудник научно-исследовательской лаборатории нейрохирургии детского возраста
Санкт-Петербург
РИНЦ SPIN-код: 7426-2245
В. В. Ушанов
Россия
Ушанов Всеслав Всеволодович – клинический ординатор кафедры нейрохирургии
Санкт-Петербург
А. П. Герасимов
Россия
Герасимов Александр Павлович – старший научный сотрудник научно-исследовательской лаборатории нейрохирургии детского возраста
Санкт-Петербург
РИНЦ SPIN-код: 9108-9354.
В. А. Хачатрян
Россия
Хачатрян Вильям Арамович – д.м.н., профессор, заведующий научно-исследовательской лабораторией нейрохирургии детского возраста
Санкт-Петербург
WoS ResearcherID: G-4002-2018;
РИНЦ SPIN-код: 7555-8039.
Рецензия
Для цитирования:
Маматханов М.Р., Ушанов В.В., Герасимов А.П., Хачатрян В.А. Хирургическое лечение МР-негативной фармакорезистентной эпилепсии у детей. Эпилепсия и пароксизмальные состояния. 2022;14(2):195-203. https://doi.org/10.17749/2077-8333/epi.par.con.2022.110
For citation:
Mamatkhanov M.R., Ushanov V.V., Gerasimov A.P., Khachatryan W.A. Surgical treatment of MRI-negative drug resistant epilepsy in children. Epilepsy and paroxysmal conditions. 2022;14(2):195-203. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.110

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































