Перейти к:
Перампанел в дополнительной терапии эпилепсии, ассоциированной с опухолями головного мозга: данные реальной клинической практики
https://doi.org/10.17749/2077-8333/epi.par.con.2022.139
Аннотация
Актуальность. Эпилепсия, ассоциированная с опухолями головного мозга (ОГМ), является важной и недостаточно изу ченной междисциплинарной проблемой. У значительной части пациентов с ОГМ заболевание дебютирует с эпилептических приступов (ЭП). Течение опухоль-ассоциированной эпилепсии часто носит фармакорезистентный характер и требует назначения рациональной политерапии. На сегодняшний день не существует единых рекомендаций по выбору антиэпилептического препарата (АЭП) для стартовой терапии эпилепсии, ассоциированной с ОГМ.
Цель: ретроспективный анализ эффективности/переносимости дополнительной терапии перампанелом в отношении ЭП у пациентов с эпилепсией, ассоциированной с глиальными ОГМ и метастазами.
Материал и методы. В анализ включен 51 пациент с глиальными опухолями и метастазами в головной мозг, которому в составе дополнительной терапии был назначен перампанел. На сроках >1≥3≥6 мес оценивали его эффективность в отношении фокальных приступов (ФП) и билатеральных тонико-клонических приступов (БТКП). Анализировали снижение частоты приступов на 50% и более (респондеры) или на 100% (освобождение от приступов). Провели анализ влияния вмешивающихся факторов в многофакторной модели, оценку эффективности применения перампанела в целом и стратифицированную оценку по вмешивающимся факторам. Также оценивали частоту и профиль нежелательных явлений (НЯ), включая их возможную ассоциацию с использованием других АЭП.
Результаты. В многофакторной модели независимым предиктором клинического эффекта на сроках >1≥3≥6 мес – химиотерапия. Ни один из применяемых в первой линии терапии АЭП не продемонстрировал влияния на клинический эффект. У пациентов с БТКП за весь период наблюдения оказывающих влияние предикторов клинического эффекта выявлено не было. Из 51 пациента респондерами явились 48 (94,1%), причем у 36 из них (70,6%) зафиксировано прекращение приступов. Среди больных с ФП доля респондеров составила на разных сроках наблюдения 83,3–90,9%, в т.ч. 31,2–50,0% демонстрировали освобождение от приступов. Среди пациентов с БТКП респондерами стали 86,7–92,3%, в т.ч. 56,1–88,5% достигли освобождения от приступов. НЯ отмечены у 7 (13,7%) больных, самым распространенным была агрессия – 4 пациента (7,8%). Ни в одном случае не потребовалось снижения дозы или прекращения приема препарата. У большинства пациентов на сроках >1≥3≥6 мес медиана составила 6 мг/сут.
Заключение. Выполненное в условиях реальной клинической практики наблюдение подтвердило высокую эффективность и безопасность применения перампанела в дополнительной терапии ЭП, ассоциированных с глиальными ОГМ и метастазами, что в совокупности с низким потенциалом межлекарственных взаимодействий позволяет рекомендовать препарат данному контингенту пациентов.
Ключевые слова
Для цитирования:
Самсонова Г.Г., Жидкова И.А. Перампанел в дополнительной терапии эпилепсии, ассоциированной с опухолями головного мозга: данные реальной клинической практики. Эпилепсия и пароксизмальные состояния. 2022;14(4):321-333. https://doi.org/10.17749/2077-8333/epi.par.con.2022.139
For citation:
Samsonova G.G., Zhidkova I.A. Perampanel in adjunctive therapy of patients with brain tumor-related epilepsy: real-world data. Epilepsy and paroxysmal conditions. 2022;14(4):321-333. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.139
ВВЕДЕНИЕ / INTRODUCTION
Эпилепсия, ассоциированная с опухолями головного мозга (ОГМ), является важной и недостаточно изученной междисциплинарной проблемой, требующей взаимодействия невролога-эпилептолога, онконейрохирурга и онколога для выработки единой тактики лечения и ведения таких пациентов. У значительной части больных с ОГМ (как злокачественными, так и доброкачественными) заболевание дебютирует с эпилептических приступов (ЭП): они являются начальными симптомами у 20–40% пациентов, а у 30–50% из них развиваются при прогрессировании опухоли [1–4].
Глиомы высокой степени злокачественности (III–IV) являются наиболее распространенными и злокачественными первичными ОГМ с выживаемостью в среднем 15–24 мес. Частота развития эпилепсии при них составляет 30–50% [5], при глиомах низкой степени злокачественности – до 90% [6–8].
ЭП у пациентов с ОГМ усугубляют бремя основного заболевания, внося существенный вклад в снижение качества жизни [9]. Также у пациентов с опухоль-ассоциированными эпилепсиями регистрируется более высокая частота нежелательных явлений (НЯ) на фоне лечения, что обусловлено взаимодействием антиэпилептических препаратов (АЭП) с противоопухолевой терапией. После первого ЭП у таких больных высок риск рецидива повторного приступа, что требует незамедлительного назначения антиэпилептической терапии, а изменение клинического ответа на лечение в связи с прогрессированием опухоли приводит к фармакорезистентности [2][10][11].
Пациентам данной когорты кроме комплексного противоопухолевого лечения, включающего по показаниям своевременное оперативное вмешательство, химиотерапию, лучевую терапию, необходим контроль ЭП. На сегодняшний день не существует единых рекомендаций по выбору АЭП для стартовой терапии эпилепсии, ассоциированной с ОГМ. Итальянские эксперты рекомендуют в качестве первого выбора рассматривать АЭП нового поколения, такие как леветирацетам (ЛЕВ), ламотриджин (ЛТД), топирамат (ТПМ), а также вальпроевую кислоту (ВК) [12]. Американская академия неврологии предлагает отдавать предпочтение следующим АЭП нового поколения: ЛЕВ, лакосамид (ЛКМ), зонисамид (ЗНС), – а в комбинированной терапии использовать АЭП новейшего поколения: перампанел (ПЕР), бриварацетам. Индукторы микросомальных ферментов печени (цитохрома Р450) могут изменять метаболизм и эффективность используемых химиотерапевтических средств и дексаметазона, поэтому их следует избегать [13].
Течение эпилепсии, ассоциированной с ОГМ, часто носит фармакорезистентный характер и требует назначения дуо- и политерапии [8][9]. При выборе АЭП при опухоль-ассоциированной эпилепсии следует учитывать не только его эффективность, но и переносимость/безопасность, а также потенциал лекарственных взаимодействий [10]. Поэтому существует реальная потребность в поиске эффективных АЭП с благоприятным профилем безопасности, позволяющим сочетать их применение как с другими АЭП, так и с противоопухолевой терапией [14].
В этой ситуации предпочтительно назначение новых и новейших АЭП [9]. Одним из таких препаратов является ПЕР, обладающий уникальным механизмом действия: высокоселективной неконкурентной блокадой мест связывания глутамата на рецепторах α-амино-3-гидрокси5-метил-4-изоксазолпропионовой кислоты (англ. α-amino-3-hydroxy-5-methyl-4-isoxazolepropionic acid, AMPA) постсинаптической мембраны возбудительного нейрона, что блокирует основной путь генерации и распространения возбуждения [11][15].
Как известно, один из основных возбуждающих медиаторов в центральной нервной системе – глутамат. Нарушение регуляции глутаматергической нейротрансмиссии является составной частью патогенеза развития ЭП.
У пациентов с глиомами повышен уровень глутамата во внеклеточной жидкости головного мозга [16][17]. Клетки глиомы экспрессируют AMPA-рецепторы, которые стимулируются глутаматом и посредством активации онкогенных сигнальных путей и участия в ремоделировании цитоскелета способствуют росту и инвазии опухоли [18][19]. Таким образом, высокий уровень внеклеточного глутамата в синаптическом пространстве способствует развитию эпилептического фенотипа, стимулирует пролиферацию и инвазию опухолевых клеток [20][21]. Соответственно, АЭП, механизм действия которых связан с контролем глутаматергической передачи, являются многообещающими кандидатами для контроля ЭП у пациентов с глиомами. ПЕР действует как антагонист AMPA-рецепторов и снижает уровень внеклеточного глутамата в культурах опухолевых клеток, но не оказывает влияния на профиль экспрессии генов, связанных с его высвобождением и обратным поглощением. Так, в одном из экспериментальных исследований in vitro продемонстрировано, что инкубация клеточных линий глиобластомы и метастазов с ПЕР значительно снижала уровни внеклеточного глутамата в данных культурах [8].
В настоящее время все больше признается необходимость дополнения проспективных регистрационных исследований новых препаратов данными реальной клинической практики (англ. real-world data, RWD) с тем, чтобы получить более широкое представление об эффективности и безопасности их терапевтического воздействия. Это помогает формировать доказательную базу, необходимую для вхождения методик ведения больного в клинические рекомендации и перечни лекарственных средств [22–24].
Цель – ретроспективный анализ эффективности/ переносимости дополнительной терапии перампанелом в отношении ЭП у пациентов с эпилепсией, ассоциированной с глиальными ОГМ и метастазами.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Для анализа использовались обезличенные данные из медицинских документов пациентов с эпилепсией, ассоциированной с глиальными ОГМ и метастазами, которые проходили обследование и лечение на базе ГБУЗ «Областная клиническая больница Калининградской области» и которым в составе дополнительной терапии был назначен ПЕР.
В рамках анализа оценивали эффект терапии ПЕР в отношении ЭП, а также частоту НЯ, связанных с применением ПЕР, и мероприятия по их коррекции.
Результаты оценивали на временных интервалах >1<3 мес, ≥3<6 мес и ≥6 мес, сравнивая их с показателями до начала терапии ПЕР, т.е. использовали дизайн с отсутствием контрольной группы и контролем параметров до и после лечения. Указанные временные интервалы были выбраны с учетом отсутствия возможности оценки в фиксированные дни в условиях реальной клинической практики.
Оценка эффективности / Efficiency evaluation
Положительный эффект подвергался бинарной оценке:
– снижение частоты фокальных приступов (ФП) на 50% и более (респондеры) или на 100% (освобождение от ФП по сравнению с базовым значением);
– снижение частоты билатеральных тонико-клонических приступов (БТКП) на 50% и более (респондеры) или на 100% (освобождение от БТКП по сравнению с базовым значением).
Этапы анализа / Stages of the analysis
На первом этапе провели клинико-неврологическую оценку пациентов, включая анамнез, возраст, пол, дебют и продолжительность заболевания, распределение по типу опухоли, типу ЭП, их частоте, проводимому лечению. Типы ЭП определяли согласно действующей классификации Международной Противоэпилептической Лиги (англ. International League Against Epilepsy, ILAE) 2017 г. [25–27].
На следующем этапе был выполнен анализ влияния вмешивающихся факторов в многофакторной модели. В качестве зависимой переменной было выбрано достижение положительного эффекта на сроках >1<3 мес, ≥3<6 мес и ≥6 мес. Независимые переменные разделили на две группы:
– предикторы положительного эффекта (параметры, зарегистрированные до начала лечения, – пол, дебют заболевания с ЭП, длительность заболевания, химиотерапия);
– лекарственная терапия, которая могла повлиять на положительный эффект (применение АЭП: ВК, карбамазепин (КБЗ), ЛЕВ, бензобарбитал (БЗБ), окскарбазепин (ОКС), ТПМ, ЛТД, ЛКМ.
Далее выполняли оценку эффективности применения ПЕР в целом и стратифицированную оценку по вмешивающимся факторам.
На каждом временном интервале наблюдения оценивали частоту НЯ на фоне применения ПЕР и их возможную ассоциацию с использованием других АЭП.
Этические аспекты / Ethical aspects
Анализ был выполнен в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации Всемирной медицинской ассоциации 2013 г. (Форталеза, Бразилия). В связи с ретроспективным характером работы информированного согласия пациентов не требовалось.
Методы статистического анализа / Methods of statistical analysis
Статистическую обработку материала проводили с использованием статистического программного обеспечения «R» версии 4.1.3 [28]. Рассчитывали экстенсивные показатели и их доверительные интервалы (ДИ). Тестирование типа распределения выполняли с помощью теста Шапиро–Уилка. Для показателей, распределенных параметрически, вычисляли средние значения и их 95-процентные ДИ. При распределении, отличном от нормального, применяли непараметрическую статистику. Также рассчитывали ДИ для биномиально распределенных данных методом Уилсона. Определяли скорректированное отношение шансов (англ. adjusted odds ratio, aOR). Для изучения влияния на результаты анализа предикторов и сопутствующей лекарственной терапии проводили многофакторный анализ с использованием логистической регрессии.
РЕЗУЛЬТАТЫ / RESULTES
Клинико-анамнестические данные / Clinical and anamnestic data
В анализ включены данные 51 пациента с опухольассоциированной эпилепсией, которому в процессе наблюдения в качестве дополнительной терапии был назначен ПЕР (табл. 1). Мужчин было достоверно больше, чем женщин: 35 (67,3%) и 17 (32,7%) соответственно (p=0,01). Средний возраст пациентов составил 48,3 года (95% ДИ 44,7–51,9). У 31 пациента отмечался дебют заболевания в виде ЭП (60,8%; 95% ДИ 47,1–73,0).
Наиболее распространенными типами ОГМ были астроцитомы (21) и глиобластомы (15). Девять пациентов имели метастатическое поражение головного мозга. В единичных случаях встречались другие типы ОГМ.
Большинству больных (46) было выполнено хирургическое вмешательство (90,2%; 95% ДИ 79,0–95,7). Химиотерапия проводилась в 37 случаях (72,5%; 95% ДИ 59,1–82,9), лучевая терапия – в 37 (75,2%; 95% ДИ 59,1– 82,9). У 28 пациентов в процессе наблюдения был зафиксирован продолженный рост опухоли (54,9%; 95% ДИ 41,4–67,7).
У одного и того же пациента могли регистрироваться несколько типов приступов. ФП без нарушения сознания (сенсорные, моторные, сенсомоторные) имели 28 больных (54,9%; 95% ДИ 41,4–67,7). ФП с нарушением сознания отмечены у 9 пациентов (17,6%; 95% ДИ 9,6–30,3). У 41 больного регистрировались БТКП (80,4%; 95% ДИ 67,5–89,0). В 2 случаях (3,9%; 95% ДИ 1,1–13,2) наблюдался эпилептический статус: у 1 пациента – статус БТКП, у другого – статус ФП. АЭП, применяемые для контроля ЭП, представлены в таблице 2.
Большинство пациентов на момент включения в анализ принимали КБЗ и ВК, в дальнейшем проводилась коррекция антиэпилептической терапии. После начала использования ПЕР в качестве дополнительного АЭП (начиная со срока >1<3 мес) увеличилась доля больных, которым был назначен ЛЕВ. В то же время в процессе наблюдения отменены ЗСМ и ЛТД.
На сроке наблюдения >1<3 мес 42 пациента принимали два АЭП (включая ПЕР), три АЭП (включая ПЕР) получали 7 больных, только 2 пациентам ПЕР был назначен четвертым препаратом. На сроке ≥3<6 мес два АЭП использовали 30 пациентов, три АЭП – 4 пациента, четыре АЭП – 2 пациента.
На сроке ≥6 мес комбинированную терапию из двух АЭП получали 24 больных, три АЭП – 5 пациентов, четыре АЭП принимал только 1 пациент (табл. 3). Наиболее часто использовались комбинации ПЕР с КБЗ, ВК, ЛЕВ. Большинству пациентов ПЕР был назначен в ранней дополнительной терапии, т.е. вторым препаратом.
Медиана дозы ПЕР на сроке >1<3 мес составляла 4 мг/сут (1–3-й квартили 4 мг/сут), на сроке ≥3<6 мес – 4 мг/сут (1–3-й квартили 4–6 мг/сут), на сроке ≥6 мес – 6 мг/сут (1–3-й квартили 4–6 мг/сут). Минимальная дозировка – 4 мг/сут, максимальная – 10 мг/сут.
Таблица 1. Клинико-анамнестические данные пациентов (n=51)
Table 1. Clinical and anamnestic data of patients (n=51)
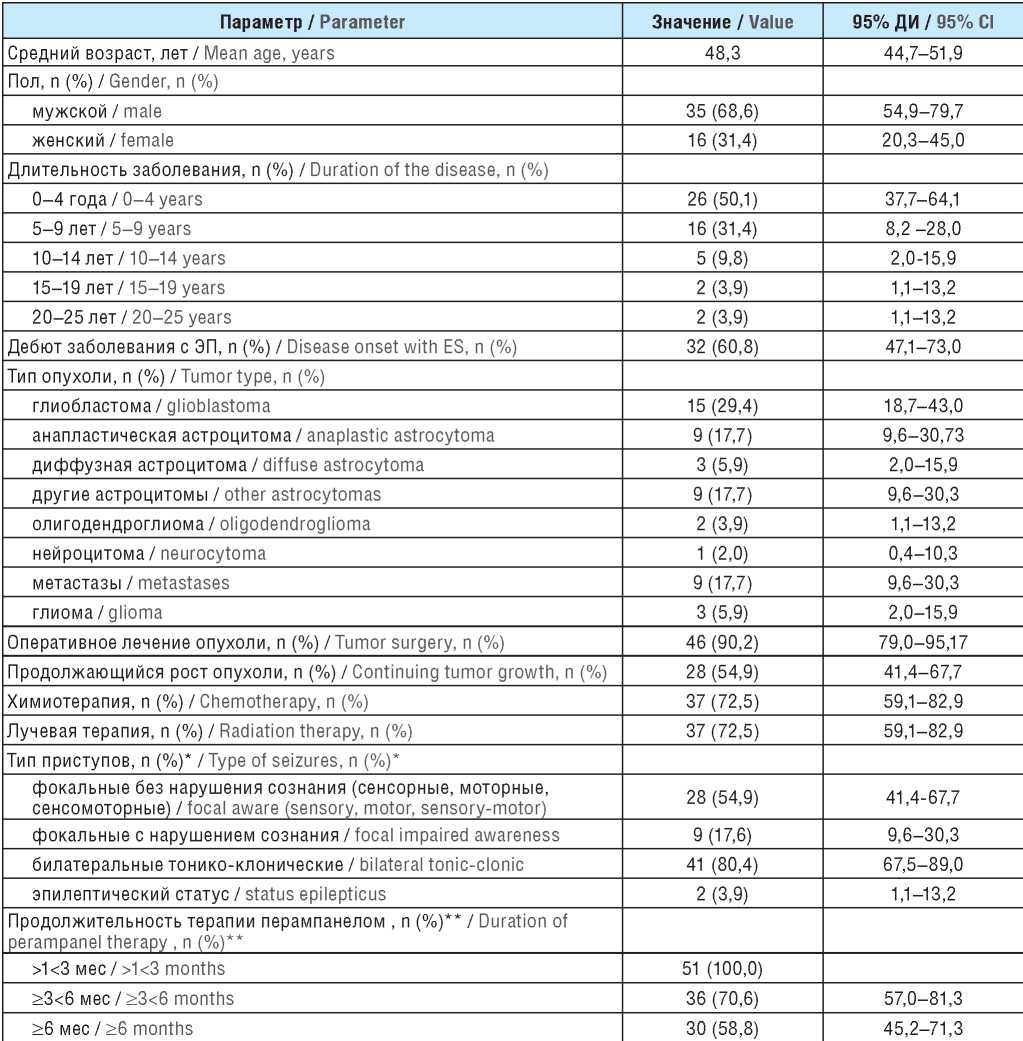
Примечание. ДИ – доверительный интервал; ЭП – эпилептический приступ. * Пациенты могли иметь различные типы приступов одновременно. ** Пациенты могли быть отнесены к нескольким группам одновременно.
Note. CI – confidence interval; ES – epileptic seizure. * Patients could have different types of seizures at the same time. ** Patients could be assigned to several groups at the same time.
Таблица 2. Применяемые в исследовании антиэпилептические препараты (АЭП)
Table 2. Antiepileptic drugs (AEDs) used in the study
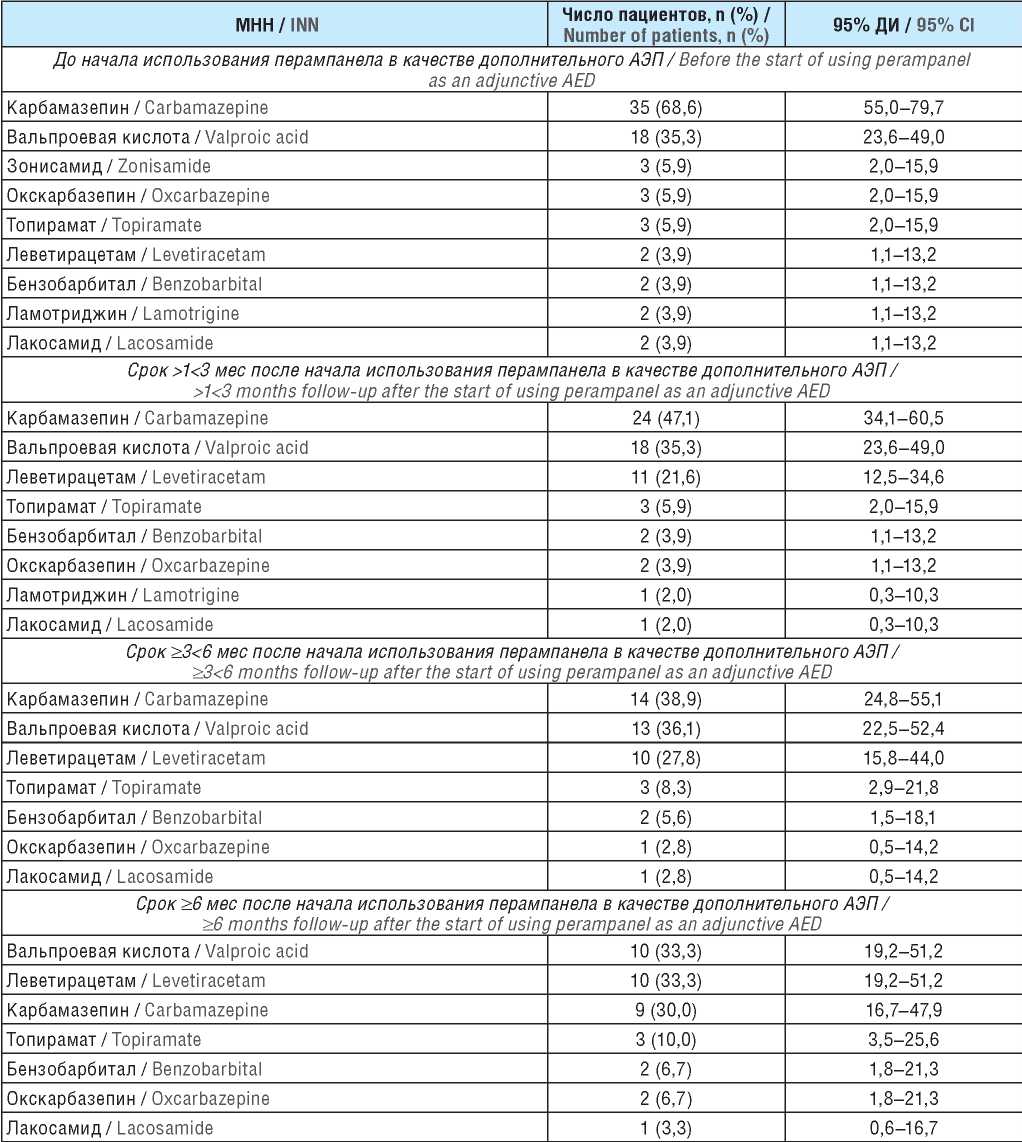
Примечание. МНН – международное непатентованное наименование; ДИ – доверительный интервал.
Note. INN – international nonproprietary name; CI – confidence interval.
Таблица 3. Применяемые в исследовании антиэпилептические препараты (АЭП) и их комбинации с перампанелом
Table 3. Antiepileptic drugs (AEDs) used in the study and their combinations with perampanel
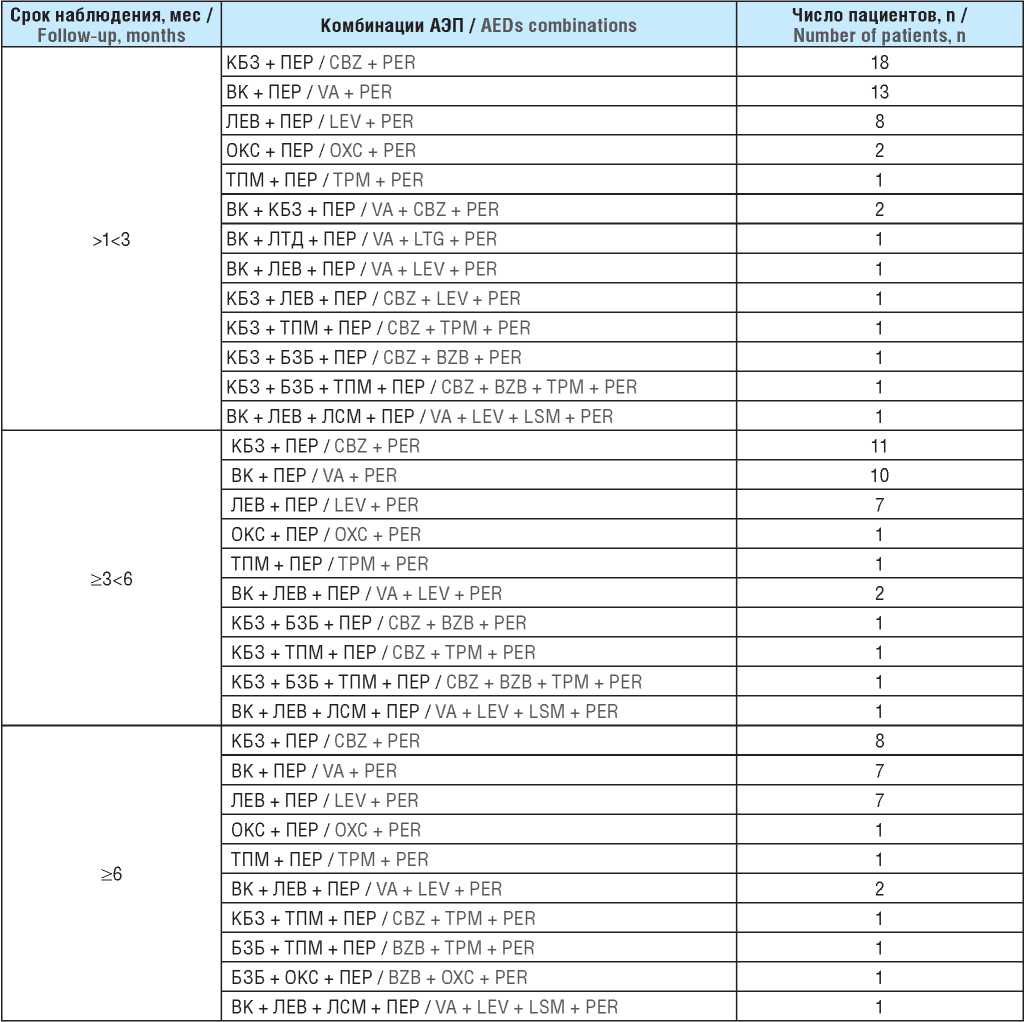
Примечание. КБЗ – карбамазепин; ПЕР – перампанел; ВК – вальпроевая кислота; ЛЕВ – леветирацетам; ОКС – окскарбазепин; ТПМ – топирамат; ЛТД – ламотриджин; БЗБ – бензобарбитал; ЛСМ – лакосамид.
Note. CBZ – carbamazepine; PER – perampanel; VA – valproic acid; LEV – levetiracetam; OXC – oxcarbazepine; TPM – topiramate; LTG – lamotrigine; BZB – benzobarbital; LSM – lacosamide.
Анализ влияния вмешивающихся факторов / Analysis of the effect of intervening factors
Также анализировали факторы, которые потенциально могли повлиять на результаты лечения (вмешивающиеся факторы). К потенциальным вмешивающимся факторам относили: пол, дебют заболевания с ЭП, длительность заболевания, проводимое лечение.
Фокальные приступы
В многофакторной модели независимым предиктором клинического эффекта на сроке >1<3 мес после начала использования ПЕР в качестве дополнительного АЭП был дебют заболевания в виде ЭП (aOR 5,18; 95% ДИ 1,44–21,41). При анализе АЭП, ассоциированных с положительным эффектом, ни один из них не продемонстрировал статистической достоверности. Таким образом, в отношении прекращения ФП на сроке >1<3 мес статистически значимое влияние оказывал дебют заболевания в виде ЭП.
На сроке ≥3<6 мес после начала использования ПЕР в качестве дополнительного АЭП независимым предиктором эффекта терапии оставался дебют заболевания в виде ЭП (aOR 4,17; 95% ДИ 1,13–18,51). АЭП, ассоциированных с положительным эффектом, выявлено не было. Таким образом, в отношении прекращения ФП на сроке ≥3<6 мес статистически значимое влияние продолжал оказывать дебют заболевания в виде ЭП.
На сроке ≥6 мес и более после начала использования ПЕР в качестве дополнительного АЭП значимым предиктором выступала химиотерапия (aOR 0,20; 95% ДИ 0,04–0,93) – она снижала вероятность эффекта, однако вероятность того, что это влияние было случайным, приближается к 5% (p=0,048). АЭП, ассоциированных с положительным эффектом, выявлено не было.
Билатеральные тонико-клонические приступы
В отношении БТКП оказывающих влияние предикторов клинического эффекта на сроках >1<3 мес, ≥3<6 мес и ≥6 мес обнаружено не было. Ассоциированных с положительным эффектом АЭП также не выявлено.
Оценка эффективности / Efficiency assessment
Фокальные приступы
На сроке наблюдения >1<3 мес у 32 пациентов на момент включения в анализ имели место ФП. У 24 из них отмечался дебют заболевания в виде ЭП, т.е. имелся определенный выше значимый предиктор клинического эффекта терапии. 100-процентное отсутствие ФП было зафиксировано у 10 из 32 больных (31,2%; 95% ДИ 18,0–48,6) (рис. 1). Среди пациентов, имеющих дебют заболевания в виде ЭП, их отсутствие было зафиксировано у 9 из 24 больных (37,5%; 95% ДИ 21,2–57,3), в то время как у пациентов с дебютом заболевания без ЭП их прекращение наблюдалось только в 1 из 8 случаев (12,5%; 95% ДИ 2,2–47,1).
В целом отсутствие или 50-процентное снижение частоты ФП на сроке наблюдения >1<3 мес имело место у 29 из 32 пациентов (90,6%; 95% ДИ 75,8–96,8) (рис. 2). При дебюте заболевания в виде ЭП данный эффект отмечался у 22 из 24 больных (91,7%; 95% ДИ 74,2–97,7). Также 7 из 8 пациентов без дебюта с ЭП (87,5%; 95% ДИ 52,9–97,8) продемонстрировали отсутствие или снижение частоты ФП на 50% и более на данном сроке наблюдения. На сроке наблюдения ≥3<6 мес ФП на момент включения в анализ были диагностированы у 22 пациентов. Дебют заболевания в виде ФП отмечался у 18 больных. Прекращение ФП было зафиксировано у 10 из 22 пациентов (45,5%; 95% ДИ 26,9–65,3) (см. рис. 1), при дебюте с приступов – у 9 из 18 (50,0%; 95% ДИ 29,0–71,0), в то время как при манифестации с других проявлений – только у 1 из 4 (25,0%; 95% ДИ 4,6–69,9). В целом на данном сроке наблюдения отсутствие или 50-процентное снижение частоты ФП зафиксировано у 20 из 22 пациентов (90,9%; 95% ДИ 72,2–97,5) (см. рис. 2), в т.ч. при дебюте с приступов – у 16 из 18 (88,9%; 95% ДИ 67,2–96,9), а также у остальных 4 пациентов без дебюта с ЭП.
На сроке наблюдения ≥6 мес ФП на момент включения в исследование имели место у 18 пациентов, химиотерапия была назначена 10 больным. Прекращение ФП наблюдалось у 9 из 18 пациентов (50,0%; 95% ДИ 29,0–71,0) (см. рис. 1). Среди получавших химиотерапию 100-процентное отсутствие ФП на данном сроке наблюдения отмечено у 6 из 10 пациентов (60,0%; 95% ДИ 31,3–83,2), а среди тех, кому химиотерапия не проводилась, – только у 3 из 8 больных (37,5%; 95% ДИ 13,7–69,4).
В целом отсутствие или 50-процентная редукция ФП на сроке наблюдения ≥6 мес имела место у 15 из 18 больных (83,3%; 95% ДИ 60,8–94,2) (см. рис. 2). Среди пациентов, подвергшихся химиотерапии, отсутствие или редукция ФП на 50% на данном сроке отмечались у 8 из 10 больных (80,0%; 95% ДИ 49,0–94,3), что было сопоставимо с показателями у пациентов без химиотерапии – 7 из 8 больных (87,5%; 95% ДИ 52,9–97,8).
Билатеральные тонико-клонические приступы
Поскольку у пациентов с БТКП не было выявлено предикторов клинической эффективности со стороны вмешивающихся факторов, анализ выполняли в общей группе. На сроке наблюдения >1<3 мес БТКП имел 41 пациент. Прекращение БТКП было зафиксировано у 23 из них (56,1%; 95% ДИ 41,0–70,1) (рис. 3).
В целом на данном сроке наблюдения прекращение или снижение частоты БТКП на 50% и более имели место у 36 пациентов (87,8%; 95% ДИ 74,5–94,7) (рис. 4). На сроке наблюдения ≥3<6 мес БТКП имели 30 пациентов.
Свобода от приступов зарегистрирована у 24 из них (80,0%; 95% ДИ 62,7–90,5) (см. рис. 3). Отсутствие или 50-процентная редукция БТКП отмечены на данном сроке наблюдения у 26 больных (86,7%; 95% ДИ 70,3– 94,7) (см. рис. 4).
На сроке наблюдения ≥6 мес осталось 26 больных с БТКП.
Свобода от приступов была достигнута у 23 из них (88,5%; 95% ДИ 71,0–96,0) (см. рис. 3). Отсутствие или редукция БТКП на 50% и более зарегистрированы у 24 пациентов (92,3%; 95% ДИ 75,9–97,9) (см. рис. 4). Оценка безопасности / Safety assessment За все время наблюдения НЯ зафиксированы у 7 (13,7%) пациентов. Из 51 больного на сроке >1<3 мес у 2 отмечалась агрессия (3,9%; 95% ДИ 1,1–13,2). Один из 2 пациентов с агрессией также принимал ВК, другой – КБЗ.
Анализ показал отсутствие ассоциации агрессии с параллельным приемом ВК (аOR 1,9; 95% ДИ 0,02– 152,14; p=1) и КБЗ (аOR 1,1; 95% ДИ 0,01–91,0; p=1). Еще у 1 пациента отмечалась сонливость (2,0%; 95% ДИ 0,3– 10,3). Ни в одном случае не было зарегистрировано аггравации приступов.
На сроке наблюдения ≥3<6 мес из 36 пациентов, получавших ПЕР, у 1 (2,8%; 95% ДИ 0,5–14,2) имела место сонливость, не потребовавшая коррекции дозы или отмены препарата. Других НЯ не зафиксировано.
На сроке наблюдения ≥6 мес 30 пациентов продолжали получать ПЕР. У 1 пациента отмечено одно неуточненное НЯ, у 2 больных (6,7%; 95% ДИ 1,8–21,3) – агрессия. В одном случае пациент с агрессией параллельно принимал ВК (использовал ее и ранее; аOR 2,1; 95% ДИ 0,02–174,0; p=0,5), а также ЛЕВ (аOR 2,1; 95% ДИ 0,02–174,0; p=0,5). Во втором случае больной принимал КБЗ (аOR 2,4; 95% ДИ 0,03–205,5; p=0,5). Ассоциации агрессии с приемом этих препаратов не выявлено.
Анализ ассоциации данных НЯ с дозой ПЕР продемонстрировал отсутствие таковой. Ни одному пациенту не потребовалась коррекция дозы или отмена ПЕР из-за НЯ.
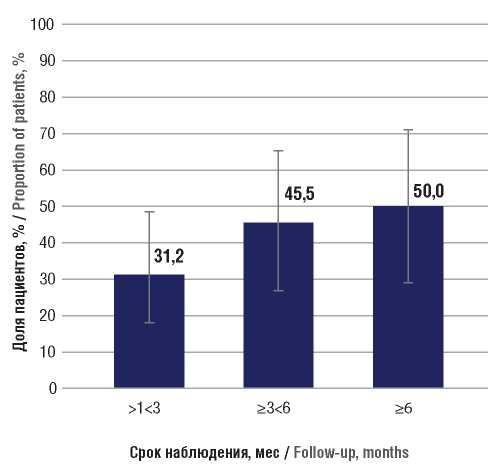
Рисунок 1. Доли пациентов, у которых в процессе наблюдения достигнуто освобождение от фокальных приступов на фоне лечения перампанелом
Figure 1. The proportions of patients taking perampanel in whom the relief from focal seizures (seizure freedom) was achieved during follow-up
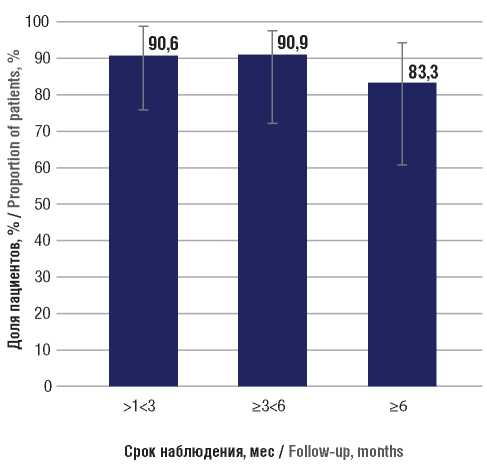
Рисунок 2. Доли пациентов, у которых в процессе наблюдения достигнуто снижение частоты фокальных приступов на 50% и более (респондеры) на фоне лечения перампанелом
Figure 2. The proportions of patients taking perampanel in whom the decrease in the frequency of focal seizures by 50% or more (responders) was achieved during follow-up
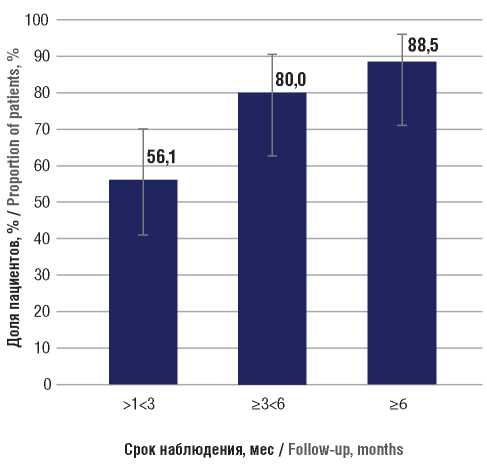
Рисунок 3. Доли пациентов, у которых в процессе наблюдения достигнуто освобождение от билатеральных тонико-клонических приступов на фоне лечения перампанелом
Figure 3. The proportions of patients taking perampanel in whom the relief from bilateral tonic-clonic seizures (seizure freedom) was achieved during follow-up
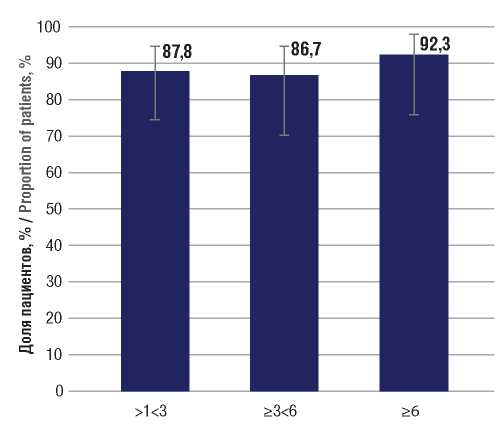
Рисунок 4. Доли пациентов, у которых в процессе наблюдения достигнуто снижение частоты билатеральных тонико-клонических приступов на 50% и более (респондеры) на фоне лечения перампанелом
Figure 4. The proportions of patients taking perampanel in whom the decrease in the frequency of bilateral tonicclonic seizures by 50% or more (responders) was achieved during follow-up
ОБСУЖДЕНИЕ / DISCUSSION
В нашей работе продемонстрированы высокая эффективность и хорошая переносимость дополнительной терапии ПЕР для такой тяжелой категории больных, как пациенты с эпилепсией, ассоциированной с глиальными ОГМ и метастазами. Количество респондеров среди пациентов с ФП на разных сроках наблюдения составило 83,3–90,9%, в т.ч. 31,2–50,0% демонстрировали освобождение от ФП в процессе лечения. Среди больных с БТКП доля респондеров на разных сроках наблюдения достигала 86,7–92,3%. При этом доля пациентов, достигших освобождения от БТКП, на сроке >1<3 мес составила 56,1%, а в процессе наблюдения существенно возрастала: до 80,0% на сроке ≥3<6 мес и до 88,5% на сроке ≥6 мес. У 13,7% больных зарегистрированы НЯ легкой или средней степени тяжести, не требующие коррекции дозы или отмены ПЕР.
Полученные результаты оказались сопоставимыми с результатами ранее опубликованных исследований, посвященных эффективности и безопасности ПЕР в дополнительной терапии ЭП у больных со злокачественными новообразованиями головного мозга. В исследовании PERADET с участием 36 пациентов с неконтролируемыми ФП, получающих от одного до трех АЭП, включая ПЕР, через 12 мес свобода от приступов была достигнута у 33,3%, а снижение частоты приступов на 50% и более – у 90,4% [9]. В данной работе была показана более высокая эффективность ПЕР у пациентов с нарушением экспрессии изоцитратдегидрогеназы 1 (англ. isocitrate dehydrogenase 1, IDH1) и O-6-метилгуанин-ДНК-метилтрансферазы (англ. O-6 methylguanine-DNA methyl transferase, MGMT).
Недавнее исследование в реальной клинической практике, которое провели M. Maschio et al. (2019 г.), с участием 11 пациентов с глиомой, имеющих ЭП и получающих ПЕР в дополнительной терапии по поводу неадекватного контроля ЭП или развившихся НЯ на фоне применения предшествующих АЭП, продемонстрировало ответ на терапию у 81,8% больных [29]. При этом авторы не выявили взаимосвязи с гистологией, наличием/ отсутствием химиотерапии, лучевой терапии, прогрессированием заболевания, оценкой по шкале Карновского (англ. Karnofsky Performance Score, KPS), IDH1, MGMT. В нашем наблюдении выявлена взаимосвязь клинического эффекта в отношении ФП с дебютом заболевания в виде ЭП и химиотерапией, что может быть обусловлено большим, нежели в исследовании M. Maschio et al., количеством включенных пациентов.
В отечественном исследовании, выполненном А.С. Шершевером и др. в реальной клинической практике, ПЕР продемонстрировал высокую эффективность в отношении ЭП у 87 больных с метастазами в головной мозг: у всех пациентов через 6–10 сут на фоне проводимой терапии ПЕР в комбинации с другими АЭП и в монотерапии отмечено статистически значимое уменьшение частоты ЭП: сокращение приступов на 30–75% отмечено у 70% больных, у остальных – на 10–17%. В дальнейшем за весь период наблюдения при медиане выживаемости 8–13 мес частота приступов сокращалась и далее оставалась постоянной. Также авторы отметили положительную динамику в отношении тревожных расстройств в течение 30 сут приема ПЕР [30]. Данные результаты в целом сопоставимы с результатами нашего анализа, но прямое сравнение не представляется возможным вследствие различий в критериях включения (в нашем наблюдении метастазы – только один из типов опухолей) и методологии оценки эффективности. Также следует отметить, что ПЕР не зарегистрирован для применения в режиме монотерапии в Российской Федерации [31].
В нашем анализе наиболее частым НЯ была агрессия, которая в разные сроки в течение периода наблюдения отмечалась у 4 (7,8%) пациентов. Только в 1 случае зарегистрирована сонливость, не повлиявшая на дальнейшее лечение. Зависимости частоты НЯ от дозы ПЕР, а также от его комбинации с другими препаратами, выявлено не было. В ряде других работ сообщается о более высокой частоте НЯ. Так, в исследовании M. Maschio et al. (2020 г.) из 26 пациентов с опухоль-ассоциированной эпилепсией, получающих ПЕР в дополнительной терапии, НЯ развились у 4 (15,4%), при этом у 2 из них потребовалась коррекция дозы [10]. В более ранней работе тех же авторов НЯ были зарегистрированы у 2 из 11 больных, у 1 потребовалось снижение дозы [29]. В исследовании PERADET НЯ наблюдались у 30,6% пациентов и, хотя ни одно из них не было тяжелым, 3 больным потребовалось прерывание лечения [9]. Возможно, это связано со скоростью титрации, поскольку ранее была продемонстрирована связь более быстрой титрации (1 нед) с развитием повышенной утомляемости и головокружения у пациентов с глиомой, получающих ПЕР в качестве дополнительного АЭП, что потребовало изменения дизайна исследования в пользу 2-недельного шага титрации [14]. Рекомендованная скорость титрации у пациентов, одновременно получающих лекарственные препараты, не уменьшающие период полувыведения ПЕР, – не чаще чем 1 раз в 2 нед. У пациентов, одновременно принимающих препараты, уменьшающие период полувыведения ПЕР (например, мощные индукторы CYP3A), следует титровать (увеличивать) дозу ПЕР не чаще чем 1 раз в 1 нед [31].
Благодарность / Acknowledgement
Авторы выражают признательность группе биостатистиков и медицинских писателей Института Превентивной и Социальной Медицины за оказанную помощь в анализе и интерпретации данных, полученных в ходе работы.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Выполненное в условиях реальной клинической практики наблюдение подтвердило высокую эффективность и безопасность применения ПЕР в качестве дополнительной терапии ЭП, ассоциированных с глиальными ОГМ и метастазами. В целом за период наблюдения ≥6 мес из 51 пациента респондерами явились 48 (94,1%), при этом у 36 из них (70,6%) зафиксирован полный клинический ответ (прекращение ЭП). НЯ возникли у 7 (13,7%) больных, но ни в одном случае не потребовалось корректировать дозу или прекращать терапию ПЕР.
Полученные результаты можно объяснить уникальным механизмом действия ПЕР, благоприятным профилем безопасности и низким потенциалом лекарственных взаимодействий, в т.ч. с противоопухолевыми препаратами. В многофакторной модели продемонстрировано, что предикторами клинического эффекта выступают дебют заболевания в виде ЭП, а также проведение химиотерапии у пациентов с ФП. Необходимы более масштабные исследования, которые позволят расширить понимание механизма действия ПЕР в отношении ЭП, ассоциированных с ОГМ, и возможной синергии с другими АЭП.
Список литературы
1. Glantz M.J., Cole B.F., Forsyth P.A., et al. Practice parameter: anticonvulsant prophylaxis in patients with newly diagnosed brain tumors. Neurology. 2000; 54 (10): 1886–93. https://doi.org/10.1212/wnl.54.10.1886.
2. Perucca E. Optimizing antiepileptic drug treatment in tumoral epilepsy. Epilepsia. 2013; 54 (Suppl. 9): 97–104. https://doi.org/10.1111/epi.12452.
3. Maschio M. Brain tumor-related epilepsy. Curr Neuropharmacol. 2012; 10 (2): 124–33. https://doi.org/10.2174/157015912800604470.
4. Maschio M., Sperati F., Dinapoli L., et al. Weight of epilepsy in brain tumor patients. J Neurooncol. 2014; 118 (2): 385–93. https://doi.org/10.1007/s11060-014-1449-7.
5. Bromfield E.B. Epilepsy in patients with brain tumors and other cancers. Rev Neurol Dis. 2004; 1 (Suppl. 1): S27–33.
6. Chaichana K.L., Parker S.L., Olivi A., Quiñones-Hinojosa A. Long-term seizure outcomes in adult patients undergoing primary resection of malignant brain astrocytomas. Clinical article. J Neurosurg. 2009; 111 (2): 282–92. https://doi.org/10.3171/2009.2.JNS081132.
7. Sizoo E.M., Braam L., Postma T.J., et al. Symptoms and problems in the end-of-life phase of high-grade glioma patients. Neuro Oncol. 2010; 12 (11): 1162–6. https://doi.org/10.1093/neuonc/nop045.
8. Lange F., Weßlau K., Porath K., et al. AMPA receptor antagonist perampanel affects glioblastoma cell growth and glutamate release in vitro. PLoS One. 2019; 14 (2): e0211644. https://doi.org/10.1371/journal.pone.0211644.
9. Coppola A., Zarabla A., Maialetti A., et al. Perampanel confirms to be effective and well-tolerated as an add-on treatment in patients with brain tumor-related epilepsy (PERADET Study). Front Neurol. 2020; 11: 592. https://doi.org/10.3389/fneur.2020.00592.
10. Maschio M., Zarabla A., Maialetti A., et al. Perampanel in brain tumor-related epilepsy: observational pilot study. Brain Behav. 2020; 10 (6): e01612. https://doi.org/10.1002/brb3.1612.
11. Лебедева А.В., Бурд С.Г., Власов П.Н. и др. Лечение эпилепсии, ассоциированной с первичными и метастатическими опухолями головного мозга. Эпилепсия и пароксизмальные состояния. 2021; 13 (3): 286–304. https://doi.org/10.17749/2077-8333/epi.par.con.2021.099.
12. Maschio M., Aguglia U., Avanzini G., et al. Management of epilepsy in brain tumors. Neurol Sci. 2019; 40 (10): 2217–34. https://doi.org/10.1007/s10072-019-04025-9.
13. Stec N.E., Walbert T. Neuro-oncology and supportive care: the role of the neurologist. Neurol Sci. 2022; 43 (2): 939–50. https://doi.org/10.1007/s10072-021-05862-3.
14. Dunn-Pirio A.M., Woodring S., Lipp E., et al. Adjunctive perampanel for glioma-associated epilepsy. Epilepsy Behav Case Rep. 2018; 10: 114–7. https://doi.org/10.1016/j.ebcr.2018.09.003.
15. Di Bonaventura C., Labate A., Maschio M., et al. AMPA receptors and perampanel behind selected epilepsies: current evidence and future perspectives. Expert Opin Pharmacother. 2017; 18 (16): 1751–64. https://doi.org/10.1080/14656566.2017.1392509.
16. Marcus H.J., Carpenter K.L.H., Price S.J., Hutchinson P.J. In vivo assessment of high-grade glioma biochemistry using microdialysis: a study of energy-related molecules, growth factors and cytokines. J Neurooncol. 2010; 97 (1): 11–23. https://doi.org/10.1007/s11060-009-9990-5.
17. Armstrong T.S., Grant R., Gilbert M.R., et al. Epilepsy in glioma patients: mechanisms, management, and impact of anticonvulsant therapy. Neuro Oncol. 2016; 18 (6): 779–89. https://doi.org/10.1093/neuonc/nov269.
18. Wirsching H.G., Weller M. Does neuronal activity promote glioma progression? Trends Cancer. 2020; 6 (1): 1–3. https://doi.org/10.1016/j.trecan.2019.11.002.
19. Tatsuoka J., Sano E., Hanashima Y., et al. Anti-tumor effects of perampanel in malignant glioma cells. Oncol Lett. 2022; 24 (6): 421. https://doi.org/10.3892/ol.2022.13541.
20. Ishiuchi S., Yoshida Y., Sugawara K., et al. Ca2+-permeable AMPA receptors regulate growth of human glioblastoma via Akt activation. J Neurosci. 2007; 27 (30): 7987–8001. https://doi.org/10.1523/JNEUROSCI.2180-07.2007.
21. Buckingham S.C., Campbell S.L., Haas B.R., et al. Glutamate release by primary brain tumors induces epileptic activity. Nat Med. 2011; 17 (10): 1269–74. https://doi.org/10.1038/nm.2453.
22. Омельяновский В.В., Максимкина Е.А., Ивахненко О.И. и др. Совершенствование системы формирования перечней лекарственных препаратов для медицинского применения: анализ изменений Постановления Правительства РФ № 871. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2020;13 (2): 113–23. https://doi.org/10.17749/2070-4909/farmakoekonomika.2020.032.
23. Колбин А.С., Гомон Ю.М., Касимова А.Р. и др. Реальная практика проведения клинико-экономических исследований лекарственных средств, входящих в федеральную программу высокозатратных нозологий. ФАРМАКОЭКОНОМИКА. Современная фармако экономика и фармакоэпидемиология. 2022; 15 (1): 87–105. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.107.
24. Новодережкина Е.А., Зырянов С.К. Значение исследований реальной клинической практики в оценке технологий здраво охранения. ФАРМАКОЭКОНОМИКА. Современная фармакоэкономика и фармакоэпидемиология. 2022; 15 (3): 380–9. https://doi.org/10.17749/2070-4909/farmakoekonomika.2022.120.
25. Scheffer I.E., Berkovic S., Capovilla G., et al. ILAE classification of the epilepsies: position paper of the ILAE Commission for Classification and Terminology. Epilepsia. 2017: 58 (4): 512–21. https://doi.org/10.1111/epi.13709.
26. Fisher R.S., Cross J.H., D’Souza C., et al. Instruction manual for the ILAE 2017 operational classification of seizure types. Epilepsia. 2017; 58 (4): 531–42. https://doi.org/10.1111/epi.13671.
27. Авакян Г.Н., Блинов Д.В., Лебедева А.В. и др. Классификация эпилепсии Международной Противоэпилептической Лиги: пересмотр и обновление 2017 года. Эпилепсия и пароксизмальные состояния. 2017; 9 (1): 6–25. https://doi.org/10.17749/2077-8333.2017.9.1.006-025.
28. The R Project for Statistical Computing. URL: https://www.R-project.org (дата обращения 10.11.2022).
29. Maschio M., Pauletto G., Zarabla A., et al. Perampanel in patients with brain tumor-related epilepsy in real-life clinical practice: a retrospective analysis. Int J Neurosci. 2019; 129 (6): 593–7. https://doi.org/10.1080/00207454.2018.1555160.
30. Шершевер А.С., Лаврова С.А., Бенцион Д.Л. и др. Противоэпилептические препараты в лечении структурной эпилепсии у пациентов с метастазами в головной мозг: комбинированный подход. Эпилепсия и пароксизмальные состояния. 2022; 14 (1): 15–27. https://doi.org/10.17749/2077-8333/epi.par.con.2022.065.
31. Общая характеристика лекарственного препарата Файкомпа® (перампанел). ЛП-№(000644)-(РГ-RU) от 24.03.2022.
Об авторах
Г. Г. СамсоноваРоссия
Самсонова Галина Геннадьевна – врач невролог-эпилептолог
ул. Клиническая, д. 74, Калининград 236016
И. А. Жидкова
Россия
Жидкова Ирина Александровна – д.м.н., профессор кафедры нервных болезней лечебного факультета
ул. Делегатская, д. 20/1, Москва 127473
Рецензия
Для цитирования:
Самсонова Г.Г., Жидкова И.А. Перампанел в дополнительной терапии эпилепсии, ассоциированной с опухолями головного мозга: данные реальной клинической практики. Эпилепсия и пароксизмальные состояния. 2022;14(4):321-333. https://doi.org/10.17749/2077-8333/epi.par.con.2022.139
For citation:
Samsonova G.G., Zhidkova I.A. Perampanel in adjunctive therapy of patients with brain tumor-related epilepsy: real-world data. Epilepsy and paroxysmal conditions. 2022;14(4):321-333. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.139

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































