Перейти к:
Развитие синдрома опсоклонус-миоклонус-атаксии у взрослого пациента на фоне терапии пембролизумабом (описание клинического случая и анализ литературных данных)
https://doi.org/10.17749/2077-8333/epi.par.con.2023.131
Аннотация
Актуальность. Синдром опсоклонус-миоклонус-атаксии (англ. opsoclonus-myoclonus-ataxia syndrome, ОМАS) у взрослых является крайне редким заболеванием, зачастую приводящим к быстрой инвалидизации пациентов. Описанные в литературе случаи чаще всего трактуются как постинфекционные, паранеопластические или идиопатические. Однако стали появляться публикации о развитии OMAS на фоне терапии онкологических заболеваний ингибиторами контрольных точек. За последнее десятилетие показания к применению иммунотерапии для лечения злокачественных новообразований значительно расширились, что приводит к росту иммуноопосредованных осложнений, в т.ч. с поражением нервной системы.
Цель: продемонстрировать возможную связь между терапией ингибитором PD-1 и развитием OMAS.
Материал и методы. Представлен клинический случай возникновения OMAS у пожилого пациента при применении пембролизумаба в качестве первой линии терапии по поводу плоскоклеточного рака бронха. Исследование проведено в соответствии с Хельсинкской декларацией. Также выполнен обзор научной литературы и клинических рекомендаций: обобщены основные клинические характеристики OMAS у взрослых, патогенетические и иммунологические механизмы указанного синдрома, освещены современные подходы к диагностике и терапии.
Результаты. Развитие клинической картины OMAS тяжелой степени на фоне иммунотерапии потребовало отмены таргетного лечения, что в сочетании с применением глюкокортикоидов привело к значимому регрессу неврологического дефицита. По данным проведенного обследования были исключены вероятные параинфекционные и органические причины, предположен лекарственно-индуцированный механизм развития OMAS.
Заключение. Развитие клинической картины OMAS у взрослых пациентов с известным онкологическим заболеванием на фоне терапии ингибиторами контрольных точек может стать обоснованной причиной для отмены проводимого лечения при исключении других возможных этиологических факторов.
Ключевые слова
Для цитирования:
Румянцева К.А., Полушин А.Ю., Абдулоева Н.Х., Скиба Я.Б., Моисеенко В.М. Развитие синдрома опсоклонус-миоклонус-атаксии у взрослого пациента на фоне терапии пембролизумабом (описание клинического случая и анализ литературных данных). Эпилепсия и пароксизмальные состояния. 2023;15(1):26-35. https://doi.org/10.17749/2077-8333/epi.par.con.2023.131
For citation:
Rumiantseva K.A., Polushin A.Yu., Abduloeva N.Kh., Skiba Ya.B., Moiseenko V.M. Opsoclonus-myoclonus-ataxia syndrome as a complication of pembrolizumab treatment in an adult patient (a case report and literature review). Epilepsy and paroxysmal conditions. 2023;15(1):26-35. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2023.131
ВВЕДЕНИЕ / INTRODUCTION
Первое описание синдрома «танцующих глаз» было представлено в 1962 г. детским неврологом M. Kinsbourne в работе «Миоклоническая энцефалопатия младенцев» [1]. С тех пор данный синдром устойчиво ассоциируется с педиатрической практикой. Тем не менее можно найти и более ранние публикации о синдроме опсоклонус-миоклонус-атаксии (англ. оpsoclonus-myoclonus-ataxia syndrome, OMAS): в 1911–1912 гг. американский невролог F. Kennedy описывал похожую клиническую картину у 20-месячного ребенка с нейробластомой паравертебральной локализации [2]. Однако в то время связь между образованием и клинической картиной не была установлена. Только в 1968 г. была опубликована статья G. Solomon, где впервые описана ассоциация синдрома опсоклонуса-миоклонуса с нейробластомой у детей [3].
На сегодняшний день встречаемость OMAS в детской популяции, по данным литературы, составляет порядка 1:5 000 000, в то время как у взрослых – в два раза реже [4]. Наиболее часто OMAS у взрослых выявляется на фоне онкологических и инфекционных заболеваний, также нередко упоминаются токсические и дисметаболические факторы. В литературе встречаются описания развития OMAS у беременных женщин [5], ч то может свидетельствовать в пользу иммуноопосредованного характера процесса.
Клиническая картина OMAS в его классическом проявлении очень характерна: она складывается из комбинации глазодвигательных, координаторных и моторных нарушений, а также возможных поведенческих расстройств и когнитивного дефицита, возникающих на фоне онкологического заболевания (или выявления онконейрональных антител). Для постановки диагноза паранеопластического OMAS необходимо наличие трех из четырех критериев: опсоклонус, миоклонус/атаксия, диссомния, онкологический анамнез или выявленные онконейрональные антитела [6]. Некоторые пациенты также предъявляют жалобы на выраженное головокружение и зрительные нарушения по типу осциллопсий [6]. При этом согласно данным литературы у пожилых больных выраженность явлений энцефалопатии и снижение когнитивной функции встречаются гораздо чаще, чем у молодых [7]. Глобально клинические проявления OMAS стоят в линейке широкого спектра пароксизмальных состояний у пациентов с онкологическими заболеваниями: наряду с развитием остро возникающих симптоматических эпилептических приступов [8] и психогенных псевдоэпилептических пароксизмов [9] неэпилептические двигательные феномены органического генеза, например миоклонии [10], могут встречаться в практике невролога при консультировании данной группы больных.
По данным крупного исследования, включавшего 114 взрослых пациентов с установленным OMAS различной этиологии, на терапию лучше отвечают больные с идиопатическим характером синдрома, в то время как паранеопластический вариант чаще протекает с рецидивами и более неблагоприятным прогнозом в отдаленной перспективе [7]. В литературе встречаются отдельные описания клинических наблюдений развития OMAS на фоне проводимой иммунотерапии уже известного онкологического заболевания [11][12], однако в 69% случаев OMAS предшествует выявлению опухолевого процесса и, следовательно, может служить первым сигналом для подробного онкологического поиска [7].
КЛИНИЧЕСКИЙ СЛУЧАЙ / CASE REPORT
Пациент Н., 72 года, получал системное лечение в условиях амбулаторного отделения ГБУЗ «Санкт-Петербургский клинический научно-практического центр специализированных видов медицинской помощи (онкологический)» по поводу плоскоклеточного рака правого нижнедолевого бронха, выявленного за 5 мес до начала терапии (октябрь 2020 г.).
Анамнез / Medical history
На момент начала лечения (март 2021 г.) процесс стадирован как T4N1M1 IVA. В связи с выявленной по данным иммуногистохимического исследования высокой (65%) экспрессией PD-1 пациент с марта 2022 г. начал получать иммунотерапию пембролизумабом по стандартной схеме (внутривенное введение 200 мг препарата каждые 3 нед). По данным контрольных компьютерных томограмм (КТ) органов грудной клетки, брюшной полости и малого таза отмечалась положительная динамика с последующей стабилизацией. Введения препарата больной переносил удовлетворительно.
Через 2 мес после начала терапии (с конца мая 2021 г.) пациент стал отмечать появление головокружения и незначительной шаткости при ходьбе, нечеткость зрения, что сам он связал с возрастом. Жалоб по этому поводу активно не предъявлял. Через 3 мес (сентябрь 2021 г.) отметил ухудшение самочувствия в виде прогрессирования головокружения, усиления шаткости при ходьбе, появления подергиваний мышц подбородка, рук и ног, выраженной дневной сонливости. В течение последующей недели появились зрительные нарушения, которые больной описывал как «двоение и рябь в глазах», появилось ощущение «бегущей строки перед глазами и бегущих предметов». Пациент перестал себя обслуживать, самостоятельно ходить – передвигался только на сидячей каталке, появилась забывчивость, стал путать имена и даты, возникли агрессия, раздражительность. С вышеуказанными жалобами больной госпитализирован.
Неврологический статус / Neurological status
В неврологическом статусе при поступлении наблюдалось значимое когнитивно-мнестическое снижение: по тесту «батарея оценки лобной функции» (англ. Frontal Assessment Battery, FAB) – 13 баллов, по краткой шкале оценки психического статуса (англ. Mini-Mental State Examination, MMSE) – 18 баллов. Отмечены эпизоды насильственных эмоций, незначительная дизартрия.
Выявлены глазодвигательные нарушения в виде опсоклонуса, выраженность которого усиливалась при попытках фиксации взора и плавного слежения за стимулом. Присутствовали непроизвольные сокращения мимической мускулатуры, мышц конечностей и туловища. Мимические (преимущественно орофациальные) миоклонии значимо усиливались при разговоре, миоклонические подергивания в мышцах рук – при целенаправленных движениях. Миоклонии в мышцах ног усиливались при попытках вертикализации, обусловливая невозможность самостоятельной ходьбы, при этом пареза в конечностях не выявлялось. Координаторные пробы больной выполнял с двусторонней интенцией. Отмечалась грубая статико-локомоторная атаксия.
Таким образом, у пациента имелась клиническая картина OMAS, соответствующая диагностическим критериям: опсоклонус, миоклонус, атаксия в сочетании с энцефалопатией и диссомнией.
Магнитно-резонансная томография / Magnetic resonance imaging
С целью исключения вторичного органического процесса выполнена магнитно-резонансная томография (МРТ) головного мозга с контрастным усилением на аппарате Magnetom Verio 3T ECO (Siemens, Германия). Определены возрастные изменения без признаков очагового поражения.
Лабораторные исследования / Laboratory tests
Данные лабораторных исследований крови при поступлении не показали значимых отклонений. Исследование ликвора и сыворотки крови на вирусные и бактериальные инфекции (вирус простого герпеса 1-го, 2-го, 6-го, 7-го типов, парвовирус В19, цитомегаловирус, вирус Эпштейна–Барр, полиомавирус, микобактерии туберкулеза, микоплазма пневмонии) методом полимеразно-цепной реакции не выявило возбудителя. При цитологическом исследовании ликвора изменений также не обнаружено. Анализ антинейрональных антител методом непрямой реакции иммунофлюоресценции не выявил патологии (титр <100). Определен патологический тип синтеза иммуноглобулина G (англ. immunoglobulin G, IgG): олигоклональный IgG (ОСВ+) тип синтеза в ликворе, поликлональный IgG в сыворотке (2-й тип синтеза), что косвенно свидетельствовало о текущем иммунном интратекальном воспалении.
Таким образом, с большой долей вероятности инфекционный генез OMAS исключен. Рассматривая в качестве наиболее вероятных вариантов паранеопластический тип OMAS и иммуноопосредованную реакцию на терапию пембролизумабом, с учетом отсутствия выявленных антинейрональных антител и развития заболевания на фоне длительно известного опухолевого процесса генез расценили как лекарственно-индуцированный.
Терапия / Therapy
В связи с этим терапия пембролизумабом была прервана, начата терапия глюкокортикоидами (преднизолон 2 мг/кг/сут внутривенно с последующей деэскалацией дозы по –5 мг каждые 3 дня). В течение последующих 7 дней отмечена положительная динамика в виде регресса выраженности опсоклонуса, миоклонуса и атаксии. На фоне улучшения (уменьшение выраженности координаторных расстройств, глазодвигательных нарушений) пациент был выписан на амбулаторный этап лечения с рекомендацией продолжения приема преднизолона перорально по указанной схеме.
Контрольное обследование / Control examination
При контрольном осмотре через 6 нед отмечена положительная динамика в виде купирования опсоклонуса и миоклонуса, восстановления режима сна, значимого регресса выраженности статико-локомоторной атаксии, что позволило пациенту передвигаться самостоятельно с минимальной дополнительной опорой (трость). Регрессировали явления энцефалопатии: улучшилась концентрация внимания, восстановилась ориентация во времени и пространстве, купированы агрессия и насильственные эмоции.
При выполнении контрольной КТ органов грудной клетки, брюшной полости и малого таза с контрастным усилением зафиксирована стабилизация процесса основного заболевания. Пациент остается под динамическим наблюдением онколога и невролога.
ОБСУЖДЕНИЕ / DISCUSSION
OMAS является редким неврологическим синдромом. При достаточно характерной клинической картине этиологические факторы могут сильно варьировать, что значительно затрудняет быстрый выбор терапевтической тактики и требует углубленного обследования пациентов. В типичных случаях OMAS развивается остро (в течение нескольких дней) или подостро (до нескольких недель).
На сегодняшний день не существует единого мнения о точном механизме возникновения и анатомической локализации поражения, обусловливающего развитие OMAS. Ранние теории предполагали поражение омнипаузных нейронов ядер шва варолиева моста, однако проведенные морфологические исследования не подтвердили наличия патологических изменений в этих анатомических структурах [13]. Другая версия предлагает рассматривать в качестве основной анатомической структуры, ответственной за клиническую картину, ядра шатра мозжечка, что косвенно подтверждают функциональные МРТ двух пациентов с OMAS, у которых выявлялась локальная активность в сравнении с двумя здоровыми добровольцами [14].
Теория аутоиммунного механизма развития заболевания стала рассматриваться исследователями на основании часто подтверждаемого положительного ответа на иммуносупрессивную терапию, а также изменений в ликворе, характерных для аутоиммунного воспаления (плеоцитоз, повышенный уровень белка, выявление патологического типа синтеза IgG) [15]. При дальнейших исследованиях было показано наличие у некоторых больных широкого спектра антинейрональных антител (англ. anti-Hu, -Ri, -Yo, -Ma1, -Ta, -CRMP-5 и др.). Чаще всего найденные anti-Hu и -Ri коррелировали с наличием у пациента мелкоклеточного рака легкого и рака молочной железы соответственно [16]. Однако нередко выявляются и антитела к антигенам клеточной поверхности – GlyR, GABABR, NMDAR, DPPX [17]. Особый интерес представляет обнаружение антител к GlyR, поскольку глицин является нейротрансмиттером омнипаузных нейронов ретикулярной формации моста [18]. Однако единый достоверный иммунологический диагностический маркер OMAS до сих пор не определен [6]. Другим подтверждающим фактором заинтересованности иммунной системы стало выявление в спинномозговой жидкости и сыворотке крови повышения уровня В-клеточного активационного фактора (англ. B-cell activating factor, BAFF) – цитокина, относящегося к семейству фактора некроза опухоли [19]. Данные аутопсии демонстрируют незначительную периваскулярную лимфоцитарную инфильтрацию, но крайне редко определяется нейрональная дегенерация или массивная Т-клеточная инфильтрация, что в большей степени поддерживает теорию участия антител [20].
OMAS параинфекционной этиологии наиболее часто ассоциируется со следующими возбудителями: вирусы Зика, Коксаки, Эпштейна–Барр, лихорадка Западного Нила, энтеро-, парвовирусы, вирусы гриппа, ветряной оспы, герпеса человека 6-го типа, цитомегаловирус, вирус иммунодефицита человека, а также различные бактериальные возбудители [21].
Рассматривая воздействие ингибиторов контрольных иммунных точек в качестве возможного триггера развития OMAS, следует упомянуть, что механизм действия иммунотерапии основывается на способности препаратов блокировать отрицательную регуляцию активации Т-клеток, воздействуя на цитотоксический Т-лимфоцит-ассоциированный антиген 4 (англ. cytotoxic T-lymphocyte-associated protein 4, CTLA-4) и мембранные белки программируемой смерти клеток PD-1 и его лиганда PD-L1. Этот процесс запускает разрушительный противоопухолевый иммунный ответ Т-клеток, зачастую подвергая данному воздействию и клетки организма, имеющие перекрестную иммунную реактивность [22].
Поскольку исходный провоцирующий фактор, определяющий характер заболевания, может принципиально менять терапевтический подход, представляется важным своевременно определить тип OMAS (табл. 1).
Таблица 1. Дифференциальные критерии диагностики синдрома опсоклонус-миоклонус-атаксии у взрослых пациентов
Table 1. Differential diagnostic criteria of оpsoclonus-myoclonus-ataxia syndrome in adults
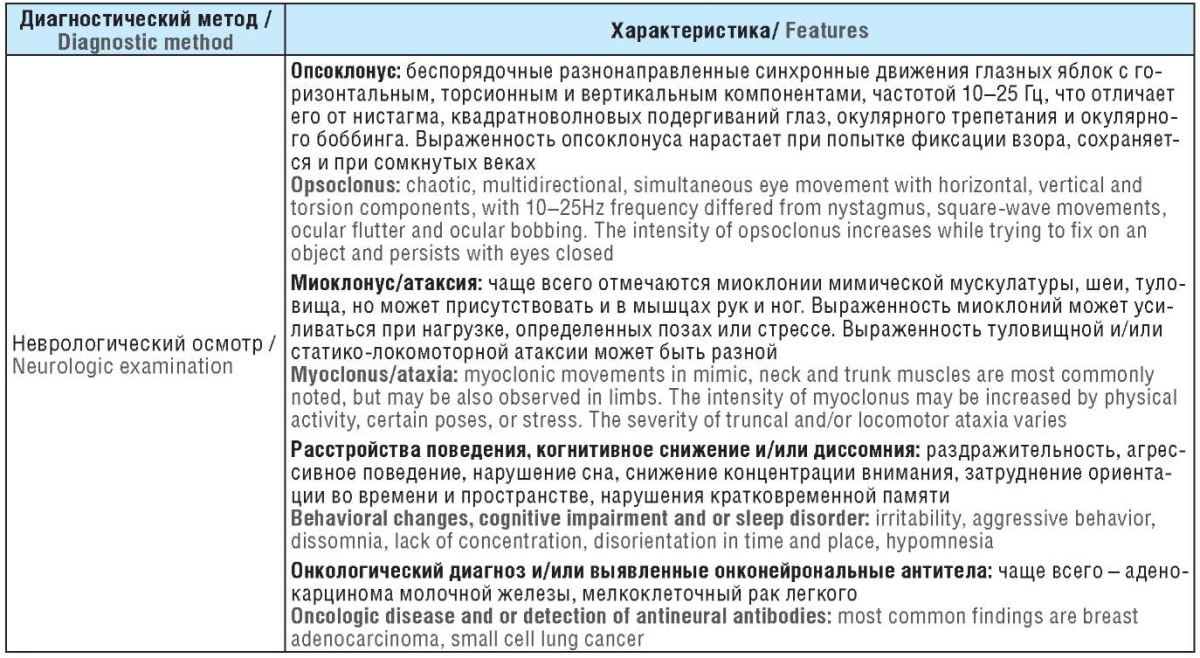
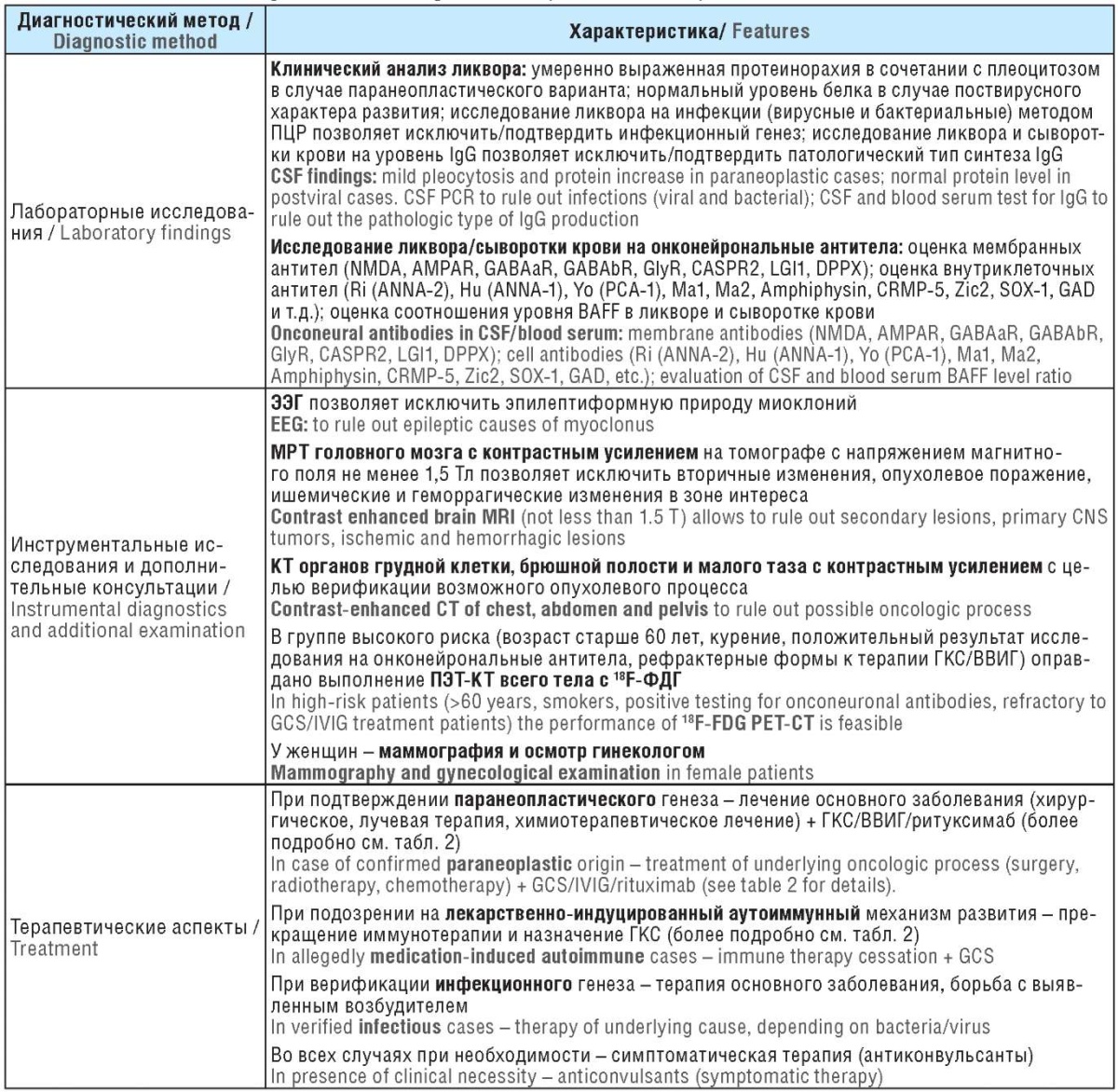
Примечание. ПЦР – полимеразная цепная реакция; IgG (англ. immunoglobulin G) – иммуноглобулин G; BAFF (англ. B-cell activating factor) – В-клеточный активирующий фактор; ЭЭГ – электроэнцефалография; МРТ – магнитно-резонансная томография; КТ – компьютерная томография; ГКС – глюкокортикостероид; ВВИГ – внутривенные иммуноглобулины; ПЭТ-КТ – позитронно-эмиссионная томография, совмещенная с компьютерной томографией; ФДГ – фтордизоксиглюкоза.
Note. PCR – polymerase chain reaction; IgG – immunoglobulin G; CSF – cerebrospinal fluid; BAFF – B-cell activating factor; EEG – electroencephalography; MRI – magnetic resonance imaging; CNS – central nervous system; CT – computed tomography; GCS – glucocorticosteroid; IVIG – intravenous immunoglobulins; PET-CT – positron emission tomography combined with computed tomography; FDG – fluorodesoxyglucose.
OMAS представляет собой крайне редкую нозологию, поэтому на сегодняшний день не существует стандартизированного подхода к терапии данного заболевания. Вероятнее всего, можно считать оправданной тактику, направленную на устранение провоцирующего фактора в сочетании с симптоматической терапией. Не исключено использование часто встречающейся эскалационной иммуносупрессивной терапии, применяемой при других иммуноопосредованных заболеваниях нервной системы, в особенности при невозможности отмены потенциально провоцирующего фактора по жизненным показаниям [23]. При подтверждении онкологического процесса у пациента должна быть рассмотрена возможность комплексного лечения основного заболевания (хирургическое вмешательство, химиотерапия, лучевая терапия и т.д.) в сочетании с иммуносупрессивной терапией. Однако, по данным некоторых авторов, истинный паранеопластический OMAS чаще всего остается резистентным к проводимому лечению [24]. В то же время постинфекционные и иммуноопосредованные варианты OMAS лучше отвечают на применение глюкокортикостероидов и иммуноглобулинов. Возможные варианты иммуносупрессивной терапии подразумевают использование кортикостероидов и адренокортикотропного гормона, внутривенных иммуноглобулинов, ритуксимаба, циклофосфамида и метотрексата (табл. 2).
Таблица 2. Терапия паранеопластического и иммуно-терапевтически-индуцированного синдрома опсоклонусмиоклонус-атаксии на основании степени тяжести (модификация шкалы оценки OMАS evaluation scale M. Pranzatelli [25])
Table 2. Paraneoplastic and immune-therapy-induced оpsoclonus-myoclonus-ataxia syndrome treatment based on the severity (modification of M. Pranzatelly OMAS evaluation scale [25])
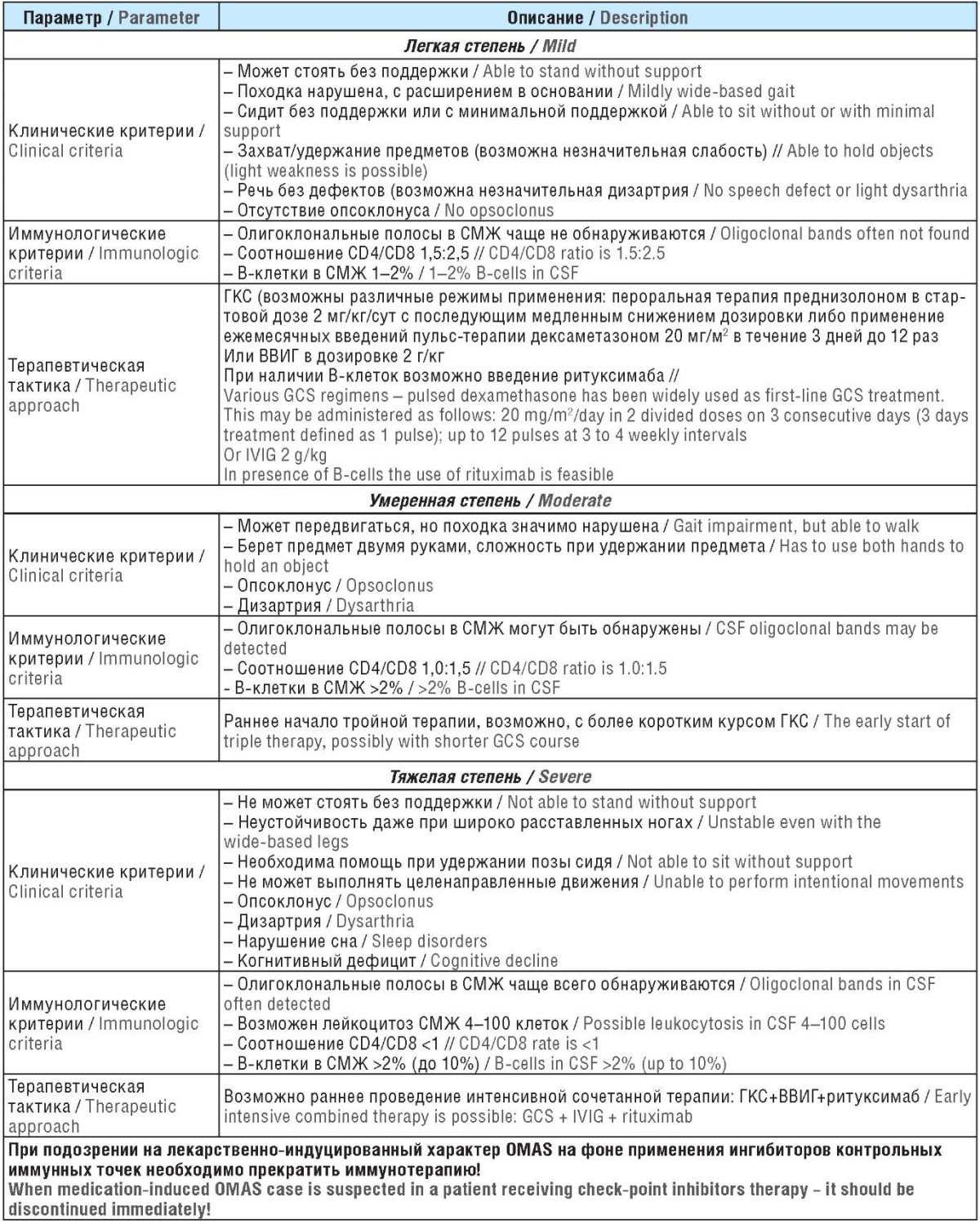
Примечание. СМЖ – спинномозговая жидкость; ГКС – глюкокортикостероид; ВВИГ – внутривенный иммуноглобулин.
Note. CSF – cerebrospinal fluid; GCS – glucocorticosteroid; IVIG – intravenous immunoglobulin.
Перспективным направлением в терапии паранеопластического варианта OMAS может стать применение натализумаба – моноклонального антитела, подавляющего воспаление в тканях путем блокирования взаимодействия a4-экспрессирующих лейкоцитов с их лигандами. В исследовании A. Hottinger et al. представлены положительные результаты его использования в лечении лимбического энцефалита, развившегося на фоне терапии ингибиторами контрольных точек, что дает надежду на возможное успешное его применение и в лечении других иммуноопосредованных неврологических осложнений [26].
Точных сведений о частоте рецидивов у взрослых пациентов в крупных исследованиях на сегодняшний день не опубликовано, но, по данным исследования в детской популяции, до 75% пациентов с паранеопластическим OMAS могут иметь рецидивирующее течение [27].
Представленный клинический случай потенциально мог иметь смешанную этиологию. В отсутствие четких клинических рекомендаций терапии OMAS дальнейшая лечебная тактика могла не предполагать отмены пембролизумаба. Тем не менее, руководствуясь алгоритмом лечения иммуноопосредованных нежелательных явлений Российского общества клинической онкологии [28], можно заключить, что, вероятно, именно отмена PD-1 и последующее назначение преднизолона позволили получить положительный эффект.
Принимая во внимание недостаточную чувствительность и специфичность панели антинейрональных антител (выявляются лишь у 19% пациентов с клинической картиной OMAS и известными опухолевыми процессами различных локализаций [7]), а также отсутствие описанных подобных побочных эффектов при применении пембролизумаба, полностью исключить паранеопластический генез неврологических осложнений довольно сложно.
Однако при анализе нами данных PubMed/MEDLINE и Scopus обнаружено несколько случаев развития OMAS у пациентов на фоне терапии другими ингибиторами контрольных иммунных точек. Так, например, в статье H. Arai еt al. описан случай развития OMAS у пациента с мелкоклеточным раком легкого на фоне комбинированного лечения, включавшего терапию атезолизумабом [12]. Другое наблюдение представлено в работе B. Maller et al. – развитие клинической картины OMAS у больного с мезотелиомой плевры на фоне комбинированной терапии ипилимумабом с ниволумабом [11].
В крупном канадском исследовании, посвященном частоте развития нейроофтальмических осложнений на фоне терапии ингибиторами контрольных точек, пембролизумаб упоминается как ведущий агент (32,1%) по частоте возникновения или усугубления имевшихся глазодвигательных нарушений, преимущественно ассоциированных с нарушениями нервно-мышечной передачи (глазная форма миастении), а также невритом зрительного нерва и орбитальным миозитом [29]. По данным клиники Mayo, общая частота зафиксированных неврологических осложнений на фоне анти-PD-1-терапии (пембролизумаб и ниволумаб) среди 347 пациентов составила 2,9% [30]. При этом публикаций, посвященных OMAS как осложнению приема пембролизумаба, нами обнаружено не было, что позволяет считать данную работу первым подобным опубликованным случаем.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Развитие иммуноопосредованных неврологических осложнений на фоне терапии ингибиторами контрольных точек встречается все чаще в связи с расширением показаний к применению этих препаратов в терапии онкологических заболеваний, но точный механизм патогенеза до конца не исследован. Также остается открытым вопрос поиска чувствительных и надежных маркеров возможного развития неврологических осложнений в результате применения ингибиторов PD-1.
OMAS – это тяжелый неврологический синдром с высокой вероятностью неблагоприятного исхода. Редкость данной нозологии определяет отсутствие четких клинических рекомендаций по лечению. Следует признать эффективность использования глюкокортикоидов в случаях развития нежелательных реакций на фоне иммунотерапии онкологических заболеваний. Необходимо проведение рандомизированных проспективных исследований для дальнейшей разработки стандартизированных протоколов диагностики и лечения OMAS с целью улучшения результатов лечения таких пациентов.
Список литературы
1. Kinsbourne M. Myoclonic encephalopathy of infants. J Neurol Neurosurg Psychiatry. 1962; 25 (3): 271–6. https://doi.org/10.1136/jnnp.25.3.271.
2. Cushing H., Wolbach S.B. The transformation of a malignant paravertebral sympathicoblastoma into a benign ganglioneuroma. Am J Pathol. 1927; 3 (3): 203–16.7.
3. Solomon G.E., Chutorian A.M. Opsoclonus and occult neuroblastoma. N Engl J Med. 1968; 279 (9): 475–7. https://doi.org/10.1056/NEJM196808292790907.
4. Nwafor D.C., Petrone A.B., Collins J.M., Adcock A.K. Paraneoplastic opsoclonus myoclonus in a patient with pancreatic adenocarcinoma. Case Rep Neurol Med. 2019; 2019: 3601026. https://doi.org/10.1155/2019/3601026.
5. Koziorowska-Gawron E., Koszewicz M., Bladowska J., et al. Opsoclonusmyoclonus syndrome with severe clinical course and beneficial outcome: a case report. Medicine (Baltimore). 2021; 100 (14): e25261. https://doi.org/10.1097/MD.0000000000025261.
6. Oh S.Y., Kim J.S., Dieterich M. Update on opsoclonus-myoclonus syndrome in adults. J Neurol. 2019; 266 (6): 1541–8. https://doi.org/10.1007/s00415-018-9138-7.
7. Armangué T., Sabater L., Torres-Vega E., et al. Clinical and immunological features of opsoclonus-myoclonus syndrome in the era of neuronal cell surface antibodies. JAMA Neurol. 2016; 73 (4): 417–24. https://doi.org/10.1001/jamaneurol.2015.4607.
8. Скиба Я.Б., Полушин А.Ю., Прокудин М.Ю. и др. Остро возникшие симптоматические эпилептические приступы при проведении трансплантации гемопоэтических стволовых клеток. Эпилепсия и пароксизмальные состояния. 2021; 13 (1): 65–82. https://doi.org/10.17749/2077-8333/epi.par.con.2021.049.
9. Garcia C.R., Khan G.Q., Morrow A.M., et al. Brain tumors associated with psychogenic non-epileptic seizures: case series. Clin Neurol Neurosurg. 2018; 164: 53–6. https://doi.org/10.1016/j.clineuro.2017.11.013.
10. Миронов М.Б., Бурд С.Г., Рублева Ю.В. и др. Эпилептический миоклонус. Эпилепсия и пароксизмальные состояния. 2020; 12 (2): 122–4. https://doi.org/10.17749/2077-8333/epi.par.con.2020.030.
11. Maller B., Peguero E., Tanvetyanon T. Ipilimumab/nivolumab-related opsoclonus-myoclonus-ataxia syndrome variant in a patient with malignant pleural mesothelioma. J Immunother. 2018; 41 (9): 411–2. https://doi.org/10.1097/CJI.0000000000000228.
12. Arai H., Utsu Y., Horio J., et al. Paraneoplastic opsoclonus-myoclonus syndrome with anti-Hu and anti-SOX-1 antibodies after immunecheckpoint inhibitor treatment combined with chemotherapy in a patient with small-cell lung cancer. Intern Med. 2022; 61 (1): 71–4. https://doi.org/10.2169/internalmedicine.7167-21.
13. Ridley A., Kennard C., Scholtz C.L., et al. Omnipause neurons in two cases of opsoclonus associated with oat cell carcinoma of the lung. Brain. 1987; 110 (Pt. 6): 1699–709. https://doi.org/10.1093/brain/110.6.1699.
14. Helmchen C., Rambold H., Sprenger A., et al. Cerebellar activation in opsoclonus: an fMRI study. Neurology. 2003; 61 (3): 412–5. https://doi.org/10.1212/01.wnl.0000073271.66866.51.
15. Sahu J.K., Prasad K. The opsoclonus-myoclonus syndrome. Pract Neurol. 2011; 11 (3): 160–6. https://doi.org/10.1136/practneurol-2011-000017.
16. Bataller L., Rosenfeld M.R., Graus F., et al. Autoantigen diversity in the opsoclonus-myoclonus syndrome. Ann Neurol. 2003; 53 (3): 347–53. https://doi.org/10.1002/ana.10462.
17. DeFelipe-Mimbrera A., Masjuan J., Corral Í., et al. Opsoclonus-myoclonus syndrome and limbic encephalitis associated with GABAB receptor antibodies in CSF. J Neuroimmunol. 2014; 272 (1–2): 91–3. https://doi.org/10.1016/j.jneuroim.2014.04.009.
18. Lynch J.W. Native glycine receptor subtypes and their physiological roles. Neuropharmacology. 2009; 56 (1): 303–9. https://doi.org/10.1016/j.neuropharm.2008.07.034.
19. Pranzatelli M.R., Tate E.D., Hoefgen E.R., et al. Therapeutic downregulation of central and peripheral B-cell-activating factor (BAFF) production in pediatric opsoclonus-myoclonus syndrome. Cytokine. 2008; 44 (1): 26–32. https://doi.org/10.1016/j.cyto.2008.06.001.
20. Young C.A., MacKenzie J.M., Chadwick D.W., Williams I.R. Opsoclonusmyoclonus syndrome: an autopsy study of three cases. Eur J Med. 1993; 2 (4): 239–41.
21. Алексеева Т.М., Топузова М.П., Скрипченко Н.В. и др. Вирус-индуцированный синдром опсоклонуса-миоклонуса при беременности. Журнал неврологии и психиатрии им. С.С. Корсакова. 2020; 120 (5): 93–9. https://doi.org/10.17116/jnevro202012005193.
22. Vaddepally R.K., Kharel P., Pandey R., et al. Review of indications of FDA-approved immune checkpoint inhibitors per NCCN guidelines with the level of evidence. Cancers (Basel). 2020; 12 (3): 738. https://doi.org/10.3390/cancers12030738.
23. Чухловина М.Л., Вознюк И.А., Полушин А.Ю. Современные представления о патогенезе, диагностике и лечении синдрома Сусака. Русский медицинский журнал. 2018; 7: 10–4.
24. Bataller L., Graus F., Saiz A., Vilchez J.J. Clinical outcome in adult onset idiopathic or paraneoplastic opsoclonus-myoclonus. Brain. 2001; 124 (Pt. 2): 437–43. https://doi.org/10.1093/brain/124.2.437.
25. Swaiman K., Ashwal S., Ferriero D.M., et al. Swaiman’s pediatric neurology: principles and practice. 6th ed. Elsevier; 2017: 941.
26. Hottinger A.F., de Micheli R., Guido V., et al. Natalizumab may control immune checkpoint inhibitor-induced limbic encephalitis. Neurol Neuroimmunol Neuroinflamm. 2018; 5 (2): e439. https://doi.org/10.1212/NXI.0000000000000439.
27. Catsman-Berrevoets C.E., Aarsen F.K., van Hemsbergen M.L., et al. Improvement of neurological status and quality of life in children with opsoclonus myoclonus syndrome at long-term follow-up. Pediatr Blood Cancer. 2009; 53 (6): 1048–53. https://doi.org/10.1002/pbc.22226.
28. Проценко С.А., Антимоник Н.Ю., Берштейн Л.М. и др. Практические рекомендации по коррекции иммуноопосредованных нежелательных явлений. URL: https://rosoncoweb.ru/standarts/RUSSCO/2017/recoms2017_49.pdf (дата обращения 15.09.2022).
29. Yu C.W., Yau M., Mezey N., et al. Neuro-ophthalmic complications of immune checkpoint inhibitors: a systematic review. Eye Brain. 2020; 12: 139–67. https://doi.org/10.2147/EB.S277760.
30. Kao J.C., Liao B., Markovic S.N., et al. Neurological complications associated with anti-programmed death 1 (PD-1) antibodies. JAMA Neurol. 2017; 74 (10): 1216–22. https://doi.org/10.1001/jamaneurol.2017.1912.
Об авторах
К. А. РумянцеваРоссия
Румянцева Ксения Алексеевна – невролог отделения нейроонкологии
Ленинградская ул., д. 68А, лит. А, Санкт-Петербург 197758
А. Ю. Полушин
Россия
Полушин Алексей Юрьевич – к.м.н., руководитель отделения химиотерапии и трансплантации при онкологических и аутоиммунных заболеваниях, заведующий научно-исследовательской лабораторией нейроонкологии и аутоиммунных заболеваний Научно-исследовательского института детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, доцент кафедры неврологии
ул. Льва Толстого, д. 6-8, Санкт-Петербург 197022
Scopus Author ID: 57195962540
Н. Х. Абдулоева
Россия
Абдулоева Нуринисо Хамдуллоевна – к.м.н., заместитель директора по амбулаторно-поликлинической помощи
Ленинградская ул., д. 68А, лит. А, Санкт-Петербург 197758
Scopus Author ID: 41560995500
Я. Б. Скиба
Россия
Скиба Ярослав Богданович – к.м.н., врач-невролог Научно-исследовательского института детской онкологии, гематологии
и транспланталогии им. Р.М. Горбачевой
ул. Льва Толстого, д. 6-8, Санкт-Петербург 197022
WoS ResearcherID: ABC-9723-2020
Scopus Author ID: 57211950985
В. М. Моисеенко
Россия
Моисеенко Владимир Михайлович – д.м.н., профессор, член-корреспондент РАН, директор
Ленинградская ул., д. 68А, лит. А, Санкт-Петербург 197758
Scopus Author ID: 6603976335
Рецензия
Для цитирования:
Румянцева К.А., Полушин А.Ю., Абдулоева Н.Х., Скиба Я.Б., Моисеенко В.М. Развитие синдрома опсоклонус-миоклонус-атаксии у взрослого пациента на фоне терапии пембролизумабом (описание клинического случая и анализ литературных данных). Эпилепсия и пароксизмальные состояния. 2023;15(1):26-35. https://doi.org/10.17749/2077-8333/epi.par.con.2023.131
For citation:
Rumiantseva K.A., Polushin A.Yu., Abduloeva N.Kh., Skiba Ya.B., Moiseenko V.M. Opsoclonus-myoclonus-ataxia syndrome as a complication of pembrolizumab treatment in an adult patient (a case report and literature review). Epilepsy and paroxysmal conditions. 2023;15(1):26-35. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2023.131
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.







































