Перейти к:
Изучение нейротропных свойств новых противоэпилептических азотсодержащих препаратов
https://doi.org/10.17749/2077-8333/epi.par.con.2023.174
Аннотация
Цель: в экспериментальном исследовании оценить эффективность новых азотсодержащих соединений для купирования эпилептиформных состояний и провести молекулярное моделирование нового нейротропного препарата.
Материал и методы. Проводилось изучение противосудорожной и психотропной активности шести новых синтезированных в Институте тонкой органической химии гетероциклических соединений: № 1 (тетрагидробензотиенопиримидин), № 2 (пиридoпиримидин), № 3 (пиранотриазолопиридин), № 4 (тиоалкилпиранотриазолопиридин), № 5 (пиразолилтетрагидротиеноизохинолин) и № 6 (тиоксопиранопиридин). Опыты выполняли на 300 белых аутбредных мышах-самцах массой 18–24 г и 48 крысах-самцах массой 120–150 г. Противосудорожный спектр действия исследовали на мышах по тестам «максимальный электрошок», «коразоловые судороги». Психотропные свойства соединений определяли по тестам: «приподнятый крестообразный лабиринт», «открытое поле», «конфликтная ситуация». Нейротоксические эффекты соединений оценивали по нарушению координации движений в тесте «вращающийся стержень». Сравнение проводили с препаратами пуфемид (3-(п-изопропоксифенил)сукцинимид), этосуксимид и диазепам.
Результаты. У новых азотсодержащих препаратов выявлена высокая противосудорожная активность, особенно по тесту «коразоловые судороги». Все отобранные соединения обладали противосудорожным, анксиолитическим, психоседативным или активирующим поведение действием. Соединение № 1 (N3212) наиболее эффективно (эффективная 50% доза 16 мг/кг) по антагонизму с коразолом. По данному показателю оно статистически достоверно превосходит этосуксимид в 10 раз и пуфемид в 5 раз. Соединение является наименее токсичным (летальная 50% доза 2300 мг/кг) и имеет низкую нейротоксичность (токсичная 50% доза 660 мг/кг). Терапевтический и защитный индексы соединения превосходят этосуксимид в 17 и 13 раз, а пуфемид – в 6 и 8 раз соответственно.
Заключение. Исследуемые соединения превосходят известные используемые в медицинской практике препараты пуфемид и этосуксимид. Отобранное среди них соединение N3212 может найти применение как противосудорожный препарат с психотропными свойствами.
Ключевые слова
Для цитирования:
Пароникян Р.Г., Авакян Г.Г., Авакян В.Н., Пароникян Е.Г. Изучение нейротропных свойств новых противоэпилептических азотсодержащих препаратов. Эпилепсия и пароксизмальные состояния. 2023;15(4):318-325. https://doi.org/10.17749/2077-8333/epi.par.con.2023.174
For citation:
Paronikyan R.G., Avakyan G.G., Avakyan V.N., Paronikyan E.G. Assessing neurotropic effects of new antiepileptic nitrogen-containing drugs. Epilepsy and paroxysmal conditions. 2023;15(4):318-325. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2023.174
ВВЕДЕНИЕ / INTRODUCTION
По данным Всемирной организации здравоохранения, сейчас в мире около 50 млн человек страдают эпилептиформными нарушениями. В последние годы арсенал противосудорожных средств ощутимо расширился. Благодаря этому терапия больных эпилепсией стала более дифференцированной, избирательной и индивидуальной.
Современная фармакотерапия эпилепсий и эпилептических синдромов осуществляется за счет противосудорожных и противоэпилептических препаратов (ПЭП) с инновационными механизмами действия на мишени патологической эпилептической системы [1–3]. С точки зрения механизма действия фармакотерапия направлена на регуляцию нейротрансмиттерных белков-мишеней, обеспечивающих процесс переноса анионов и катионов, который способствует снижению электроактивности клеток. Одним из таких механизмов является коразоловый путь действия – он приводит к угнетению нейротрансмиттера гамма-аминомасляной кислоты А (англ. gamma-aminobutyric acid А, GABAА), играющего важную роль в процессах сигналинга [4]. С другой стороны, транспортер серотонина (англ. serotonin transporter, SERT) и рецептор 5-HT1А вовлечены в моноаминогенный путь эпилептогенеза [5].
Мы провели экспериментальное исследование нейротропного действия новых противосудорожных азотсодержащих соединений, синтезированных в Институте тонкой органической химии ГНКО «Научно-технологический центр органической и фармацевтической химии» Национальной академии наук Республики Армения (НАН РА).
Цель – в экспериментальном исследовании оценить эффективность новых азотсодержащих соединений для купирования эпилептиформных состояний и провести молекулярное моделирование нового нейротропного препарата.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHОDS
Препараты сравнения / Comparators
Выполняли изучение нейротропной активности шести новых синтезированных в Институте тонкой органической химии ГНКО «Научно-технологический центр органической и фармацевтической химии» НАН РА соединений – производных различных азотсодержащих препаратов – № 1 (производное бензотиенопиримидина, N3212), № 2 (производное пиридoпиримидина), № 3 (производное триазолопиридина), № 4 (литиевое производное дилантина (5,5-дифенилгидантоина), № 5 (производное тиеноизохинолина) и № 6 (производное пиранопиридина).
Сравнение проводили с пуфемидом, синтезированным в 1980-х гг. в Институте тонкой органической химии НАН РА, а также с применяемыми в лечебной практике известными препаратами этосуксимид и диазепам [6].
Дозировки / Dosages
Исследуемые соединения вводили в диапазоне доз 12,5–100 мг/кг, препарат сравнения диазепам – в дозах 0,1–2,0 мг/кг, пуфемид – в дозе 200 мг/кг, этосуксимид – в дозах 150–300 мг/кг внутрибрюшинно за 45 мин до введения коразола в виде суспензии с карбоксиметилцеллюлозой и твин-80.
Тесты / Tests
Опыты выполняли на 300 белых аутбредных мышах-самцах массой 18–24 г и 48 крысах-самцах массой 120–150 г. Противосудорожный спектр действия исследовали по тестам «коразоловые судороги», «максимальный электрошок» [7–10]. Психотропные свойства соединений изучали по тестам «приподнятый крестообразный лабиринт», «открытое поле», «конфликтная ситуация». Нейротоксические эффекты соединений оценивали по нарушению координации движений в тесте «вращающийся стержень» [7][11–15].
Седативное, активирующее и противотревожное действие отобранных наиболее активных соединений изучали на крысах в тесте «открытое поле». Регистрацию спонтанного поведения у каждого отдельного животного осуществляли в течение 5 мин. О наличии седативного и активирующего действия судили по количеству горизонтальных (пересечения квадратов) и вертикальных (подъемы на задние лапы) перемещений.
Анксиолитический эффект препарата оценивали в тесте «приподнятый крестообразный лабиринт» на мышах по увеличению числа заходов в открытые рукава и времени нахождения в них, без увеличения общей двигательной активности. При этом фиксировали время, проведенное в закрытых, открытых рукавах установки, в центре и количество заходов в закрытые рукава установки.
Исследовали также транквилизирующее действие соединений на модели «конфликтная ситуация». Конфликтную ситуацию у крыс создают путем столкновения двух мотиваций – питьевой и оборонительной. О наличии анксиолитического эффекта свидетельствует увеличение взятий воды, несмотря на получение электроболевого раздражения.
Компьютерный анализ / Computer analysis
In silico исследованиe с использованием методов молекулярного докинга и компьютерного анализа проведено с применением различных мишеней. Молекулярные модели исследуемых соединений получены с помощью программного пакета Chem Office (PerkinElmer, США) [17]. Молекулярные модели исследуемых мишеней взяты из базы данных RCSB с идентификационными номерами SERT Transporter, GABAА receptor, 5-HT1А receptor.
Статистический анализ / Statistical analysis
Результаты экспериментов были статистически обработаны путем расчета их эффективных 50% доз (ЭД50), летальных 50% доз (ЛД50) и нейротоксических 50% доз (ТД50). Расчеты данных показателей и доверительных интервалов проводили методом пробит-анализа по Litchfield и Wilcoxon [16]. Количественные данные представлены в виде среднего арифметического и ошибки среднего арифметического (М±m). Пороговым значением, при котором результат признавали статистически значимым, считали значение p≤0,05.
Терапевтический индекс (ТИ) определяли по формуле:
ТИ = ЛД50/ЭД50.
Защитный индекс (ЗИ) рассчитывали по формуле:
ЗИ = ТД50/ ЭД50.
Этические аспекты / Ethical aspects
Исследования проводили согласно правилам Европейской конвенции о защите животных, используемых в экспериментах (Директива 2010/63/EU), уход за животными и их содержание осуществляли в соответствии с рекомендациями руководства по содержанию и использованию лабораторных животных [18].
РЕЗУЛЬТАТЫ / RESULTS
Противосудорожное действие и токсичность / Anticonvulsant effect and toxicity
Как показано в таблице 1, соединения №№ 1, 2, 3, 5 и 6 имеют выраженный антикоразоловый эффект и превосходят функциональные аналоги (пуфемид и этосуксимид) в несколько раз. По остальным судорожным тестам соединения проявляют слабовыраженное действие. Соединение № 4 оказывает выраженное антиэлектрошоковое действие (оно является литиевым производным известного ПЭП фенитоин).
Таблица 1. Антагонизм по коразолу и токсичность
соединений №№ 1–6 и препаратов сравнения
Table 1. The anti-corazole effects and toxicity level
for compounds No. 1–6 and comparators
|
Соединение / препарат // |
ЭД50 (95% ДИ*), мг/кг / |
ЛД50 (95% ДИ*), мг/кг / |
ТД50 (95% ДИ*), мг/кг / |
ТИ / |
ЗИ / |
|
№ 1 / No. 1 |
16 (10,32÷24,8)** |
2300 (2000÷2645)** |
660 (528÷825)** |
143,75 |
41,25 |
|
№ 2 / No. 2 |
35 (28÷43,75)** |
780 (600÷1014)** |
480 (369÷624)** |
22,28 |
13,70 |
|
№ 3 / No. 3 |
21 (11,6÷37,8)** |
1350 (900÷2025)** |
580 (475÷708)** |
64,30 |
27,60 |
|
№ 4 / No. 4 |
25 (16,6÷37,5)*** |
250 (172,4÷362,5)** |
64,5 (43÷96,8)** |
10,00 |
2,60 |
|
№ 5 / No. 5 |
28 (16÷49)** |
1200 (983,6÷1464)** |
785 (628÷981)** |
42,85 |
28,0 |
|
№ 6 / No. 6 |
33 (24,8÷43,8)** |
1250 (1000÷1562,5)** |
620 (504÷762,6)** |
37,88 |
18,79 |
|
Этосуксимид / Ethosuximide |
155 (117,5÷204,5)** |
1325 (1200÷1462)** |
520 (412,6÷655)** |
8,55 |
3,35 |
|
Пуфемид / Pufemide |
86 (58,1÷127,3)** |
2150 (1930÷2390)** |
450 (366÷553,5)** |
25,00 |
5,25 |
|
Диазепам / Diazepam |
0,5 (0,4÷0,7)** |
180 (128,5÷252,0)** |
2,7 (1,4÷5,5)** |
360,00 |
5,40 |
Примечание.ЭД – эффективная доза;
ЛД – летальная доза;
ТД – токсичная доза;
ТИ – терапевтический индекс;
ЗИ – защитный индекс.
* Рассчитаны по методу Литчфильда и Уилкоксона.
** Антагонизм по коразолу/электрошоку, р≤0,05.
*** Соединение № 4 проявляет только антиэлектрошоковое действие.
Note. ED – effective dose;
LD – lethal dose;
TD – toxic dose;
TI – therapeutic index;
PI – protective index.
* Calculated using the Litchfield and Wilcoxon’s method.
** Corazole/electric shock antagonism, p≤0.05.
*** Compound No. 4 exhibits anti-electric shock effect only.
Изученные соединения малотоксичны и имеют высокие ТИ и ЗИ (см. табл. 1). По антикоразоловой активности все они уступают диазепаму, однако диазепам вызывает миорелаксацию в очень низких дозах, в отличие от исследованных соединений, и имеет низкий ЗИ.
Соединение № 1 наиболее активно (ЭД50 = 16 мг/кг) по антагонизму с коразолом. Оно статистически достоверно превосходит этосуксимид в 10 раз и пуфемид в 5 раз. Соединение является наименее токсичным (ЛД50 = 2300 мг/кг) и имеет низкую нейротоксичность (ТД50 = 660 мг/кг). ТИ и ЗИ соединения превосходят этосуксимид в 17 и 13 раз, а пуфемид – в 6 и 8 раз соответственно.
Психотропные свойства / Psychotropic effects
В тесте «открытое поле» (табл. 2) соединение № 1 в дозе 50 мг/кг уменьшает число горизонтальных перемещений животных по сравнению с контрольной группой с 24,2 до 14,2, вертикальных перемещений – с 5,6 до 2,8, a количество обследованных ячеек увеличивается от 0,5 до 3,6. Аналогичный эффект дают соединение № 4 в дозе 25 мг/кг и пуфемид в дозе 200 мг/кг. Все остальные изученные соединения в тех же условиях, что и диазепам, приводят к увеличению количества горизонтальных перемещений и обнюхивания ячеек, а этосуксимид не дает эффекта.
Таблица 2. Исследовательская и анксиолитическая активность соединений №№ 1–6
и препаратов сравнения на моделях «открытое поле» и «конфликтная ситуация»
Table 2. Research and anxiolytic activity of compounds No. 1–6
and comparators in open field and conflict situation models
|
Соединение / препарат // Compound / drug |
Доза, мг/кг // Dose, mg/kg |
Количество за 5 мин, n / Quantity per 5 min, n |
Число взятий воды на модели «конфликтная ситуация», n / Number of water draws in “conflict situation” model, n |
||
|
Горизонтальных перемещений / Horizontal movements |
Вертикальных перемещений / Vertical movements |
Обследованных ячеек / Examined wells |
|||
|
Контроль / Control |
– |
24,2±1,7 |
5,6±2,1 |
0,5±0,4 |
2,5±0,5 |
|
№ 1 / No. 1 |
50 |
14,2±1,2* |
2,8±1,1 |
3,6±0,4* |
14,6±3,0* |
|
№ 2 / No. 2 |
50 |
45,8±7,9* |
7,4±1,5 |
3,4±0,8* |
12,2±3,6* |
|
№ 3 / No. 3 |
50 |
35,6±5,7* |
5,4±2,9 |
4,2±0,3* |
28,6±8,0* |
|
№ 4 / No. 4 |
25 |
13,8±5,2* |
2,4±1,5 |
3,8±0,9* |
15,4±2,6* |
|
№ 5 / No. 5 |
50 |
32,8±4,8* |
5,4±1,0 |
3,0±0,7* |
17,6±2,3* |
|
№ 6 / No. 6 |
50 |
38,6±3,8* |
4,4±0,9 |
3,0±0,8* |
13,5±2,8* |
|
Пуфемид / Pufemide |
200 |
12,0±3,1* |
2,6±0,75 |
1,5±0,3* |
14,1±2,7* |
|
Этосуксимид / Ethosuximide |
300 |
26,8±4,4 |
5,6±1,5 |
0,8±0,3 |
3,4±1,5 |
|
Диазепам / Diazepam |
2 |
43,6±4,2* |
8,4±1,0 |
5,0±1,3* |
9,2±2,1* |
Примечание. * Статистически значимая разница по сравнению с контролем (р≤0,05).
Note. * Significant difference compared with control group (р≤0,05).
Таким образом, изучение исследовательской активности указывает на то, что соединения №№ 1 и 4 вызывают некоторый седативный эффект, уменьшaя двигательную активность животных, в отличие от диазепама и всех остальных соединений (№№ 2, 3, 5, 6), которые оказывают активирующее действие. Одновременно все отобранные соединения, как и диазепам, увеличивают количество обследованных ячеек, что указывает на антитревожное действие веществ. Все отобранные соединения статистически значимо увеличивают число взятий воды, несмотря на электроболевое раздражение, т.е. проявляется анксиолитическое действие. Такой же эффект наблюдается у диазепама и пуфемида, в отличие от этосуксимидa. Число взятий воды на модели «конфликтная ситуация» увеличивается от 2,5 (контроль) до 14,6 в случае соединения № 1. Фактически, как соединение № 1, так и все изученные соединения проявляют транквилизирующее действие.
На экспериментальной модели «приподнятый крестообразный лабиринт» введение соединения № 1 в дозах 50 и 100 мг/кг сопровождается у животных отсутствием эффекта страха (животные достаточно времени проводят в открытых рукавах), в отличие от контроля, где присутствует феномен страха. Соединение № 1 в дозе 100 мг/кг уменьшает время нахождения мышей в темных рукавах от 257 до 5,6 с и увеличивает время в открытых рукавах до 58 с (табл. 3).
Таблица 3. Влияние соединений №№ 1–6 и препаратов сравнения
на модели «приподнятый крестообразный лабиринт» (5 мин исследований)
Table 3. Effects of сompounds No. 1–6 and comparators
on elevated plus-maze model (5 min studies)
|
Соединение / препарат // |
Доза, мг/кг // |
Время нахождения в закрытых рукавах (95% ДИ*), с / |
Число входов в темные рукава (95% ДИ*), n / |
Время нахождения в центре (95% ДИ*), с / |
Время нахождения в открытых рукавах (95% ДИ*), с / |
|
Контроль / Control |
– |
257,4 (224,3÷290,5) |
6,2 (3,0÷9,4) |
42,6 (8,4÷76,8) |
– |
|
№ 1 / No. 1 |
100 |
5,6 (0,6÷10,6)** |
3,0 (2,2÷3,8) |
236,0 (189,0÷295,5) |
58,0 (46,0÷72,5)** |
|
№ 2 / No. 2 |
50 |
58,0 (46,4÷72,5)** |
5,8 (4,6÷7,3 ) |
80,6 (67,2÷96,7) |
36,4 (29,0÷45,5)** |
|
№ 3 / No. 3 |
50 |
133,0 (78,2÷187,8)** |
5,6 (4,6÷6,72) |
79,0 (45,0÷110,8)** |
88,0 (70,0÷110)** |
|
№ 4 / No. 4 |
25 |
200,6 (171,0÷230,3)** |
7,4 (6,7÷8,1) |
80,0 (70,0÷105,9)** |
11,4 (6,0÷16,5)** |
|
№ 5 / No. 5 |
50 |
199,4 (180,8÷218,0)** |
5,0 (2,9÷7,1) |
90,8 (76,0÷105,7) |
9,8 (4,0÷15,5)** |
|
№ 6 / No. 6 |
50 |
233,8 (175,0÷202,3)** |
3,8 (2,8÷4,8) |
44,6 (16,8÷72,0) |
– |
|
Пуфемид / Pufemide |
200 |
272,0 (256,1÷287,8) |
8,6 (3,0÷13,9) |
28,0 (12,1÷43,9) |
– |
|
Этосуксимид / Ethosuximide |
300 |
245,2 (212,9÷277,5) |
8,0 (5,6÷10,6) |
52,8 (19,7÷85,9) |
– |
|
Диазепам / Diazepam |
2 |
200,5 (167,0÷240,6) |
5,5 (2,7÷8,9) |
42,5 (11,2÷73,8) |
57,0 (47,5÷68,0)** |
Примечание. * Рассчитаны по методу Литчфильда и Уилкоксона.
** Статистически значимая разница по сравнению с контролем (р≤0,05).
Note. * Calculated using the Litchfield and Wilcoxon’s method.
** Significant difference compared with control group (р≤0,05).
Число входов в темные рукава не меняется по сравнению с контролем после введения этосуксимидa, пуфемида, диазепама. Соединение № 1 в дозах 50 и 100 мг/кг уменьшает число входов в темные рукава, увеличивает время нахождения в центре. Это может свидетельствовать о появлении некой защитной реакции «против страха и безысходности». Аналогичная картина наблюдается и с препаратами №№ 2, 3, 5, 6 в дозе 50 мг/кг, № 4 в дозе 25 мг/кг и у диазепама в дозе 2 мг/кг. Пуфемид и этосуксимид не обладают таким свойством. Время нахождения в открытых рукавах указывает, что все отобранные соединения обладают анксиолитическим действием, которое особенно выражено у соединения № 3 (88 с).
Докинг-исследование / Docking research
Исходя из полученных результатов исследований указанных нейротропных препаратов, молекулярный докинг был проведен с применением различных мишеней (GABAA, 5-HT1А и SERT) с наиболее активным соединением № 1 (N3212).
Соединение N3212, по сути, взаимодействует со всеми исследуемыми мишенями, но при этом является уникальным для SERT и 5-HT1А, в основном проявляя избирательный характер взаимодействия. С SERT наблюдаются как гидрофобные, так и электростатические типы связей, что может привести к стабильному комплексообразованию. Необходимо отметить, что водородных связей при построении конформационных карт не обнаружено. Наблюдается также образование сульфидного мостика с Phe341, который является одним из ключевых аминокислотных остатков активного центра SERT (рис. 1).
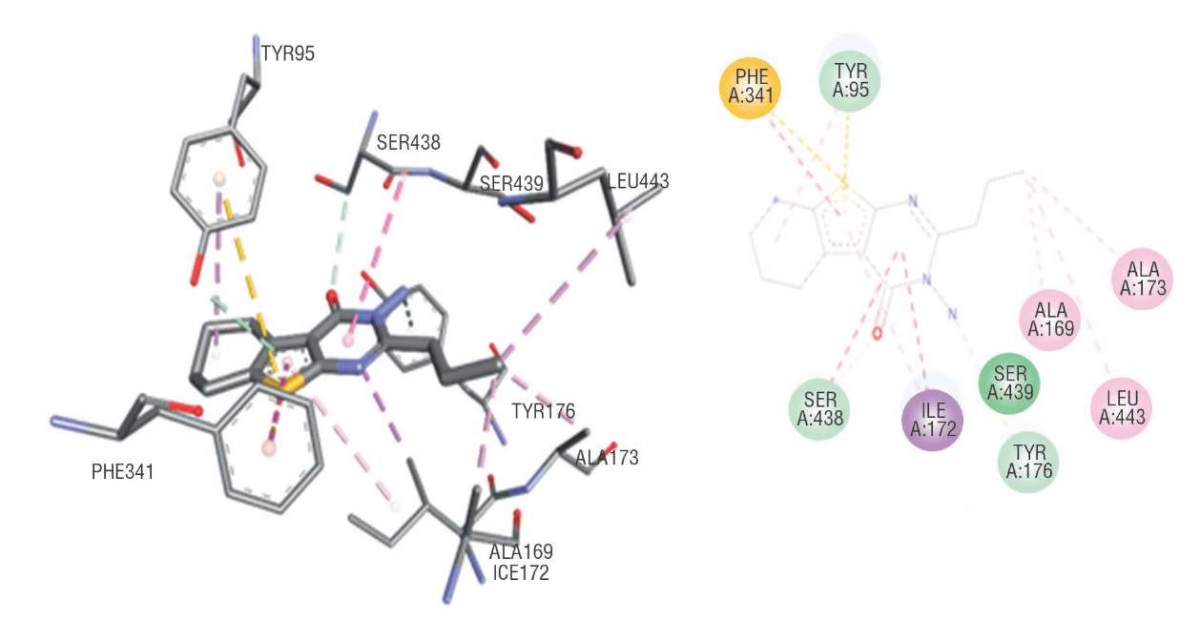
Рисунок 1. Комплексообразование и конформационная карта
соединения N3212 с транспортером серотонина
Figure 1. Complexation and conformational map
between Compound N3212 and serotonin transporter
На рисунке 2 представлены результаты комплекса соединения N3212 с 5-HT1А, где визуализируются в основном гидрофобные взаимодействия. Что касается водородной связи, то рассчитанная дистанция связи является максимальной, для верификации данной связи необходимы дополнительные исследования.
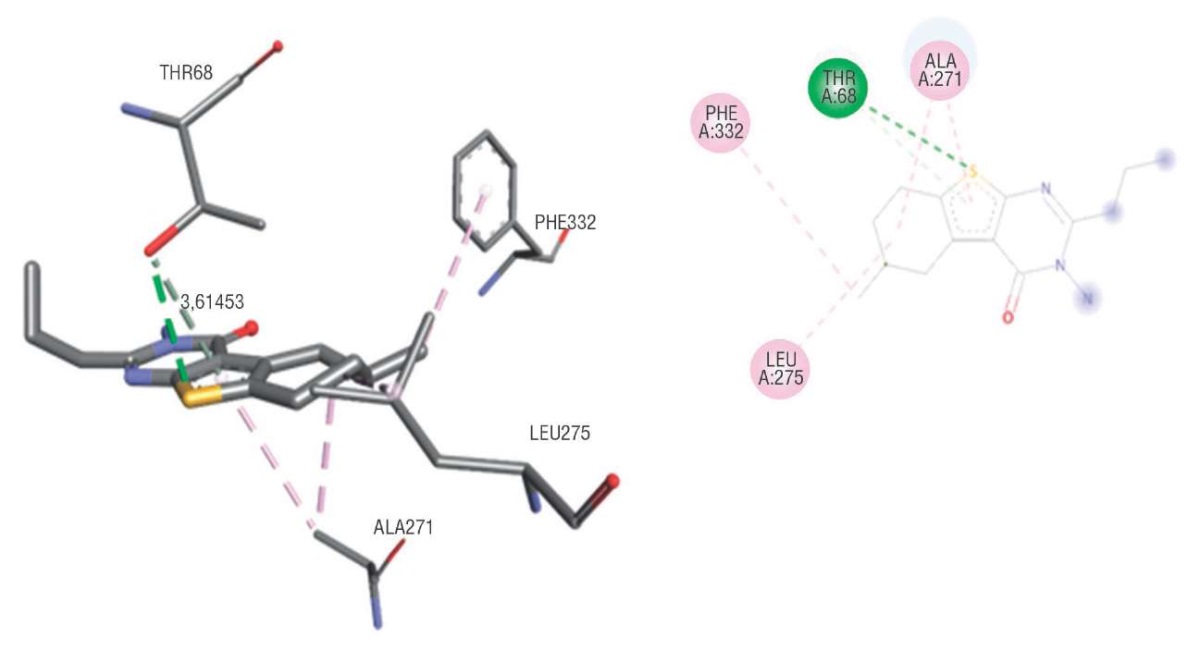
Рисунок 2. Комплексообразование и конформационная карта
соединения N3212 с рецептором 5-HT1А
Figure 2. Complexation and conformational map
between Compound N3212 and 5-HT1А receptor
Таким образом, можно констатировать, что соединение N3212 взаимодействует с рецепторами 5-HT1А, SERT и GABAА, что указывает на совпадение in silico исследований с результатами in vivo исследований.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Выявлены новые соединения, синтезированные в ГНКО «Научно-технологический центр органической и фармацевтической химии» НАН РА и обладающие противосудорожным, анксиолитическим, психоседативным или активирующим действием одновременно. Отобранные соединения по многим исследованным показателям превосходят некоторые применяемые в медицинской практике психотропные препараты и перспективны для дальнейшего изучения и последующего внедрения в качестве ПЭП с психотропными свойствами.
На основе полученных пространственно-энергетических значений и конформационных карт соединения N3212 определено, что оно взаимодействует с рецепторами SERT, 5-HT1А и GABAА, что указывает на совпадение in silico исследований с результатами in vivo исследований.
Список литературы
1. Авакян Г.Н. Современная эпилептология. Проблемы и решения. Эпилепсия и пароксизмальные состояния. 2014; 6 (4): 46–9.
2. Пароникян Р.Г. Новые производные пиримидина с противосудорожными и психотропными свойствами. Эпилепсия и пароксизмальные состояния. 2017; 9 (3): 40–6. https://doi.org/10.17749/2077-8333.2017.9.3.040-046.
3. Пароникян Р.Г., Авагян М.Н., Арутюнян А.А. и др. Экспериментальное изучение противосудорожных и психотропных свойств пуфемида, пиратидина и соединения N3212 в сравнении с известными противоэпилептическими препаратами. Эпилепсия и пароксизмальные состояния. 2019; 11 (3): 244–54. https://doi.org/10.17749/2077-8333.2019.11.3.244-254.
4. Treiman D.M. GABAergic mechanisms in epilepsy. Epilepsia. 2001; 42 (Suppl. 3): 8–12. https://doi.org/10.1046/j.1528-1157.2001.042suppl.3008.x.
5. Svob Strac D., Pivac N., Smolders I.J., et al. Monoaminergic mechanisms in epilepsy may offer innovative therapeutic opportunity for monoaminergic multi-target drugs. Front Neurosci. 2016; 10: 492. https://doi.org/10.3389/fnins.2016.00492.
6. Vogel H.G. Psychotropic and neurotropic activity. In: Vogel H.G. (Ed.) Drug discovery and evaluation: pharmacological assays. 3rd ed. Springer; 2008: 565–876.
7. Бунятян Н.Д., Васильев А.Н., Верстакова О.Л. и др. (ред.) Руководство по проведению доклинических исследований лекарственных средств. М.: Гриф и К; 2012; 235–50.
8. Purpura D.P., Penry J.K. Experimental models of epilepsy – a manual for the laboratory worker. 1st ed. New-York: Raven Press; 1972: 615 pp.
9. Yuen E., Trocóniz I. Can pentylenetetrazole and maximal electroshock rodent seizure models quantitatively predict antiepileptic efficacy in humans? Seizure. 2015; 24: 21–7. https://doi.org/10.1016/j.seizure.2014.11.006.
10. File S.E. Factors controlling measures of anxiety and responses to novelty in the mouse. Behav Brain Res. 2001; 125 (1-2): 151–7. https://doi.org/10.1016/s0166-4328(01)00292-3.
11. Crawley J.N. Neuropharmacologic specificity of a simple animal model for the behavioral actions of benzodiazepines. Pharmacol Biochem Behav. 1981; 15 (5): 695–9. https://doi.org/10.1016/0091-3057(81)90007-1.
12. Stanford S.C. The open field test: reinventing the wheel. J Psycopharmacol. 2007; 21 (2): 134–5. https://doi.org/10.1177/0269881107073199.
13. Pelow S., File S.E. Anxiolytic and anxiogenic drug effects on exploratory activity in an elevated plus-maze: a novel test of anxiety in the rat. Pharmacol Biochem Behav. 1986; 24 (3): 525–9. https://doi.org/10.1016/0091-3057(86)90552-6.
14. Dunham N.W., Miya T.S. A note on a simple apparatus for detecting neurological deficitin rats and mice. J Am Pharm Assoc. 1957; 46 (3): 208–9. https://doi.org/10.1002/jps.3030460322.
15. Машковский М.Д. Лекарственные средства. М.: Новая волна; 2020: 1216 c.
16. Беленький М.Л. Элементы количественной оценки фармакологического эффекта. Л.: Медгиз; 1963: 152 с.
17. Baidya A.T.K., Ghosh K., Amin S.A., et al. In silico modelling, identification of crucial molecular fingerprints, and prediction of new possible substrates of human organic cationic transporters 1 and 2. New J Chem. 2020; 44 (10): 4129–43. https://doi.org/10.1039/C9NJ05825G.
18. Гарбер Д.С., Барби Р.В., Билицки Д.T. и др. Руководство по содержанию и использованию лабораторных животных. 8-е изд. М.: Ирбис; 2017: 304 с.
Об авторах
Р. Г. ПароникянАрмения
Пароникян Рузанна Гарниковна – д.б.н., доцент, ведущий научный сотрудник Института тонкой органической химии
Scopus Author ID: 6507514418
пр-т Азатутян, д. 26, Ереван 0014
Г. Г. Авакян
Россия
Авакян Георгий Гагикович – д.м.н., доцент кафедры неврологии, нейрохирургии и медицинской генетики медицинского факультета
Scopus Author ID: 35794841000
ул. Островитянова, д. 1, стр. 7, Москва 117513
В. Н. Авакян
Россия
Авакян Ваган Мкртичевич
ул. Акопа Акопяна, д. 3/15, Ереван 0054
Е. Г. Пароникян
Армения
Пароникян Ерванд Гарникович – д.х.н., профессор, заведующий лабораторией синтеза психотропных соединений Института тонкой органической химии
Scopus Author ID: 6508362250.
пр-т Азатутян, д. 26, Ереван 0014
Рецензия
Для цитирования:
Пароникян Р.Г., Авакян Г.Г., Авакян В.Н., Пароникян Е.Г. Изучение нейротропных свойств новых противоэпилептических азотсодержащих препаратов. Эпилепсия и пароксизмальные состояния. 2023;15(4):318-325. https://doi.org/10.17749/2077-8333/epi.par.con.2023.174
For citation:
Paronikyan R.G., Avakyan G.G., Avakyan V.N., Paronikyan E.G. Assessing neurotropic effects of new antiepileptic nitrogen-containing drugs. Epilepsy and paroxysmal conditions. 2023;15(4):318-325. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2023.174

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































