Перейти к:
Новый подход к пространственной локализации электрической активности по данным ЭЭГ
https://doi.org/10.17749/2077-8333/epi.par.con.2023.177
Аннотация
Актуальность. Проблема точности и надежности методов пространственной локализации мозговой активности по данным электроэнцефалографии (ЭЭГ) не теряет своей актуальности. Существующие методы локализации сопряжены с определенными трудностями в связи с неоднозначностью получаемого решения.
Цель: верификация нового метода локализации мозговой активности по данным ЭЭГ «Виртуально вживленный электрод» и демонстрация его возможностей.
Материал и методы. Верификация нового метода проведена на основе данных глубокой стимуляции мозга (ГСМ). Использованы данные скальповой электрической активности, которая индуцирована исключительно потенциалами отдвух вживленных в глубокие области мозга человека электродов, что достигалось фильтрацией сигналов ЭЭГ на частоте стимуляции и исключало сигналы от других областей мозга. Представлен также клинический пример применения нового метода для анализа ЭЭГ пациента с пароксизмальной активностью.
Результаты. Метод «Виртуально вживленный электрод» позволяет достаточно точно определить локализацию источников тока ГСМ. Продемонстрирована эффективность применения метода для анализа механизмов пароксизмальной активности – по изменению потенциалов, рассчитанных в 33 точках мозга (мозговых структурах), выделено три группы структур, дающих свой специфический вклад в развитие пароксизмальной активности. Для сравнения проведена локализация этих же искусственных источников ГСМ другими известными способами – программами BrainLoc (Россия) и sLORETA (Швейцария), которые дали значительно худший результат.
Заключение. Решение пространственной локализации электрических потенциалов, регистрируемых на поверхности скальпа, на основе нового подхода с помощью метода «Виртуально вживленный электрод» показывает высокую эффективность и надежность, демонстрируя явное преимущество перед другими известными методами локализации.
Ключевые слова
Для цитирования:
Вартанов А.В. Новый подход к пространственной локализации электрической активности по данным ЭЭГ. Эпилепсия и пароксизмальные состояния. 2023;15(4):326-338. https://doi.org/10.17749/2077-8333/epi.par.con.2023.177
For citation:
Vartanov А.V. A new approach to spatial localization of EEG-based electrical activity. Epilepsy and paroxysmal conditions. 2023;15(4):326-338. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2023.177
ВВЕДЕНИЕ / INTRODUCTION
Одним из наиболее известных и практически доступных методов исследования мозга как в целях медицинской диагностики, так и в качестве инструмента научного исследования по праву является электроэнцефалография (ЭЭГ). По ряду причин этот метод имеет определенное преимущество даже перед таким современным методом, как функциональная магнитно-резонансная томография (МРТ): это его высокое разрешение по времени (порядка миллисекунд в сравнении с секундами или даже десятками секунд при функциональной МРТ), простота и относительная дешевизна использования.
Уже начиная с 1990-х гг. в связи с развитием компьютерной техники постоянно появляются различные методы компьютерной обработки и анализа ЭЭГ-сигналов [1]. Для целей исследования высших когнитивных функций или заболеваний головного мозга с помощью ЭЭГ часто необходима пространственная локализация изменений потенциалов [2–4]. Это наиболее актуально при выявлении механизмов развития судорожных приступов.
Однако возникает проблема точности и надежности получаемого решения, поскольку сигналы от глубинных структур мозга на скальповых электродах смешиваются (суммируются с разными весами), в результате чего очень трудно определить, активность какой именно мозговой структуры мы наблюдаем. Такое пространственное смешение электрических потенциалов определяется исключительно геометрией расположения локусов мозга (генераторов электропотенциалов) и не связано с их ролью в распределенном информационном анализе. Данная проблема усугубляется еще и тем, что нет полного согласия в отношении модели и источников генерации электропотенциалов, регистрируемых на поверхности скальпа. Некоторые старые, но стойкие стереотипы утверждают, что на поверхности скальпа вообще не может отражаться активность глубинных структур. Однако это опровергается экспериментально: на основе регистрации подкорковой активности с помощью электродов глубокой стимуляции мозга (ГСМ) с одновременной записью скальповой ЭЭГ представлены прямые доказательства того, что ЭЭГ скальпа действительно может воспринимать подкорковые сигналы [5].
К настоящему времени разработано достаточно много различных алгоритмов поиска источников – генераторов электрических потенциалов внутри головы по данным скальповой ЭЭГ [1], однако все они страдают от общей проблемы неопределенности получаемого решения. Типичный естественнонаучный подход к задаче локализации мозговой активности заключается в разработке теоретической модели и подборе соответствующих параметров для наилучшей (с точки зрения заданного критерия) аппроксимации всего имеющегося массива ЭЭГ-данных. В качестве общепринятой модели до настоящего времени используется так называемая дипольная модель, предполагающая в качестве источников ЭЭГ возникновение токового диполя в связи с появлением постсинаптических потенциалов на дендритах пирамидных нейронов. Это определяет и закон распространения потенциала до скальповых электродов – в указанной модели обычно используются уравнения Максвелла, а заряд ослабевает обратно квадратически от расстояния. Кроме того, для полной аппроксимации данных критически важной оказывается проблема оценки числа дипольных источников, одновременно учитываемых в модели, поскольку результаты определяются суммированием потенциалов от всех источников.
Невозможность полного и однозначного решения при таком подходе обусловлена тем, что количество неизвестных параметров модели (для значительного числа источников) всегда превышает количество известных уравнений – числа сенсоров ЭЭГ-сигналов, которые вообще возможно разместить на голове человека. Поэтому всегда имеется множество равноэффективных решений и часто обнаруживаются ложные (с точки зрения физиологии) источники, которые, тем не менее, хорошо описывают наблюдаемые на скальповых электродах потенциалы. Иными словами, для любой записи ЭЭГ всегда найдется несколько (бесконечное множество) формальных решений, и определить предпочтение внутри них по степени «правильности» некоторого решения на основании используемых формальных критериев невозможно, поскольку все они одинаковы.
При этом и теоретическая модель в виде эквивалентного токового диполя также оказывается не адекватна низкочастотной (обычно до 32 Гц) ЭЭГ, которая в подавляющем большинстве случаев применяется на практике. Данная общепринятая модель источника генерации электропотенциалов применима, в первую очередь, к локализации гамма-ритма ЭЭГ, который регистрируется в частотной полосе выше 32 Гц. Это можно легко объяснить тем, что период типичных постсинаптических потенциалов (возбуждающих или тормозных) составляет порядка 10–20 мс, или 50–100 Гц, а такая частота отсекается фильтрами энцефалографа.
Согласно ряду работ Е.Л. Машерова ([6][7] и информация из личной коммуникации с автором), источниками низкочастотной ЭЭГ ни в каком виде (ни при случайном, ни при синхронизированном приходе) не могут быть постсинаптические потенциалы. Источником низкочастотной ЭЭГ, скорее всего, являются следовые потенциалы, связанные с восстановлением мембранного потенциала покоя нейрона при активном транспорте ионов после генерации потенциалов действия. С помощью вычислительной симуляции Е.Л. Машеров продемонстрировал, что случайная суммация таких потенциалов (период которых в среднем составляет 100 мс, или 10 Гц, но может меняться при изменении функционального состояния нейрона) способна демонстрировать ЭЭГ-подобную активность с характерными веретенами альфа-ритма. Для расчета локализации таких источников больше подходит модель объемного ненаправленного пространственного заряда – униполярная модель [7]. В связи с этим и закон распространения электромагнитного поля, сформулированный в уравнениях Максвелла, корректно применять только для дипольной модели, т.е. для гамма-ритма, а при расчетах локализации низкочастотной ЭЭГ более адекватно использовать закон линейного ослабления потенциала (падения напряжения, рассчитываемого на основе закона Ома).
Основная идея нового подхода к задаче локализации базируется на отказе от цели полной аппроксимации всего массива экспериментальных данных ЭЭГ и предложении применить метод фильтрации: убрать «ненужные», но оставить «нужные» сигналы. При этом используется пространственная фильтрация, когда фильтр настроен не на динамические параметры сигнала (частоту и т.п.), а на пространственное положение источника. Акцент делается не на теоретическом расчете абсолютного сигнала, а на выявлении динамики изменения сигнала ЭЭГ с помощью процедуры факторного анализа. Такую новую технологию можно назвать «Виртуально вживленный электрод», поскольку она позволяет реконструировать электрическую активность в области интереса внутри головы, которая задана пространственными координатами по данным низкочастотной скальповой ЭЭГ1 (способ подробно описан в работе [8]). Метод предполагает в качестве источника ЭЭГ следовые потенциалы и другую функцию убывания потенциала – линейную. Результат можно рассматривать в качестве аналога потенциала локального поля.
На рисунке 1 представлена общая идея метода на примере ненаправленного источника звука, расположенного в некоторой точке пространства (точке интереса), по краям которой (в данном примере по кругу) расположены сенсоры (микрофоны). Если функцию изменения объемного заряда задать в точке интереса, то, зная расстояния от нее до каждого из сенсоров и приняв условие линейного ослабления сигнала, всегда можно рассчитать, какой амплитуды будет сигнал на сенсорах. Поскольку метод применяется не для звукового источника, а для электрического потенциала (распространяющегося со скоростью света в небольшом пространстве головы человека), ясно, что сигнал попадет на все сенсоры одновременно. Поэтому сигналы на сенсорах будут высококоррелированны, т.е. описываться одним общим фактором. Таким образом, всегда можно сгенерировать ЭЭГ-подобный сигнал, отличающийся по амплитуде на системе сенсоров в соответствии с паттерном расстояний от точки интереса до этих сенсоров. Такой паттерн будет уникален для каждой точки пространства. Факторный анализ имеет дело с нормированными данными, поэтому с целью отображения в факторных нагрузках общего фактора амплитуды нашего сигнала необходимо добавить к сигналам на каждом из сенсоров свои дополнительные (характерные) сигналы равной амплитуды, но которые не коррелируют друг с другом и с основным сигналом в точке интереса. В результате применение факторного анализа к такому сгенерированному массиву позволит получить один общий фактор, нагрузки на который обратно пропорциональны расстояниям из точки интереса до сенсоров. Далее предлагается объединить массив сгенерированных данных и массив экспериментальной ЭЭГ и провести факторный анализ этого общего массива. Очевидно, что всегда будет существовать один общий фактор, который в результате вращения полученной факторной структуры может быть однозначно и точно ориентирован на тот единственный фактор, который уже присутствует в искусственно сгенерированном массиве данных. После этого всегда можно рассчитать факторные значения отдельно для данного фактора для случаев экспериментальной ЭЭГ.

Рисунок 1. Общая схема получения решения за счет пространственной фильтрации.
ЭЭГ – электроэнцефалография
Figure 1. General scheme for constructing spatial filtering-based picture.
EEG – electroencephalography
В результате новый метод позволяет получать однозначное и надежное решение даже для ЭЭГ с небольшим числом отведений, поскольку выявляется только один источник. При этом вероятность получения ложных решений очень мала, поскольку, например, даже при полном отсутствии сигнала в области интереса все равно будет получено единственное решение, но с сигналом в этой точке, близким к нулю. Такой способ можно применять неограниченное число раз к одним и тем же ЭЭГ-данным. Это можно использовать для эффективной «очистки» искомого сигнала за счет вычитания активности окружающих точек (которая независимо оценена). Таким образом, предлагаемый новый способ локализации мозговой активности может эффективно применяться в качестве инструмента в научных исследованиях нейрокогнитивного функционирования человека в норме и при различных заболеваниях, в частности для исследования механизмов развития пароксизмального состояния.
Цель – верификация нового метода локализации мозговой активности по данным ЭЭГ «Виртуально вживленный электрод» и демонстрация его возможностей.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Верификация метода по данным ГСМ /
Method verification based on deep brain stimulation data
Как и любой новый метод, «Виртуально вживленный электрод» нуждается в экспериментальной верификации. Одним из общепринятых способов верификации может быть проверка точности работы метода на материале ЭЭГ, зарегистрированной у лиц с вживленными электродами для ГСМ [2].
Как известно, ГСМ заняла прочное место в алгоритмах лечения болезни Паркинсона и дистонии, однако ее также с успехом используют при лечении тяжелого, медикаментозно-резистентного синдрома Туретта (СТ) [9]. Синдром Туретта – это прогрессирующее заболевание экстрапирамидной системы, характеризующееся разнообразными по продолжительности и течению моторными и вокальными тиками, а также коморбидными когнитивными и поведенческими нарушениями: синдромом дефицита внимания с гиперактивностью, тревожными и обсессивно-компульсивными расстройствами.
Для верификации нового метода локализации была зарегистрирована ЭЭГ пациента, которому за год до этого при лечении тяжелого, медикаментозно-резистентного СТ в ФГБНУ «Научный центр неврологии» была выполнена МРТ-направленная двусторонняя имплантация электродов для ГСМ в постеровентральную область GPi [8][10].
Электрическая стимуляция через такие вживленные электроды в чистом виде находит свое отражение в ЭЭГ, отфильтрованной в полосе стимуляции, что исключает влияние других электрических источников. Это открывает возможность наиболее экологичной (по сравнению с физическим фантомом) проверки эффективности различных алгоритмов локализации источников. Для этого полученные ЭЭГ-подобные данные были обработаны несколькими программными средствами, включая новый метод «Виртуально вживленный электрод», программное обеспечение BrainLoc 6.0 (BrainLoc – 3D Dipole Localization Software, Россия) и алгоритм sLORETA (Швейцария) в пакете Brainstorm [1].
Пациент / Patient
Данные испытуемого описаны в работе [9] (случай 4 из серии клинических наблюдений) следующим образом:
«Больной 31 года, поступил в Научный центр неврологии с жалобами на непроизвольное произнесение однотипных звуков, сопровождающееся резкими поворотами туловища и головы вправо. Со слов родителей, в возрасте 5 лет у пациента появилось непроизвольное моргание. В возрасте 7 лет присоединились непроизвольные повороты головы и вокальные тики, в том числе копролалия, которые усиливались при эмоциональном напряжении и усталости. В это время был диагностирован СТ, пациент принимал галоперидол, этаперазин, хлорпротиксен. До 12-летнего возраста состояние больного оставалось стабильным, затем моторные и вокальные тики стали нарастать, продолжал прием нейролептиков. В последнее время выраженность гиперкинезов варьировала в разные дни. Учитывая недостаточную эффективность нейролептической терапии и затруднения в социальной жизни и профессиональной деятельности, в плановом порядке было проведено оперативное лечение – имплантация электродов для ГСМ в область GPi с двух сторон» [9].
Локализация электродов ГСМ /
Localization of deep brain stimulation electrodes
Процедура имплантирования описана в исследовании В.М. Тюрникова и др. [9] следующим образом:
«Накануне операции пациенту проводилась высокопольная МРТ головного мозга (1,5 Тл). По данным МРТ на планирующей станции Radionics с использованием стереотаксического атласа Schaltenbrand и Wahren осуществлялись стереотаксические расчеты точки-цели (постеровентральная часть бледного шара – GPi). Средние параметры координат мишени для стимуляции постеровентральной части GPi: кпереди на 2 мм от середины линии, соединяющей переднюю и заднюю комиссуры; латерально от средней линии на 20–23 мм; ниже межкомиссуральной линии на 4–5 мм» (рис. 2).
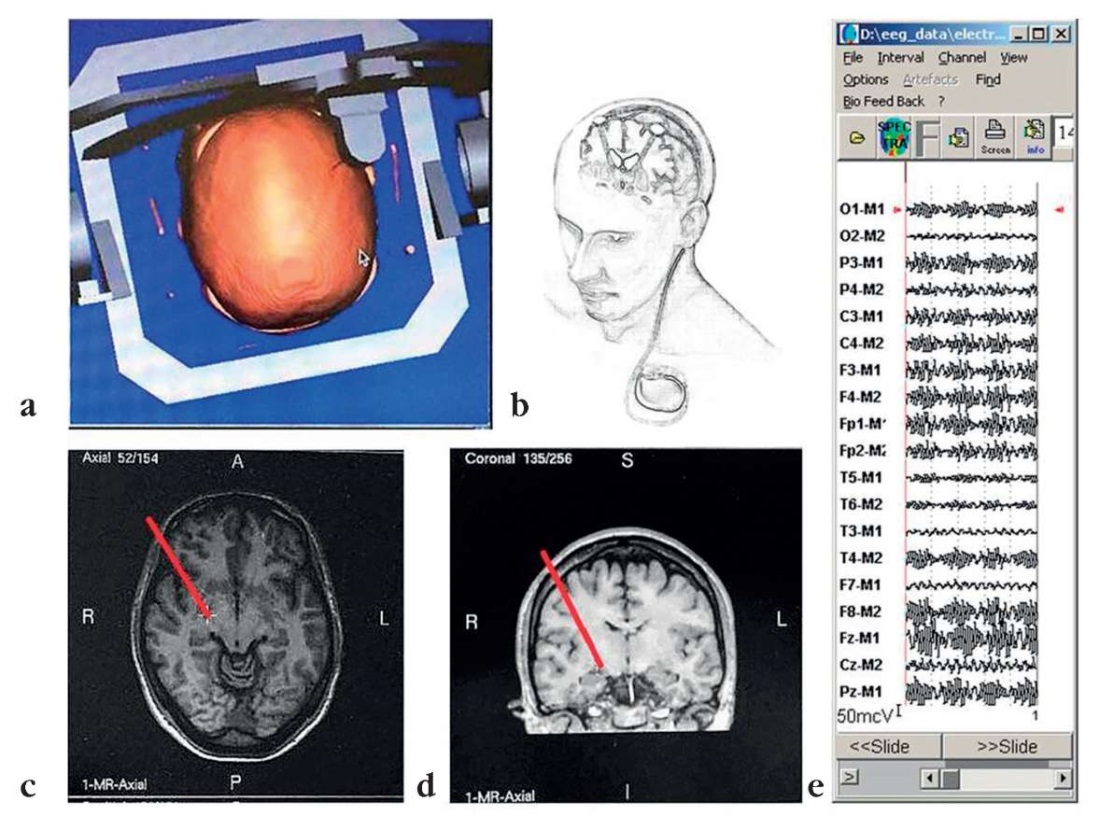
Рисунок 2. Имплантация электродов для глубокой стимуляции мозга:
а – место-цель имплантации;
b – общая схема вживления стимулирующих электродов (составлено автором);
c, d – на магнитно-резонансном томографическом изображении мозга
показана точка-цель одного из вживленных электродов (стрелки),
цель второго выбиралась симметрично
(данные любезно предоставлены В.М. Тюрниковым);
e – отфильтрованный в диапазоне 90–200 Гц
(т.е. выделена только частота стимуляции 180 Гц)
фрагмент зарегистрированной электроэнцефалограммы (данные получены автором)
Figure 2. Implantation of electrodes for deep brain stimulation:
a – place-target of implantation;
b – general scheme for implantation of stimulating electrodes (compiled by the author);
c, d – brain magnetic resonance imaging shows
the target site for one of the implanted electrodes (arrows),
the target of the second site was selected symmetrically
(data kindly provided by V.M. Tyurnikov);
e – fragment of the recorded electroencephalogram
filtered within the range of 90–200 Hz
(i.e., only the stimulation frequency of 180 Hz is highlighted)
(data obtained by the author)
«В день операции под местной анестезией после установки на голове больного базового кольца стереотаксической рамы CRW c локалайзером проводилась КТ или МРТ головы ... Имплантация электродов для ГСМ проводилась через фрезевые отверстия диаметром 10 мм, которые накладывались на расстоянии 4 см от средней линии и 12,5 см от назиона. Перед имплантацией электродов в точку-цель пациентам проводилась микроэлектродная регистрация (МЭР) при помощи аппарата ISIS (Inomed, Германия). Необходимость осуществления МЭР связана с анатомической и физиологической вариабельностью подкорковых структур головного мозга. Для проведения МЭР обычно использовалось 3 микроэлектрода. Помимо МЭР выполнялась также микростимуляция установленными микроэлектродами. После проведения микростимуляции самый эффективный микроэлектрод заменялся на электрод для постоянной ГСМ и проводилась макростимуляция. При макростимуляции через электрод для ГСМ моделировался клинический эффект, ожидаемый во время постоянной нейромодуляции, что позволяет правильно позиционировать электрод для окончательной установки в точку-цель. При отсутствии побочных эффектов и хорошем ответе на стимуляцию электрод фиксировался во фрезевом отверстии при помощи специальной заглушки. При появлении моторных, зрительных, психических, речевых нарушений приходилось находить альтернативную точку-цель. После операции положение имплантированных электродов контролировали при помощи КТ. Через 2–3 дня после имплантации электродов следовал II этап – операция имплантации генератора в подключичную область и соединение генератора с дистальными концами электродов посредством коннекторов. Через 1 неделю после операции подбирали параметры стимуляции имплантированного генератора» [9].
Параметры стимуляции / Stimulation parameters
Параметры ГСМ для случая 4 из серии клинических наблюдений описаны в работе [9] следующим образом.
Исходно установленные параметры монополярной стимуляции: справа – напряжение 2,5 В, ширина импульса 90 мс, частота 180 Гц; слева – напряжение 3,8 В, ширина импульса 90 мс, частота 180 Гц. После начала стимуляции состояние больного улучшилось, уменьшились частота и выраженность моторных и вокальных тиков по шкале YGTSS2 на 20%. Таким образом, результаты оперативного лечения были положительными: тики по шкале YGTSS уменьшились на 20–85% (в среднем на 37,5%), значимых осложнений не наблюдалось.
Методика ЭЭГ-регистрации / EEG registration technique
Регистрация ЭЭГ осуществлялась стандартно в 19 монополярных отведениях (электроды располагались в соответствии с международной системой «10–20%») на электроэнцефалографе «Нейро-КМ» («Статокин», Россия) с вводом в компьютер. Для первичной обработки и анализа ЭЭГ использовалась система программ Brainsys (Россия).
Поскольку стимуляция проводилась на высокой частоте (180 Гц), полученная фоновая ЭЭГ фильтровалась в диапазоне 90–200 Гц с целью убрать любую мозговую активность и оставить только потенциалы, получаемые со стимулирующих электродов (см. рис. 2). Регистрация ЭЭГ проводилась через 1 год после вживления электродов, поэтому точные амплитудные параметры регистрируемых сигналов в точках вживления могли отличаться от первоначально заявленных (справа 2,5 В, слева 3,8 В) в связи с неизвестным сопротивлением тканей, окружающих электроды.
Задание областей интереса для локализации /
Setting regions of interest for localization
Для оценки точности и эффективности работы алгоритма в соответствии с вышеописанным методом выявления электрической активности внутри головы в качестве точек интереса были выбраны 855 точек в окрестности бледного шара (globus pallidus medialis) справа и слева. Координаты центров в системе координат ЭЭГ «10–20%»: X = 1,5 см; Y = –1,0 см (слева) или Y = 1,0 см (справа); Z = 2,9 см. Окружающие точки выбраны с равным шагом в диапазоне X от –2,5 до 4,5 см; Y от –2,0 до 2,0 см; Z от 1,5 до 3,5 см.
Ясно, что любой алгоритм фильтрации (даже при включении механизма очистки) имеет ограниченную точность, т.е. невозможно добиться 100% отделения сигнала в данной точке от сигналов, генерируемых в соседних точках. Однако амплитуда восстанавливаемого сигнала будет больше в точке его непосредственной генерации по сравнению с другими точками. Это позволяет оценить эффективность работы предлагаемого метода посредством выявления координат максимума реконструируемых сигналов в трехмерном пространстве мозга с последующим сопоставлением положения выявленных максимумов сигнала с априорно известной информацией о локализации вживленных стимулирующих электродов.
РЕЗУЛЬТАТЫ / RESULTS
Реконструкция методом «Виртуально вживленный электрод» /
Reconstruction using the “Virtually Implanted Electrode” method
В результате работы алгоритма проведена реконструкция сигналов, истинным источником которых были два стимулирующих электрода, для всех вышеуказанных точек интереса и получена карта пространственного распределения амплитуды восстановленного сигнала. На рисунке 3 показаны максимумы амплитуды выявленных в результате пространственной фильтрации сигналов и локализация двух максимумов, спроецированных на МРТ мозга данного человека.
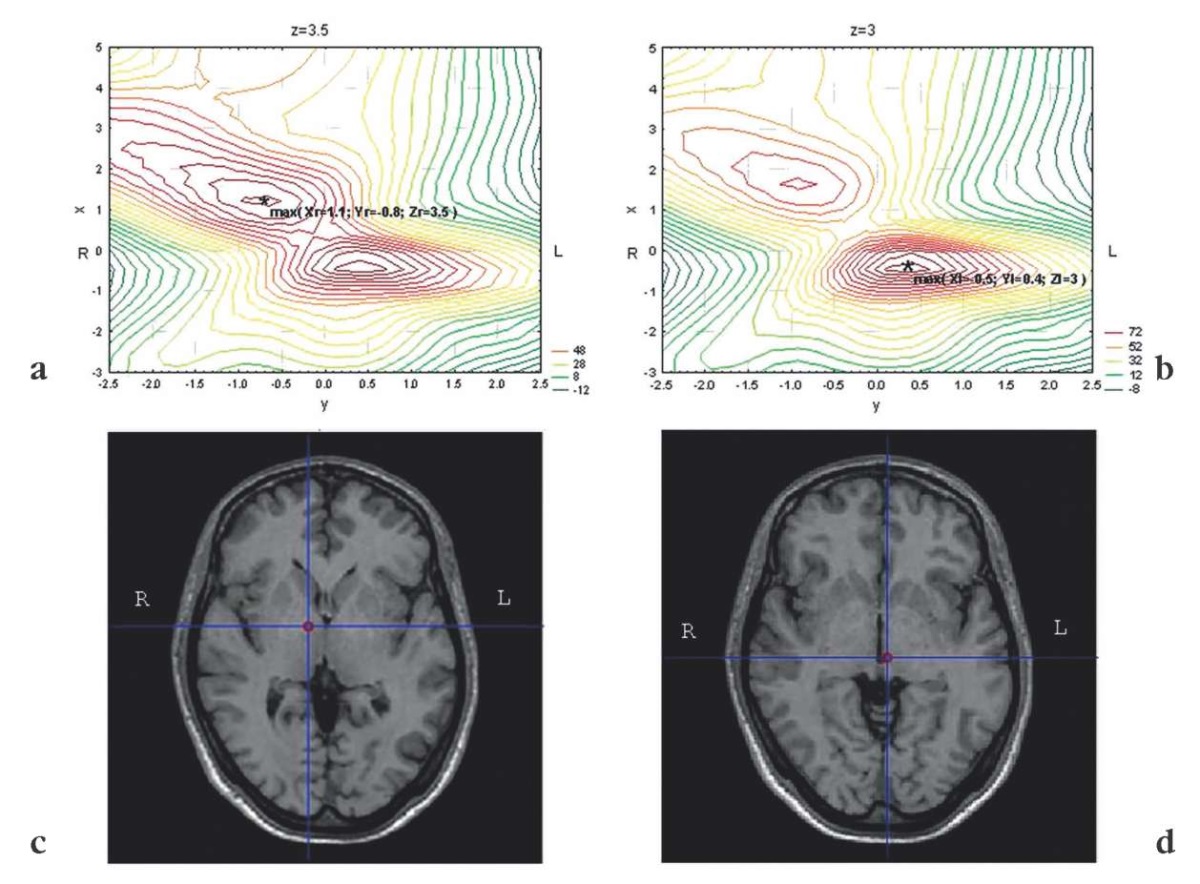
Рисунок 3. Результаты применения нового метода
в задаче выявления локализации источников электрической стимуляции
с помощью двух электродов глубокой стимуляции мозга:
а, b – максимумы амплитуды выявленного
в результате пространственной фильтрации сигнала
от правого, с более низким исходным напряжением (а),
и левого (b) вживленных стимулирующих электродов,
изолинии в плоскости x–y для заданного уровня по оси z;
с, d – положение точки-максимума
выявляемого пространственной фильтрацией сигнала
на магнитно-резонансной томограмме мозга данного человека
в аксиальной проекции
Figure 3. Results of the new method
on identifying the localization of sources of electrical stimulation
using two deep brain stimulation electrodes:
a, b – maxima of the amplitude of the signal detected due to spatial filtering
from the right, with a lower initial voltage (a),
and left (b) implanted stimulating electrodes,
isolines in x–y plane for a level set along z axis;
c, d – position of the maximum site for signal detected by spatial filtering
on brain magnetic resonance imaging scan for the patient in the axial projection
Таким образом, выявлено, что максимум сигнала от правого электрода локализуется (с точностью до 0,5 см) в координатах Xr = 1,1 см, Yr = –0,8 см, Zr = 3,5 см, а для левого – Xl = –0,5 см, Yl = 0,4 см, Zl = 3,0 см (координаты даны в системе координат ЭЭГ «10–20%»). Визуальный анализ исходной и выявленной локализаций стимулирующих электродов демонстрирует достаточно хорошее совпадение, что доказывает работоспособность обсуждаемого нового метода локализации «Виртуально вживленный электрод».
Сопоставление с результатами локализации другими программами /
Comparison with results of localization by other programs
Данный пример с целью сопоставления эффективности работы нового метода с другими алгоритмами локализации был обработан двумя различными способами на основе дипольной модели с подвижными источниками с помощью BrainLoc 6.0, а также алгоритма sLORETA в пакете Brainstorm [1].
На рисунке 4 представлен результат локализации на основе модели с одним подвижным источником. Только в некоторых случаях диполь попадает близко к месту более высокоамплитудной стимуляции от левого электрода, а бо́льшая часть диполей демонстрирует ложную локализацию.
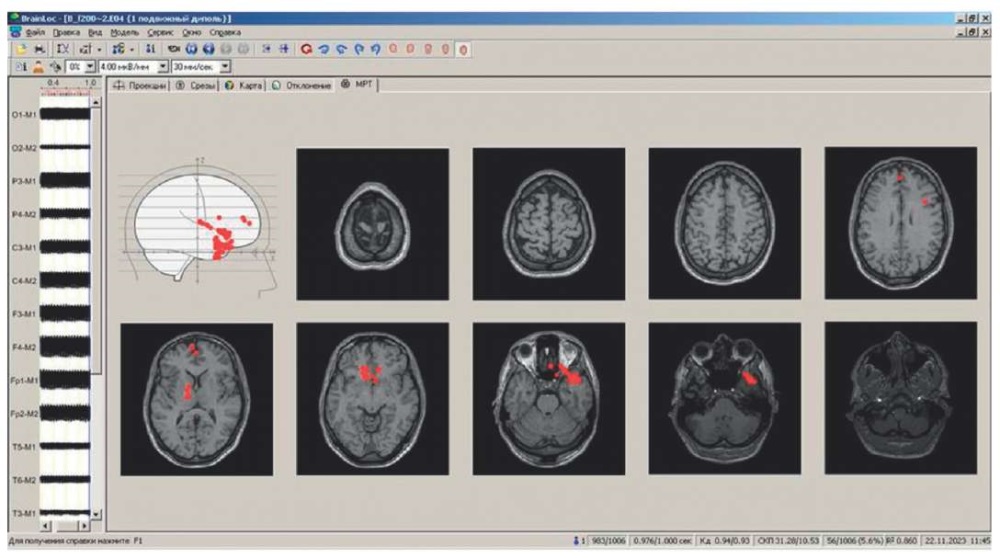
Рисунок 4. Результаты локализации с помощью программы BrainLoc 6.0 (Россия)
на основе модели с одним подвижным источником
на уровне коэффициента дипольности 0,95
Figure 4. Localization results using the BrainLoc 6.0 software (Russia)
based on a model with a single moving source, dipole coefficient level of 0.95
На рисунке 5 показаны результаты локализации на основе модели с двумя подвижными источниками. Видно, что практически нет случаев локализации диполей близко к местам стимуляции, большинство диполей демонстрируют ложную локализацию.
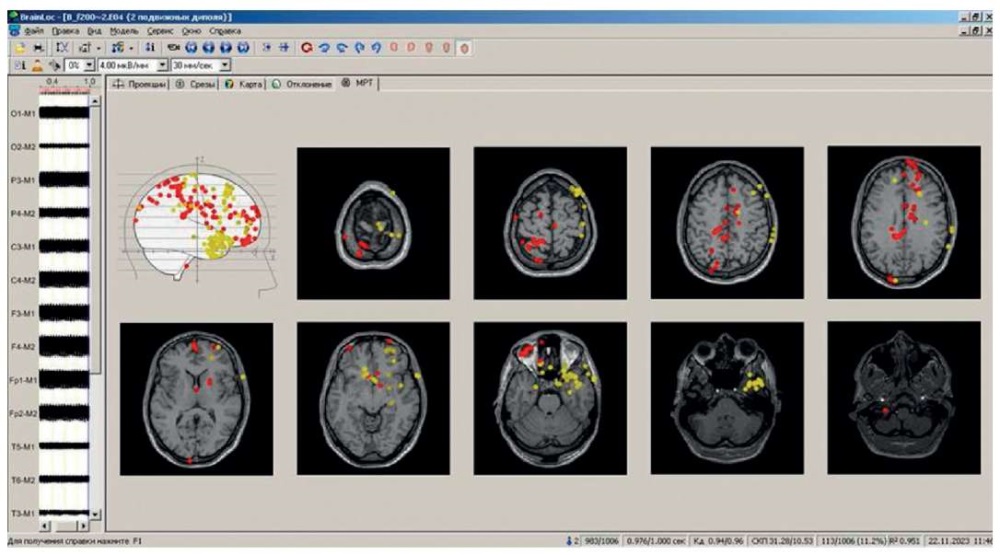
Рисунок 5. Результаты локализации с помощью программы BrainLoc 6.0 (Россия)
на основе модели с двумя подвижными источниками
на уровне коэффициента дипольности 0,95
Figure 5. Localization results using the BrainLoc 6.0 software (Russia)
based on a model with two moving sources, dipole coefficient level of 0.95
На рисунке 6 представлены результаты локализации того же образца с помощью алгоритма sLORETA в пакете Brainstorm. Этот алгоритм предпочитает относить активность глубинных источников на поверхность коры, что в данном случае никак не согласуется с фактическим положением источников, т.е. метод дает заведомо ложное решение.

Рисунок 6. Результаты локализации с помощью алгоритма sLORETA
в пакете Brainstorm (Швейцария)
Figure 6. Localization results using the sLORETA algorithm
in the Brainstorm software package (Switzerland)
Возможности применения нового метода к анализу механизмов пароксизмальной активности /
The possibilities of applying the new method to the analysis of paroxysmal activity mechanisms
Новые возможности, открывающиеся при использовании предлагаемого метода локализации «Виртуально вживленный электрод», можно продемонстрировать на данных ЭЭГ пациентки ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России с пароксизмальной активностью, возникшей после оперативного родоразрешения.
Анамнез
Состояние после оперативного родоразрешения. Ухудшение состояния в ранний послеоперационный период, когда у пациентки, вероятно во сне, развилось пароксизмальное состояние в виде внезапной вокализации. Со слов медперсонала, отмечались клонические подергивания в конечностях, закатывание глаз, «пена у рта», признаки «остановки дыхания» с последующим постиктальным состоянием в виде психомоторного возбуждения. Введено внутривенно 10 мг диазепама. Начата магнезиальная терапия.
Известно, что с детства пациентка наблюдается у невролога по поводу редких синкопальных состояний, чаще на фоне провоцирующих факторов (mensis, голод, боль). Последний приступ потери сознания около 4 лет назад. Приступы описывает как продолжительные, с наличием постиктального периода в виде сна, иногда с тризмом жевательной мускулатуры. Все приступы, вероятно, в вертикальном положении, иногда с генерализованной «дрожью». Проходила обследование у эпилептолога, МРТ головного мозга, ЭЭГ – без патологии, данных за эпилепсию не выявлено. Данных за кардиогенный генез синкоп нет. Неврологический анамнез отягощен не был.
Результаты локализации ЭЭГ с периодом пароксизмальной активности
На рисунке 7 представлен фрагмент записи фоновой ЭЭГ, на котором отмечаются билатеральные генерализованные вспышки пароксизмальной активности по типу абсанса. К этой же записи в виде 33 дополнительных каналов добавлена рассчитанная активность в 33 соответствующих областях интереса – мозговых структурах (включая глубинные).

Рисунок 7. Фрагмент записи фоновой электроэнцефалограммы (ЭЭГ),
на котором отмечаются билатеральные генерализованные вспышки
пароксизмальной активности по типу абсанса (выделено рамкой).
Вверху показаны каналы ЭЭГ в стандартных отведениях по системе «10–20%»,
а внизу (отмечено синим) – восстановленные с помощью нового метода локализации
сигналы в 33 структурах мозга (областях интереса)
Figure 7. Fragment of a background electroencephalogram (EEG)
recording with bilateral generalized bursts
of absence-like paroxysmal activity (highlighted in box).
Top: EEG channels in standard leads using the 10–20% system are shown;
bottom (highlighted in blue): signals reconstructed
using a new localization method in 33 brain areas (sites of interest)
Полученные результаты можно анализировать не только визуально, но и статистически, в частности с помощью факторного анализа. Во фрагменте от 2,5 до 4,5 с, содержащем генерализованные вспышки, динамика изменений в выбранных 33 точках (структурах) описывается на 72,98% от общей дисперсии с помощью трех факторов. После вращения было выделено три группы мозговых структур, активность которых в данном периоде была высоко синхронизирована. На рисунке 8 представлены соответствующие группы мозговых структур и их активность. Видно, что активность структур, входящих в разные группы, существенно различается, хотя внутри группы наблюдается большое сходство паттернов. В итоговую скальповую ЭЭГ все эти группы структур вносят специфический вклад (фактор 1 с весом 0,128405; фактор 2 с весом 0,46628; фактор 3 с весом 0,514374), совместно описывая наблюдаемую по отведениям динамику изменения потенциала.

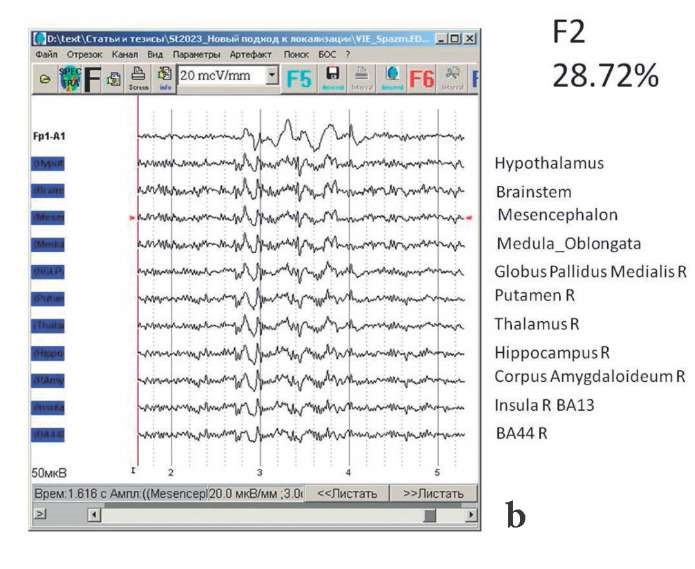

Рисунок 8. Выявленная с помощью нового метода локализации
«Виртуально вживленный электрод» активность 33 структур мозга,
сгруппированная с помощью факторного анализа в три группы (a–c).
Для удобства везде сверху (первым каналом)
оставлена исходная запись в отведении Fp1
Figure 8. Activity at 33 brain areas
detected by new localization method “Virtually Implanted Electrode”,
grouped into three groups (a–c) by using factor analysis.
For convenience, the original recording at Fp1 lead is left at the top (first channel)
На рисунке 8 видно, что первая группа включает только левосторонние подкорковые ядра и корковые области, включая речевую область Брока. Вторая группа – правосторонние корковые области (включая гомологичную области Брока область 44 БА справа) и глубинные (стволовые) структуры. Третья группа – области цингулярной и доросмедиальной префронтальной коры (слева), а также головки хвостатых ядер. Такая организация патологического процесса может объяснить наблюдаемые поведенческие проявления – внезапные вокализации (поскольку задействованы речевые зоны), клонические подергивания в конечностях (поскольку задействованы подкорковые двигательные ядра – бледный шар и хвостатое ядро), а также признаки «остановки дыхания» (поскольку задействованы глубинные стволовые структуры).
ОБСУЖДЕНИЕ / DISCUSSION
Представленный пример демонстрирует лишь возможность более глубокого научного исследования пароксизмальных проявлений благодаря разработанному инструменту локализации «Виртуально вживленный электрод», но не претендует на исчерпывающее описание механизмов данного феномена.
Как отмечают M. Seeber et al. [5], точность локализации нейронной активности с использованием неинвазивных методов все еще является предметом дискуссий. При этом одним из «золотых стандартов» оценки точности локализации источника являются внутричерепные записи у пациентов, которым в клинических целях имплантированы подкорковые или внутричерепные электроды [5]. Чаще всего такие процедуры применяются для выявления эпилептических очагов.
Исследования, использующие удаленную зону после успешной операции при эпилепсии в качестве основы для определения локализации, показали, что визуализация источника ЭЭГ высокой плотности правильно идентифицировала эту зону с точностью около 85% [11]. Визуализация электрических источников имела чувствительность 84% и специфичность 88%, если ЭЭГ регистрировалась большим количеством электродов (128–256 каналов), а в качестве модели головы использовалось индивидуальное МРТ-изображение [11]. Эти показатели выгодно отличались от показателей структурной МРТ (чувствительность 76%, специфичность 53%), позитронно-эмиссионной томографии (чувствительность 69%, специфичность 44%) и иктальной/межприступной однофотонной эмиссионно-компьютерной томографии (чувствительность 58%, специфичность 47%). Однако чувствительность и специфичность визуализации электрического источника снизились до 57% и 59% соответственно при малом количестве электродов (менее 32 каналов) и модели головы-шаблона. Авторы приходят к выводу, что, учитывая низкую стоимость и высокую гибкость ЭЭГ-систем даже при большом количестве каналов, визуализация ЭЭГ-источника является очень ценным инструментом в предоперационной оценке эпилепсии [11].
При этом важно понимать, что природа генерации электрического сигнала в области эпилептического очага может отличаться от природы генерации ЭЭГ в норме. Одна из современных моделей генерации активности в эпилептическом фокусе, предложенная Е.Л. Машеровым [7], основана на предположении о синхронизации колебаний, возникающих в ходе регулирования уровня постоянного потенциала, и синхронизации нейронных разрядов с медленными колебаниями. В этой связи, поскольку природа эпилептиформной активности еще остается дискуссионной, ценность представленных выше данных с точки зрения оценки эффективности работы алгоритмов локализации также становится сомнительной. А проверка алгоритмов по данным вживленных стимулирующих электродов остается на первом плане по степени доказательности.
Кроме того, как отмечают M. Seeber et al. [5], отдельным уместным вопросом является то, можно ли определить активность в более глубоких структурах мозга с помощью скальповой ЭЭГ или магнитоэнцефалографии. Хотя прямых доказательств или опровержений утверждения, что активность глубоких структур мозга не проявляется в скальповой ЭЭГ, пока предоставлено не было, в некоторых публикациях все же утверждается, что они способны определять активность в подкорковых структурах [5][11][12]. В частности, P. Krishnaswamy et al. [12] показали, что магнитоэнцефалография и ЭЭГ позволяют измерять электромагнитные поля, генерируемые подкорковыми структурами. Локализовать источники этих полей очень сложно, поскольку поля, генерируемые подкорковыми структурами, малы и их невозможно отличить от распределенной активности коры. Однако кортикальные и подкорковые поля можно различить, если кортикальные источники разрежены. Для этого авторы предлагают применять алгоритм, который использует разреженность иерархическим образом для совместной локализации кортикальных и подкорковых источников [12].
Представленный новый подход и реализующий его алгоритм [7] даже для небольшого числа каналов ЭЭГ также показывает высокую точность и надежность локализации, в частности, глубинных источников.
Благодарности / Acknowledgements
Автор выражает благодарность кандидату медицинских наук, старшему научному сотруднику нейрохирургического отделения ФГБНУ «Научный центр неврологии», нейрохирургу, врачу высшей категории Владимиру Михайловичу Тюрникову за предоставление возможности проведения ЭЭГ-регистрации и дополнительной информации о своем пациенте. Также автор признателен руководству и сотрудникам ФГБУ «Национальный медицинский исследовательский центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России за предоставление возможности проанализировать ЭЭГ-запись пациентки с пароксизмальной активностью.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Таким образом, на основании проведенных расчетов и сопоставления итоговых результатов локализации электрической активности, сгенерированной с помощью глубокой электростимуляции мозга, показано, что новый метод локализации ЭЭГ «Виртуально вживленный электрод» демонстрирует наиболее близкий к фактическому результат локализации источников электрической активности. Применение закона линейного убывания потенциала, на основе которого работает метод, является более адекватным по сравнению с законом обратного квадратичного убывания, лежащим в основе дипольного моделирования, и гораздо лучше соответствует экспериментальным данным.
1. Патент RU 2785268С1 «Способ исследования мозговой активности по данным скальповой электроэнцефалограммы».
2. Yale Global Tic Severity Scale (YGTSS) – Йельская глобальная шкала тяжести тиков.
Список литературы
1. Иванов А.А. Обзор методов математического анализа ЭЭГ. Количественная ЭЭГ. Эпилепсия и пароксизмальные состояния. 2023; 15 (2): 171–92. https://doi.org/10.17749/2077-8333/epi.par.con.2023.154.
2. Lin H., Peng N., Zhang D., et al. Brain connectivity markers for the identification of effective contacts in subthalamic nucleus deep brain stimulation. Hum Brain Mapp. 2020; 41 (8): 2028–36. https://doi.org/10.1002/hbm.24927.
3. Lachaux J.P., Axmacher N., Mormann F., et al. High-frequency neural activity and human cognition: past, present and possible future of intra-cranial EEG research. Prog Neurobiol. 2012; 98 (3): 279–301. https://doi.org/10.1016/j.pneurobio.2012.06.008.
4. Kropotov J.D. Functional neuromarkers for Psychiatry: applications for diagnosis and treatment. 1st ed. Academic Press; 2016: 498 pp.
5. Seeber M., Cantonas LM., Hoevels M., et al. Subcortical electrophysiological activity is detectable with high-density EEG source imaging. Nat Commun. 2019; 10: 753. https://doi.org/10.1038/s41467-019-08725-w.
6. Машеров Е.Л. Электрохимическая обратная связь как один из возможных механизмов генерации низкочастотной составляющей биоэлектрической активности мозга. Биофизика. 2019; 64 (3): 572–7. https://doi.org/10.1134/S0006302919030189.
7. Машеров Е.Л. Моделирование низкочастотной составляющей спектра ЭЭГ с позиций теории автоматического управления. Презентация. URL: https://www.ihna.ru/ru/news/institute-news/novyepodhody-k-kolichestvennomu-analizu-eeg-v-eksperimente-i-klinike (дата обращения 30.11.2023).
8. Vartanov A.V. A new method of localizing brain activity using the scalp EEG data. Procedia Comput Sci. 2022; 213: 41–8. https://doi.org/10.1016/j.procs.2022.11.036.
9. Тюрников В.М., Иллариошкин С.Н., Низаметдинова Д.М. и др. Двусторонняя стимуляция бледного шара при тяжелом медикаментозно-резистентном синдроме Туретта. Нервные болезни. 2018; 1: 40–4.
10. Тюрников В.М., Симонян А.С., Петросян Д.В. и др. Отдаленные результаты глубокой стимуляции мозга (GPi) при синдроме Туретта с выраженными инвалидизирующими тиками. Российский нейрохирургический журнал имени профессора А.Л. Поленова. 2021; 13 (S1): 97.
11. Brodbeck V., Spinelli L., Lascano A.M., et al. Electroencephalographic source imaging: a prospective study of 152 operated epileptic patients. Brain. 2011; 134 (Pt. 10): 2887–97. https://doi.org/10.1093/brain/awr243.
12. Krishnaswamy P., Obregon-Henao G., Ahveninen J., et al. Sparsity enables estimation of both subcortical and cortical activity from MEG and EEG. Proc Natl Acad Sci USA. 2017; 114 (48): E10465–74. https://doi.org/10.1073/pnas.1705414114.
Об авторе
А. В. ВартановРоссия
Вартанов Александр Валентинович – к.псх.н., доцент по специальности, старший научный сотрудник кафедры психофизиологии факультета психологии; ведущий научный сотрудник
WoS ResearcherID: D-9907-2012;
Scopus Author ID: 6603018783
Ленинские горы, д. 1, Москва, 119991;
Загородное ш., д. 2, Москва, 117152
Рецензия
Для цитирования:
Вартанов А.В. Новый подход к пространственной локализации электрической активности по данным ЭЭГ. Эпилепсия и пароксизмальные состояния. 2023;15(4):326-338. https://doi.org/10.17749/2077-8333/epi.par.con.2023.177
For citation:
Vartanov А.V. A new approach to spatial localization of EEG-based electrical activity. Epilepsy and paroxysmal conditions. 2023;15(4):326-338. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2023.177

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.









































