Перейти к:
Клинические особенности эволюционной и эпилептической энцефалопатии, вызванной мутацией в гене KCNQ2
https://doi.org/10.17749/2077-8333/epi.par.con.2023.171
Аннотация
В современной классификации эпилептических синдромов, предложенной Международной Противоэпилептической Лигой в 2022 г., эволюционная и эпилептическая энцефалопатия (англ. developmental and epileptic encephalopathy, DEE), вызванная мутацией в гене KCNQ2, выделена в качестве самостоятельной нозологической формы. Альтернативные названия этого заболевания: DEE 7-го типа или ранняя инфантильная эпилептическая энцефалопатия 7-го типа (OMIM: 613720). В статье представлен краткий обзор литературы по данной теме, а также приведено собственное клиническое наблюдение этой редкой патологии.
Ключевые слова
Для цитирования:
Малов А.Г., Калашникова Т.П., Вдовина Н.А. Клинические особенности эволюционной и эпилептической энцефалопатии, вызванной мутацией в гене KCNQ2. Эпилепсия и пароксизмальные состояния. 2023;15(4):354-360. https://doi.org/10.17749/2077-8333/epi.par.con.2023.171
For citation:
Malov А.G., Kalashnikova Т.P., Vdovina N.А. Clinical features of developmental and epileptic encephalopathy caused by KCNQ2 gene mutation. Epilepsy and paroxysmal conditions. 2023;15(4):354-360. https://doi.org/10.17749/2077-8333/epi.par.con.2023.171
ВВЕДЕНИЕ / INTRODUCTION
Эволюционная и эпилептическая энцефалопатия (англ. developmental and epileptic encephalopathy, DEE), вызванная мутацией в гене KCNQ2 (KCNQ2-DEE), зарегистрирована в OMIM (англ. Online Mendelian Inheritance in Man) под кодовым номером 613720. Альтернативные названия: DEE 7-го типа или ранняя инфантильная эпилептическая энцефалопатия 7-го типа [1].
Ген KCNQ2 (англ. potassium channel, voltage-gated, KQT-like subfamily, member 2) расположен в локусе 20q13.33 и кодирует потенциал-зависимый калиевый канал, который экспрессируется в головном мозге [2]. Спектр болезней, ассоциированных с различными мутациями в этом гене, включает кроме DEE 7-го типа доброкачественную неонатальную эпилепсию 1-го типа и/или миокимию (OMIM: 121200), что является примером фенотипической аллельной гетерогенности [1]. Оба заболевания наследуются по аутосомно-доминантному типу. KCNQ2-DEE чаще возникает вследствие миссенс-мутаций de novo.
Основными клиническими признаками KCNQ2-DEE являются фармакорезистентные эпилептические судорожные припадки, возникающие в раннем детстве, часто в неонатальном периоде, а также стойкие тяжелые психоневрологические нарушения, которые сохраняются даже при ремиссии приступов [3]. В связи со сходной клиникой припадков и выявлением на электроэнцефалограмме (ЭЭГ) в дебюте паттерна «вспышка – подавление» нередко болезнь рассматривалась как разновидность ранней инфантильной DEE Отахары [4].
В современной классификации эпилептических синдромов, предложенной Международной Противоэпилептической Лигой (англ. International League Against Epilepsy, ILAE) в 2022 г., заболевание выделено в качестве самостоятельной нозологической формы в подгруппе этиологически специфических синдромов, входящих в эпилептические синдромы с началом в неонатальном периоде и младенчестве [5]. Обязательными критериями диагностики KCNQ2-DEE названы тонические, миоклонические и/или другие фокальные припадки в сочетании с паттерном «вспышка – подавление» либо мультифокальными разрядами на ЭЭГ, возникшие до 3-месячного возраста, а также очевидная на момент начала заболевания задержка развития нервной системы или энцефалопатия [6]. В легких случаях гетерозиготные мутации в гене KCNQ2 проявляются фенотипом самокупирующейся (семейной) неонатальной эпилепсии (англ. self-limited (familial) neonatal epilepsy, SeLNE). Для нее характерно возникновение на 1-й неделе жизни фокальных (в основном тонических) припадков с изменением латерализации моторных феноменов как во время приступа (миграция), так и в разных приступах (альтернация). В большинстве случаев приступы прекращаются к 6-недельному или, реже, 6-месячному возрасту.
Для KCNQ2-DEE очень характерна различная степень экспрессивности мутантного гена с фенотипическим разнообразием даже при одинаковых мутациях. Так, в одном наблюдении [7] у матери и сына с гетерозиготной мутацией KCNQ2 и неонатальным дебютом эпилепсии отмечался разный исход. У матери уже в младенчестве возникла ремиссия припадков, а впоследствии наблюдалось нормальное психомоторное развитие. У сына, несмотря на лечение, сформировались эпилептическая энцефалопатия с фармакорезистентными судорогами и психическое недоразвитие с гипотонией и дистонией. В другом случае [3] из 4 членов семьи у матери и младшей дочери фенотип соответствовал типичной доброкачественной неонатальной эпилепсии. Однако у родной сестры матери наблюдались фармакорезистентные припадки до 5 лет и умеренная умственная отсталость во взрослом возрасте. У старшей дочери на 8-й день жизни развились кластеры правосторонних тонических приступов. Полиморфные, резистентные к терапии припадки сохранялись до 7 лет. У нее также была тяжелая умственная отсталость с алалией и спастический тетрапарез, что соответствовало DEE.
S. Weckhuysen et al. [8] сообщили о 8 неродственных пациентах с неонатальной эпилептической энцефалопатией, ассоциированной с KCNQ2. У всех приступы возникли на 1-й неделе жизни, а 2 матери ретроспективно отметили внутриутробные подергивания плода в течение последних 2 мес беременности. В дебюте наблюдались ежедневные фармакорезистентные тонические припадки, но в период от 9 мес до 4 лет частота приступов снижалась, и у большинства они прекратились. Семь пациентов имели глубокие психические нарушения и моторные расстройства, чаще – спастический тетрапарез.
Припадки при KCNQ2-DEE зачастую хорошо контролируются антиконвульсантами, но, несмотря на это, у детей наблюдаются серьезные перманентные психоневрологические нарушения. A.T. Berg et al. [9] провели структурированный онлайн-опрос родителей 39 детей различного возраста с KCNQ2-DEE. Дебют приступов состоялся в первые дни жизни. Во время активной стадии эпилепсии у 35 детей припадки наблюдались ежедневно. Серийное возникновение приступов (3 и более в день) было отмечено у 37 детей, причем у 19 из них – более 10 в день. Наиболее распространенными типами припадков были билатеральные тонико-клонические или, реже, тонические. У большинства пациентов наблюдались тяжелые перманентные расстройства в виде нарушений коммуникации, двигательной функции, использования рук, кормления и др. У 72% были нарушения более чем в двух доменах. Четкой связи между сроком ремиссии по приступам и видом или количеством перманентных нарушений выявлено не было.
Наиболее крупное исследование пациентов с KCNQ2-DEE проведено A. Cossu et al. в 2023 г. [10]. По специально разработанной анкете были собраны данные о 80 пациентах различного возраста (от 4 мес до 43 лет) с мутациями KCNQ2 из 14 стран. Интересно, что у 5 пациентов в возрасте от 2 до 11 лет эпилепсии никогда не было. Основываясь на клинических особенностях, авторы разделили больных старше 2 лет (n=71) на три фенотипа по степени тяжести. Средний возраст между группами был сопоставим. При легкой степени тяжести (42%) дети могли ходить и разговаривать. У них реже отмечалась активная эпилепсия, но чаще диагностировался аутизм. Тяжелый фенотип (27%) характеризовался способностью самостоятельно сидеть и стоять, но не ходить, спастическим мышечным гипертонусом и речью, представленной звуками или слогами. Эпилепсия отмечена почти во всех случаях, а аутизм – редко. При глубокой степени тяжести (31%) наблюдались невозможность держать голову высоко, изменение мышечного тонуса с гипо- и/или гипертонусом и алалия. У всех диагностирована эпилепсия, нередко с ежедневными припадками, а аутизм – ни у кого. У пациентов c глубокой степенью тяжести обнаружены определенные особенности эпилепсии: более высокая частота приступов в первые 10 ч жизни, более частое возникновение эпилептических спазмов и выявление паттерна «вспышка – подавление» уже на первой ЭЭГ. Из 75 обследованных с эпилепсией у 41 пациента в возрасте от 5 мес до 32 лет на момент опроса припадков уже не было. Возраст последнего приступа составил от 2 мес до 10 лет. Среди пациентов с активной эпилепсией у лиц старшего возраста частота приступов была ниже по сравнению с пациентами моложе 6 лет. Изменения при магнитно-резонансной томографии (МРТ) головного мозга были выявлены в 43% (32/75) случаев. Отмечены следующие изменения: гипомиелинизация – в 37% случаев, аномалии белого вещества – в 12%, истончение мозолистого тела – в 28%, корковая атрофия – в 9%, пороки развития коры – в 6%, другие неспецифические аномалии – в 50% [10].
В некоторых работах [11] подчеркивается роль каналов KCNQ2 в процессе развития коры головного мозга. В качестве примера приводится наличие у ребенка с KCNQ2-DEE мальформации коры вследствие аномальной нейрональной миграции в виде гетеротопии серого вещества.
Самым характерным типом эпилептиформной активности на ЭЭГ при KCNQ2-DEE, встречающимся более чем в 60% случаев, является паттерн «вспышка – подавление», который временами может быть асимметричным [6]. В других случаях или позднее могут наблюдаться мультифокальные аномалии, включая спайки и острые волны. Возможно диффузное замедление биоэлектрической активности мозга или ее депрессия в одной гемисфере. Описано появление гипсаритмии [12].
В лечении KCNQ2-DEE обычно применяют блокаторы натриевых каналов (БНК), назначение которых зачастую приводит к ремиссии приступов [12]. Неэффективность фенобарбитала, который часто назначают при неонатальных судорогах, и эффективность БНК, таких как карбамазепин и фенитоин, отмечаются как одна из важных характеристик KCNQ2-DEE [6]. В исследовании A. Cossu et al. [10] из 75 пациентов с эпилепсией 33 человека принимали один антиконвульсант, 30 – два или более, а 12 уже не использовали никаких антиэпилептических препаратов. БНК принимали 40 пациентов, причем 18 – в качестве монотерапии; 10 человек в течение всей жизни следовали кетогенной диете.
Рассматриваются варианты таргетной терапии в зависимости от типа мутации, которые могут быть как с усилением функции белка (англ. gain-of-function, GOF), так и с потерей функции (англ. loss-of-function, LOF), что требует разных терапевтических подходов [13]. По данным F. Miceli et al. [14], отсутствие неонатальных судорог при наличии припадков в детском возрасте является надежным и важным клиническим признаком в пользу GOF-вариантов мутаций гена KCNQ2. При мутациях с усилением функции, таких как KCNQ2 R144, авторами предполагается эффективность амитриптилина, который блокирует каналы, содержащие субъединицы R144Q Kv7.2 и Kv7.3. В случае мутаций, вызывающих эффект потери функции нейрональных калиевых (K+) каналов Kv7.2, клинико-электроэнцефалографическое улучшение отмечается при назначении активатора Kv7 габапентина [15]. Ретигабин, селективно открывающий калиевые каналы KV7.2 и KV7.3, также применяют в качестве прецизионной терапии у пациентов с KCNQ2-DEE [16].
В связи с редкой встречаемостью заболевания и тем, что описаний клинических случаев KCNQ2-DEE в отечественной литературе мы не встретили, приводим собственное наблюдение.
КЛИНИЧЕСКИЙ СЛУЧАЙ / CASE REPORT
Пациент Х. впервые поступил в неврологическое отделение в возрасте 1,5 мес с жалобами на ежедневные приступы в виде тонического поворота головы, чаще вправо, с напряжением конечностей длительностью до 1 мин.
Этические аспекты / Ethical aspects
Вся медицинская помощь оказывалась в полном соответствии со стандартами, порядками и клиническими рекомендациями, а также принципами Хельсинкской декларации Всемирной медицинской ассоциации (Форталеза, Бразилия, 2013 г.). У родителей пациента получено информированное согласие на публикацию. Анонимность больного обеспечена отсутствием персональной информации, в т.ч. изображения, имени, инициалов ребенка и номеров медицинских документов.
Анамнез / History of disease
Из анамнеза известно, что ребенок от первой беременности, протекавшей на фоне анемии, хронического пиелонефрита и острой респираторной вирусной инфекции в 27 нед у матери, срочных родов. Родоразрешение оперативное в связи с тазовым предлежанием. Оценка по шкале Апгар 8/9 баллов, послед без особенностей. Масса тела при рождении 3490 г, рост 53 см. Наследственность по эпилепсии не отягощена.
Со слов мамы, она заметила приступы со 2–3-го дня жизни. Однако из врачей ей «никто не верил», и она «перестала жаловаться». Впервые ребенок осмотрен неврологом в возрасте 1 мес. В связи с подозрением на «эпилептиформные пароксизмы» было рекомендовано проведение ЭЭГ амбулаторно. На стационарное обследование направлен только через 2 нед.
Описание приступов / Seizure description
В отделении зафиксированы серийные адверсивные тонические фокальные моторные припадки в виде поворота головы вправо и/или влево с одновременным напряжением конечностей, иногда с формированием позы асимметричного шейного тонического рефлекса. Изменение латерализации поворота головы могло происходить как во время одного приступа (миграция), так и во время разных припадков (альтернация). В начале приступа могло возникать срыгивание, во время – могли наблюдаться билатеральные миоклонии, в основном в ручках, и нистагм, а в конце – автоматизмы в виде движений языка и/или сглатываний. В конце, а иногда и во время припадка ребенок сильно плакал, что свидетельствовало о сохранности сознания. Длительность приступов обычно составляла несколько минут, но нередко они группировались в кластеры до получаса, которые могли повторяться несколько раз в день. Учитывая серийное течение припадков, с первого дня назначены вальпроаты в виде депакина сиропа с постепенным титрованием дозы с 10 до 40 мг/кг/сут. Уже в начале терапии приступы стали протекать легче, но полной ремиссии удалось достичь только на максимальной дозе.
При объективном неврологическом обследовании выявлена диффузная гипотония с неуверенной опорой. Окружность головы 39 см, большой родничок 2×2 см. Проконсультирован педиатром. Установлен диагноз: хроническое расстройство питания по типу постнатальной гипотрофии 2-й степени (масса тела 4,2 кг). После ультразвукового исследования пилорического отдела желудка проконсультирован хирургом. Установлен диагноз: пилороспазм. В связи с подозрением на наследственную болезнь обмена проконсультирован генетиком, взята кровь для тандемной масс-спектрометрии на спектр аминокислот и ацилкарнитинов, результат которой, полученный позднее, оказался без особенностей. Уровень лактата в крови составил 2,7 ммоль/л (при норме 0,5–2,2 ммоль/л).
ЭЭГ и МРТ (возраст 1,5 мес) / EEG and MRI (age 1.5 months)
На ЭЭГ, записанной в дневном сне, зарегистрирована мультирегиональная эпилептиформная активность (ЭА) в виде комплексов «острая – медленная волна» (ОМВ) с четким акцентом в левой лобной области (рис. 1). На повторной ЭЭГ, записанной в дневном сне через 10 дней на дозе депакина 30 мг/кг/сут, отмечена положительная динамика в виде уменьшения амплитуды и представленности ЭА.
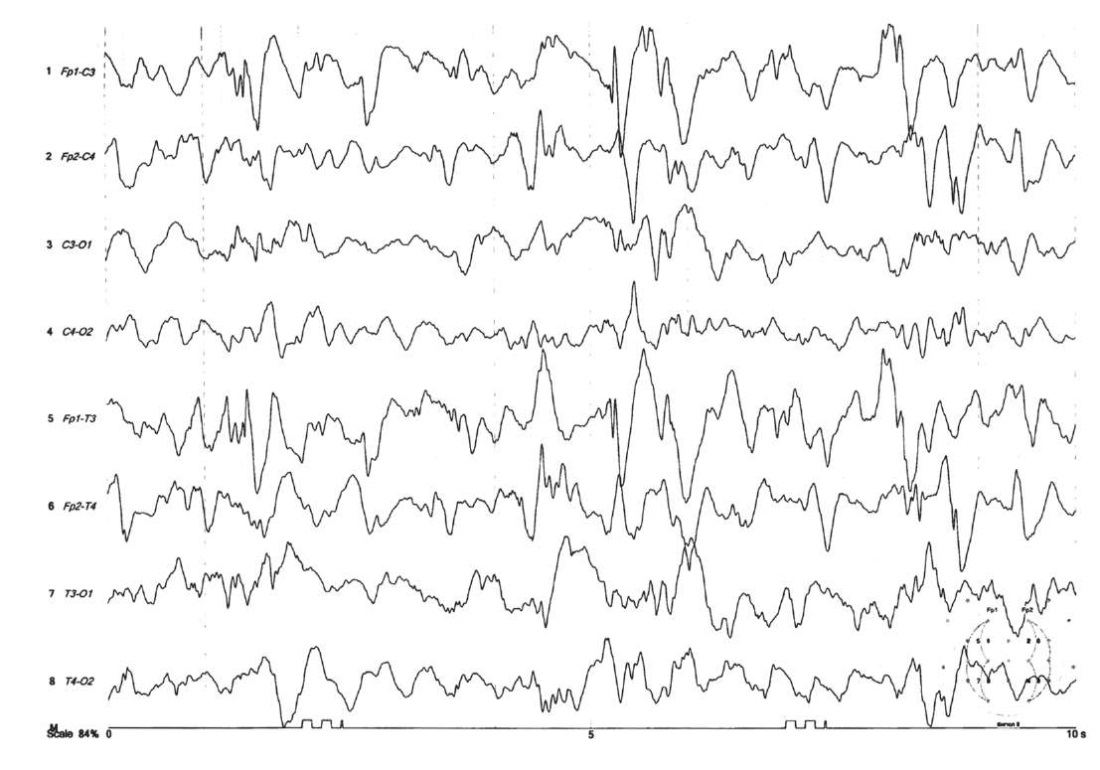
Рисунок 1. Мультирегиональная эпилептиформная активность
с акцентом в левой лобной области
на электроэнцефалограмме пациента Х. (возраст 1,5 мес)
Figure 1. Рatient Х. (aged 1.5 months).
Electroencephalogram-specific multiregional epileptiform activity
highlighting the left frontal region
При МРТ головного мозга данных за наличие изменений очагового и диффузного характера в веществе мозга не выявлено. Пациент был выписан под наблюдение невролога с диагнозом: криптогенная фокальная эпилепсия. Рекомендованы постоянный прием вальпроевой кислоты в дозе 40 мг/кг/сут и лабораторное генетическое обследование для уточнения диагноза.
Неврологический статус и ЭЭГ (возраст 8 мес) /
Neurological status and EEG (age 8 months)
Повторно поступил на стационарное обследование в возрасте 8 мес с жалобами на задержку психомоторного развития: не поворачивается, не ползает, не сидит. Припадки не повторялись. При объективном обследовании отмечена малая окружность головы (42 см), большой родничок закрыт (постнатальная микроцефалия).
В неврологическом статусе: за предметами не следит, непостоянное альтернирующее расходящееся косоглазие, при тракции за ручки не подтягивается, мышечный тонус повышен по спастическому типу преимущественно в ручках, симптом Бабинского с двух сторон. Офтальмологом впервые отмечена частичная атрофия дисков зрительных нервов с двух сторон.
На ЭЭГ выявлены единичные комплексы ОМВ, но в двух регионах: в левых височных и правых лобно-теменных отведениях. При хромосомном микроматричном анализе патологии не выявлено.
Генетический анализ / Genetic analysis
Уже после выписки из отделения были получены результаты секвенирования ДНК по панели «Наследственные болезни обмена веществ» (лаборатория «Геномед», Россия), кровь для которого была взята еще в возрасте 5 мес. Обнаружена «вероятно патогенная мутация, являющаяся возможной причиной заболевания». Выявлена ранее не описанная гетерозиготная мутация в экзоне 17 гена KCNQ2 (chr20:62038349C>CCGTA), приводящая к сдвигу рамки считывания начиная с кодона 756 (p.Gly756fs, NM_172107.2) и нарушающая синтез полноразмерного белка. Также определена гетерозиготная «мутация с неизвестным клиническим значением, имеющая возможное отношение к фенотипу» в гене DHCR7. Гомозиготные мутации в этом гене приводят к развитию аутосомно-рецессивного заболевания – синдрома Смита–Лемли–Опица.
Хотя в заключении было указано, что гетерозиготные мутации в гене KCNQ2 описаны у пациентов с ранней младенческой эпилептической энцефалопатией 7-го типа (OMIM: 613720), а клиническая картина пациента полностью соответствовала ранее описанным проявлениям аутосомно-доминантного заболевания KCNQ2-DEE, генетиком было принято решение о необходимости секвенирования экзома или генома. Результаты полноэкзомного секвенирования ДНК ребенка подтвердили наличие мутаций в обоих генах. Секвенирование этих генов по Сэнгеру у родителей выявило наличие гетерозиготной мутации в гене DHCR7 у матери. Таким образом, мутация в гене KCNQ2 возникла у ребенка de novo.
ЭЭГ и МРТ (возраст 2 года, 3 года, 5 лет) /
EEG and MRI (age 2 years, 3 years, 5 years)
В возрасте 2 года ребенок стал следить за яркими предметами, удерживать (но не брать) предметы руками, но сидеть и стоять не мог. Хотя на фоне регулярной антиэпилептической терапии (вальпроевая кислота в дозе 30 мг/кг/сут) припадки не повторялись и на ЭЭГ выявлялись только «элементы» ЭА, перманентные нарушения были значительными. Выявлялось психическое недоразвитие с тотальной алалией, сформировался выраженный центральный тетрапарез.
В возрасте 3 года в положении лежа на животе мальчик стал приподниматься на локтях, иногда ползать по-пластунски, переворачиваться, но речи не было. На МРТ головного мозга впервые отмечены признаки неярко выраженной заместительной гидроцефалии как проявления кортикальной атрофии.
При последней госпитализации в возрасте 5 лет положительной динамики в неврологическом статусе не отмечено, навыки сидения и стояния не сформировались. Однако на фоне приема прежней дозы вальпроатов припадки не повторялись и ЭА на ЭЭГ не регистрировалась.
ОБСУЖДЕНИЕ / DISCUSSION
Анализируя картину нашего клинического наблюдения в сравнении с данными литературы, можно отметить следующие особенности. Дебют заболевания зарегистрирован в первые дни жизни, что типично для KCNQ2-DEE [3]. Серии адверсивных припадков с напряжением конечностей и изменением латерализации моторных феноменов, с явлениями миграции и альтернации более характерны для SeLNE [6]. Наблюдалась мультирегиональная эпилептиформная активность на ЭЭГ, хотя более типичным для KCNQ2-DEE считается паттерн «вспышка – подавление» [6]. Отмечен быстрый и стойкий эффект вальпроевой кислоты, блокирующей как кальциевые, так и натриевые потенциал-зависимые каналы, а эффективность БНК – один из важных признаков KCNQ2-DEE, в отличие от других DEE [6][12]. Изменения на МРТ головного мозга в начале заболевания отсутствовали, признаки кортикальной атрофии появились только в возрасте 3 лет, что нередко встречается при KCNQ2-DEE [10]. Выраженные перманентные психоневрологические нарушения, сохранявшиеся даже в возрасте 5 лет, соответствуют глубокой степени тяжести, которая наблюдалась почти у 1/3 пациентов, обследованных A. Cossu et al. [10].
В последние годы установлена корреляция «генотип – фенотип» для KCNQ2-ассоциированных эпилепсий [16]. Гетерозиготные варианты с потерей функции (варианты сдвига рамки считывания, нонсенс-варианты, варианты сплайсинга и некоторые миссенс-варианты) вызывают SeLNE. Миссенс-варианты с доминантно-негативным эффектом соответствуют KCNQ2-DEE, уменьшая калиевые токи в нейронах более чем на 50%. Интересным феноменом является возможность формирования фенотипов KCNQ2-DEE или SeLNE у разных представителей одной семьи [3][7], т.е. при одинаковых мутациях в гене KCNQ2.
Несомненно, что выяснение причин различной степени экспрессивности мутантного гена будет способствовать дальнейшей разработке методов прецизионной терапии KCNQ2-DEE, что активно происходит в последние годы при моногенных эпилептических синдромах [17].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Таким образом, особенностью представленного наблюдения является сочетание признаков KCNQ2-DEE и SeLNE, которая также чаще обусловлена мутациями в гене KCNQ2. Дебют серийных тонических фокальных припадков в сочетании с региональной интериктальной ЭА на ЭЭГ с первых дни жизни, их уменьшение при назначении антиконвульсантов, блокирующих натриевые каналы, возможны при обоих заболеваниях. Изменение латерализации моторных феноменов как во время припадка (миграция), так и в разных приступах (альтернация) более характерно для SeLNE. Однако наличие стойких психоневрологических нарушений, которые сохраняются, несмотря на ремиссию приступов и нормализацию ЭЭГ, наблюдается только при KCNQ2-DEE.
Список литературы
1. OMIM ® . An Online Catalog of Human Genes and Genetic Disorders. URL: https://omim.org (дата обращения 28.09.2023).
2. Biervert C., Schroeder B.C., Kubisch C., et al. A potassium channel mutation in neonatal human epilepsy. Science. 1998; 279 (5349): 403–6. https://doi.org/10.1126/science.279.5349.403.
3. Borgatti R., Zucca C., Cavallini A. et al. A novel mutation in KCNQ2 associated with BFNC, drug resistant epilepsy, and mental retardation. Neurology. 2004; 63 (1): 57–65. https://doi.org/10.1212/01.wnl.0000132979.08394.6d.
4. Saitsu H., Kato M., Koide A., et al. Whole exome sequencing identifies KCNQ2 mutations in Ohtahara syndrome. Ann Neurol. 2012; 72 (2): 298–300. https://doi.org/10.1002/ana.23620.
5. Zuberi S.M., Wirrell E., Yozawitz E., et al. ILAE classification and definition of epilepsy syndromes with onset in neonates and infants: position statement by the ILAE Task Force on Nosology and Definitions. Epilepsia. 2022; 63 (6): 1349–97. https://doi.org/10.1111/epi.17239.
6. Блинов Д.В. Эпилептические синдромы: определение и классификация Международной Противоэпилептической Лиги 2022 года. Эпилепсия и пароксизмальные состояния. 2022; 14 (2): 101–82. https://doi.org/10.17749/2077-8333/epi.par.con.2022.123.
7. Dedek K., Fusco L., Teloy N., Steinlein O.K. Neonatal convulsions and epileptic encephalopathy in an Italian family with a missense mutation in the fifth transmembrane region of KCNQ2. Epilepsy Res. 2003; 54 (1): 21–7. https://doi.org/10.1016/s0920-1211(03)00037-8.
8. Weckhuysen S., Mandelstam S., Suls A., et al. KCNQ2 encephalopathy: emerging phenotype of a neonatal epileptic encephalopathy. Ann Neurol. 2012; 71 (1): 15–25. https://doi.org/10.1002/ana.22644.
9. Berg A.T., Mahida S., Poduri A. KCNQ2-DEE: developmental or epileptic encephalopathy? Ann Clin Transl Neurol. 2021; 8 (3): 666–76. https://doi.org/.1002/acn3.51316.
10. Cossu A., Lo Barco T., Proietti J., et al. Clinical characteristics of 80 subjects with KCNQ2-related encephalopathy: results from a family-driven survey. Epilepsy Behav. 2023; 142: 109153. https://doi.org/10.1016/j.yebeh.2023.109153.
11. Legros L., Adle-Biassette H., Dozières-Puyravel B., et al. Neuropathology findings in KCNQ2 neonatal epileptic encephalopathy. Seizure. 2022; 99: 36–9. https://doi.org/10.1016/j.seizure.2022.05.008.
12. Kato M., Yamagata T., Kubota M., et al. Clinical spectrum of early onset epileptic encephalopathies caused by KCNQ2 mutation. Epilepsia. 2013; 54 (7): 1282–7. https://doi.org/10.1111/epi.12200.
13. Chokvithaya S., Caengprasath N., Buasong A., et al. Nine patients with KCNQ2-related neonatal seizures and functional studies of two missense variants. Sci Rep. 2023; 13 (1): 3328. https://doi.org/10.1038/s41598-023-29924-y.
14. Miceli F., Millevert C., Soldovieri M.V., et al. KCNQ2 R144 variants cause neurodevelopmental disability with language impairment and autistic features without neonatal seizures through a gain-of-function mechanism. EBioMedicine. 2022; 81: 104130. https://doi.org/10.1016/j.ebiom.2022.104130.
15. Soldovieri M.V., Freri E., Ambrosino P., et al. Gabapentin treatment in a patient with KCNQ2 developmental epileptic encephalopathy. Pharmacol Res. 2020; 160: 105200. https://doi.org/10.1016/j.phrs.2020.105200.
16. Borggraefe I., Wagner M. Precision therapy in KCNQ2-related epilepsy. Neuropediatrics. 2023; 54 (5): 295–6. https://doi.org/10.1055/s-0043-1772667.
17. Zimmern V., Minassian B., Korff C. A review of targeted therapies for monogenic epilepsy syndromes. Front Neurol. 2022; 13: 829116. https://doi.org/10.3389/fneur.2022.829116.
Об авторах
А. Г. МаловРоссия
Малов Александр Германович – д.м.н., доцент кафедры неврологии и медицинской генетики
ул. Петропавловская, д. 26, Пермь, 614000
Т. П. Калашникова
Россия
Калашникова Татьяна Павловна – д.м.н., профессор кафедры неврологии и медицинской генетики
ул. Петропавловская, д. 26, Пермь, 614000
Н. А. Вдовина
Россия
Вдовина Наталья Анатольевна – врач-невролог отделения неврологии
ул. Героев Хасана, д. 10А, Пермь, 614010
Рецензия
Для цитирования:
Малов А.Г., Калашникова Т.П., Вдовина Н.А. Клинические особенности эволюционной и эпилептической энцефалопатии, вызванной мутацией в гене KCNQ2. Эпилепсия и пароксизмальные состояния. 2023;15(4):354-360. https://doi.org/10.17749/2077-8333/epi.par.con.2023.171
For citation:
Malov А.G., Kalashnikova Т.P., Vdovina N.А. Clinical features of developmental and epileptic encephalopathy caused by KCNQ2 gene mutation. Epilepsy and paroxysmal conditions. 2023;15(4):354-360. https://doi.org/10.17749/2077-8333/epi.par.con.2023.171

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































