Перейти к:
Этиопатогенетические механизмы эпилепсии и сравнительная характеристика экспериментальных моделей аудиогенной эпилепсии
https://doi.org/10.17749/2077-8333/epi.par.con.2023.161
Аннотация
Эпилепсия – распространенное неврологическое хроническое заболевание, для которого характерны повторяющиеся припадки, проявляющиеся в виде кратковременных парциальных или генерализованных судорог и сопровождающиеся потерей сознания. Для правильного подбора способа лечения эпилепсии необходимо исследовать факторы, вызывающие ее развитие, однако не всегда удается выявить причину заболевания и подобрать адекватное лечение. Лекарственная устойчивость остается одной из главных проблем при лечении эпилепсии, несмотря на большое количество работ, описывающих ее природу. В связи с этим следует подобрать модель для изучения эпилептических припадков и их механизмов, поиска генов, участвующих в регуляции эпилепсии, а также оценки эффективности и безопасности новых противоэпилептических препаратов. Отмечено, что грызуны, в особенности крысы Крушинского–Молодкиной, являются подходящей генетической моделью аудиогенной эпилепсии для изучения механизмов эпилептогенеза, генетических основ предрасположенности к судорожным состояниям, развития лекарственной устойчивости и тестирования новых противоэпилептических лекарств. Несмотря на то что аудиогенная форма рефлекторной эпилепсии достаточно редко встречается у человека, выявлено, что в реализации аудиогенных припадков грызунов и эпилепсии человека участвуют одни и те же гены, молекулярные механизмы и сигнальные пути, возникают сходные нейроанатомические аномалии.
Для цитирования:
Бажанова Е.Д., Козлов А.А., Соколова Ю.О. Этиопатогенетические механизмы эпилепсии и сравнительная характеристика экспериментальных моделей аудиогенной эпилепсии. Эпилепсия и пароксизмальные состояния. 2023;15(4):372-383. https://doi.org/10.17749/2077-8333/epi.par.con.2023.161
For citation:
Bazhanova Е.D., Kozlov А.А., Sokolova Yu.О. Etiopathogenetic mechanisms of epilepsy and comparative characteristics of audiogenic epilepsy experimental models. Epilepsy and paroxysmal conditions. 2023;15(4):372-383. https://doi.org/10.17749/2077-8333/epi.par.con.2023.161
ВВЕДЕНИЕ / INTRODUCTION
Как известно, любой мозг имеет склонность к припадкам, которые возникают, когда возбудимость области или областей превышает определенный порог. Эпилепсия представляет собой группу гетерогенных неврологических состояний, при которых один или множество факторов различной природы приводят к снижению внутреннего судорожного порога, что увеличивает склонность к спонтанным повторным припадкам [1]. Это хроническое неврологическое заболевание, характеризующееся повторяющимися спонтанными приступами. От него страдает приблизительно 0,5–1,0% населения мира [2].
Распространенность и частота эпилепсии незначительно выше у мужчин по сравнению с женщинами и, как правило, достигает пика в пожилом возрасте вместе с другими заболеваниями нервной системы: нейродегенеративными, инсультами и злокачественными опухолями. Общий прогноз эпилепсии благоприятный для большинства пациентов, и 55–68% из них имеют тенденцию к достижению длительной ремиссии [3], но в случае генерализованных тонико-клонических припадков, ночных приступов и так называемой рефрактерной, или лекарственно-устойчивой, эпилепсии нередок смертельный исход [4].
Развитие эпилепсии может быть связано с множеством разнообразных факторов, включая генетическую предрасположенность, дисфункцию развития, черепно-мозговые травмы, которые ежегодно получают свыше 64–74 млн человек [5], химическое воздействие, гипоксию и инсульт. Почти в 30% случаев не удается выяснить причину, а следовательно, и подобрать адекватное лечение.
Существует несколько гипотез о природе лекарственной устойчивости (фармакокинетическая, транспортная, гипотеза нейронной сети, внутренней сложности, генетическая и эпигенетическая, гипотеза мишени и гипотеза, ставящая на первое место нейровоспаление и апоптоз), но ни одна из них не в состоянии объяснить ее причины. Скорее всего, в случае каждого отдельного пациента резистентность опосредуется несколькими механизмами, вклад которых может варьировать, в т.ч. во времени. Несмотря на появление новых противоэпилептических препаратов с различными механизмами действия, лекарственная устойчивость остается одной из главных проблем при лечении эпилепсии [6].
Апоптоз нейронов и глиальных клеток головного мозга имеет большое значение в патогенезе эпилепсии, особенно лекарственно-устойчивых форм. Частые и продолжительные припадки приводят к повреждению головного мозга, но даже короткие одиночные приступы могут индуцировать развитие апоптоза нейронов и глии. Аберрантная гибель нейронов является одной из основных причин хронических нейродегенеративных заболеваний [7][8].
КЛАССИФИКАЦИЯ И ПРИЧИНЫ ЭПИЛЕПСИИ /
CLASSIFICATION AND CAUSES OF EPILEPSY
Классификация / Classification
Первая международная классификация эпилепсии и эпилептических синдромов была принята в 1989 г. и впоследствии пересмотрена Международной Противоэпилептической Лигой (англ. International League Against Epilepsy, ILAE). На данный момент эпилепсия классифицируется в соответствии с пересмотренной терминологией и концепциями организации припадков и эпилепсий [9][10]. Новая классификация не представляет фундаментального изменения понимания природы эпилепсии, но обеспечивает бо́льшую гибкость и прозрачность для диагностики [11]. Согласно этой многоуровневой классификации каждый случай эпилепсии у человека рассматривается с нескольких сторон: тип припадка, локализация (фокальная, генерализованная, комбинированная фокально-генерализованная и неклассифицированная), характеристики эпилептического синдрома и его этиология (рис. 1). Отправной точкой здесь является тип приступа, который может иметь фокальное, генерализованное и неизвестное начало. Многие формы эпилепсии включают несколько типов одновременно, существует группа комбинированных генерализованных и фокальных эпилепсий. В случае неуточненной эпилепсии диагноз поставить трудно из-за недостаточности имеющихся данных, например отсутствия или ошибок электроэнцефалографии.
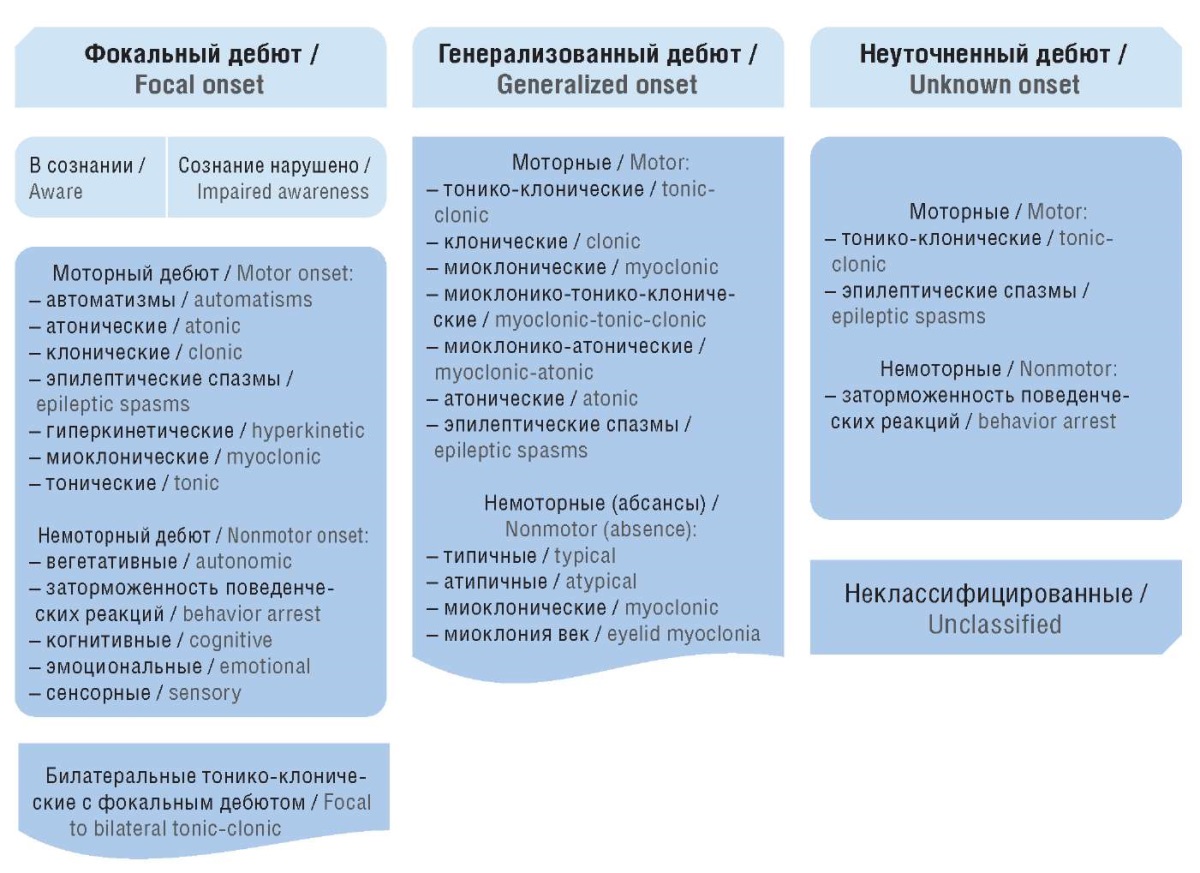
Рисунок 1. Расширенная рабочая классификация типов приступов
Международной Противоэпилептической Лиги (ILAE) 2017 г.
Figure 1. International League Against Epilepsy (ILAE) 2017 classification
of seizure types expanded version
По типам припадки разделяют на атонические с потерей сознания и быстрым восстановлением, клонические (нерегулярные кратковременные судороги, характеризующиеся быстрым периодическим сокращением и расслаблением мышц), тонические с длительным напряжением мускулатуры, миоклонические с быстрыми сокращениями различных групп мышц и бессудорожные, при которых человек просто теряет сознание [11]. По локализации и степени вовлеченности структур мозга выделяют фокальные, генерализованные, комбинированные и неуточненные формы эпилепсии (см. рис. 1).
Совокупность характеристик включает тип припадка, показания электроэнцефалографии, других методик нейровизуализации, а также признаки коморбидности.
Причины / Causes
Согласно текущей классификации причины эпилепсии делятся на шесть категорий: структурные, генетические, инфекционные, метаболические, иммунные и оставшиеся невыясненными. При этом у конкретного пациента эпилепсия может иметь более чем одну причину [10][12].
Для структурной эпилепсии характерны врожденные или приобретенные повреждения тех или иных структур головного мозга: инсульты, травмы, аномалии развития. Теоретически любое структурное поражение головного мозга может привести к судорогам и эпилепсии. К наиболее распространенным и часто подлежащим хирургическому удалению повреждениям относятся склероз гиппокампа, опухоли, пороки развития коры и питающих ее сосудов, глиальные рубцы после травм и инсультов, участки, пострадавшие от воспаления.
Генетические причины эпилепсии – это различные мутации. Классические эпидемиологические исследования показали, что примерно в 1/4 случаев эпилепсии в основе лежит приобретенная причина – травмы, инсульты, инфекции и другие заболевания. В остальных 75% случаев найти ее не удается, и во многих из них виноваты гены. Кроме того, роль генетических факторов может быть существенна, даже если причина эпилепсии ясна [13].
Развитие методик секвенирования нового поколения позволяет выявлять все больше генов, которые вносят вклад в этиологию эпилепсии, в т.ч. очень редких вариантов. При этом лишь небольшая часть эпилепсий относится к моногенным заболеваниям, а в основе большинства лежит неправильная работа множества генов. Каждая отдельная мутация может не представлять особой опасности, но вместе они приводят к развитию эпилепсии. Идентификация мутаций имеет решающее значение, поскольку некоторые из них потенциально излечимы. В случае отдельных генетически обусловленных эпилепсий, например патологий натриевых каналов, велик риск внезапной смерти пациента.
Частично пересекаются с ними метаболические причины – нарушения обмена веществ, часто наследственные. Приобретенные метаболические нарушения могут возникать из-за почечной или печеночной недостаточности, сахарного диабета, дефицита питательных веществ, отравлений токсикантами или лекарственными препаратами. Многие из этих факторов приводят к судорогам, но не к эпилепсии. Врожденные нарушения метаболизма нечасты среди причин эпилепсии, хотя выявлено более 200 генетических, в т.ч. митохондриальных, нарушений обмена веществ, связанных с эпилепсией. Часто они плохо поддаются лечению или пополняют число случаев рефрактерной эпилепсии. К таковым относится пиридоксин-зависимая эпилепсия с мутацией гена антиквитина (ALDH7A1) [14].
Инфекционные эпилепсии развиваются как следствие перенесенных или хронических нейроинфекций, включая внутриутробные. Любая тяжелая системная инфекция, даже не затронувшая головной мозг, вызывает метаболические нарушения и может запустить аутоиммунные процессы. Но именно церебральные инфекции, вызываемые бактериями, вирусами, грибками и паразитами, являются одной из наиболее частых причин судорог и эпилепсии во всем мире, особенно в развивающихся странах. Судороги могут многократно (в 18 раз в случае с бактериальным менингитом) увеличить летальность и без того смертоносного заболевания. В наиболее бедных регионах, таких как страны Африки к югу от Сахары, инфекции становятся причиной эпилепсии у 1/4 пациентов [15].
Эпилепсия также может быть аутоиммунным заболеванием. Аутоиммунные процессы редко затрагивают мозг, но ряд патологий, таких как системная красная волчанка, саркоидоз, целиакия, болезнь Бехчета и энцефалопатия Хашимото, влияют на функции головного мозга. В настоящее время известно множество антител, связанных с судорогами, однако патогенное значение некоторых аутоантител, специфически связанных с судорогами, до сих пор неясно. Доказано, что значительная часть эпилепсий у пациентов с невыясненной этиологией имеет аутоиммунную причину [16].
У многих больных эпилепсией причина ее неизвестна. В этой категории невозможно поставить конкретный диагноз, кроме основной электроклинической симптоматики, такой как эпилепсия лобной доли. Эта этиология не абсолютна, т.к. возможности диагностики в разных медицинских учреждениях и странах различаются [10].
Все эти причины могут комбинироваться, либо могут так и не быть раскрыты. В последнее время к ним можно добавить нейродегенеративные факторы [1][9]. Важно учитывать наличие сопутствующих заболеваний у каждого пациента с эпилепсией на каждом этапе классификации, что позволяет осуществлять раннее выявление, диагностику и соответствующее лечение [10].
РЕФЛЕКТОРНАЯ ЭПИЛЕПСИЯ / REFLEX EPILEPSY
С припадками сталкивается каждый десятый человек на планете. Они могут возникать в самых разных случаях и при разных заболеваниях. Не все судорожные состояния можно считать эпилепсией, но эпилепсия – это любое расстройство, при котором спонтанное повторение неспровоцированных припадков является основным симптомом [17].
Рефлекторные приступы представляют собой эпилептические явления, которые объективно и последовательно случаются в ответ на определенный афферентный стимул или активность больного. Разнообразие таких стимулов чрезвычайно велико – от вспышки света, физических упражнений, испуга, приема пищи, прослушивания музыки, просмотра телевизора, видеоигр, чтения книги, до сложных внутренних.
Эпилептические припадки, которые явно провоцируются специфическим перцептивным стимулом, впервые были обнаружены во II веке н.э. Рефлекторные эпилепсии классифицируются как специфический синдром, при котором все эпилептические приступы провоцируются сенсорными стимулами. При этом у большинства пациентов наряду с такими приступами возникают и обычные для эпилепсии спонтанные.
Общая распространенность рефлекторной эпилепсии составляет 4–7% у всех больных эпилепсией и более 21% при идиопатической генерализованной эпилепсии. Наиболее распространенными стимулами у человека являются визуальные, составляющие до 75–80% от общего числа случаев. При этом важно отметить, что судороги, вызванные отменой препарата, лихорадкой, сильным эмоциональным дистрессом, потерей сна и прочими факторами, не считаются эпилепсией [18].
Аудиогенная и музыкогенная эпилепсия /
Audiogenic and musicogenic epilepsy
Частным случаем рефлекторной эпилепсии является аудиогенная, которая встречается у животных, в т.ч. и у человека [19]. Классическая аудиогенная эпилепсия, когда приступы вызываются простыми акустическими стимулами, у людей практически не наблюдается, а рефлекторные слуховые эпилепсии, классифицируемые как идиопатические генерализованные, вызываются сложными комбинациями звуков, воспоминаний, эмоционального состояния и пр. [20].
Данная форма эпилепсии чрезвычайно редка, частота ее встречаемости составляет приблизительно 1 случай на 10 млн человек с преобладанием у женщин. Точная распространенность аудиогенной и музыкогенной эпилепсии неизвестна, т.к. пациенты часто не считают звуковые раздражители триггером, а при электроэнцефалографии звук для провокации приступа не используется. Описания припадков, вызванных музыкой, появились еще в 1841 г., а в 1937 г. музыкогенная эпилепсия была выделена в отдельную форму, но с 1884 по 2007 гг. в мире было зарегистрировано лишь 110 таких случаев [21].
Приступы чаще всего фокальные, с нарушением сознания или без него, исходят из височных долей, с редкой вторичной генерализацией. Была выдвинута гипотеза, что в основе такой эпилепсии может лежать нарушение регуляции гиппокампа и префронтальной коры, опосредованное изменением дофаминергической передачи сигналов, стрессом и эмоциональной дисрегуляцией [18]. Это состояние известно более 75 лет, но до сих пор полностью не исследовано. В некоторых случаях приступы могут быть спровоцированы одной мыслью о мелодии, а эпилептиформная активность может быть предотвращена или прекращена прослушиванием какой-либо другой музыки. Триггерами также могут быть другие звуки, например звон колоколов или работа механизмов [22].
Музыкогенные припадки отличаются от простых стимульных аудиогенных сложностью триггера и, вероятно, связаны с эмоциональным аспектом восприятия музыки либо с памятью. Этот вид эпилепсии обычно развивается в более позднем возрасте, чем обычная аудиогенная [23].
АУДИОГЕННАЯ ЭПИЛЕПСИЯ У ЖИВОТНЫХ /
AUDIOGENIC EPILEPSY IN ANIMALS
Однако аудиогенная эпилепсия не редкость у животных, для которых слух играет гораздо более важную роль, при этом от качества слуха и быстрой реакции на опасность зависит их выживание. Приступы развиваются по сходной схеме у животных разных видов и генотипов. Для изучения механизмов эпилептогенеза, поиска связанных с эпилепсией генов и регуляторных путей, а также тестирования новых противоэпилептических препаратов большое значение имеют модельные лабораторные животные – как интактные, так и генетически предрасположенные к возникновению припадков. Среди этого многообразия выделяются именно генетические модели аудиогенной эпилепсии.
Кошки / Cats
Аудиогенные судороги отмечены у кошек и получили название «кошачьи аудиогенные рефлекторные припадки» (англ. feline audiogenic reflex seizures, FARS). Они чаще всего проявляются у животных в возрасте старше 15 лет с сопутствующими заболеваниями и индуцируются звуками высокой частоты, лежащими в диапазоне около 40 кГц, такими как шуршание фольги, звон стекла, телефонный звонок или работа сигнализации. У некоторых кошек при этом наблюдаются спонтанные миоклонические судороги без явного шумового раздражителя.
Заболевание имеет наследственную природу, т.к. встречается чаще среди бирманских кошек. Одной из загадок синдрома являются аудиогенные припадки у глухих кошек или при серьезных нарушениях слуха. Возможно, у таких животных не была затронута область улитки, воспринимающая высокие частоты, и они лишь кажутся глухими для человека [24][25].
Кошки не нашли применения в качестве лабораторных животных для изучения аудиогенной эпилепсии, поскольку судороги у них проявляются в позднем возрасте, когда у животных имеется множество сопутствующих заболеваний, и не являются стабильным синдромом. Кроме того, возраст появления судорог (15 лет) делает неудобным использование их в качестве модели.
Куры / Chikens
Аудиогенной, а также фотогенной рефлекторной эпилепсией из-за аутосомной рецессивной мутации страдают куры линии Фаюми (Fayoumi, Fepi). У всех кур Fepi наблюдаются вызванные звуком судороги от вылупления из яйца до зрелого возраста. Источник припадка у них локализован в стволе головного мозга, что делает кур потенциально хорошей моделью для изучения наследственных рефлекторных эпилептических синдромов животных и человека [26].
Грызуны / Rodents
Однако большинство исследований выполняется на грызунах. Помимо основных преимуществ грызунов, таких как простота содержания, нетребовательность к пище и быстрый темп размножения, относительно короткий срок жизни, близкая к человеку морфофизиология, для них характерны стабильный характер судорог, отсутствие необходимости инвазивных воздействий и введения токсичных химических соединений, простота визуализации и хорошая воспроизводимость результатов [27].
Эпилепсия у грызунов, несомненно, носит наследственный характер. Первым подтверждением этого стала успешная селекция линий крыс с аудиогенной эпилепсией с последующим повышением пенетрантности и частоты судорог. Независимо от вида и линии грызунов, склонных к судорогам в ответ на звуковую стимуляцию, у них обнаружено повышение акустических порогов, таких как пороги кохлеарных потенциалов действия, и разнообразные морфологические аномалии улитки наряду с нейрохимическими отклонениями, дисфункцией ионных каналов, дисбалансами в ГАМК-1 и глутаматергической системах. Во всех случаях просматриваются множественные параллели между аудиогенными судорогами и защитной реакцией избегания опасности [28].
Рассмотрим некоторые из линий грызунов, склонных к аудиогенным припадкам и используемых в лабораторной практике.
Мыши линии Black Swiss считаются хорошей моделью рефлекторной эпилепсии у человека. У многих линий мышей с аудиогенными припадками часто наблюдается потеря слуха, что усложняет приписывание патогенеза аномальной возбудимости мозга, однако линия Black Swiss лишена этого недостатка. Она была получена от скрещивания мышей линий National Institutes of Health Swiss и C57BL/6. В дальнейшем у таких мышей случайно были обнаружены типичные аудиогенные судороги, восприимчивость к которым наследовалась как простой рецессивный признак [29]. За развитие судорог у них ответственен локус jams1 на 10-й хромосоме, ограниченный маркером D10Mit140 и геном BSG (Basigin). Эта область в значительной степени похожа на область человеческой хромосомы 19p13.3, которая вовлечена в семейные ювенильные фебрильные судороги. Локус jams1 содержит 128 известных или предсказанных генов, один из которых (HCN2) кодирует субъединицу потенциал-зависимого ионного канала. Каналы HCN имеют решающее значение для возбудимости клеток, а роль субъединицы HCN2 в патогенезе генерализованной эпилепсии и в фебрильных судорогах у грызунов достоверно известна [30].
У белых мышей линии Frings также наблюдаются аудиогенные судороги, но уже в сочетании с потерей слуха. За развитие этих симптомов ответственен ген MASS1, который теперь обозначается как MGR1 с неизвестной, но важной для развития центральной нервной системы функцией [31]. Он кодирует VLGR1 (англ. very large G-protein coupled receptor 1 – очень большой рецептор 1, связанный с G-белком), также известный как MASS1 (англ. monogenic audiogenic seizure-susceptible 1 – моногенный аудиогенный чувствительный к судорогам 1), который представляет собой орфанный рецептор, связанный с G-белком [32].
К аудиогенным судорогам склонны мыши линии DBA/2 [33]. Для этих животных характерно формирование эпилептических очагов в коре головного мозга и частая гибель во время судорог [34]. Эта модель не лишена недостатков: с возрастом все меньшее количество животных реагирует на звук судорогами [35].
Первый сирийский хомячок с аудиогенной эпилепсией появился на свет спонтанно в Университете Вальядолида (Испания), где эта линия получила название GPG:Vall, а затем был передан в Университет Саламанки, где на его основе выведена линия GASH:Sal [36]. Хомячки из Саламанки линии GASH/Sal демонстрируют индуцированные громким звуком судороги, сходные с генерализованными тоническими судорогами, наблюдаемыми у пациентов с эпилепсией. Однако генетическая основа судорог у хомячков остается пока неясной. Секвенирование их генома позволило выявить 342 варианта, из которых 21 был классифицирован как мутации с высоким уровнем воздействия, а функциональный анализ показал нарушения в работе 44 путей, в т.ч. связанных с глутаматергическими синапсами [37]. Также для хомячков характерны проблемы со слухом. Кохлеарная гистопатология показала сохранение сенсорных волосковых клеток при потере нейронов спирального ганглия и атрофии сосудистой полоски, а также аномалии ретикулярной пластинки. Стереоцилии волосковых клеток располагались в беспорядке, отсутствовали или отличались большой длиной. На молекулярном уровне отмечались паттерны аномальной экспрессии генов prestin, cadherin 23, protocadherin 15, везикулярных переносчиков глутамата 1 (VGLUT1) и 2 (VGLUT2), указывая на восходящее распространение аномальной глутаматергической передачи по первичному акустическому пути в эпилептогенную область [38].
Генетическая предрасположенность к аудиогенной эпилепсии у крыс была выявлена еще в 1906 г., когда в Вистаровском институте (США) вывели существующую до сих пор аутбредную линию крыс Wistar. Среди них были животные, реагировавшие на громкий звук эпилептиморфными припадками [39]. С тех пор на их основе в разных странах было создано несколько линий крыс с аудиогенной эпилепсией.
Генетически предрасположенные к эпилепсии крысы (англ. genetically epilepsy-prone rat, GEPR) представляют собой две независимо выведенные линии GEPR-3 и GEPR-9, приступы у которых различаются по степени тяжести. Приступы у животных GEPR-3 умеренные, с генерализованным клонусом головы и передних конечностей, которые типичны при локализации эпилептического очага в переднем мозге и возникают в ответ на стандартный звуковой раздражитель. Приступы у животных GEPR-9 тяжелые, их тонико-клонические судороги всех конечностей напоминают последствия удара электрическим током, а эпилептический очаг локализован в стволе головного мозга. Эпилепсия не является фармакорезистентной и хорошо поддается лечению множеством уже имеющихся и экспериментальных противоэпилептических препаратов [40–42]. Крысы линии GEPR-3 демонстрируют высокий уровень тревожности, нарушения памяти и распознавания новых объектов. В основе этого, а также судорожного синдрома лежат общие генетические нарушения [43].
Крысы линии Wistar с аудиогенной эпилепсией (англ. Wistar audiogenic rat, WAR) были выведены более 25 лет назад в Бразилии. В ответ на аудиогенную стимуляцию у них развиваются тонико-клонические припадки. Основные нейроэтиологические, электрофизиологические, клеточные и молекулярные протоколы подтверждают, что WAR являются подходящими и надежными модельными животными для изучения эпилепсии [42].
Выведенная в Китае линия крыс P77PMC генетически предрасположена к аудиогенным судорогам, а также имеет сниженный уровень холецистокинина, селективного антагониста опиоидной анальгезии [45]. От обычных крыс Wistar их отличает характер экспрессии более 15 генов в коре головного мозга, среди которых уровни экспрессии 13 генов повышены по сравнению с Wistar, а уровни экспрессии 2 генов снижены [46].
Также имеются сведения о генетически предрасположенных к аудиогенным судорогам крысах (англ. Wistar audiogenic susceptible, WAS) [47] и крысах с генетической абсансной эпилепсией (англ. genetic absence epilepsy rat strain, GAERS) из Страсбурга (Франция), для которых характерны рекуррентные генерализованные бессудорожные припадки в 100% случаев [48], о нидерландской линии Wistar Albine Glaxo/Rijswijk (WAG/Rij) [49], японских WER (англ. Wakayama epileptic rats) [50], IGER (англ. Ihara genetically epileptic rat) [51], NER (англ. Noda epileptic rat) [52] и SER (англ. spontaneously epileptic rats) [53].
История линии крыс Крушинского–Молодкиной началась, когда в 1947–1948 гг. натуралист, кинолог, физиолог и нейробиолог Л.В. Крушинский, а также его коллеги и ученики Л.Н. Молодкина и Д.А. Флесс изучали общую возбудимость центральной нервной системы и эффекты ее модуляции. Результатом их работы стали крысы Wistar, реагировавшие на звуки звонка диким бегом с последующими судорогами. К 1948 г. они оформились в отдельную линию, большинство животных из которой проявляли одинаковую реакцию. Несмотря на закрытие лаборатории и запрет генетики в СССР, Л.В. Крушинскому было разрешено продолжить селекцию крыс для исследования аудиогенной эпилепсии [54]. Судороги у них развиваются в ответ на звуковой стимул с вероятностью до 99% [55]. В 1980-х гг. крысы Крушинского–Молодкиной были приведены в инбредное состояние. Их генетическую однородность подтверждают как биохимические анализы, так и реципрокная изотрансплантация кожи [56].
В настоящее время помимо оригинальной инбредной линии крыс Крушинского–Молодкиной существуют еще две, полученные в 2000-х гг. путем гибридизации с обычными крысами Wistar и поддерживаемые более 30 поколений: Линия 4 с максимальной интенсивностью судорог и Линия 0, не реагирующая на звук. Имея сходную генетику, они участвуют в тех же экспериментах по исследованию коморбидности эпилепсии и других патологических состояний, а также их влияния на эпилепсию и мозг. Помимо аудиогенных припадков крысы Крушинского–Молодкиной склонны к кровоизлияниям в мозг и могут служить также моделью нарушений мозгового кровообращения. Подобной триады не существует ни для одной из описанных выше линий экспериментальных животных, выведенных на десятилетия позже [57].
Как и другие животные с генетически обусловленной аудиогенной эпилепсией, крысы линии Крушинского–Молодкиной отличаются от предков линии Wistar по ряду биохимических, поведенческих и нейрофизиологических особенностей. В частности, у них имеют место гиперфункция щитовидной железы и нарушения нейромедиаторных систем мозга, высокая нейропластичность и возбудимость [58]. Для этих крыс характерны нарушения нейрогенеза в гиппокампе по сравнению с обычными крысами Wistar. Если у обычных крыс нейрональные прогениторные клетки дифференцируются как в ГАМК-ергические, так и в глутаматергические нейроны, то у крыс линии Крушинского–Молодкиной отмечаются в основном глутаматергические клетки. Столь явный дисбаланс между возбуждающими и тормозными сигналами в головном мозге при избыточной активности возбуждающей глутаматергической системы является одним из основных механизмов предрасположенности к судорогам. В их гиппокампе отмечается повышенная экспрессия внеклеточной сигнально-регулируемой киназы (англ. еxtracellular signal-regulated kinase 1/2, ERK1/2), участвующей в дифференцировке нейронов. У мышей подобные изменения сопровождаются спонтанными судорогами, у человека высокая активность ERK1/2 выявляется в эпилептических очагах коры головного мозга больных неокортикальной эпилепсией. У крыс Крушинского–Молодкиной повышена активность и других сигнальных путей, например PKA, Akt, у человека однозначно связанных с эпилепсией [59][60]. У этих крыс снижен также сам уровень пролиферации нейральных прогениторных клеток по сравнению с крысами Wistar из-за снижения уровня активности сигнального пути Akt/Gsk3b/b-catenin/CREB. При торможении пролиферации у животных данной линии наблюдается активация дифференцировки [61].
Все эти нарушения отражаются на поведении крыс Крушинского–Молодкиной даже в отсутствие звуковой стимуляции и судорог. Это выражается в повышенном уровне тревожности, дефиците социальных взаимодействий, стремлении избегать незнакомых животных и сниженной локомоторной активности. Крысы не проявляют интереса к исследованию, часто замирают на месте. Подобные изменения поведения наблюдаются у человека при расстройствах аутистического спектра, однако у крыс Крушинского–Молодкиной не выявлено никаких проявлений гиперактивности [62][63].
ЗАКЛЮЧЕНИЕ / CONCLUSION
За последние 80 лет модели исследования на животных, в основном грызунах, были ключом к разработке новых методов лечения эпилепсии. В экспериментах с ними были открыты и прошли испытания множество противосудорожных препаратов, позже вошедших в клиническую практику. Все это подтверждает ценность животных для выявления новых лекарств для пациентов с эпилепсией, в т.ч. считающейся фармакорезистентной. Эффективность противоэпилептических препаратов демонстрирует, что модели животных по природе судорог и реакции на лечение напоминают эпилепсию человека, что является логической предпосылкой для любой программы разработки лекарств. Для эпилепсии как ни для какого другого заболевания центральной нервной системы на животных достигнута высокая прогностическая ценность.
Полезным инструментом для изучения потенциала противоэпилептогенных или модифицирующих заболевание лекарств стали генетические модели эпилепсии, среди которых выделяются крысы с аудиогенными судорогами. Полученные на них данные можно использовать для предотвращения генетической эпилепсии у восприимчивых людей, многие формы которой не поддаются терапии имеющимися препаратами.
Любые модельные животные – не более чем простое представление сложной системы, и на них невозможно воспроизвести все аспекты заболевания человека. Тем не менее они играют и будут играть роль в идентификации и разработке лекарств, которые помогут пациентам с лекарственной устойчивостью.
Таким образом, несмотря на отсутствие у человека эпилептических приступов в ответ на простые звуковые стимулы и крайнюю их редкость в ответ на сложные, модели аудиогенной эпилепсии у грызунов могут быть признаны адекватными для изучения механизмов эпилептогенеза, генетических основ предрасположенности к судорожным состояниям, развития лекарственной устойчивости и тестирования новых противоэпилептических препаратов. За аудиогенными припадками грызунов и эпилепсией человека стоят одни и те же гены, нейроанатомические аномалии, молекулярные механизмы и сигнальные пути.
1. ГАМК – гамма-аминомасляная кислота.
Список литературы
1. Balestrini S., Arzimanoglou A., Blümcke I., et al. The aetiologies of epilepsy. Epileptic Disord. 2021; 23 (1): 1–16. https://doi.org/10.1684/epd.2021.1255.
2. Ong M., Kohane I.S., Cai T., et al. Population-level evidence for an autoimmune etiology of epilepsy. JAMA Neurol. 2014; 71 (5): 569–74. https://doi.org/10.1001/jamaneurol.2014.188.
3. Beghi E., Giussani G., Sander J.W. The natural history and prognosis of epilepsy. Epileptic Disord. 2015; 17 (3): 243–53. https://doi.org/10.1684/epd.2015.0751.
4. Beghi E. The epidemiology of epilepsy. Neuroepidemiology. 2020; 54 (2): 185–91. https://doi.org/10.1159/000503831.
5. Mukherjee S., Arisi G.M., Mims K., et al. Neuroinflammatory mechanisms of post-traumatic epilepsy. J Neuroinflammation. 2020; 17 (1): 193. https://doi.org/10.1186/s12974-020-01854-w.
6. Bazhanova E.D., Kozlov A.A., Litovchenko A.V. Mechanisms of drug resistance in the pathogenesis of epilepsy: role of neuroinflammation. a literature review. Brain Sci. 2021; 11 (5): 663. https://doi.org/10.3390/brainsci11050663.
7. Sokolova T.V., Zabrodskaya Y.M., Litovchenko A.V., et al. Relationship between neuroglial apoptosis and neuroinflammation in the epileptic focus of the brain and in the blood of patients with drug-resistant epilepsy. Int J Mol Sci. 2022; 23 (20): 12561. https://doi.org/10.3390/ijms232012561.
8. Litovchenko A.V., Zabrodskaya Y.M., Sitovskaya D.A., et al. Markers of neuroinflammation and apoptosis in the temporal lobe of patients with drug-resistant epilepsy. J Evol Biochem Phys. 2021; 57 (5): 1040–9. https://doi.org/10.1134/S0022093021050069.
9. Блинов Д.В. Эпилептические синдромы: определение и классификация Международной Противоэпилептической Лиги 2022 года. Эпилепсия и пароксизмальные состояния. 2022; 14 (2): 101–82. https://doi.org/10.17749/2077-8333/epi.par.con.2022.123.
10. Scheffer I.E., Berkovic S., Capovilla G., et al. ILAE classification of the epilepsies: position paper of the ILAE Commission for Classification and Terminology. Epilepsia. 2017; 58 (4): 512–21. https://doi.org/10.1111/epi.13709.
11. Fisher R.S., Cross J.H., French J.A., et al. Operational classification of seizure types by the International League Against Epilepsy: position paper of the ILAE Commission for Classification and Terminology. Epilepsia. 2017; 58 (4): 522–30. https://doi.org/10.1111/epi.13670.
12. Авакян Г.Н., Блинов Д.В., Лебедева А.В. и др. Классификация эпилепсии Международной Противоэпилептической Лиги: пересмотр и обновление 2017 года. Эпилепсия и пароксизмальные состояния. 2017; 9 (1): 6–25. https://doi.org/10.17749/2077-8333.2017.9.1.006-025.
13. Perucca P., Bahlo M., Berkovic S.F. The genetics of epilepsy. Annu Rev Genomics Hum Genet. 2020; 21: 205–30. https://doi.org/10.1146/annurev-genom-120219-074937.
14. Reddy C., Saini A.G. Metabolic epilepsy. Indian J Pediatr. 2021; 88 (10): 1025–32. https://doi.org/10.1007/s12098-020-03510-w.
15. Preux P.M., Druet-Cabanac M. Epidemiology and aetiology of epilepsy in sub-Saharan Africa. Lancet Neurol. 2005; 4 (1): 21–31. https://doi.org/10.1016/S1474-4422(04)00963-9.
16. Husari K.S., Dubey D. Autoimmune epilepsy. Neurotherapeutics. 2019; 16 (3): 685–702. https://doi.org/10.1007/s13311-019-00750-3.
17. Shneker B.F., Fountain N.B. Epilepsy. Dis Mon. 2003; 49 (7): 426–78. https://doi.org/10.1016/s0011-5029(03)00065-8.
18. Hanif S., Musick S.T. Reflex epilepsy. Aging Dis. 2021; 12 (4): 1010–20. https://doi.org/10.14336/AD.2021.0216.
19. Ross K.S., Coleman J.R. Developmental and genetic audiogenic seizure models: behavior and biological substrates. Neurosci Biobehav Rev. 2000; 24 (6): 639–53. https://doi.org/10.1016/s0149-7634(00)00029-4.
20. Wolf P. Reflex epileptic mechanisms in humans: lessons about natural ictogenesis. Epilepsy Behav. 2017; 71 (Pt. B): 118–23. https://doi.org/10.1016/j.yebeh.2015.01.009.
21. Maguire M.J. Music and epilepsy: a critical review. Epilepsia. 2012; 53 (6): 947–61. https://doi.org/10.1111/j.1528-1167.2012.03523.x.
22. Okudan Z.V., Özkara Ç. Reflex epilepsy: triggers and management strategies. Neuropsychiatr Dis Treat. 2018; 14: 327–37. https://doi.org/10.2147/NDT.S107669.
23. Stern J. Musicogenic epilepsy. Handb Clin Neurol. 2015; 129: 469–77. https://doi.org/10.1016/B978-0-444-62630-1.00026-3.
24. Lowrie M., Bessant C., Harvey R.J., et al. Audiogenic reflex seizures in cats. J Feline Med Surg. 2016; 18 (4): 328–36. https://doi.org/10.1177/1098612X15582080.
25. Lowrie M., Thomson S., Bessant C., et al. Levetiracetam in the management of feline audiogenic reflex seizures: a randomised, controlled, open-label study. J Feline Med Surg. 2017; 19 (2): 200–6. https://doi.org/10.1177/1098612X15622806.
26. Fadlallah N., Guy N., Teillet M.A., et al. Brain chimeras for the study of an avian model of genetic epilepsy: structures involved in sound and light-induced seizures. Brain Res. 1995; 675 (1–2): 55–66. https://doi.org/10.1016/0006-8993(95)00038-r.
27. Garbuz D.G., Davletshin A.А., Litvinova S.A., et al. Rodent models of audiogenic epilepsy: genetic aspects, advantages, current problems and perspectives. Biomedicines. 2022; 10 (11): 2934. https://doi.org/10.3390/biomedicines10112934.
28. Fedotova I.B., Surina N.M., Nikolaev G.M., et al. Rodent brain pathology, audiogenic epilepsy. Biomedicines. 2021; 9 (11): 1641. https://doi.org/10.3390/biomedicines9111641.
29. McLean M.J., Engström S., Qinkun Z., et al. Effects of a static magnetic field on audiogenic seizures in black Swiss mice. Epilepsy Res. 2008; 80 (2–3): 119–31. https://doi.org/10.1016/j.eplepsyres.2008.03.022.
30. Italiano D., Striano P., Russo E., et al. Genetics of reflex seizures and epilepsies in humans and animals. Epilepsy Res. 2016; 121: 47–54. https://doi.org/10.1016/j.eplepsyres.2016.01.010.
31. Klein B.D., Fu Y.H., Ptacek L.J., White H.S. Auditory deficits associated with the frings Mgr1 (Mass1) mutation in mice. Dev Neurosci. 2005; 27 (5): 321–32. https://doi.org/10.1159/000086712.
32. Shin D., Lin S.T., Fu Y.H., Ptácek L.J. Very large G protein-coupled receptor 1 regulates myelin-associated glycoprotein via Gαs/Gαq-mediated protein kinases A/C. Proc Natl Acad Sci USA. 2013; 110 (47): 19101–6. https://doi.org/10.1073/pnas.1318501110.
33. Irizarry R., Sukato D., Kollmar R., et al. Seizures induce obstructive apnea in DBA/2J audiogenic seizure-prone mice: lifesaving impact of tracheal implants. Epilepsia. 2020; 61 (2): e13–6. https://doi.org/10.1111/epi.16431.
34. Takao T., Murakami H., Fukuda M., et al. Transcranial imaging of audiogenic epileptic foci in the cortex of DBA/2J mice. Neuroreport. 2006; 17 (3): 267–71. https://doi.org/10.1097/01.wnr.0000201505.61373.42.
35. Шмидт Е.Ф. Инбредные мыши в моделировании эпилептиформных аудиогенных припадков для тестирования противосудорожных препаратов. Биомедицина. 2006; 1 (4): 121–3.
36. Muñoz L.J., Carballosa-Gautam M.M., Yanowsky K., et al. The genetic audiogenic seizure hamster from Salamanca: the GASH:Sal. Epilepsy Behav. 2017; 71 (Pt. B): 181–92. https://doi.org/10.1016/j.yebeh.2016.03.002.
37. Díaz-Casado E., Gómez-Nieto R., De Pereda J.M., et al. Analysis of gene variants in the GASH/Sal model of epilepsy. PLoS One. 2020; 15 (3): e0229953. https://doi.org/10.1371/journal.pone.0229953.
38. Sánchez-Benito D., Hyppolito M.A., Alvarez-Morujo A.J., et al. Morphological and molecular correlates of altered hearing sensitivity in the genetically audiogenic seizure-prone hamster GASH/Sal. Hear Res. 2020; 392: 107973. https://doi.org/10.1016/j.heares.2020.107973.
39. Ross K.S., Coleman J.R. Developmental and genetic audiogenic seizure models: behavior and biological substrates. Neurosci Biobehav Rev. 2000; 24 (6): 639–53. https://doi.org/10.1016/s0149-7634(00)00029-4.
40. Dailey J.W., Yan Q.S., Adams-Curtis L.E., et al. Neurochemical correlates of antiepileptic drugs in the genetically epilepsy-prone rat (GEPR). Life Sci. 1996; 58 (4): 259–66. https://doi.org/10.1016/0024-3205(95)02286-4.
41. Jobe P.C., Mishra P.K., Adams-Curtis L.E., et al. The genetically epilepsy-prone rat (GEPR). Ital J Neurol Sci. 1995; 16 (1–2): 91–9. https://doi.org/10.1007/BF02229080.
42. Merrill M.M., Clough R.W., Jobe P.C., Browning R.A. Brainstem seizure severity regulates forebrain seizure expression in the audiogenic kindling model. Epilepsia. 2005; 46 (9): 1380–8. https://doi.org/10.1111/j.1528-1167.2005.39404.x.
43. Aguilar B.A., Malkova L., N'Gouemo P., Forcelli P.A. Genetically epilepsy-prone rats display anxiety-like behaviors and neuropsychiatric comorbidities of epilepsy. Front Neurol. 2018; 9: 476. https://doi.org/10.3389/fneur.2018.00476.
44. Garcia-Cairasco N., Umeoka E.H.L., de Oliveira J.A.C. The Wistar Audiogenic Rat (WAR) strain and its contributions to epileptology and related comorbidities: history and perspectives. Epilepsy Behav. 2017; 71 (Pt. B): 250–73. https://doi.org/10.1016/j.yebeh.2017.04.001.
45. Zhang L.X., Li X.L., Wang L., Han J.S. Rats with decreased brain cholecystokinin levels show increased responsiveness to peripheral electrical stimulation-induced analgesia. Brain Res. 1997; 745 (1–2): 158–64. https://doi.org/10.1016/s0006-8993(96)01095-5.
46. Bo X., Zhiguo W., Xiaosu Y., et al. Analysis of gene expression in genetic epilepsy-prone rat using a cDNA expression array. Seizure. 2002; 11 (7): 418–22. https://doi.org/10.1053/seiz.2002.0685.
47. Marescaux C., Vergnes M., Kiesmann M., et al. Kindling of audiogenic seizures in Wistar rats: an EEG study. Exp Neurol. 1987; 97 (1): 160–8. https://doi.org/10.1016/0014-4886(87)90290-1.
48. Vergnes M., Marescaux C., Micheletti G., et al. Spontaneous paroxysmal electroclinical patterns in rat: a model of generalized non-convulsive epilepsy. Neurosci. Lett. 1982; 33 (1): 97–101. https://doi.org/10.1016/0304-3940(82)90136-7.
49. van Luijtelaar E.L., Coenen A.M. Two types of electrocortical paroxysms in an inbred strain of rats. Neurosci Lett. 1986; 70 (3): 393–7. https://doi.org/10.1016/0304-3940(86)90586-0.
50. Tsubota Y., Miyashita E., Miyajima M., et al. The Wakayama epileptic rat (WER), a new mutant exhibiting tonic-clonic seizures and absence-like seizures. Exp Anim. 2003; 52 (1): 53–62. https://doi.org/10.1538/expanim.52.53.
51. Amano S., Ihara N., Uemura S., et al. Development of a novel rat mutant with spontaneous limbic-like seizures. Am J Pathol. 1991; 149 (1): 329–36.
52. Noda A., Hashizume R., Maihara T., et al. NER rat strain: a new type of genetic model in epilepsy research. Epilepsia. 1998; 39 (1): 99–107. https://doi.org/10.1111/j.1528-1157.1998.tb01281.x.
53. Serikawa T., Yamada J. Epileptic seizures in rats homozygous for two mutations, zitter andtremor. J Hered. 1986; 77 (6): 441–4. https://doi.org/10.1093/oxfordjournals.jhered.a110277.
54. Poletaeva I.I., Surina N.M., Kostina Z.A., et al. The Krushinsky–Molodkina rat strain: the study of audiogenic epilepsy for 65 years. Epilepsy Behav. 2017; 71 (Pt. B): 130–41. https://doi.org/10.1016/j.yebeh.2015.04.072.
55. Дорофеева Н.А., Никитина Д.С., Зосен Д.В. и др. Функциональное состояние нигростриатной системы крыс линии Крушинского–Молодкиной в ходе аудиогенных судорог. Вавиловский журнал генетики и селекции. 2016; 20 (2): 204–11. https://doi.org/10.18699/VJ16.146.
56. Копаладзе Р.А. Рефлекторная эпилепсия у крыс линии Крушинского–Молодкиной, вызванная гипобарической декомпрессией. Патогенез. 2016; 14 (4): 35–42.
57. Сурина Н.М., Полетаева И.И., Федотова И.Б. Модель эпилепсии – крысы линии Крушинского–Молодкиной (КМ). Доклад на XIII международном междисциплинарном конгрессе «Нейронаука для медицины и психологии». Судак, Крым, Россия, 9 июня 2017. URL: https://istina.msu.ru/conferences/presentations/92560701/ (дата обращения 03.06.2023).
58. Ватаев С.И. Специфические особенности крыс линии Крушинского–Молодкиной как генетической модели генерали - зованных судорожных припадков. Российский физиологический журнал им И.М. Сеченова. 2019; 105 (6): 667–79. https://doi.org/10.1134/S0869813919060104.
59. Naumova A.A., Oleynik E.A., Chernigovskaya E.V., Glazova M.V. Glutamatergic fate of neural progenitor cells of rats with inherited audiogenic epilepsy. Brain Sci. 2020; 10 (5): 311. https://doi.org/10.3390/brainsci10050311.
60. Солюс Г.М., Ревищин А.В., Павлова Г.В., Полетаева И.И. Аудиогенная эпилепсия и ГАМКергическая система нижнего двухолмия у крыс линии Крушинского–Молодкиной. Доклады Академии наук. 2016: 466 (2): 237. https://doi.org/10.7868/S0869565216020298.
61. Сапарова В.Б., Черниговская Е.В., Глазова М.В. Характеристика нейрональных стволовых клеток крыс Крушинского–Молодкиной. В кн.: Материалы XXIII съезда Физиологического общества им. И.П. Павлова с международным участием. Воронеж, 18–22 сентября 2017 г. Воронеж: Истоки; 2017: 1633–5.
62. Ребик А.А., Рига В.Д., Смирнов К.С. и др. Поведенческие особенности крыс линии Крушинского–Молодкиной в тестах зоосоциального взаимодействия. В кн.: Сборник тезисов XXVI научной школы-конференции молодых ученых по физиологии высшей нервной деятельности и нейрофизиологии. Москва, 26–27 октября 2022 г. М.: КвантМедиа; 2022: 251–6. https://doi.org/10.24412/cl-36993-2022-1-251-256.
63. Löscher W. Animal models of seizures and epilepsy: past, present, and future role for the discovery of antiseizure drugs. Neurochem Res. 2017; 42 (7): 1873–88. https://doi.org/10.1007/s11064-017-2222-z.
Об авторах
Е. Д. БажановаРоссия
Бажанова Елена Давыдовна – д.б.н., заведующая лабораторией морфологии и электронной микроскопии; ведущий научный сотрудник
Scopus Author ID: 6701718880
ул. Бехтерева, д. 1, Санкт-Петербург, 192019;
пр-т Тореза, д. 44, Санкт-Петербург, 194223
А. А. Козлов
Россия
Козлов Александр Александрович – научный сотрудник лаборатории морфологии и электронной микроскопии
WoS ResearcherID: 57194517307;
Scopus Author ID: 57224219098
ул. Бехтерева, д. 1, Санкт-Петербург, 192019
Ю. О. Соколова
Россия
Соколова Юлия Олеговна – к.б.н., научный сотрудник лаборатории морфологии и электронной микроскопии
ул. Бехтерева, д. 1, Санкт-Петербург, 192019
Рецензия
Для цитирования:
Бажанова Е.Д., Козлов А.А., Соколова Ю.О. Этиопатогенетические механизмы эпилепсии и сравнительная характеристика экспериментальных моделей аудиогенной эпилепсии. Эпилепсия и пароксизмальные состояния. 2023;15(4):372-383. https://doi.org/10.17749/2077-8333/epi.par.con.2023.161
For citation:
Bazhanova Е.D., Kozlov А.А., Sokolova Yu.О. Etiopathogenetic mechanisms of epilepsy and comparative characteristics of audiogenic epilepsy experimental models. Epilepsy and paroxysmal conditions. 2023;15(4):372-383. https://doi.org/10.17749/2077-8333/epi.par.con.2023.161

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.









































