Перейти к:
Постинфекционная эпилепсия: особенности клиники и диагностики
https://doi.org/10.17749/2077-8333/epi.par.con.2024.157
Аннотация
Актуальность. Нейроинфекции повышают риск развития эпилепсии. Многие годы считалось, что ведущую роль в генезе эпилептического процесса постинфекционной этиологии играют острые инфекционные заболевания – вирус клещевого энцефалита и менингококк. Что же касается хронически протекающих персистирующих инфекций, то их роль была не до конца изучена.
Цель: выявить клинические, диагностические и морфологические особенности локально обусловленной эпилепсии (ЛОЭ) постинфекционной этиологии как в дебюте заболевания при появлении первых эпилептических приступов на фоне острого инфекционного процесса, так и при их повторении на фоне хронически протекающей персистирующей инфекции.
Материал и методы. Материалом для данного исследования послужило наблюдение 1500 пациентов с ЛОЭ, находившихся на стационарном и амбулаторном лечении в различных лечебных учреждениях в период с 2007 по 2017 гг. Постинфекционная ЛОЭ с четкой причинно-следственной связью между перенесенным нейроинфекционным заболеванием и дебютом эпилептических приступов имела место у 127 больных (1-я группа). В когорте пациентов с повторяющимися эпилептическими приступами при первичных обращениях наличие инфекционных факторов в генезе ЛОЭ в виде хронически протекающей персистирующей инфекции было заподозрено более чем у 1/3 лиц из 1373 человек, обратившихся за медицинской помощью, что составило 550 человек (2-я группа). Таким образом, итоговая выборка включила 677 человек. Помимо клинической оценки состояния пациентов были выполнены инструментальные исследования, в т.ч. рутинная электроэнцефалография (ЭЭГ), видео-ЭЭГ-мониторинг сна, магнитно-резонансная томография (МРТ), а ряду пациентов также было проведено патоморфологическое исследование с применением электронно-микроскопических и гистологических методик.
Результаты. При видео-ЭЭГ-мониторинге у пациентов 1-й группы наиболее часто выявлялись грубые и выраженные диффузные нарушения биоэлектрической активности головного мозга (58% и 31% соответственно), а умеренно выраженные фиксировались реже (11% наблюдений). Во 2-й группе большинство диффузных нарушений биоэлектрической активности головного мозга были умеренно выраженными (79%), а легкие и ирритативные регистрировались реже (в 21% случаев). По данным МРТ, нарушения со стороны амигдало-гиппокампальной системы наблюдались у 41 больного (32%) в 1-й группе и у 211 (38%) во 2-й группе. В результате гистологических и электронно-микроскопических исследований у больных с ЛОЭ постинфекционной этиологии выявлен ряд общих морфологических нарушений с описанными в литературе митохондриальными энцефаломиопатиями (мегакония и плейокония митохондрий), а также совокупность специфических проявлений, характерных для данной патологии.
Заключение. Выполненные клинические, нейрофизиологические, нейровизуализационные и патоморфологические исследования при постинфекционной эпилепсии позволили выявить специфические особенности развития данного заболевания на разных его этапах – от зарождения на фоне острого инфекционного процесса до его хронизации при персистирующей инфекции. Установлено, что комплексный анализ наличия и воздействия инфекционных агентов у пациентов с эпилептическими приступами имеет важное значение в течении и прогнозе постинфекционной эпилепсии, что представляется актуальным для своевременной диагностики и разработки специфической медикаментозной фармакотерапии.
Для цитирования:
Василенко А.В., Улитин А.Ю., Онищенко Л.С., Ананьева Н.И., Гребенщикова Р.В., Гайкова О.Н., Иваненко А.В., Колосов С.С., Туранов С.А., Чудиевич С.Н. Постинфекционная эпилепсия: особенности клиники и диагностики. Эпилепсия и пароксизмальные состояния. 2024;16(1):18-32. https://doi.org/10.17749/2077-8333/epi.par.con.2024.157
For citation:
Vasilenko А.V., Ulitin А.Yu., Onishchenko L.S., Ananyeva N.I., Grebenshchikova R.V., Gaykova О.N., Ivanenko А.V., Kolosov S.S., Turanov S.А., Chudievich S.N. Postinfectious epilepsy: clinical and diagnostical features. Epilepsy and paroxysmal conditions. 2024;16(1):18-32. https://doi.org/10.17749/2077-8333/epi.par.con.2024.157
ВВЕДЕНИЕ / INTRODUCTION
В основе ряда неврологических заболеваний, в т.ч. и эпилепсии, по мнению некоторых авторов, лежат возбудители нейроинфекций [1–5]. Многие годы считалось, что ведущую роль в генезе эпилептического процесса постинфекционной этиологии играют острые инфекционные заболевания – вирус клещевого энцефалита и менингококк [5–11]. Что же касается хронически протекающих персистирующих инфекций, в определенной степени тропных к центральной нервной системе и вызывающих хроническое воспаление, таких как вирусы простого герпеса человека (преимущественно 1-го, 2-го, 6-го, 7-го типов и их различных сочетаний), цитомегаловирус, вирус Эпштейна–Барр (мононуклеоз), вирус иммунодефицита, а также токсо- и микоплазма, то их значение в развитии эпилептического процесса изучалось в экспериментальных и клинических условиях [12–18].
Однако именно феномен персистирования инфекции является тем вариантом взаимодействия макро- и микроорганизма на клеточном уровне, который позволяет возбудителю длительное время находиться в организме человека. Этим процессам может способствовать ослабленный генетический контроль иммунного ответа [12][19][20]. Длительная антигенная стимуляция при персистировании инфекции приводит к хроническому воспалению и формированию реакции организма, подобной состоянию иммунной недостаточности, что в сочетании с наследственным снижением иммунитета, особенно с факторами врожденной предрасположенности к эпилепсии, на фоне запуска механизма демиелинизации может приводить к хронизации патологического процесса и развитию эпилепсии1 [21–24]. Некоторые авторы предполагали наличие взаимосвязи между хроническим воспалением и развитием склероза гиппокампа, обусловливающим не только возникновение эпилептических приступов, но и тяжелое, нередко статусное течение заболевания и даже фармакорезистентность [25–27].
Кроме того, большое количество научных работ свидетельствует о том, что оксидантный стресс, приводящий к повреждению основных компонентов клетки (липиды, белки, нуклеиновые кислоты, гликоген и пр.), также играет важную роль в патогенезе эпилепсии [28][29]. Таким образом, хроническое воспаление и оксидантный стресс, вызванные персистирующей нейроинфекцией, могут не только принимать участие в формировании эпилептического процесса, но и влиять на развитие фармакорезистентности у больных с постинфекционными формами эпилепсии. Однако получены доказательства нейропластичности центральной нервной системы, которая у некоторых пациентов может обусловливать хотя и кратковременное, но относительно благоприятное течение заболевания даже в условиях коморбидности эпилепсии и хронической персистирующей нейроинфекции [30].
Несмотря на большое количество работ по эпилептогенезу постинфекционной этиологии, корреляции между клинико-диагностическими и морфологическими особенностями изучены недостаточно, в связи с чем и предпринято настоящее исследование.
Цель – выявить клинические, диагностические и морфологические особенности локально обусловленной эпилепсии (ЛОЭ) постинфекционной этиологии как в дебюте заболевания при появлении первых эпилептических припадков на фоне острого инфекционного процесса, так и при их повторении на фоне хронически протекающей персистирующей инфекции.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Материалом для данного ретроспективного нерандомизированного исследования стали наблюдения 1500 пациентов с ЛОЭ в период с 2007 по 2017 гг., находившихся на стационарном и амбулаторном лечении в различных клиниках г. Санкт-Петербурга и Ленинградской обл.
Критерии включения и исключения / Inclusion and exclusion criteria
Критериями включения послужили дебют эпилепсии на фоне острой инфекции или повторяющиеся приступы на фоне персистирующей инфекции. Критериями исключения являлись отказ от госпитализации с выполнением люмбальной пункции, проведением диагностики для верификации возбудителя.
Группы пациентов / Patient groups
Постинфекционная ЛОЭ с четкой причинно-следственной связью между перенесенным нейроинфекционным заболеванием (острым менингитом, менингоэнцефалитом и др.) и дебютом эпилептических приступов имела место у 127 больных, которые вошли в 1-ю группу.
В когорте пациентов с повторяющимися эпилептическими приступами при первичных обращениях наличие инфекционных факторов в генезе ЛОЭ в виде хронически протекающей персистирующей инфекции было заподозрено более чем у 1/3 лиц из 1373 человек, обратившихся за медицинской помощью, что составило 550 пациентов, которые были включены во 2-ю группу.
Таким образом, итоговая выборка составила 677 человек.
Методы обследования / Examination methods
У всех включенных в исследование пациентов выполнялись клинико-неврологические, нейрофизиологические (электроэнцефалографический (ЭЭГ) видеомониторинг с обязательной записью сна), нейровизуализационные (магнитно-резонансная томография (МРТ) головного мозга по специальной эпилептической программе), лабораторные (анализ крови, ликвора и слюны на инфекционные маркеры) и в отдельных случаях гистологические и электронно-микроскопические исследования (ЭМИ), материал для которых приготавливали по общепринятым методикам [31][32].
Магнитно-резонансная томография
МРТ выполняли пациентам в ФГБУ «Национальный медицинский исследовательский центр психиатрии и неврологии им. В.М. Бехтерева» Минздрава России на томографе Atlas Exelart Vantage XGV (Canon, Япония) с силой индукции магнитного поля 1,5 Tл. Использовали стандартную 8-канальную катушку для головы. Для исследования головного мозга применяли стандартный алгоритм МРТ-исследования, который включает в себя импульсные последовательности быстрого спинового эха (англ. fast spin echo, FSE) для получения Т1-взвешенных изображений (Т1-ВИ) и Т2-взвешенных изображений (Т2-ВИ), а также последовательность инверсии – восстановления с подавлением сигнала от жидкости (англ. fluid attenuated inversion recovery, FLAIR), обеспечивающая подавление сигнала свободной воды при сохранении базовой Т2-взвешенности изображения.
Для получения Т2-ВИ использовали следующие параметры: TR (англ. repetition time) 4300; ТЕ (англ. echo time) 105; FOV (англ. field of view) 25,0; MTX (англ. matrix) 320; ST (англ. slice thickness) 6,0; Gap 1,2; FA (англ. flip angle) 90/160. Для получения Т1-ВИ: TR 540; TE 15; FOV 5; MTX 256; ST 6,0; GAP 1,2; FA 90/180. FLAIR выполняли со следующими параметрами: TR 1000; TE 105; FOV 25; MTX 224×320; ST 6,0; GAP 1,2; FA 90/180.
Для прицельного исследования медиобазальных отделов височных долей применяли дополнительный протокол, включающий выполнение FLAIR-oblique Cor и Ax: Real IR-oblique Cor с толщиной среза 2,2 мм. Данные изображения получаются в косой аксиальной (параллельно к длинной оси гиппокампа) и косой коронарной (перпендикулярно к длинной оси гиппокампа) плоскостях, хорошо демонстрируют структуры медиобазальных отделов височных долей: энторинальную кору, головку, тело и хвост гиппокампа, височные рога боковых желудочков, цистерны основания мозга. FLAIR выполняли со следующими параметрами: TR 8000; TE 105; FOV 22,0; MTX 30; ST 2,2; GAP 0,6; FA 90/180. Real IR – с параметрами: TR 3450; TE 18; FOV 22; MTX 320; ST 2,2; GAP 0,6; FA 90/160.
Гистологические и электронно-микроскопические исследования
У пациентов обеих групп под местным наркозом для световой микроскопии и ЭМИ были взяты биоптаты четырехглавой мышцы бедра. Для световой микроскопии кусочки биоптата фиксировали в 10% нейтральном формалине и после промывки в воде обезвоживали в спиртах восходящей концентрации (от 70 до 96 градусов), после этого заливали в парафин. Изготовленные парафиновые срезы толщиной 7–10 мкм окрашивали гематоксилином и эозином, анализировали в световом микроскопе и фотографировали при увеличении в 200–600 раз.
Для ЭМИ материал фиксировали в 2,5% растворе глютарового альдегида, приготовленном на фосфатном буфере в течение 4–18 ч, затем дофиксировали в течение 1 ч в 1% растворе четырехокиси осмия на том же фосфатном буфере (уровень рН буфера в обоих случаях составлял 7,4 ед.). После отмывки в этом же буфере и обезвоживания в спиртах возрастающей концентрации (от 70 до 96 градусов) и ацетоне кусочки погружали в смесь эпоксидных смол (эпон, аралдит) и подвергали полимеризации в термостате при температуре от 37 до 60 °С в течение 2–3 сут. Изготовленные на ультратоме LKB (Швеция) полутонкие срезы толщиной не более 1 мкм окрашивали в 1% растворе толуидинового синего по методу Ниссля, анализировали и фотографировали в световом микроскопе при увеличении в 200–1000 раз. Далее из этих же блоков изготавливали ультратонкие срезы толщиной 200–400 нм для анализа в трансмиссионном электронном микроскопе 100 CX (JEOL, Япония) при увеличении в 8–333 тыс. раз, которые фотографировали для получения электронограмм. Электронограммы оцифровывали для получения иллюстраций.
Этические аспекты / Ethical aspects
Исследование соответствовало принципам Хельсинкской декларации Всемирной медицинской ассоциации (Форталеза, Бразилия, 2013 г.). Все включенные пациенты подписали форму информированного согласия на участие в исследовании и публикацию результатов.
Статистический анализ / Statistical analysis
Статистическую обработку данных проводили с использованием пакета прикладных программ Statistica for Windows (StatSoft Inc., США) в соответствии с рекомендациями по обработке результатов медико-биологических исследований [33]. Все результаты подвергались многофакторному анализу, основой которого являлись матрицы парных корреляций между элементами матриц исходных данных. Численные результаты морфологических и цитохимических исследований обработаны методами вариационной статистики. Различия считали статистически значимыми при р<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Лабораторные и инструментальные исследования / Laboratory and instrumental studies
У 127 пациентов 1-й группы в дебюте эпилептических приступов в 30% наблюдений имел место серозный менингоэнцефалит, в 3,5% – гнойный менингоэнцефалит, в 11,5% – инфекционный мононуклеоз, в 9% – цитомегаловирусная инфекция, в 15% – перенесенное во взрослом возрасте детское инфекционное заболевание (наиболее часто ветряная оспа), в 3% – хламидиоз, в 7% – клещевой энцефалит, в 1% – боррелиоз, в 3% – вирус простого герпеса человека с клиническими проявлениями, в 1% – активная хроническая микоплазменная инфекция, в 16% – неуточненные и микст-инфекции.
Во 2-й группе пациентов с повторяющимися эпилептическими приступами наличие хронически протекающей персистирующей инфекции было заподозрено на основании длительного (устойчивого) субфебрилитета, отмечавшегося достаточно часто в продроме эпилептических припадков, а также общемозговой и астенической симптоматики с признаками воспаления по данным общеклинических и инструментальных исследований.
При лабораторном анализе биологических сред у пациентов 2-й группы с повторяющимися эпилептическими припадками и установленным диагнозом «эпилепсия» была диагностирована герпетическая микст-инфекция, подтвержденная положительными анализами полимеразной цепной реакции с антигенами вируса простого герпеса 1-го и 2-го типов, вируса Эпштейна–Барр, цитомегаловируса, вирусов простого герпеса человека 6-го и 7-го типов в различных сочетаниях (табл. 1). Абсолютное большинство составляли пациенты с повторяющимися эпилептическими приступами и наличием вирусов простого герпеса человека 6-го и 7-го типов, вируса Эпштейна–Барр и цитомегаловируса, а также их различных сочетаний.
Таблица 1. Результаты лабораторной диагностики маркеров нейроинфекций
в биологических средах (анализ полимеразной цепной реакции)
Table 1. Results of laboratory diagnostics for neuroinfection-related markers
in biological fluids (polymerase chain reaction analysis)
|
Антигены / Antigens |
Число пациентов, % / Number of patients, % |
|
HPV |
6,29 |
|
Антигены микоплазмы / Mycoplasma antigens |
9,45 |
|
Антигены хламидий / Chlamydia antigens |
7,27 |
|
HSV 1/2 |
10,24 |
|
CMV |
19,69 |
|
EBV |
51,97 |
|
HHV 6 |
69,29 |
|
HHV 7 |
39,37 |
Примечание. HPV ( англ. human papillomavirus) – вируспапилломычеловека;
HSV (англ. herpes simplex virus) – вируспростогогерпеса;
CMV (англ. cytomegalovirus) – цитомегаловирус;
EBV (англ. Epstein–Barr virus) – вирусЭпштейна–Барр;
HHV (англ. human herpes virus) – вирусгерпесачеловека.
Note. HPV – human papillomavirus; HSV – herpes simplex virus;
CMV – cytomegalovirus; EBV – Epstein–Barr virus; HHV – human herpes virus.
Необходимо отметить, что при клиническом наблюдении больных с выявленной микст-инфекцией эпилептические припадки протекали как сложные фокальные, вторично-генерализованные судорожные (тонические, тонико-клонические) с высокой частотой (11,79±5,65 в месяц), тенденцией к серийному и статусному течению. У 70% пациентов заболевание характеризовалось фармакорезистентностью. В то же время у больных с одним типом выявленной хронической инфекции и/или с инфекцией, находящейся в неактивной фазе (после курса лечения), эпилептические приступы чаще протекали как простые и сложные фокальные, а вторично-генерализованные судорожные наблюдались несколько реже (4,60±1,75 в месяц) (табл. 2).
Таблица 2. Клиническая характеристика эпилептических приступов
в зависимости от этиологии инфекционного возбудителя
Table 2. Infectious agent-related clinical characteristics of epileptic seizures
|
Инфекционный агент / Infectious agent |
Число пациентов, n / Number of patients, n |
Частота эпилептических приступов в месяц, n / Frequency of epileptic seizures per month, n |
р |
|
|
Простые фокальные (без судорожного компонента) / Simple focal (without seizures) |
Сложные фокальные, в т.ч. с вторичной генерализацией / Complex focal, including secondary generalized |
|||
|
1-й тип инфекции / Type 1 infection |
225 |
4,45±3,95 |
4,60±1,75 |
<0,01 |
|
Микст-инфекция / Mixt-infection |
452 |
1,5±2,35 |
11,79±5,65 |
|
Помимо этого, у большинства пациентов 1-й группы по данным клинико-неврологического обследования определялась очаговая неврологическая, пирамидная, общемозговая и даже менингеальная симптоматика, являвшаяся этиологическим отражением перенесенного острого инфекционного процесса, – 127 больных (100%).
У пациентов 2-й группы с хронически протекающей персистирующей инфекцией неврологическая симптоматика была менее значимой и в большинстве случаев (478 (87%)) была представлена астеническим, вегетативно-дистоническим, умеренным гипертензионно-гидроцефальным и/или цефалгическим синдромами, что ограничивало привычную деятельность (p<0,05).
Видео-ЭЭГ-мониторинг / Video-EEG monitoring
При видео-ЭЭГ-мониторинге у пациентов 1-й группы с дебютом эпилептических приступов на фоне острого инфекционного процесса наиболее часто выявлялись грубые и выраженные диффузные нарушения биоэлектрической активности головного мозга (58% и 31% соответственно), а умеренно выраженные фиксировались реже (11% наблюдений). Что касается локальных и пароксизмальных нарушений, то у большинства больных этой группы регистрировались изменения с наиболее частой зоной локализации в височных и/или лобно-височных, теменных отведениях, а разряды эпилептической (эпилептиформной) активности в виде отдельных острых волн, комплексов «острая – медленная волна» и «пик – медленная волна» не отличались устойчивостью и относительным постоянством, что свидетельствует о еще не сформировавшемся очаге эпилептиформной активности (p<0,01).
Во 2-й группе пациентов с постинфекционной эпилепсией и наличием хронически протекающей персистирующей инфекции по данным видео-ЭЭГ-мониторинга большинство диффузных нарушений биоэлектрической активности головного мозга были умеренно выраженными (79%), а легкие и ирритативные регистрировались реже (в 21% случаев). По данным ЭЭГ-исследований у абсолютного большинства (72%) больных 2-й группы определялась локальная эпилептиформная активность в виде стойкого очага, а в 28% наблюдений выявлялось более одного очага эпилептиформной активности (рис. 1).
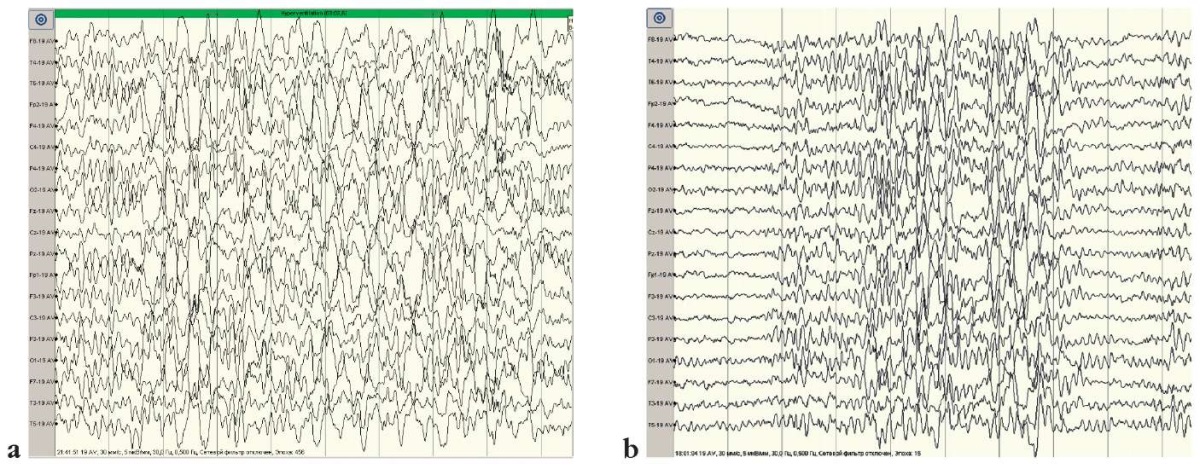
Рисунок 1. Результаты электроэнцефалографического мониторинга
у двух пациентов из 1-й (а) и 2-й (b) групп
Figure 1. Results of electroencephalographic monitoring
in two patients from Group 1 (a) and Group 2 (b)
МРТ головного мозга / Brain MRI
При МРТ головного мозга у больных с постинфекционной ЛОЭ выявлялись внутренняя и/или наружная заместительная гидроцефалия (43%), асимметрия боковых желудочков и/или расширение височного рога одного из них (72%), расширение щелей субарахноидального пространства (33%), локальная или диффузная атрофия коры (32%), краниовертебральные аномалии (32%), склероз гиппокампа и его различные варианты строения в виде инверсии или округлой формы (36%), кистозно-глиозные изменения (27%), внутримозговые арахноидальные кисты (5%) (табл. 3).
Таблица 3. Клиническая характеристика эпилептических приступов
в зависимости от этиологии инфекционного возбудителя
по результатам магнитно-резонансной томографии (МРТ)
Table 3. Infectious agent-related clinical characteristics of epileptic seizures
based on magnetic resonance imaging (MRI) data
|
МРТ-изменения / MRI pathology |
Число пациентов, n / Number of patients, n |
р |
|
|
1-я группа / Group 1 |
2-я группа / Group 2 |
||
|
Внутренняя и/или наружная заместительная гидроцефалия // Internal and/or external substitutional hydrocephalus |
127 |
164 |
<0,01 |
|
Асимметрия боковых желудочков / Asymmetry of lateral ventricles |
124 |
363 |
<0,05 |
|
Расширение щелей субарахноидального пространства / Expanded arachnoid space fissures |
103 |
120 |
<0,01 |
|
Локальная или диффузная атрофия коры / Local or diffuse cortical atrophy |
22 |
194 |
<0,05 |
|
Краниовертебральные аномалии / Craniovertebral anomalies |
41 |
176 |
<0,01 |
|
Нарушения гиппокампов / Impaired hippocampi |
32 |
211 |
<0,01 |
|
Кистозно-глиозные изменения / Cystic-gliotic changes |
21 |
161 |
<0,05 |
|
Внутримозговые арахноидальные кисты / Intracerebral arachnoid cysts |
5 |
29 |
<0,05 |
|
Очаги демиелинизации / Foci of demyelination |
3 |
184 |
<0,05 |
|
Другое / Others |
6 |
28 |
>0,05 |
Нарушения со стороны амигдало-гиппокампальной системы наблюдались у 41 больного (32%) в 1-й группе и у 211 пациентов (38%) во 2-й группе, что показывает предрасположенность к возникновению эпилептических приступов в обеих группах наблюдения.
У больных с ЛОЭ и рассеянным склерозом отмечалось преобладание кортикальных и субкортикальных очагов демиелинизации, а также фокальная кортикальная атрофия различной локализации, псевдотуморозные очаги демиелинизации (рис. 2) [34].
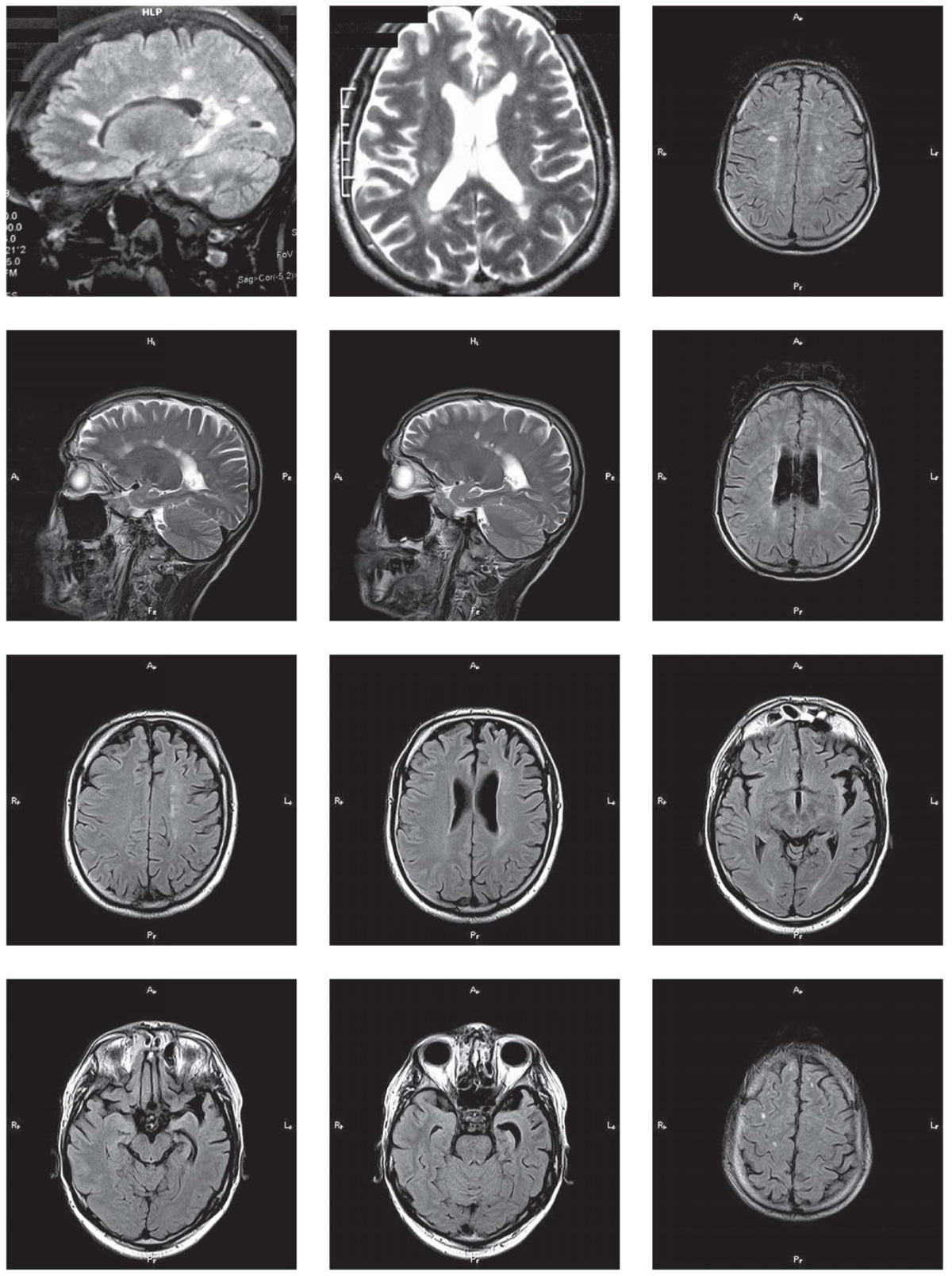
Рисунок 2. Магнитно-резонансные томограммы головного мозга
у пациентов с локально обусловленной эпилепсией и рассеянным склерозом
Figure 2. Magnetic resonance images
of patients with locally induced epilepsy and multiple sclerosis
Гистологическое и электронно-микроскопическое исследования / Histological and electron microscopic studies
При гистологическом исследовании мышц пациентов 2-й группы с ЛОЭ постинфекционной этиологии обнаружены лимфомакрофагальные инфильтраты, свидетельствующие об умеренном воспалении мышц, коррелировавшем с длительностью инфекционного процесса. Поперечная исчерченность была выражена слабо. Многие мышечные волокна расщеплены, иногда имели змеевидную форму и признаки гипотрофии (рис. 3). Периодически встречалась многоядерность, являющаяся генетическим отражением хронического патологического (инфекционного) процесса. В некоторых мышечных волокнах ядра располагались в центре волокна, что может свидетельствовать о запуске генетических перестроек под воздействием хронически протекающей персистирующей инфекции.
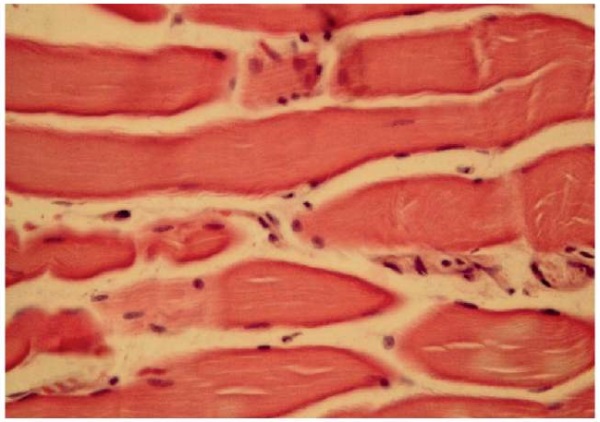
Рисунок 3. Участок биоптата пациента из 2-й группы с расщеплением волокон,
слабой поперечной исчерченностью и умеренной лимфомакрофагальной инфильтрацией
(окраска гематоксилином и эозином, ув. ×600)
Figure 3. Biopsy specimen of a patient from Group 2 showing fiber splitting,
weak transverse striation, and moderate lymphocyte-macrophage infiltration
(hematoxylin and eosin staining, magnification ×600)
При ЭМИ биоптатов пациентов 2-й группы с ЛОЭ постинфекционной этиологии поперечная исчерченность мышечных пучков нередко отсутствовала, а в ряде участков миофибриллы вообще располагались хаотически. В исследованных биоптатах I-диски определялись хуже, чем Z-диски, однако толщина последних была неодинаковой, а их фрагменты встречались и в пространстве между пучками миофибрилл. Данный факт указывает на снижение сократительной способности мышц, причинами которого может быть длительное (хроническое) воздействие инфекционных агентов. Об этом же свидетельствует различная толщина миофибрилл, их истончение и разрывы, а также змеевидность структуры волокон. Кроме того, в отдельных участках встречались картины лизиса целых пучков миофибрилл, чаще на уровне I-дисков. В этих участках находились крупные прозрачные вакуоли саркоплазматической сети и практически отсутствовал гликоген (рис. 4).

Рисунок 4. Электронограмма биоптата пациента из 2-й группы
с локально обусловленной эпилепсией постинфекционной этиологии
с хаотическим расположением миофибрилл (ув. ×20 000)
Figure 4. Electronogram of biopsy specimen of a patient from Group 2
with post-infection locally induced epilepsy
showing chaotic arrangement of myofibrils (magnification ×20,000)
Помимо этого, при ЭМИ биоптатов у пациентов 2-й группы с постинфекционной эпилепсией среди измененных пучков миофибрилл встречались многочисленные измененные митохондрии (плейокония) с прозрачным содержимым вследствие исчезновения матрикса и крист, и в некоторых из них были видны мелкие гранулы. В исследованных биоптатах достаточно часто наблюдались митохондрии гигантских размеров (мегакония) с разрушенными кристами и гранулами неясного генеза, а также митохондрии с более плотной структурой, но без четкой дифференцировки матрикса и крист. Подобные митохондрии обнаруживались и среди пучков миофибрилл с полным отсутствием исчерченности. В этих же участках миоцитов находились вакуоли, содержавшие в себе плотные тельца, которые, вероятно, являлись митохондриями с плохо различимыми матриксом и кристами. В непосредственной близости с измененными митохондриями встречались прозрачные вакуоли с разрушенной мембраной, которые представляли собой канальцы саркоплазматической сети (рис. 5).

Рисунок 5. Электронограммы:
а – крупные слабо осмиофильные вакуоли с различным содержимым (ув. ×33 000);
b – липиды и многочисленные митохондрии
с разрушенными матриксом и кристами (ув. ×13 000)
Figure 5. Electronograms:
a – large weakly osmiophilic vacuoles of varying contents (magnification ×33,000);
b – lipids and numerous mitochondria with disrupted matrix and cristae (magnification ×13,000)
Особенно интересен тот факт, что наряду с описанными выше изменениями среди мышечных волокон встречались крупные образования, имевшие утолщенную стенку и содержавшие внутри себя различные органеллы мышечной клетки, включая единичные канальцы саркоплазматической сети, измененные митохондрии, гликоген, рибосомы и полисомы (рис. 6). Данный факт, на наш взгляд, может быть характерен для эпилепсии постинфекционной этиологии, поскольку, по нашим наблюдениям и по данным литературы, он не характерен для других нозологических форм. Наличие таких митохондрий может также свидетельствовать о мутациях в митохондриальной ДНК, происходящих под воздействием хронического воспалительного и/или инфекционного процесса.
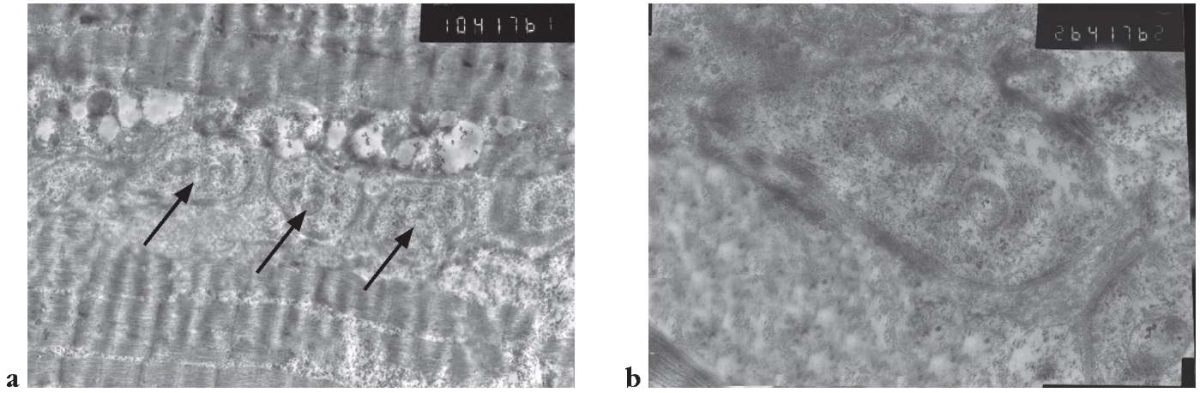
Рисунок 6. Нетипичные включения (стрелки) среди миофибрилл в участках биоптата:
а – ув. ×10 000; b – ув. ×20 000
Figure 6. Atypical inclusions (arrows) among myofibrils in biopsy specimens:
a – magnification ×10,000; b – magnification ×20,000
Кроме того, в сильно разрушенных участках миоцитов отмечались скопления гликогена с одной стороны и мелких прозрачных пузырьков неясного генеза – с другой. Позволим себе высказать предположение о том, что они могут быть связаны с имеющим место инфекционным процессом у обследуемых пациентов (рис. 7).
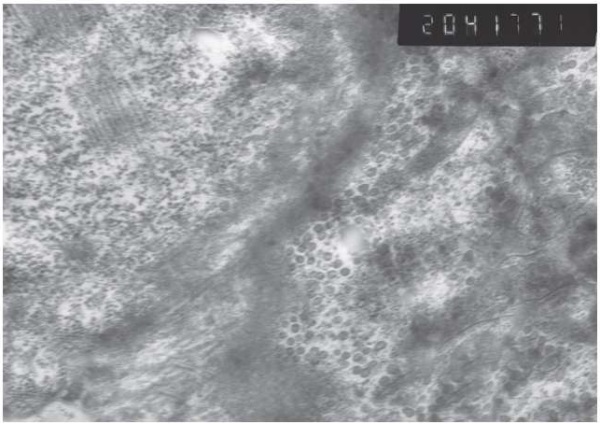
Рисунок 7. Участок биоптата с сильно измененным рисунком миофибрилл
и всей структуры миоцита (ув. ×20 000)
Figure 7. Biopsy specimen with profoundly altered pattern of myofibrils
and overall structure of myocytes (magnification ×20,000)
У больных 1-й группы при световой микроскопии в биоптате четырехглавой мышцы бедра вблизи сарколеммы нередко обнаруживались обширные участки миолиза, а на некотором расстоянии внутри мышцы располагались ядра в виде цепочек (рис. 8а). Кроме нарушения структуры миоцита сами мышечные фибриллы часто имели змеевидное рыхлое расположение, и внутри пучков миофибрилл обнаруживались крупные лимфо-макрофагальные инфильтраты, окрашенные гематоксилином в фиолетовый цвет (рис. 8b).
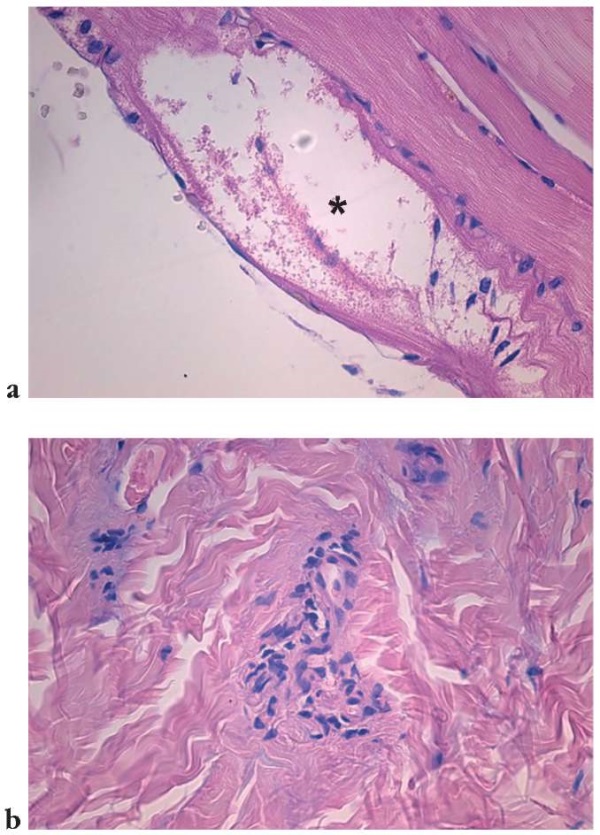
Рисунок 8. Результаты световой микроскопии:
а – обширный участок миолиза отмечен звездочкой (ув. ×400);
b – в центре снимка – лимфо-макрофагальный инфильтрат
внутри пучка змеевидных миофибрилл (ув. ×1000)
Figure 8. Results of light microscopy:
a – extensive area of myolysis (*) (magnification ×400;
b – lymphocyte-macrophage infiltrate within a bundle of snake-like myofibrils
at the center of the image (center, magnification ×1,000)
Полностью сохранных мышечных клеток в биоптате без изменения каких-либо их органелл при ЭМИ не найдено, и напротив, в миоцитах биоптата обнаруживался как слабо, так и сильно выраженный миолиз. Обращает на себя внимание наличие большого количества капилляров в эндомизии, а также их повсеместно тесный контакт с мышечными клетками. Участки контакта нередко имели прослойку из рыхлого коллагена, что может быть косвенным признаком воспалительных изменений мышцы. Участки миолиза часто наблюдались под сарколеммой, и в них, как правило, находились скопления митохондрий (плейокония) с измененным матриксом и кристами, липиды и лизосомы (рис. 9а). Встречались также обширные участки миолиза внутри мышцы, и в них наблюдались продольные расщепления пучков миофибрилл с потерей чаще Z- и реже I-дисков (рис. 9b).
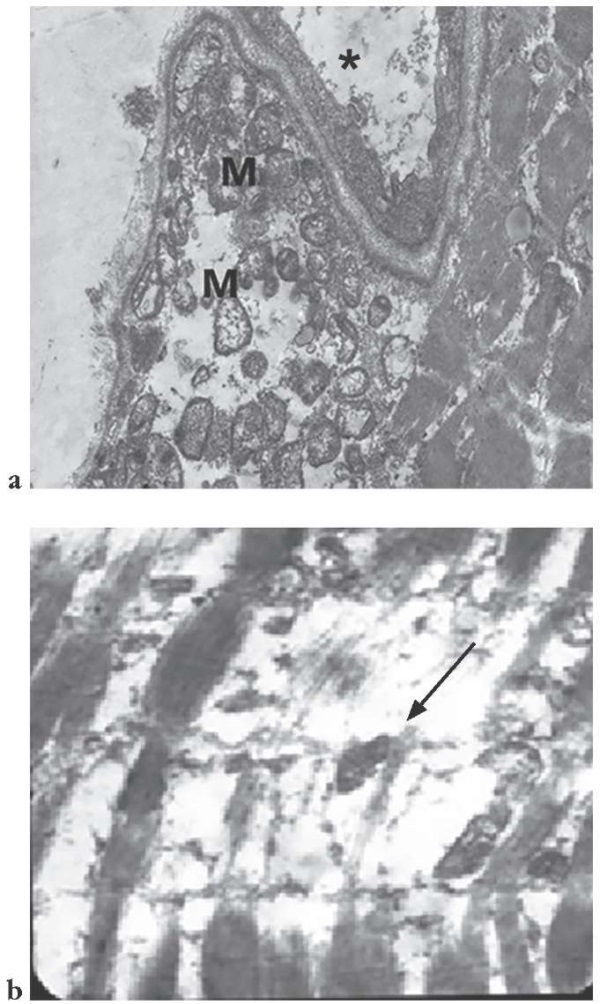
Рисунок 9. Результаты электронно-микроскопического исследования:
а – участок миолиза под сарколеммой,
заполненный многочисленными полуразрушенными митохондриями (М)
и фрагмент капилляра (отмечен звездочкой) в тесном контакте с мышцей (ув. ×8000);
b – крупный участок миолиза (стрелка) внутри мышцы с разрушением дисков
и полным исчезновением пучков миофибрилл (ув. ×8000)
Figure 9. Results of electron microscopic examination:
a – area of myolysis beneath sarcolemma filled
with numerous semi-disrupted mitochondria (M)
and a capillary fragment (asterisk) in close contact with the muscle (magnification ×8,000);
b – large area of myolysis (arrow) within the muscle with disc disruption
and fully disappeared myofibril bundles (magnification ×8,000)
Миолиз часто встречался вблизи разрушенных Z-дисков, и там же нередко парами находились измененные митохондрии с перетяжкой, имевшие вид гантели, как бы замещавшие эти диски (рис. 10).

Рисунок 10. Измененные митохондрии (M) на месте Z-дисков мышцы (ув. ×10 000)
Figure 10. Altered mitochondria (M) in the place of muscle Z-discs (magnification ×10,000)
В участках миолиза на фоне разрушенных миофибрилл Z-диски, как правило, располагались хаотично либо отсутствовали. Митохондрии имели выраженные нарушения матрикса и крист, вследствие чего становились вакуолизированными. Довольно часто такие митохондрии представляли собой кольцевидную структуру, внутри которой, а также снаружи (но в тесном контакте с митохондрией) располагались липиды (рис. 11). Миофибриллы в этих участках отсутствовали.

Рисунок 11. Митохондрии (М) неправильной формы с измененной структурой
в участках миолиза (звездочками отмечены липиды):
а – ув. ×8000; b – ув. ×10 000
Figure 11. Irregularly shaped mitochondria (M) with altered structure
in areas of myolysis (lipids are marked with asterisks):
a – magnification ×8,000; b – magnification ×10,000
Таким образом, при морфологическом исследовании биоптатов пациентов с постинфекционной эпилепсией можно констатировать явное повреждение типичной структуры мышцы, при котором в отдельных ее участках обнаруживались выраженные изменения органелл, что, в свою очередь, может приводить к отчетливым нарушениям функции мышц у пациентов с эпилепсией и хронически протекающей персистирующей инфекцией.
В целом в результате выполненных нами гистологических исследований и ЭМИ у больных с ЛОЭ постинфекционной этиологии был выявлен ряд общих морфологических нарушений с описанными в литературе митохондриальными энцефаломиопатиями (мегакония и плейокония митохондрий), а также совокупность специфических проявлений, характерных для данной патологии.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Таким образом, выполненные клинические, нейрофизиологические, нейровизуализационные и патоморфологические исследования при постинфекционной эпилепсии позволили выявить специфические особенности развития данного заболевания на разных его этапах – от зарождения на фоне острого инфекционного процесса до хронизации при персистирующей инфекции. Установлено, что комплексный анализ наличия и воздействия инфекционных агентов у пациентов с эпилептическими приступами имеет важное значение для контроля течения и прогноза постинфекционной эпилепсии, что представляется актуальным для своевременной диагностики и разработки специфической медикаментозной фармакотерапии.
1. Гайкова О.Н. Изменения белого вещества головного мозга при височной эпилепсии. Автореф. дис. … д-ра мед. наук. СПб.; 2001.
Список литературы
1. Одинак М.М., Михайленко А.А., Онищенко Л.С. и др. Патология нервной системы при экспериментальной хламидийной инфекции. Вестник Росийской Военно-медицинской академии. 2006; 1: 41–8.
2. Скрипченко Н.В., Лобзин Ю.В., Иванова Г.П. и др. Нейроинфекции у детей. Детские инфекции. 2014; 13 (1): 8–18. https://doi.org/10.22627/2072-8107-2014-13-1-8-18.
3. Al Sufiani F., Ang L.C. Neuropathology of temporal lobe epilepsy. Epilepsy Res Treat. 2012; 2012: 624519. https://doi.org/10.1155/2012/624519.
4. Gritti P., Lanterna A.L., Sarnecki T., et al. What is hiding behind bubbles of air? An unusual Streptococcus pyogenes meningitis. Infez Med. 2014; 22 (4): 317–21.
5. Лобзин С.В., Улитин А.Ю., Василенко А.В. и др. Постинфекционная эпилепсия (обзор литературы). Медицинский алфавит. 2020; 22: 9–14. https://doi.org/10.33667/2078-5631-2020-22-9-14.
6. Панов А.Г. Клещевой энцефалит. Л.: Медгиз; 1956: 282 с.
7. Miftode E., Vâţă A., Leca D., et al. Community acquired acute bacterial meningitis – a 10 year review. Rev Med Chir Soc Med Nat Iasi. 2009; 113 (2): 402–9 (in Romanian).
8. Bianchi M.T., Dworetzky B.A., Bromfield E.B. Auditory auras in patients with postencephalitic epilepsy: case series. Epilepsy Behav. 2009; 14 (1): 250–2. https://doi.org/10.1016/j.yebeh.2008.08.008.
9. Chaudhary N., Gupta M.M., Shrestha S., et al. Clinicodemographic profile of children with seizures in a tertiary care hospital: a cross-sectional observational study. Neurol Res Int. 2017; 2017: 1524548. https://doi.org/10.1155/2017/1524548.
10. Reddy Y., Balakrishna Y., Mubaiwa L. Convulsive status epilepticus in a quaternary hospital paediatric intensive care unit (PICU) in South Africa: an 8 year review. Seizure. 2017; 51: 55–60. https://doi.org/0.1016/j.seizure.2017.07.016.
11. Zhang X.F., Zhang X.Q., Wu C.C., et al. Application value of procalcitonin in patients with central nervous system infection. Eur Rev Med Pharmacol Sci. 2017 (17): 3944–9.
12. Arias Mayorga J., del Pozo Pérez M.A., Ortiz de Lejarazu R., et al. Previous dissociative psychiatric disorder and status epilepticus in a case of acute HIV infection. An Med Interna. 1992 (5): 241–5 (in Spanish).
13. Karatas H., Gurer G., Pinar A., et al. Investigation of HSV-1, HSV-2, CMV, HHV-6 and HHV-8 DNA by real-time PCR in surgical resection materials of epilepsy patients with mesial temporal lobe sclerosis. J Neurol Sci. 2008; 264 (1-2): 151–6. https://doi.org/10.1016/j.jns.2007.08.010.
14. Li J.M., Lei D., Peng F., et al. Detection of human herpes virus 6B in patients with mesial temporal lobe epilepsy in West China and the possible association with elevated NF-κB expression. Epilepsy Res. 2011; 94 (1-2): 1–9. https://doi.org/10.1016/j.eplepsyres.2010.11.001.
15. Huang C., Yan B., Lei D., et al. Apolipoprotein 4 may increase viral load and seizure frequency in mesial temporal lobe epilepsy patients with positive human herpes virus 6B. Neurosci Lett. 2015; 593: 29–34. https://doi.org/10.1016/j.neulet.2014.12.063.
16. Ngô Н.М., Zhou Y., Lorenzi Н., et al. Toxoplasma modulates signature pathways of human epilepsy, neurodegeneration & cancer. Sci Rep. 2017; 7: 11496. https://doi.org/10.1038/s41598-017-10675-6.
17. Gales J.M., Prayson R.A. Chronic inflammation in refractory hippocampal sclerosis-related temporal lobe epilepsy. Ann Diagn Pathol. 2017; 30: 12–6. https://doi.org/10.1016/j.anndiagpath.2017.05.009.
18. Missig G., Mokler E.L., Robbins J.O., et al. Perinatal immune activation produces persistent sleep alterations and epileptiform activity in male mice. Neuropsychopharmacology. 2018; 43 (3): 482–91. https://doi.org/10.1038/npp.2017.243.
19. Spadafora R., Pomero G., Delogu A., et al. A rare case of neonatal sepsis/meningitis caused by Pasteurella multocida complicated with status epilepticus and focal cerebritis. Pediatr Med Chir. 2011; 33 (4): 199–202.
20. Егорова В.П., Козлов В.К., Лобзин Ю.В. и др. Коррекция Ронколейкином® иммунной недостаточности при инфекционной патологии. Terra Medica. 2001; 1: 7–9.
21. Vezzani A., Friedman A. Brain inflammation as a biomarker in epilepsy. Biomark Med. 2011; 5 (5): 607–14. https://doi.org/10.2217/bmm.11.61.
22. Vezzani A., French J., Bartfai T., Baram T.Z. The role of inflammation in epilepsy. Nat Rev Neurol. 2011; 7 (1): 31–40. https://doi.org/10.1038/nrneurol.2010.178.
23. Anand A., Salas A., Mahl E., Levine M.C. Cerebral abscess presenting as a complex febrile seizure. Pediatr Emerg Care. 2015; 31 (7): 499–502. https://doi.org/10.1097/PEC.0000000000000281.
24. Гайкова О.Н., Новожилова А.П. Морфология эпилептической лейкоэнцефалопатии. Архив патологии. 1998; 2: 42–7.
25. Ананьева Н.И., Громов С.А., Липатова Л.В. и др. Органическая энцефалопатия и эпилептический синдром (обоснованность диагностики). СПб.; 2014: 30 с.
26. Ананьева Н.И., Ежова Р.В., Гальсман И.Е. и др. Гиппокамп: лучевая анатомия и варианты строения. Лучевая диагностика и терапия. 2015; 1: 39–44.
27. Gales J.M., Prayson R.A. Chronic inflammation in refractory hippocampal sclerosis-related temporal lobe epilepsy. Ann Diagn Pathol. 2017; 30: 12–6. https://doi.org/10.1016/j.anndiagpath.2017.05.009.
28. Лобзин С.В., Одинак М.М., Дыскин Д.Е. и др. Оксидантный стресс и его значение в этиопатогенезе локально обусловленной эпилепсии. Вестник Росийской Военно-медицинской академии. 2010; 3: 250–3.
29. Иванов М.В., Дубинина Е.Е., Незнанов Н.Г. и др. Окислительный стресс в психиатрии и неврологии. СПб.: Человек и его здоровье; 2016: 159–203.
30. Василенко А.В., Фоминцева М.В. Демиелинизация, эпилептизация и пароксизмальность В кн.: Лобзин С.В., Головкин В.И. (ред.) Рассеянный склероз. Продолжение учения. М.: МЕДпресс-информ; 2021: 101–29.
31. Меркулов Г.А. Курс патологогистологической техники. Л.: Медицина; 1969: 424 с.
32. Миронов А.А., Комиссарчик Я.Ю., Миронов В.А. Методы электронной микроскопии в биологии и медицине. СПб.: Наука; 1994: 400 с.
33. Юнкеров В.И., Григорьев С.Г. Математико-статистическая обработка данных медицинских иcследований. 3-е изд. СПб.; 2005: 318 с.
34. Moyano L.M., O’Neal S.E., Ayvar V., et al. High prevalence of asymptomatic neurocysticercosis in an endemic rural community in Peru. PloS Negl Trop Dis. 2016; 10 (12): e0005130. https://doi.org/10.1371/journal.pntd.0005130.
Об авторах
А. В. ВасиленкоРоссия
Василенко Анна Владимировна – заведующая учебной частью, доцент кафедры нейрохирургии Института медицинского образования; доцент кафедры неврологии им. академика С.Н. Давиденкова
Scopus Author ID: 35773656400
ул. Аккуратова, д. 2, Санкт-Петербург 197341
ул. Кирочная, д. 41, Санкт-Петербург 191015
А. Ю. Улитин
Россия
Улитин Алексей Юрьевич – д.м.н., профессор, заведующий кафедрой нейрохирургии Института медицинского образования; профессор кафедры нейрохирургии им. профессора А.Л. Поленова
ул. Аккуратова, д. 2, Санкт-Петербург 197341
ул. Кирочная, д. 41, Санкт-Петербург 191015
Л. С. Онищенко
Россия
Онищенко Людмила Семёновна – к.б.н., старший научный сотрудник лаборатории электронной микроскопии и иммунногистохимии
ул. Академика Лебедева, д. 6, Санкт-Петербург 194044
Н. И. Ананьева
Россия
Ананьева Наталия Исаевна – д.м.н., профессор кафедры нейрохирургии Института медицинского образования
WoS ResearcherID: O-8903-2014; Scopus Author ID: 25623015500
ул. Аккуратова, д. 2, Санкт-Петербург 197341
Р. В. Гребенщикова
Россия
Гребенщикова Руслана Владимировна – врач-рентгенолог
ул. Бехтерева, д. 3, Санкт-Петербург 192019
О. Н. Гайкова
Россия
Гайкова Ольга Николаевна – д.м.н., профессор, ведущий научный сотрудник
ул. Бехтерева, д. 1, Санкт-Петербург 192019
А. В. Иваненко
Россия
Иваненко Андрей Валентинович – д.м.н., доцент кафедры нейрохирургии Института медицинского образования
Scopus Author ID: 26767826800
ул. Аккуратова, д. 2, Санкт-Петербург 197341
С. С. Колосов
Россия
Колосов Сергей Сергеевич – аспирант кафедры нейрохирургии Института медицинского образования
ул. Аккуратова, д. 2, Санкт-Петербург 197341
С. А. Туранов
Россия
Туранов Семен Александрович – аспирант кафедры нейрохирургии Института медицинского образования
ул. Аккуратова, д. 2, Санкт-Петербург 197341
С. Н. Чудиевич
Россия
Чудиевич Сергей Николаевич – студент 6-го курса лечебного факультета
ул. Кирочная, д. 41, Санкт-Петербург 191015
Рецензия
Для цитирования:
Василенко А.В., Улитин А.Ю., Онищенко Л.С., Ананьева Н.И., Гребенщикова Р.В., Гайкова О.Н., Иваненко А.В., Колосов С.С., Туранов С.А., Чудиевич С.Н. Постинфекционная эпилепсия: особенности клиники и диагностики. Эпилепсия и пароксизмальные состояния. 2024;16(1):18-32. https://doi.org/10.17749/2077-8333/epi.par.con.2024.157
For citation:
Vasilenko А.V., Ulitin А.Yu., Onishchenko L.S., Ananyeva N.I., Grebenshchikova R.V., Gaykova О.N., Ivanenko А.V., Kolosov S.S., Turanov S.А., Chudievich S.N. Postinfectious epilepsy: clinical and diagnostical features. Epilepsy and paroxysmal conditions. 2024;16(1):18-32. https://doi.org/10.17749/2077-8333/epi.par.con.2024.157
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































