Перейти к:
Взаимосвязь кишечного микробиома и эпилепсии: потенциальные возможности терапии фармакорезистентной эпилепсии
https://doi.org/10.17749/2077-8333/epi.par.con.2024.190
Аннотация
Актуальность. По данным Всемирной организации здравоохранения, около 50 млн человек во всем мире страдают эпилепсией. Почти у 1/3 пациентов диагностируется фармакорезистентная эпилепсия (ФРЭ). Между кишечным микробиомом (КМБ) и центральной нервной системой существует взаимосвязь, которая осуществляется на протяжении всей жизни через двунаправленную динамическую сеть. Имеются данные, что КМБ изменяется у пациентов с ФРЭ.
Цель: обобщить современные литературные данные, посвященные роли оси «микробиом – кишечник – мозг» в ФРЭ, а также определить ценность изменения состава КМБ в качестве прогностического маркера формирования ФРЭ.
Материал и методы. Проведен поиск публикаций в электронных базах данных PubMed/MEDLINE и eLibrary, а также в поисковой системе Google Scholar. Оценку статей проводили в соответствии с рекомендациями PRISMA. В результате поиска было извлечено 4158 публикаций из базы PubMed/MEDLINЕ, 173 публикации из eLibrary и 1100 публикаций, найденных с помощью Google Scholar. После процедуры отбора в обзор было включено 121 исследование.
Результаты. В обзоре представлены убедительные доказательства корреляции между КМБ и ФРЭ. Выявлены различия в составе микробиоты кишечника у пациентов с эпилепсией в зависимости от чувствительности к лекарственным препаратам. Дисбактериоз кишечной микробиоты может быть скорректирован с помощью экзогенных вмешательств, таких как кетогенная диета, лечение пробиотиками и трансплантация фекальной микробиоты, что впоследствии приводит к изменениям в нейрохимической передаче сигналов в головном мозге и, следовательно, способствует снижению эпилептической активности.
Заключение. Кетогенная диета, пробиотики и антибиотики могут иметь определенный потенциал в отношении влияния на эпилепсию через коррекцию дисбактериоза кишечной микробиоты, но имеющиеся на сегодняшний день исследования не обеспечивают должного уровня доказательности. В будущих клинических многоцентровых исследованиях следует использовать стандартизированные протоколы и большую выборку, чтобы обеспечить более надежные доказательства. Кроме того, необходимы дальнейшие фундаментальные исследования для выяснения потенциальных механизмов и терапевтических мишеней.
Ключевые слова
Для цитирования:
Чередниченко А.С., Моздор П.В., Олейникова Т.К., Хатам П.А., Настуева Ф.М., Коваленков К.О., Сердинова А.С., Осмаева А.Х., Ровчак А.И., Есикова Ю.Ю., Шогенова М.Х., Ахмедов К.И., Амиргамзаев М.Р., Батыршина Э.Р. Взаимосвязь кишечного микробиома и эпилепсии: потенциальные возможности терапии фармакорезистентной эпилепсии. Эпилепсия и пароксизмальные состояния. 2024;16(3):250-265. https://doi.org/10.17749/2077-8333/epi.par.con.2024.190
For citation:
Cherednichenko A.S., Mozdor P.V., Oleynikova T.K., Khatam P.A., Nastueva F.M., Kovalenkov K.O., Serdinova A.S., Osmaeva A.Kh., Rovchak A.I., Esikova Yu.Yu., Shogenova M.Kh., Akhmedov K.I., Amirgamzaev M.R., Batyrshina E.R. A relationship between intestinal microbiome and epilepsy: potential treatment options for drug-resistant epilepsy. Epilepsy and paroxysmal conditions. 2024;16(3):250-265. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2024.190
ВВЕДЕНИЕ / INTRODUCTION
Неврологические, когнитивные, психологические и психосоциальные нарушения приводят к снижению качества жизни пациентов с эпилепсией, увеличивая риск смерти, что составляет значительную долю глобального бремени болезней [1][2]. По данным Всемирной организации здравоохранения, около 50 млн человек во всем мире страдают эпилепсией, причем 25% приступов можно предотвратить, а 70% – эффективно контролировать с использованием противоэпилептических препаратов (ПЭП) [3].
Однако почти у 1/3 оставшихся пациентов эпилепсия не поддается медикаментозному лечению, т.е. оказывается фармакорезистентной (ФРЭ). Она констатируется в случае сохранения эпилептических приступов, несмотря на применение двух и более переносимых и корректно подобранных схем приема ПЭП как в монотерапии, так и в комбинациях [4].
Несмотря на то что в клиническую практику было внедрено более 20 ПЭП нового поколения, их фактическая эффективность и безопасность остаются намного ниже ожидаемых уровней [5]. Кроме того, особые группы населения, такие как новорожденные, беременные женщины, пожилые люди с сопутствующими заболеваниями, а также пациенты с лекарственно-устойчивыми генерализованными припадками, которым не представляется возможным проведение инвазивного вмешательства и всестороннего обследования перед началом лечения методами нейростимуляции. Следовательно, существует острая необходимость в поиске новых терапевтических мишеней и методов терапии, которые могли бы обеспечить оптимальное лечение пациентов с ФРЭ.
Современные разработки в области омиксных технологий (включая метагеномику, метатранскриптомику, метапротеомику и метаболомику) и биоинформатики позволили исследователям более подробно изучить кишечный микробиом (КМБ), особенно его функции [6]. Каждый омиксный метод имеет свои преимущества и недостатки и может быть включен в мульти-омиксный анализ, который позволяет получить таксономическую и функциональную характеристику КМБ. КМБ – это популяция микроорганизмов, большинство из которых непатогенны и положительно влияют на работу кишечника. Между КМБ и центральной нервной системой (ЦНС) существует взаимосвязь, которая осуществляется на протяжении всей жизни через двунаправленную динамическую сеть, известную как ось «микробиом – кишечник – мозг» (англ. microbiome-gut-brain axis, MGBA) [7]. MGBA также включает сеть нейромедиаторов, кровеносных сосудов, желез и нервных компонентов, участвующих в регуляции работы кишечника [8]. В последние годы MGBA привлекает все большее внимание в неврологическом научном сообществе, и недавние исследования продемонстрировали ее роль в развитии нервной системы, а также при различных неврологических расстройствах, включая аутизм, рассеянный склероз, болезнь Паркинсона и болезнь Альцгеймера [9–11].
Помимо других неврологических заболеваний в последнее время активно изучалась сложная взаимосвязь между КМБ и эпилепсией. Суммируя результаты проведенных исследований, можно заключить, что КМБ изменяется у пациентов с ФРЭ. Хорошо известная кетогенная диета (КД) – диета с высоким содержанием жиров, достаточным количеством белков и низким содержанием углеводов – оказывает противосудорожное действие. Вмешательства, направленные на коррекцию дисбактериоза, включая пробиотики, антибиотики и трансплантацию фекальной микробиоты (ТФМ), обладают многообещающим потенциалом в качестве альтернативного лечения ФРЭ, несмотря на то что точный механизм действия остается неясным [12–17].
Цель – обобщить современные литературные данные, посвященные роли MGBA в ФРЭ, а также определить ценность изменения состава КМБ в качестве прогностического маркера формирования ФРЭ.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Стратегия поиска публикаций / Publication search strategy
Проведен поиск публикаций в электронных базах данных PubMed/MEDLINE и eLibrary, а также в поисковой системе Google Scholar. Стратегия поиска включала следующие ключевые слова и их сочетания на русском и английском языках: «фармакорезистентная эпилепсия», «микробиом», «кишечный микробиом», «ось микробиом – кишечник – мозг», «эпилепсия», “drug-resistant epilepsy”, “microbiome”, “gut microbiome”, “microbiome-gut-brain axis”, “epilepsy”. Поиск выполнялся среди исследований, опубликованных до апреля 2024 г.
Методы отбора исследований / Research selection methods
Оценка статей проводилась в соответствии с рекомендациями PRISMA. Алгоритм отбора исследований представлен на рисунке 1.
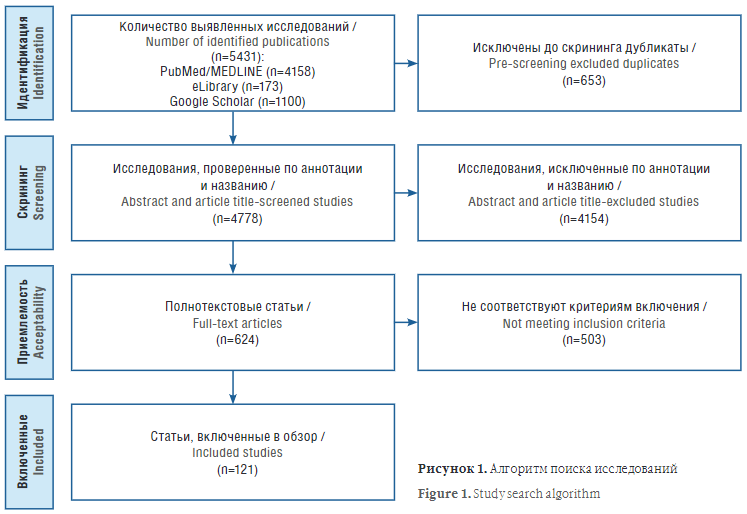
Рисунок 1. Алгоритм поиска исследований
Figure 1. Study search algorithm
В результате поиска было извлечено 4158 публикаций из PubMed/MEDLINE, 173 публикаций из eLibrary и 1100 публикации, найденных с помощью Google Scholar. Независимо друг от друга все авторы проводили скрининг названий и аннотаций выявленных статей, при обнаружении релевантных исследований извлекался полный текст соответствующей статьи. Дубликаты и неполнотекстовые версии были исключены. Полнотекстовые версии статей оценивались на предмет соответствия следующим критериям включения:
– работа опубликована на английском или русском языках;
– работа опубликована в рецензируемом научном издании;
– работа представляет собой обзор литературы, экспериментальное или клиническое исследование, содержащее указанные ключевые слова.
После процедуры отбора в обзор было включено 108 статей.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Особенности патогенеза ФРЭ / Features of DRE pathogenesis
Изучение патогенеза ФРЭ имеет решающее значение не только для выбора подходящих стратегий, но и для предложения современных методов лечения. Метаанализ 35 клинических исследований с участием пациентов с эпилепсией обобщил клинические факторы риска, связанные с развитием ФРЭ, включая возраст начала, симптоматическую эпилепсию, аномальные результаты нейровизуализации и электроэнцефалографии, задержку психического развития в анамнезе, нервно-психические расстройства, фебрильные припадки и эпилептический статус [18].
Что касается механизмов, лежащих в основе фармакорезистентности, существуют различные гипотезы, которые можно разделить на две категории – этиология эпилепсии и изменение ответа на ПЭП, которые могут быть взаимосвязаны [4][19]. Этиологическими факторами, которые могут способствовать формированию ФРЭ, являются особенности поражения головного мозга, аутоиммунные нарушения, тяжесть заболевания и сопутствующие патологии. Нарушение ответа на ПЭП включает снижение эффективной концентрации ПЭП, а также изменение или отсутствие терапевтических мишеней [19].
Этиологические факторы
Известно, что различные формы эпилепсии имеют неодинаковый прогноз. Идиопатические генерализованные формы хорошо поддаются фармакотерапии, в то время как симптоматическая и криптогенная формы имеют худший терапевтический потенциал [4][20]. Действительно, трудно контролировать вторичные эпилептические приступы до устранения очагов травматического повреждения, острого кровотечения или диффузного повреждения аксонов.
Повреждение гиппокампа влияет на всасывание и метаболизм лекарственных препаратов. Например, полная потеря потенциалзависимых натриевых каналов в гранулярных клетках у пациентов с тромбоэмболией легочной артерии приводила к резистентности к карбамазепину [21]. Также обнаружено, что натриевые каналы влияют на чувствительность к фенитоину в нейронах зоны СА1 гиппокампа [22]. C. Xu et al. показали, что субикулярные пирамидные нейроны играют ключевую роль в контроле чувствительности к ПЭП [23].
Кроме того, у значительной части пациентов с впервые возникшей ФРЭ она имеет аутоиммунную природу [24], что выражается в продукции антител к специфическим мишеням головного мозга, включая рецептор N-метил-D-аспарагиновой кислоты (NMDA-рецептор), рецептор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты (AMPA-рецептор), рецептор гамма-аминомасляной кислоты типа В (ГАМКВ) или богатый лейцином инактивируемый глиомой протеин 1. У таких больных в конечном итоге могут развиться как острые приступы, так и хроническая эпилепсия с преимущественным поражением височной доли [25].
И последнее, но не менее важное: после общих тонико-клонических и сложных фокальных парциальных приступов возникает ряд сопутствующих симптомов, таких как нарушение координации, снижение способности к внешнему восприятию и ухудшение памяти, что ограничивает эффективность лечения и приверженность пациентов к нему [26]. Поэтому для таких больных критически важно выявление и устранение этиологии эпилепсии.
Факторы, связанные с фармакодинамикой и фармакокинетикой ПЭП
Теория изменения мишени лекарственного средства была предложена очень рано, и в настоящее время она является одной из наиболее общепринятых теоретических гипотез [4][27]. Некоторые экспериментальные данные показывают, что концентрация лекарственного средства, которое проникает через гематоэнцефалический барьер (ГЭБ), изменяется при различных формах заболевания, и нейровоспаление также может привести к патологической гипервозбудимости, что в конечном итоге влияет на эффективность лекарственного средства [28][29].
Проникновение ПЭП через ГЭБ на разных уровнях эпилепсии может быть связано со степенью и восприимчивостью к экспрессии множества переносчиков лекарственных средств в головном мозге. Ответ на вопрос о том, является ли ПЭП субстратом для этих переносчиков, особенно в эндотелиальных клетках капилляров и астроцитах, помогает оценить проницаемость ГЭБ и эффективность лекарственных препаратов [30]. «Гипотеза о переносчике» гласит, что фармакорезистентность обусловлена повышенной экспрессией переносчиков, таких как P-гликопротеин (Pgp), входящий в состав белка множественной лекарственной устойчивости (англ. multiple drug resistance, MDR), а также семейства белков, связанных с раком молочной железы (англ. breast cancer resistance protein, BRCP) [31]. Данная теория подтверждается следующими фактами [32]:
– в гиппокампе пациентов с ФРЭ выявлена локальная сверхэкспрессия Pgp;
– у пациентов с ФРЭ Pgp экспрессировался в эндотелии сосудов и глиальных клетках по сравнению с больными без фармакорезистентности;
– более высокая частота приступов была достоверно связана с повышенной активностью Pgp в гиппокампе.
У людей, страдающих ФРЭ, также существуют эндогенные различия в кодировании переносчиков лекарственных средств (АТФ1-связывающая кассета подсемейства B, член 1 (англ. ATP binding cassette subfamily B member 1, ABCB1), АТФ-связывающая кассета подсемейства G, член 2, ABCG2)) [33], мишеней для лекарственных средств (калиевый потенциалзависимый канал подсемейства Q, член 2 (англ. potassium channel, voltage-gated, KQT-like subfamily member 2, KCNQ2), синтезирующий синтаксин-связывающий белок 1 (англ. syntaxin binding protein 1, STXBP1)) [34], ферментов, метаболизирующих лекарственные средства (цитохром Р-450 (CYP) 2C9, CYP2C19) [35] и главного комплекса гистосовместимости, которые в различной степени могут способствовать снижению концентрации ПЭП в плазме крови и головном мозге [36].
Важно отметить, что исследования на животных пока не подтверждают фармакокинетическую гипотезу [37]. Кроме того, в настоящее время имеются противоречивые данные о связи между полиморфизмом ABCB1 и вариабельностью фармакокинетики эсликарбазепина [38].
Состав кишечного микробиома / Intestinal microbiome composition
КМБ кодирует более 3 млн генов, что значительно превышает возможности человеческого генома, который содержит всего около 23 тыс. генов [39].
Мнения о времени первоначальной колонизации кишечника человека расходятся. Одни авторы обнаружили, что у плодов в желудочно-кишечном тракте нет микроорганизмов, а бактериальная колонизация начинается при контакте с материнской микробиотой во время родов [40]. Другими авторами показано, что в кишечнике плода на 14-й неделе беременности содержится небольшое количество стафилококков и лактобацилл, а выделенные бактерии могут индуцировать активацию Т-клеток памяти in vitro, что указывает на то, что микроорганизмы могут существовать у плода и играть важную роль в становлении и активации иммунной системы [41].
В целом КМБ формируется в раннем возрасте, через 5 лет после рождения [42], и отличается у разных людей в зависимости от различных факторов, включая энтеротип, индекс массы тела, образ жизни и пищевые привычки [39]. Устойчивый КМБ отличается разнообразием, динамическим равновесием и включает шесть доминирующих типов (Firmicutes, Bacteroidetes, Actinobacteria, Proteobacteria, Fusobacteria и Verrucomicrobia), среди которых Firmicutes и Bacteroidetes составляют приблизительно 90% [39].
Изменения КМБ, ассоциированные с развитием ФРЭ / IM changes associated with DRE development
MGBA вовлечена во все аспекты патогенеза ФРЭ. Недавние исследования показали изменения в КМБ у больных ФРЭ по сравнению с пациентами с контролируемой эпилепсией (КЭ) и здоровыми лицами, не страдающими эпилепсией. Кроме того, обнаружено влияние противоэпилептической терапии на КМБ, что также продемонстрировано в ходе экспериментов на животных моделях [43–64].
Изменение КМБ у пациентов с ФРЭ
A. Peng et al. обнаружили, что состав КМБ у пациентов с КЭ и у людей без эпилепсии сходный. Однако у больных с частыми приступами наблюдалось увеличение соотношения Firmicutes/Bacteroidetesи снижение количества бифидо- и лактобактерий, чем у пациентов с четырьмя или меньшим количеством приступов в год [43].
В работе X. Gong et al. найдена модель, позволяющая отличить ФРЭ от КЭ, согласно которой у пациентов с ФРЭ в кишечных бактериальных таксонах наблюдалось увеличение числа типов Actinobacteria, Verrucomicrobia, Nitrospirae и родов Blautia, Bifidobacterium, Subdoligranulum, Dialister и Anaerostipes [44]. Кроме того, исследование, проведенное в Корее, показало, что количество Negativicutes, которые относятся к типу Firmicutes, было увеличено в группе ФРЭ [45]. Напротив, B. Şafak et al. в ходе оценки КМБ в группе пациентов с идиопатической фокальной эпилепсией обнаружили снижение количества Firmicutes, Bacteroides и Actinobacteria при увеличении количества Proteobacteria, Fusobacteria и Spirochaetes, которые участвуют в опосредовании механизмов аутоиммунных и воспалительных заболеваний в кишечнике и ЦНС [46].
Результаты оценки альфа-разнообразия также противоречивы. A. Peng et al. наблюдали значительно более высокий индекс альфа-разнообразия у пациентов с ФРЭ по сравнению с КЭ и лицами без эпилепсии [43], в то время как X. Gong et al. сообщили о совершенно противоположных результатах [44], а H. Lee et al. не обнаружили значимой разницы в альфа- и бета-разнообразиях между группами КЭ и ФРЭ [45].
В ходе исследования детей с ФРЭ X. Gong et al. показали, что в исследуемой группе наблюдается повышенное микробное альфа-разнообразие наряду со значительным преобладанием типа Actinobacteria и родов Enterococcus, Anaerostipes, Bifidobacterium, Bacteroides и Blautia [47]. G. Xie et al. выявили различия в составе КМБ между новорожденными с ФРЭ и здоровыми младенцами, у которых преобладали Proteobacteria, в то время как количество Bacteroides было снижено [48].
Примечательно, что таксоны кишечных бактерий демонстрируют значительные различия в чувствительности к лекарственным препаратам в разных возрастных группах с ФРЭ, хотя на них могут влиять привычки питания и другие факторы. Характер генетической изменчивости в патогенезе ФРЭ по-прежнему требует дальнейшего изучения с использованием более крупных выборок и более длительного времени наблюдения, чтобы исключить влияние факторов индивидуальности, с особым акцентом на изучение изменений в численности Firmicutes и Bacteroidetes. Краткие результаты клинических исследований представлены в таблице 1.
Таблица 1 (начало). Изменения в составе кишечного микробиома у пациентов с фармакорезистентной эпилепсией
Table 1 (beginning). Altered intestinal microbiome composition in patients with drug-resistant epilepsy
|
Исследование / Reference |
Выборка / Patient cohort |
Метод оценки КМБ / Assay for IM analysis |
Изменения КМБ / IM alteration |
Клинические особенности / Clinical features |
|
A. Peng et al. [43] |
42 пациента с ФРЭ, 49 пациентов с КЭ, 69 – контроль / 42 DRE patients, 49 CE patients, 69 – control |
Секвенирование гена 16S рРНК / 16S rRNA gene sequencing |
У пациентов с ФРЭ отмечено повышенное содержание многочисленных редких бактерий, в основном относящихся к типу Firmicutes / Higher abundance of multiple rare bacteria, primarily of Firmicutes spp. in DRE patients |
У пациентов с ≥4 приступами в год отмечено снижение содержания бифидобактерий и лактобактерий по сравнению с пациентами с ≤4 приступами в год / Patients with ≥4 vs. ≤4 seizures per year had decreased levels of bifidobacteria and lactobacillus |
|
X. Gong et al. [44] |
Исследовательская группа (55 пациентов и 46 – контроль), валидационная выборка (13 пациентов и 10 – контроль) / Study cohort (55 patients and 46 – control), validation cohort (13 patients and 10 – control) |
Секвенирование гена 16S рРНК / 16S rRNA gene sequencing |
У пациентов с ФРЭ отмечено увеличение количества Verrucomicrobia и Nitrospirae, а также родов Blautia, Bifidobacterium, Subdoligranulum, Dialister и Anaerostipes / Higher abundance of Verrucomicrobia and Nitrospirae, as well as genera Blautia, Bifidobacterium, Subdoligranulum, Dialister and Anaerostipes in DRE patients |
Структура и состав фекальной микробиоты различались у пациентов с ФРЭ и КЭ / Fecal microbiota pattern and composition differed in DRE and CE patients |
|
H. Lee et al. [45] |
20 пациентов с ФРЭ, 20 пациентов с КЭ / 20 DRE patients, 20 CE patients |
Секвенирование нового поколения / Next-generation sequencing |
Между двумя группами не было достоверных различий в альфа- и бета-вариантах. Относительная численность Bacteroides finegoldii и Ruminococcus увеличилась в группе КЭ, в то время как количество бактерий Negativicutes увеличилось в группе ФРЭ / No significant inter-group difference in α- and β-diversity was observed. Higher abundance of Bacteroides finegoldii and Ruminococcus in CE cohort, whereas in DRE cohort the level was higher for Negativicutes |
Представители рода Bacteroides finegoldii, рода Shigella и отряда Veillonellales были связаны с изменениями на МРТ. Bifidobacterium, Klebsiella и Streptococcus были связаны с изменениями на ЭЭГ / Bacteroides finegoldii, genus Shigella and order Veillonellales were associated with MRI alterations. Bifidobacterium, Klebsiella and Streptococcus were associated with EEG alterations |
|
G. Xie et al. [48] |
14 новорожденных с эпилепсией, 30 – контроль / 14 newborns with epilepsy, 30 – control |
Секвенирование гена 16S рРНК / 16S rRNA gene sequencing |
У тех, кто отвечает на КД, в КМБ снижается количество Proteobacteria и Cronobacter и увеличивается количество Bacteroides, таких как Prevotella и Bifidobacterium / KD responders have in IM lower abundance of Proteobacteria and Cronobacter along with higher level of Bacteroides, such as Prevotella and Bifidobacterium |
Частота приступов на фоне КД снизилась на 50% у 64% младенцев, страдающих эпилепсией / KD was associated with 50% decline in seizure frequency in 64% infants with epilepsy |
|
X. Gong et al. [47] |
12 детей с ФРЭ, 12 – контроль / 12 children with DRE, 12 – control |
ВЭЖХ, секвенирование гена 16S рРНК / HPLC, 16S rRNA gene sequencing |
Повышение количества бактерий родов Bifidobacterium, Akkermansia, Actinomyces, Enterococcaceae и снижение количества Subdoligranulum, Dialister, Alloprevotella было ассоциировано с ФРЭ / Higher abundance of genera Bifidobacterium, Akkermansia, Actinomyces, Enterococcaceae and lower level of Subdoligranulum, Dialister, Alloprevotella was associated with DRE |
Диетотерапия приводила к одновременному увеличению содержания короткоцепочечных жирных кислот в фекалиях / Diet therapy resulted in concomitantly higher fecal short-chain fatty acid levels |
Таблица 1 (окончание). Изменения в составе кишечного микробиома у пациентов с фармакорезистентной эпилепсией
Table 1 (end). Altered intestinal microbiome composition in patients with drug-resistant epilepsy
|
Исследование / Reference |
Выборка / Patient cohort |
Метод оценки КМБ / Assay for IM analysis |
Изменения КМБ / IM alteration |
Клинические особенности / Clinical features |
|
Y. Zhang et al. [49] |
20 детей с ФРЭ (14 мальчиков, 6 девочек) / 20 children with DRE (14 boys, 6 girls) |
Секвенирование гена 16S рРНК / 16S rRNA gene sequencing |
КД снижала численность Firmicutes и повышала уровень Bacteroidetes. Clostridiales, Ruminococcaceae, Rikenellaceae, Lachnospiraceae и Alistipes отнесены к видам, не реагирующим на КД / KD lowered Firmicutes abundance and increased level of Bacteroidetes. Clostridiales, Ruminococcaceae, Rikenellaceae, Lachnospiraceae and Alistipes referred to bacterial species non-responsive to KD |
Участники, ответившие на КД (n=10), демонстрировали уменьшение частоты клинических приступов и улучшение на ЭЭГ / KD responders (n=10) demonstrated lowered rate of clinical seizures and improved EEG picture |
Примечание. КМБ – кишечная микробиота; ФРЭ – фармакорезистентная эпилепсия; КЭ – контролируемая эпилепсия; рРНК – рибосомальная рибонуклеиновая кислота; МРТ – магнитно-резонансная томография; ЭЭГ – электроэнцефалография; КД – кетогенная диета; ВЭЖХ – высокоэффективная жидкостная хроматография.
Note. IM – intestinal microbiome; DRE – drug-resistant epilepsy; CE – controlled epilepsy; rRNA – ribosomal ribonucleic acid; MRI – magnetic resonance imaging; EEG – electroencephalography; KD – ketogenic diet; HPLC – high-performance liquid chromatography.
Изменение КМБ в животных моделях ФРЭ
В доклинических исследованиях КМБ in vivo на животных моделях изучалась роль определенных микроорганизмов в развитии фенотипов эпилепсии. Из-за различных этиологий и неясного механизма эпилепсии ни одна стандартная животная модель до сих пор не была подтверждена в качестве модели эпилептического синдрома. Некоторые модели состояний, сопровождающихся симптоматической эпилепсией, могут помочь в поиске эффективного лечения ФРЭ, включая модели с химическим воздействием, такие как литий-пилокарпиновая модель, каиновая модель височной эпилепсии, а также модели эпилепсии с электрическим воздействием [50][51].
Данные, полученные на животных моделях, также свидетельствуют о том, что КМБ может быть прямо или косвенно вовлечен в патогенез ФРЭ [52]. R. Citraro et al. продемонстрировали значительные различия в бета-разнообразии и соотношении Firmicutes/Bacteroidetes между крысами линий Wistar и WAG/Rij (хорошо известная генетическая модель абсансной эпилепсии) [53]. C. De Caro et al. обнаружили повышенную восприимчивость к судорогам на мышиных моделях колита, индуцированного декстрансульфатом натрия [54]. J.S. Medel-Matus et al. установили, что хронический стресс способен привести к нарушениям в КБМ, и связанные с ним изменения также могут ускорить прогрессирование и увеличить продолжительность приступов [55].
Современное представление о роли MGBA в патогенезе ФРЭ / Current understanding of MGBA role in DRE pathogenesis
КМБ играет системную регулирующую роль посредством взаимосвязи нервной, эндокринной, иммунной, кровеносной и эндокринной систем [56], которые можно разделить на три пути: нейрональный, иммунный и эндокринный. В процессе дисбактериоза эти пути нарушаются, приводя к ряду реакций, включая воспаление, нарушение ГЭБ и повреждение нейромодуляторов, которые участвуют в развитии и прогрессировании различных неврологических расстройств [57].
Нейрональный путь
Нейрональный путь включает энтеральную нервную систему (ЭНС), блуждающий, симпатические и спинномозговые нервы, а также сигнальные молекулы, такие как нейропептиды.
ЭНС состоит из более чем 100 трлн нейронов, функционирующих независимо от ЦНС, которая может не только обрабатывать информацию о локальной стимуляции кишечника, но и реагировать на сигнал от ЦНС [58]. Наиболее эффективным способом передачи сигнала между ЭНС и ЦНС является блуждающий нерв [59]. Нейроподобные клетки – это разновидность сенсорных эпителиальных клеток кишечника, которые взаимодействуют с нейронами блуждающего нерва, используя глутамат в качестве нейромедиатора [60]. Затем сигналы передаются в сенсорные ядра ствола мозга, образуя нейронную цепь «кишечник – мозг» [61]. Глутамат может увеличивать количество белков, переносящих различные лекарственные средства через ГЭБ, тем самым способствуя развитию ФРЭ [62].
В дополнение к прямому нервному пути микроорганизмы в кишечнике могут продуцировать нейромедиаторы и нейромодуляторы, такие как ГАМК, серотонин (5-гидрокситриптамин – англ. 5-hydroxytryptamine, 5-НТ) и т.д. [14]. Тормозной нейромедиатор ГАМК и возбуждающий нейромедиатор глутамат работают вместе, модулируя тормозно-возбуждающий баланс, который нарушается во время инициации и распространения судорог [63]. A. mucinophilia и Parabacteroides оказывают противосудорожное действие, снижая системные уровни ГАМК и повышая соотношение ГАМК/глутамат в гиппокампе [12]. Доказано, что лактобациллы продуцируют ингибирующий нейромедиатор ГАМК, что приводит к повышению концентрации ГАМК в желудочно-кишечном тракте и ЦНС [64].
Что касается триптофана (англ. tryptophan, Trp), который является предшественником нейротрансмиттера 5-НТ, то он метаболизируется по кинурениновому пути и был изучен в рамках противосудорожной эффективности КД у крыс [65] и детей с ФРЭ [66]. Как Trp, так и его метаболит кинуренин могут проникать через ГЭБ, где в астроцитах они расщепляются до кинуреновой кислоты, которая является антагонистом NMDA-рецепторов [67]. Использование жирных кислот может вызывать седативный эффект за счет увеличения содержания Trp и кинуреновой кислоты в головном мозге [64].
Иммунный путь
Ось «микробиота – иммунитет» является центральным медиатором взаимодействия «кишечник – мозг» [68]. Кишечно-ассоциированная лимфоидная ткань (англ. gut-associated lymphoid tissue, GALT) – крупнейший и наиболее важный иммунный орган человека, включающий около 70% иммунных клеток всего организма [69]. Стимуляция со стороны микроорганизмов и продуктов их жизнедеятельности помогает поддерживать стабильность иммунной микросреды кишечника [70].
Рецепторы опознавания паттерна (англ. pattern recognition receptors, PRR), патоген-ассоциированные молекулярные паттерны (ПАМП) и молекулярный фрагмент, ассоциированный с повреждениями (англ. damage associated molecular pattern, DAMP) играют важную роль в вышеуказанном процессе, распознавая сигналы кишечника [70]. Макрофаги устанавливают иммунный гомеостаз, воспринимая ПАМП через toll-подобные рецепторы (англ. toll-like receptors, TLR) и nod-подобные рецепторы (англ. nod-like receptors, NLR), а затем активируя врожденные лимфоидные клетки 3-й группы для высвобождения гранулоцитарно-макрофагального колониестимулирующего фактора (англ. granulocyte-macrophage colony stimulating factor 2, GM-CSF) и интерлейкина-2 (ИЛ-2), поддерживая таким образом динамический баланс регуляторных Т-клеток (англ. regulatory T-cells, Treg) [71].
Чрезмерное количество Prevotella приводит к непрерывной выработке ИЛ-6 и слабовыраженному воспалению [72]. Alistipes также положительно коррелируют с ИЛ-6 и белком группы В1 с высокой подвижностью (англ. high-mobility group protein B1, HGMB1) [73], последний положительно коррелирует с частотой судорожных припадков [74, 75]. Кроме того, сегментированные филаментные бактерии играют ключевую роль в индукции T-хелпера 17 (англ. T-helper type 17, Th17), который помогает поддерживать иммунитет слизистой оболочки кишечника [75]. В то же время Treg, индуцируемые клостридиями, обладают системным противовоспалительным действием [76].
Медиаторы нейровоспаления способствуют развитию ФРЭ, вызывая увеличение количества белков, переносящих лекарственные средства, и нестабильность ГЭБ [77]. Считается, что астроциты и микроглия являются инициаторами нейровоспаления, высвобождая провоспалительные факторы (ИЛ-1β, фактор некроза опухоли альфа и ИЛ-6), затем активируются другие иммунные клетки для участия в нейроиммунной реакции, которая приводит к повреждению ГЭБ [24, 25]. Различные подгруппы Т-клеток периферического происхождения при эпилептогенных поражениях оказывают обратное влияние на тяжесть заболевания, а агрегация γδ-Т-лимфоцитов, продуцирующих ИЛ-17, и подавление регуляции Treg-клеток свидетельствуют о плохой клинической эффективности [78]. В метаанализе, проведенном E.E. de Vries et al., сообщалось, что уровни ИЛ-6, ИЛ-17 в сыворотке крови и ИЛ-1β и ИЛ-10 в спинномозговой жидкости значительно различались у пациентов с эпилепсией [79], а у больных височной эпилепсией активируется ось ИЛ-1β/ИЛ-R1, что приводит к снижению ГАМКА [80].
Эндокринный путь
Бактериальный дисбактериоз приводит к нарушениям эндокринного обмена, что играет важную роль в развитии эпилепсии [81]. Короткоцепочечные жирные кислоты (англ. short-chain fatty acid, SCFA) – микробные метаболиты, которые в настоящее время являются объектом исследований в области MGBA. В основном это ацетат, пропионат и бутират, они могут проникать в кровоток, модулируя функцию иммунных клеток в системном кровотоке и потенциально снижая нейровоспаление [82].
M. Lindefeldt et al. предположили, что выработка SCFA снижена у пациентов с эпилепсией [83]. R. Citraro et al. дополнительно подтвердили, что концентрации пропионата и бутирата в кишечнике у крыс линии WAG/Rij были ниже, что приводило к раннему нарушению кишечного барьера и активации воспаления перед возникновением приступов [53]. ТФМ частично восстанавливала повреждения, вызванные воспалением кишечника, а также уменьшала количество абсансов [53]. Показано, что ацетат и бутират обладают противовоспалительной активностью [84], а бутират может снижать общий воспалительный статус циркулирующих моноцитов [85]. Кроме того, упомянутый выше кинуренин находится под контролем бутирата, вырабатываемого КМБ [86].
Имеются данные, что деацетилазы гистонов (англ. histone deacetylases, HDAC) участвуют в различных заболеваниях ЦНС, включая нейродегенеративные патологии и эпилепсию [87]. Исследования на животных моделях заболеваний ЦНС показывают, что SCFA могут функционировать в качестве ингибиторов HDAC, проявляя нейропротекторные и нейрорегенеративные свойства [88]. Это указывает на то, что SCFA могут воздействовать на ЦНС, связываясь с рецепторами, сопряженными с G-белком (англ. G-protein-coupled receptor, GPCR), или ингибируя активность HDAC. Хотя взаимосвязь между кишечником и ЦНС изучалась лишь в течение короткого времени, а лежащий в ее основе механизм не был выяснен, предполагается, что SCFA играют ключевую роль в системе MGBA.
Благодаря высокой экспрессии монокарбоксилатных транспортеров на эндотелиальных клетках SCFA могут проникать через ГЭБ и воздействовать на головной мозг [89]. Более того, у стерильных мышей наблюдалась сниженная экспрессия белка плотных контактов, что приводило к повышению проницаемости ГЭБ. Это явление можно обратить вспять при введении стерильным мышам бактерий, продуцирующих SCFA [90]. Аналогичным образом показано, что пропионат SCFA защищает ГЭБ от патогенного воспалительного и окислительного стресса [91]. Это позволяет предположить, что SCFA участвуют в регуляции функции ГЭБ и поддержании его целостности.
SCFA способны воздействовать на иммунные клетки и модулировать иммунный ответ, тем самым уменьшая воспаление. SCFA изменяют набор нейтрофилов, регулируя выработку воспалительных цитокинов посредством ингибирования HDAC и индуцируя хемотаксис нейтрофилов путем активации FFAR2 [92]. Эти бактериальные метаболиты влияют на созревание и способность продуцировать провоспалительные цитокины моноцитов, макрофагов и дендритных клеток [93]. Кроме того, SCFA могут модулировать активацию Т-клеток и эффекторный ответ. Ингибируя ацетилирование гистонов, SCFA непосредственно стимулируют дифференцировку Т-клеток в Т-хелперные клетки, усиливая активацию mTOR, или косвенно способствуют трансформации Т-лимфоцитов в регуляторные Т-клетки P3 (FoxP3+), а не в интерферон-γ + Т-клетки, воздействуя на дендритные клетки [94].
Клетки микроглии необходимы для развития, врожденного иммунитета и гомеостаза ЦНС. Они участвуют в синаптогенезе, регенерации аксонов, выживании нейронов и регуляции воспалительных реакций в ЦНС [95]. D. Erny et al. заметили, что клетки микроглии стерильных мышей имеют глобальные дефекты, и дефектная микроглия может быть восстановлена с помощью SCFA [96]. Физиологические микромолярные концентрации SCFA могут снижать уровни цитотоксинов и цитокинов, которые секретируются при стимуляции THP-1 микроглиоподобных клеток [97]. В нескольких исследованиях сообщалось, что бутират обладает способностью снижать активацию микроглии и оказывать сильное противовоспалительное действие in vivo и in vitro [98, 99]. Очевидно, что SCFA являются потенциальными медиаторами КМБ, влияющими на системное воспаление и нейроиммунную функцию.
КМБ как терапевтическая мишень при ФРЭ / IM as a therapeutic target in DRE
Диетотерапия (КД) доказала свою эффективность, относительную безопасность и может сочетаться с другими противоэпилептическими методами лечения. КД, пробиотики, ТФМ и антибиотики потенциально могут влиять на КМБ и таким образом способствовать контролю над судорожными приступами.
Эффективность КД в контроле судорожных приступов
Эффективность классической КД в отношении ФРЭ была доказана в различных исследованиях [100]. КД изменяла состав КМБ через 4 дня после введения в рацион. Подтверждено увеличение относительной численности Akkermansia muciniphila, paracellosis, Sutterella и Erysipelaceae [12]. Другое клиническое исследование показало, что после длительной терапии КД (24 нед) примерно у половины детей частота приступов снизилась на 66% [101].
Во время КД уровень глюкозы снижается и печень окисляет жирные кислоты для обеспечения организма энергией. При этом в крови повышается содержание кетонов, что может служить биохимическим признаком состояния метаболического кетоза, спровоцированного КД [101]. Выявлены изменения в метаболитах у пациентов с ФРЭ, в основном включающие снижение уровня лактата и повышение уровня креатина, фосфокреатина и холина [102, 103]. У пациентов с ФРЭ и КД кетоновые тела могут сбалансировать повышенные уровни глутамата за счет регуляции его везикулярных транспортеров [104] и ГАМК-рецепторов [105], в конечном итоге повышая уровень ГАМК в спинномозговой жидкости, что способствует антиоксидантному эффекту и ремиссии эпилепсии [106].
Нетрудно связать терапевтические механизмы диетических вмешательств с изменениями в кишечной флоре. На самом деле КД может в значительной степени уменьшить дисбаланс КМБ, и, что более важно, КМБ и его метаболиты необходимы для противоэпилептического эффекта КД. X. Gong et al. обнаружили восемь родов кишечной микрофлоры, ассоциированных с эпилепсией, которые полностью исчезали после 6 мес лечения КД [47]. Y. Zhang et al. оценивали эффективность КД у детей с ФРЭ, через 6 мес лечения у пациентов наблюдалось значительное снижение частоты клинических приступов и улучшение результатов электроэнцефалографии по сравнению с исходным уровнем, что сопровождалось заметным снижением соотношения Firmicutes/Bacteroidetes [49].
Кроме того, кетоновые тела могут избирательно ингибировать рост бифидобактерий, который был повышен у пациентов с ФРЭ [55], и снижать уровень провоспалительных Th17-клеток в кишечнике [107]. C.A. Olson et al. обнаружили, что Akkermansia и Parabacteroides играют роль в КД-опосредованном противоэпилептическом эффекте путем снижения активности гамма-глутамилтранспептидазы и стабилизации баланса ГАМК/глутамата в гиппокампе [12].
Роль пробиотиков и ТФМ в терапии ФРЭ
Как в клинических исследованиях пациентов с эпилепсией, так и в экспериментах на животных моделях был обнаружен дисбактериоз кишечной микрофлоры. Пробиотики изменяют состав КМБ, а некоторые добавки, как было показано, уменьшают частоту приступов.
В клиническом исследовании, проведенном в Испании, оценивалась эффективность применения пробиотика, содержащего восемь видов бактерий: Lactobacillus acidophilus, Lactobacillus plantarum, Lactobacillus casei, Lactobacillus helveticus, Lactobacillus brevis, Bifido- bacterium lactis, B. lactis и Streptococcus salivarius subsp. thermophilus у 45 пациентов с ФРЭ [107]. По результатам исследования, у 28,9% пациентов количество приступов уменьшилось более чем на 50%. После этого S. Tahmasebi et al. обнаружили, что пробиотики и добавки Nigella sativa (черный тмин) оказывают протективное действие у крыс с развившимся киндлингом, влияя не только на ремиссию судорожных приступов, но и на когнитивные нарушения, вызванные судорогами, а также на долговременную потенциацию гиппокампа [108].
Наиболее эффективной стратегией восстановления КМБ теоретически могла бы быть ТФМ от здоровых доноров. Однако на сегодняшний день не опубликовано ни одного клинического исследования, посвященного лечению пациентов с эпилепсией с использованием ТФМ. Тщательно спланированные исследования в различных популяциях и на животных моделях позволят выявить ключевые изменения КМБ при ТФМ, которые могут стать полезными для лечения эпилепсии в будущем.
Антибиотики и противоэпилептический эффект
Антибиотики оказывают кратковременное воздействие на КМБ. Доказано, что азитромицин снижает содержание бифидобактерий в КМБ детей на 14 дней [109]. Миноциклин может значительно сократить соотношение Firmicutes/Bacteroidetes в кишечнике с последующим снижением уровня системных цитокинов/хемокинов и ослаблением тревожного поведения [110].
Имеются данные о том, что у 6 детей с эпилепсией после лечения антибиотиками судорожная активность отсутствовала в течение 2 нед [111]. Другое исследование с участием 23 пациентов с ФРЭ предоставило дополнительные доказательства того, что при кратковременном приеме ципрофлоксацина у пациентов наблюдалось значительное снижение частоты приступов, которое началось на 1-й неделе и продолжалось до 12-й недели, сопровождаясь снижением соотношения Firmicutes/Bacteroidetes в кишечнике [112]. Миноциклин также продемонстрировал противосудорожную активность у пациента с астроцитомой и ФРЭ [113].
Применение антибиотиков для изменения состава кишечной микробиоты может быть тесно связано с этиологией и лечением эпилепсии, особенно у пациентов с ФРЭ и нарушениями КМБ. Антибиотики способны оказывать положительное влияние на контроль приступов у таких больных [114]. Однако, хотя H.M.H. Braakman et al. выдвинули гипотезу о благоприятном воздействии антибиотикотерапии, они не представили прямых доказательств в поддержку этой теории [111].
Тем не менее нельзя упускать из виду, что некоторые антибиотики, такие как пенициллин, цефалоспорины четвертого поколения, имипенем и ципрофлоксацин, могут вызывать симптоматические судороги [115]. Хотя этот риск количественно оценивается как низкий или очень низкий (уровень доказательности III–IV), судороги, вызванные приемом антибиотиков, часто наблюдаются при наличии сопутствующих состояний, включая травмы, внутричерепные опухоли, острое нарушение мозгового кровообращения, а также у пожилых людей или лиц с печеночно-почечной недостаточностью. Детям, страдающим ФРЭ и вторичным эпилептическим синдромом, клиническое применение антибиотиков не противопоказано, однако необходимы дальнейшие исследования, посвященные их влиянию на КМБ в данной популяции [114]. При необходимости применения антибиотиков может быть рекомендована короткая, точная, индивидуальная схема лечения в сочетании с пробиотиками [115][116].
В целом с момента официального внедрения КД-терапии в область лечения эпилепсии ее эффективность постоянно подтверждалась, а изучение соответствующих механизмов, в которых важную роль играют Bifidobacterium, Firmicutes и Bacteroidetes, постоянно обновлялось. Пробиотики и антибиотики также могут в определенной степени облегчать приступы, однако доказательств этого явно недостаточно из-за отсутствия углубленных исследований механизма действия. Кроме того, хорошо известно, что значительная часть антибиотиков могут, наоборот, инициировать эпилептические приступы [117].
Ограничения исследований / Research limitations
Существующие исследования, касающиеся оценки КМБ при ФРЭ, имеют ряд ограничений, которые необходимо учитывать при интерпретации результатов. К ним относятся:
– небольшие размеры выборок (многие исследования включают небольшое количество участников, что ограничивает возможность обобщения результатов на всю популяцию пациентов с ФРЭ);
– гетерогенность пациентов (пациенты с ФРЭ представляют собой гетерогенную группу с различными клиническими проявлениями и причинами заболевания, и это затрудняет определение общих закономерностей и механизмов, связанных с КМБ);
– дефицит рандомизированных контролируемых исследований (большинство исследований носят обсервационный характер, что не позволяет установить причинно-следственные связи между изменениями в микробиоме и течением заболевания; рандомизированные контролируемые испытания могли бы предоставить более убедительные доказательства эффективности и безопасности предлагаемых методов лечения).
Эти ограничения подчеркивают необходимость проведения дальнейших исследований с большими выборками, более строгим дизайном и применением современных аналитических методов для уточнения роли КМБ в развитии и лечении ФРЭ.
Перспективы контроля эпилепсии на основе коррекции КМБ / Prospects for epilepsy control based on IM correction
Все больше данных подтверждают, что существуют значительные различия в количестве кишечных бактерий у пациентов с эпилепсией и у людей без эпилепсии. Это открывает новые возможности для диагностики эпилепсии.
Например, незначительное увеличение соотношения Bacteroidetes/Firmicutes перед приступом при снижении численности Bacteroidetes, Paraceletes, Phascolarctobacterium и Sutterella является многообещающим показателем для прогнозирования надвигающегося приступа абсанса (прогностический биомаркер) [118][119]. Кроме того, тип и доля бактерий также могут быть тесно связаны с эпилептической активностью [120]. Выявление изменений в видах и соотношении бактерий в кишечнике пациентов с эпилепсией полезно для разработки потенциальных биомаркеров (например, соотношение Bacteroidetes/Firmicutes) [121].
Таким образом, будущие исследования с большой выборкой, основанные на метагеномике, протеомике и метаболомике, позволят охарактеризовать механизмы и количественные соотношения роли КМБ в патогенезе эпилепсии. КМБ перспективен в качестве биомаркера эпилепсии (предрасположенность/риск, диагностический, контролирующий и прогностический биомаркер). С другой стороны, КМБ может быть полезен для дифференциальной диагностики пациентов с ФРЭ и КЭ на любом уровне, а также использоваться в качестве эффективной терапевтической мишени [81].
Направления будущих исследований
Изучение КМБ при ФРЭ представляет собой перспективную область для улучшения лечения эпилепсии. Выявление точных изменений в составе или функции КМБ при ФРЭ может быть использовано в клинической практике для идентификации лекарственной устойчивости на ранней стадии и лечения пациентов с помощью более целенаправленных вмешательств (например, КД, пробиотиков и пребиотиков).
Необходимо проведение масштабных исследований с включением пациентов на ранней стадии заболевания, а также с проспективным анализом и изучением микробиома их кишечника в связи с прогрессированием заболевания (количество приступов, реакция на лечение и т.д.). Кроме того, анализ КМБ может быть использован для мониторинга реакции на лечение у пациентов, получающих терапию, направленную на коррекцию КМБ.
В будущих исследованиях следует изучить влияние ПЭП на КМБ и наоборот. Предполагается, что некоторые ПЭП могут воздействовать на рост и выживаемость кишечных бактерий. С другой стороны, КМБ может влиять на метаболизм лекарств, изменяя их всасывание, биодоступность и эффективность посредством различных прямых и косвенных механизмов. Кроме того, будущие исследования могут установить, может ли изменение бактериального состава помочь в лечении ФРЭ с использованием антибиотиков, пробиотиков и ТФМ, и выявить долгосрочные эффекты подобных вмешательств. Также важно определить побочные эффекты КД для общего состояния здоровья пациентов с точки зрения изменения КМБ.
Наконец, необходимо расширить исследования дисбактериоза кишечника как фактора, способствующего эпилептогенезу, за пределы пациентов с ФРЭ. Изменения в КМБ могут также наблюдаться в случаях контролируемой эпилепсии, и это еще предстоит изучить.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Доказательства корреляции между КМБ и ФРЭ являются убедительными. Во-первых, существуют явные различия в составе микробиоты кишечника у пациентов с эпилепсией в зависимости от чувствительности к лекарственным препаратам. Хотя результаты были разными, обнаружено, что потенциально полезные виды, такие как Bacteroidetes, выявлялись реже, в то время как потенциально патогенные виды, такие как Firmicutes, Proteobacteria, Verrucomicrobia и Fusobacteria, наблюдались чаще у пациентов с ФРЭ. Во-вторых, хотя механизмы до конца не выяснены, дисбактериоз КМБ может быть скорректирован с помощью экзогенных вмешательств, таких как КД и лечение пробиотиками, что впоследствии приведет к изменениям в нейрохимической передаче сигналов в головном мозге и, следовательно, к снижению эпилептической активности.
КМБ может быть регулятором возникновения и прогрессирования эпилепсии. С точки зрения кишечника комменсальные бактерии способствуют поддержанию стабильности кишечного барьера и местного метаболического баланса. С системной точки зрения КМБ играет ключевую роль в реактивности иммунной системы. Нарушение этого баланса приводит к проникновению токсичных соединений и мешает всасыванию лекарственных средств. Однако коррекция КМБ для лечения ФРЭ по-прежнему сопряжена с трудностями. Прежде всего, эпилепсия, особенно ФРЭ, приводит к дисбактериозу, что усложняет идентификацию конкретных штаммов пробиотиков, необходимых для восстановления исходного микробного состава, без предварительного профилирования КМБ. Кроме того, отсутствие консенсуса относительно корреляции между специфической микробиотой кишечника и ФРЭ в предыдущих исследованиях может быть объяснено многофакторным влиянием на состав КМБ, включая такие факторы, как возраст, географическое положение, особенности питания, социально-экономический статус и этиология эпилепсии.
Следовательно, КД, пробиотики и антибиотики могут оказывать влияние на эпилепсию, корректируя дисбактериоз КМБ. Однако на данный момент исследования не предоставляют достаточно убедительных доказательств. В будущих клинических исследованиях необходимо использовать стандартизированные методики и увеличить количество участников, чтобы получить более достоверные результаты. Кроме того, требуются дальнейшие фундаментальные исследования для изучения возможных механизмов и терапевтических целей.
1 АТФ – аденозинтрифосфат (англ. adenosine triphosphate, ATP).
Список литературы
1. Романов А.С., Шарахова Е.Ф. Медико-социальные аспекты эпилепсии (обзор литературы). Современные проблемы здравоохранения и медицинской статистики. 2023; 3: 80–103. https://doi.org/10.24412/2312-2935-2023-3-80-103.
2. Одинцова Г.В., Абрамов К.Б., Иванова Н.Е. и др. «Эпилепсия 90–80–70»: Межсекторальный глобальный план действий по эпилепсии и другим неврологическим расстройствам (2022–2031 гг.). Трансляционная медицина. 2023; 10 (4): 285–92. https://doi.org/10.18705/2311-4495-2023-10-4-285-292.
3. Эпилепсия: важнейшая задача общественного здравоохранения: резюме. 2019. URL: https://iris.who.int/handle/10665/325444 (дата обращения 28.05.2024).
4. Малышев С.М., Алексеева Т.М., Хачатрян В.А., Галагудза М.М. Патогенез фармакорезистентной эпилепсии. Эпилепсия и пароксизмальные состояния. 2019; 11 (1): 79–87. https://doi.org/10.17749/2077-8333.2019.11.1.79-87.
5. Тадтаева З.Г., Галустян А.Н., Громова О.А., Сардарян И.С. Антиэпилептические препараты третьего поколения: механизм действия, фармакокинетика, взаимодействие и применение в детском возрасте. Эпилепсия и пароксизмальные состояния. 2023; 15 (2): 160–70. https://doi.org/10.17749/2077-8333/epi.par.con.2023.149.
6. Волынец Г.В., Никитин А.В., Скворцова Т.А. Кишечный микробиом и современные методы его исследования у детей. Российский вестник перинатологии и педиатрии. 2022; 67 (4): 5–13. https://doi.org/10.21508/1027-4065-2022-67-4-5-13.
7. Богданова Н.М., Кравцова К.А. Кишечный микробиом. Эпилепсия и возможность расширения альтернативных методов лечения. Научно-медицинский вестник Центрального Черноземья. 2023; 24 (3): 107–21. https://doi.org/10.18499/1990-472X-2023-24-3-107-121.
8. Wang H.X., Wang Y.P. Gut microbiota-brain axis. Chin Med J. 2016; 129 (19): 2373–80. https://doi.org/10.4103/0366-6999.190667.
9. Благонравова А.С., Галова Е.А., Широкова И.Ю., Галова Д.А. Ось «кишечник – мозг» – результаты клинического исследования. Экспериментальная и клиническая гастроэнтерология. 2023; 6: 5–13. https://doi.org/10.31146/1682-8658-ecg-214-6-5-13.
10. Брсикян ЛА, Полуэктова ЕА, Полуэктов МГ. Состояние микробиома кишечника как фактор развития болезни Паркинсона. Неврология, нейропсихиатрия, психосоматика. 2023; 15 (1) :90–6. https://doi.org/10.14412/2074-2711-2023-1-90-96.
11. Сиденкова А.П., Мякотных В.С., Ворошилина Е.С. и др. Механизмы влияния кишечной микробиоты на процессы старения ЦНС и формирование когнитивных расстройств при болезни Альцгеймера. Психиатрия. 2022; 20 (3): 98–111. https://doi.org/10.30629/2618-6667-2022-20-3-98-111.
12. Olson C.A.,Vuong H.E.,Yand J.M., et al. The gut microbiota mediates the anti-seizure effects of the ketogenic diet. Cell. 2018; 173 (7): 1728–41.e1713. https://doi.org/10.1016/j.cell.2018.04.027.
13. Dahlin M., Prast-Nielsen S. The gut microbiome and epilepsy. EBioMedicine. 2019; 44: 741–6. https://doi.org/10.1016/j.ebiom.2019.05.024.
14. Holmes M., Flaminio Z., Vardhan M., et al. Cross talk between drug-resistant epilepsy and the gut microbiome. Epilepsia. 2020; 61 (12): 2619–28. https://doi.org/10.1111/epi.16744.
15. Ding M., Lang Y., Shu H., et al. Microbiota-gut-brain axis and epilepsy: a review on mechanisms and potential therapeutics. Front Immunol. 2021; 12: 742449. https://doi.org/10.3389/fimmu.2021.742449.
16. Yue Q., Cai M., Xiao B., et al.. Themicrobiota gut-brain axis and epilepsy. Cell Mol Neurobiol. 2022; 42 (2): 439–53. https://doi.org/10.1007/s10571-021-01130-2.
17. Sorboni S.G., Moghaddam H.S., Jafarzadeh-Esfehani R., Soleimanpour S. A comprehensive review on the role of the gut microbiome in human neurological disorders. Clin Microbiol Rev. 2022; 35 (1): e0033820. https://doi.org/10.1128/CMR.00338-20.
18. Kalilani L., Sun X., Pelgrims B., et al. The epidemiology of drug-resistant epilepsy: a systematic review and meta-analysis. Epilepsia. 2018; 59 (12): 2179–93. https://doi.org/10.1111/epi.14596.
19. Loscher W., Potschka H., Sisodiya S.M., Vezzani A. Drug resistance in epilepsy: clinical impact, potential mechanisms, and new innovative treatment options. Pharmacol Rev. 2020; 72 (3): 606–38. https://doi.org/10.1124/pr.120.019539.
20. Kostic D., Carlson R., Henke D., et al. Evaluation of IL-1β levels in epilepsy and traumatic brain injury in dogs. BMC Neurosci. 2019; 20 (1): 29. https://doi.org/10.1186/s12868019-0509-5.
21. Sheilabi M.A., Takeshita L.Y., Sims E.J., et al. The sodium channel B4-subunits are dysregulated in temporal lobe epilepsy drug-resistant patients. Int J Mol Sci. 2020; 21 (8): 2955. https://doi.org/10.3390/ijms21082955.
22. Zeng Y., Qin B., Shi Y.W., et al. Ilepcimide inhibited sodium channel activity in mouse hippocampal neurons. Epilepsy Res. 2021; 170: 106533. https://doi.org/10.1016/j.eplepsyres.2020.106533.
23. Xu C., Wang Y., Zhang S., et al. Subicular pyramidal neurons gate drug resistance in temporal lobe epilepsy. Ann Neurol. 2019; 86 (4): 626–40. https://doi.org/10.1002/ana.25554.
24. Шилкина О.С., Кантимирова Е.А., Усольцева А.А. и др. Аутоиммунная эпилепсия. Эпилепсия и пароксизмальные состояния. 2022; 14 (1): 74–90. https://doi.org/10.17749/2077-8333/epi.par.con.2022.108.
25. Шилкина О.С., Тимечко Е.Е., Дмитренко Д.В. Проблемы диагностики и лечения аутоиммунной эпилепсии. Эпилепсия и пароксизмальные состояния. 2023; 15 (2): 135–47. https://doi.org/10.17749/2077-8333/epi.par.con.2023.130.
26. Patra P.H., Barker-Haliski M., White H.S., et al. Cannabidiol reduces seizures and associated behavioral comorbidities in a range of animal seizure and epilepsy models. Epilepsia. 2019; 60 (2): 303–14. https://doi.org/10.1111/epi.14629.
27. Fonseca-Barriendos D., Frías-Soria C.L., Pérez-Pérez D., et al. Drug-resistant epilepsy: drug target hypothesis and beyond the receptors. Epilepsia Open. 2022; 7 (1): 23–33. https://doi.org/10.1002/epi4.12539.
28. Vezzani A., Balosso S., Ravizza T. Neuroinflammatory pathways as treatment targets and biomarkers in epilepsy. Nat Rev Neurol. 2019; 15 (8): 459–72. https://doi.org/10.1038/s41582-019-0217-x.
29. Scalmani P., Paterra R., Mantegazza M., et al. Involvement of GABAergic interneuron subtypes in 4-aminopyridine-induced seizure-like events in mouse entorhinal cortex in vitro. J Neurosci. 2023; 43 (11): 1987–2001. https://doi.org/10.1523/JNEUROSCI.1190-22.2023.
30. Leandro K., Bicker J., Alves G., et al. ABC transporters in drug-resistant epilepsy: mechanisms of upregulation and therapeutic approaches. Pharmacol Res. 2019; 144: 357–76. https://doi.org/10.1016/j.phrs.2019.04.031.
31. Garg N., Joshi R., Medhi B. A novel approach of targeting refractory epilepsy: need of an hour. Brain Res Bull. 2020; 163: 14–20. https://doi.org/10.1016/j.brainresbull.2020.07.012.
32. Langeh U., Chawla P., Gupta G.D., Singh S. A novel approach to refractory epilepsy by targeting pgp peripherally and centrally: therapeutic targets and future perspectives. CNS Neurol Disord Drug Targets. 2020; 19 (10): 741–9. https://doi.org/10.2174/1871527319999200819093109.
33. Brukner A.M., Billington S., Benifla M., et al. Abundance of P-glycoprotein and breast cancer resistance protein measured by targeted proteomics in human epileptogenic brain tissue. Mol Pharm. 2021; 18 (6): 2263–73. https://doi.org/10.1021/acs.molpharmaceut.1c00083.
34. Na J.H., Shin S., Yang D., et al. Targeted gene panel sequencing in early infantile onset developmental and epileptic encephalopathy. Brain Dev. 2020; 42 (6): 438–48. https://doi.org/10.1016/j.braindev.2020.02.004.
35. Calderon-Ospina C.A., Galvez J.M., López-Cabra C., et al. Possible genetic determinants of response to phenytoin in a group of Colombian patients with epilepsy. Front Pharmacol. 2020; 11: 555. https://doi.org/10.3389/fphar.2020.00555.
36. Orlandi A., Paolino M.C., Striano P., Parisi P. Clinical reappraisal of the influence of drug-transporter polymorphisms in epilepsy. Expert Opin Drug Metab Toxicol. 2018; 14 (5): 505–12. https://doi.org/10.1080/17425255.2018.1473377.
37. Barker-Haliski M., Steve White H. Validated animal models for antiseizure drug (ASD) discovery: advantages and potential pitfalls in ASD screening. Neuropharmacology. 2020; 167: 107750. https://doi.org/10.1016/j.neuropharm.2019.107750.
38. Zubiaur P., Del Peso-Casado M., Ochoa D., et al. ABCB1 C3435T, G2677T/A and C1236T variants have no effect in eslicarbazepine pharmacokinetics. Biomed Pharmacother. 2021; 142: 112083. https://doi.org/10.1016/j.biopha.2021.112083.
39. Balan Y., Gaur A., Sakthivadivel V., et al. Is the gut microbiota a neglected aspect of gut and brain disorders? Cureus. 2021; 13 (11): e19740. https://doi.org/10.7759/cureus.19740.
40. Kennedy K.M., Gerlach M.J., Adam T., et al. Fetal meconium does not have a detectable microbiota before birth. Nat Microbiol. 2021; 6 (7): 865–73. https://doi.org/10.1038/s41564-021-00904-0.
41. Mishra A., Lai G.C., Yao L.J., et al. Microbial exposure during early human development primes fetal immune cells. Cell. 2021; 184 (13): 3394–409. https://doi.org/10.1016/j.cell.2021.04.039.
42. Roswall J., Olsson L.M., Kovatcheva-Datchary P., et al. Developmental trajectory of the healthy human gut microbiota during the first 5 years of life. Cell Host Microbe. 2021; 29 (5): 765–76.e3. https://doi.org/10.1016/j.chom.2021.02.021.
43. Peng A., Qiu X., Lai W., et al. Altered composition of the gut microbiome in patients with drug-resistant epilepsy. Epilepsy Res. 2018; 147: 102–7. https://doi.org/10.1016/j.eplepsyres.2018.09.013.
44. Gong X., Liu X., Chen C., et al. Alteration of gut microbiota in patients with epilepsy and the potential index as a biomarker. Front Microbiol. 2020; 11: 517797. https://doi.org/10.3389/fmicb.2020.517797.
45. Lee H., Lee S., Lee D.H., Kim D.W. A comparison of the gut microbiota among adult patients with drug-responsive and drug-resistant epilepsy: an exploratory study. Epilepsy Res. 2021; 172: 106601. https://doi.org/10.1016/j.eplepsyres.2021.106601.
46. Şafak B., Altunan B., Topçu B., et al. The gut microbiome in epilepsy. Microb Pathog. 2020; 139: 103853. https://doi.org/10.1016/j.micpath.2019.103853.
47. Gong X, Cai Q, Liu X, et al. Gut flora and metabolism are altered in epilepsy and partially restored after ketogenic diets. Microb Pathog. 2021; 155: 104899. https://doi.org/10.1016/j.micpath.2021.104899.
48. Xie G., Zhou Q., Qiu C.Z., et al. Ketogenic diet poses a significant effect on imbalanced gut microbiota in infants with refractory epilepsy. World J Gastroenterol. 2017; 23 (33): 6164–71. https://doi.org/10.3748/wjg.v23.i33.6164.
49. Zhang Y, Zhou S, Zhou Y, et al. Altered gut microbiome composition in children with refractory epilepsy after ketogenic diet. Epilepsy Res. 2018;145:163-168. https://doi.org/10.1016/j.eplepsyres.2018.06.015.
50. Малышев С.М., Алексеева Т.М., Хачатрян В.А., Галагудза М.М. Негенетические экспериментальные модели эпилепсии in vivo и стимуляция блуждающего нерва. Трансляционная медицина. 2018; 5 (3): 36–44. https://doi.org/10.18705/2311-4495-2018-5-3-36-44.
51. Егорова Е.В., Дмитренко Д.В., Усольцева А.А., и др. Моделирование хронической эпилепсии на животных с помощью химических методов. Бюллетень сибирской медицины. 2019; 18 (4): 185–96. https://doi.org/10.20538/1682-0363-2019-4-185-196.
52. Mejía-Granados D.M., Villasana-Salazar B., Lozano-García L., et al. Gut-microbiota-directed strategies to treat epilepsy: clinical and experimental evidence. Seizure. 2021; 90: 80–92. https://doi.org/10.1016/j.seizure.2021.03.009.
53. Citraro R., Lembo F., De Caro C., et al. First evidence of altered microbiota and intestinal damage and their link to absence epilepsy in a genetic animal model, the WAG/Rij rat. Epilepsia. 2021; 62 (2): 529–41. https://doi.org/10.1111/epi.16813.
54. De Caro C., Leo A., Nesci V., et al. Intestinal inflammation increases convulsant activity and reduces antiepileptic drug efficacy in a mouse model of epilepsy. Sci Rep. 2019; 9 (1): 13983. https://doi.org/10.1038/s41598-019-50542-0.
55. Medel-Matus J.S., Shin D., Dorfman E., et al. Facilitation of kindling epileptogenesis by chronic stress may be mediated by intestinal microbiome. Epilepsia Open. 2018; 3 (2): 290–4. https://doi.org/10.1002/epi4.12114.
56. Cryan J.F., O'Riordan K.J., Cowan C.S.M., et al. The microbiota-gut-brain axis. Physiol Rev. 2019; 99 (4): 1877–2013. https://doi.org/10.1152/physrev.00018.2018.
57. Cryan J.F., O'Riordan K.J., Sandhu K., et al. The gut microbiome in neurological disorders. Lancet Neurol. 2020; 19 (2): 179–94. https://doi.org/10.1016/S1474-4422(19)30356-4.
58. Ивашкин В.Т., Ивашкин К.В. Кишечный микробиом как фактор регуляции деятельности энтеральной и центральной нервной системы. Российский журнал гастроэнтерологии, гепатологии, колопроктологии. 2017; 27 (5): 11–9. https://doi.org/10.22416/1382-4376-2017-27-5-11-19.
59. Fülling C., Dinan T.G., Cryan J.F. Gut microbe to brain signaling: what happens in vagus… Neuron. 2019; 101 (6): 998–1002. https://doi.org/10.1016/j.neuron.2019.02.008.
60. Kaelberer M.M., Buchanan K.L., Klein M.E., et al. A gut-brain neural circuit for nutrient sensory transduction. Science. 2018; 361 (6408): eaat5236. https://doi.org/10.1126/science.aat5236.
61. Muller P.A., Schneeberger M., Matheis F., et al. Microbiota modulate sympathetic neurons via a gut-brain circuit. Nature. 2020; 583 (7816): 441–6. https://doi.org/10.1038/s41586-020-2474-7.
62. Löscher W., Friedman A. Structural, molecular, and functional alterations of the blood-brain barrier during epileptogenesis and epilepsy: a cause, consequence, or both? Int J Mol Sci. 2020; 21 (2): 591. https://doi.org/10.3390/ijms21020591.
63. Dhaher R., Gruenbaum S.E., Sandhu M.R.S., et al. Network- related changes in neurotransmitters and seizure propagation during rodent epileptogenesis. Neurology. 2021; 96 (18): e2261–71. https://doi.org/10.1212/WNL.0000000000011846.
64. Muñana K.R., Jacob M.E., Callahan B.J. Evaluation of fecal Lactobacillus populations in dogs with idiopathic epilepsy: a pilot study. Anim Microb. 2020; 2: 19. https://doi.org/10.1186/s42523-020-00036-6.
65. Maciejak P., Szyndler J., Turzyńska D., et al. Is the interaction between fatty acids and tryptophan responsible for the efficacy of a ketogenic diet in epilepsy? The new hypothesis of action. Neuroscience. 2016; 313: 130–48. https://doi.org/10.1016/j.neuroscience.2015.11.
66. Żarnowska I., Wróbel-Dudzińska D., Tulidowicz-Bielak M., et al. Changes in tryptophan and kynurenine pathway metabolites in the blood of children treated with ketogenic diet for refractory epilepsy. Seizure. 2019; 69: 265–72. https://doi.org/10.1016/j.seizure.2019.05.006.
67. Gao K., Mu C.L., Farzi A., Zhu W.Y. Tryptophan metabolism: a link between the gut microbiota and brain. Adv Nutr. 2020; 11 (3): 709–23. https://doi.org/10.1093/advances/nmz127.
68. Fung T.C. The microbiota-immune axis as a central mediator of gut-brain communication. Neurobiol Dis. 2020; 136: 104714. https://doi.org/10.1016/j.nbd.2019.104714.
69. Sochocka M., Donskow-Łysoniewska K., Diniz B.S., et al. The gut microbiome alterations and inflammation-driven pathogenesis of Alzheimer’s disease-a critical review. Mol Neurobiol. 2019; 56 (3): 1841–51. https://doi.org/10.1007/s12035-018-1188-4.
70. Matson V., Chervin C.S., Gajewski T.F. Cancer and the microbiome-influence of the commensal microbiota on cancer, immune responses, and immunotherapy. Gastroenterology. 2021; 160 (2): 600–13. https://doi.org/10.1053/j.gastro.2020.11.041.
71. Zhou L., Chu C., Teng F., et al. Innate lymphoid cells support regulatory T cells in the intestine through interleukin-2. Nature. 2019; 568 (7752): 405–9. https://doi.org/10.1038/s41586-019-1082-x.
72. Leite A.Z., Rodrigues N.C., Gonzaga M.I., et al. Detection of increased plasma interleukin-6 levels and prevalence of and in the feces of type 2 diabetes patients. Front Immunol. 2017; 8: 1107. https://doi.org/10.3389/fimmu.2017.01107.
73. Xu Y., Wang Y., Li H., et al. Altered fecal microbiota composition in older adults with frailty. Front Cell Infect Microbiol. 2021; 11: 696186. https://doi.org/10.3389/fcimb.2021.696186.
74. Wang N., Liu H., Ma B., et al. CSF high-mobility group box 1 is associated with drug-resistance and symptomatic etiology in adult patients with epilepsy. Epilepsy Res. 2021; 177: 106767. https://doi.org/10.1016/j.eplepsyres.2021.106767.
75. Walker L.E., Sills G.J., Jorgensen A., et al. High-mobility group box 1 as a predictive biomarker for drug-resistant epilepsy: a proof-of-concept study. Epilepsia. 2022; 63 (1): e1–6. https://doi.org/10.1111/epi.17116.
76. Atarashi K., Tanoue T., Oshima K., et al. Treg induction by a rationally selected mixture of Clostridia strains from the human microbiota. Nature. 2013; 500 (7461): 232–6. https://doi.org/10.1038/nature12331.
77. Weidner L.D., Kannan P., Mitsios N., et al. The expression of inflammatory markers and their potential influence on efflux transporters in drug-resistant mesial temporal lobe epilepsy tissue. Epilepsia. 2018; 59 (8): 1507–17. https://doi.org/10.1111/epi.14505.
78. Xu D., Robinson A.P., Ishii T., et al. Peripherally derived T regulatory and γδ T cells have opposing roles in the pathogenesis of intractable pediatric epilepsy. J Exp Med. 2018; 215 (4): 1169–86. https://doi.org/10.1084/jem.20171285.
79. de Vries E.E., van den Munckhof B., Braun K.P.J., et al. Inflammatory mediators in human epilepsy: a systematic review and meta-analysis. Neurosci Biobehav Rev. 2016; 63: 177–90. https://doi.org/10.1016/j.neubiorev.2016.02.007.
80. Roseti C., van Vliet E.A., Cifelli P., et al. GABAA currents are decreased by IL-1β in epileptogenic tissue of patients with temporal lobe epilepsy: implications for ictogenesis. Neurobiol Dis. 2015; 82: 311–20. https://doi.org/10.1016/j.nbd.2015.07.003.
81. Lum G.R., Olson C.A., Hsiao E.Y. Emerging roles for the intestinal microbiome in epilepsy. Neurobiol Dis. 2020; 135: 104576. https://doi.org/10.1016/j.nbd.2019.104576.
82. Dalile B., Van Oudenhove L., Vervliet B., Verbeke K. The role of short-chain fatty acids in microbiota-gut-brain communication. Nat Rev Gastroenterol Hepatol. 2019; 16 (8): 461–78. https://doi.org/10.1038/s41575-019-0157-3.
83. Lindefeldt M., Eng A., Darban H., et al. The ketogenic diet influences taxonomic and functional composition of the gut microbiota in children with severe epilepsy. NPJ Biofilms Microbiomes. 2019; 5 (1): 5. https://doi.org/10.1038/s41522-018-0073-2.
84. Dalile B., Van Oudenhove L., Vervliet B., Verbeke K. The role of short-chain fatty acids in microbiota-gut-brain communication. Nat Rev Gastroenterol Hepatol. 2019; 16 (8): 461–78. https://doi.org/10.1038/s41575-019-0157-3.
85. Cleophas M.C.P., Ratter J.M., Bekkering S., et al. Effects of oral butyrate supplementation on inflammatory potential of circulating peripheral blood mononuclear cells in healthy and obese males. Sci Rep. 2019; 9 (1): 775. https://doi.org/10.1038/s41598-018-37246-7.
86. Kennedy P.J., Cryan J.F., Dinan T.G., Clarke G. Kynurenine pathway metabolism and the microbiota-gut-brain axis. Neuropharmacology. 2017; 112 (Pt B): 399–412. https://doi.org/10.1016/j.neuropharm.2016.07.002.
87. Kumar V, Kundu S, Singh A, Singh S. Understanding the role of histone deacetylase and their inhibitors in neurodegenerative disorders: current targets and future perspective. Curr Neuropharmacol. 2022; 20 (1): 158–78. https://doi.org/10.2174/1570159X19666210609160017.
88. Fischer A., Sananbenesi F., Mungenast A., Tsai L.H. Targeting the correct HDAC(s) to treat cognitive disorders. Trends Pharmacol Sci. 2010; 31 (12): 605–17. https://doi.org/10.1016/j.tips.2010.09.003.
89. Vijay N., Morris M.E. Role of monocarboxylate transporters in drug delivery to the brain. Curr Pharm Des. 2014; 20 (10): 1487–98. https://doi.org/10.2174/13816128113199990462.
90. Braniste V., Al-Asmakh M., Kowal C., et al. The gut microbiota influences blood-brain barrier permeability in mice. Sci Transl Med. 2014; 6 (263): 263ra158. https://doi.org/10.1126/scitranslmed.3009759.
91. Hoyles L., Snelling T., Umlai U.K., et al. Microbiome-host systems interactions: protective effects of propionate upon the blood-brain barrier. Microbiome. 2018; 6 (1): 55. https://doi.org/10.1186/s40168-018-0439-y.
92. Rodrigues H.G., Takeo Sato F., Curi R., Vinolo M.A.R. Fatty acids as modulators of neutrophil recruitment, function and survival. Eur J Pharmacol. 2016; 785: 50–8. https://doi.org/10.1016/j.ejphar.2015.03.098.
93. Corrêa-Oliveira R., Fachi J.L., Vieira A., et al. Regulation of immune cell function by short-chain fatty acids. Clin Transl Immunology. 2016; 5 (4): e73. https://doi.org/10.1038/cti.2016.17.
94. Gurav A., Sivaprakasam S., Bhutia Y.D., et al. Slc5a8, a Na+-coupled high-affinity transporter for short-chain fatty acids, is a conditional tumour suppressor in colon that protects against colitis and colon cancer under low-fibre dietary conditions. Biochem J. 2015; 469 (2): 267–78. https://doi.org/10.1042/BJ20150242.
95. Vidal-Itriago A., Radford R.A.W., Aramideh J.A., et al. Microglia morphophysiological diversity and its implications for the CNS. Front Immunol. 2022; 13: 997786. https://doi.org/10.3389/fimmu.2022.997786.
96. Erny D., Hrabě de Angelis A.L., Jaitin D., et al. Host microbiota constantly control maturation and function of microglia in the CNS. Nat Neurosci. 2015; 18 (7): 965–77. https://doi.org/10.1038/nn.4030.
97. Wenzel T.J., Gates E.J., Ranger A.L., Klegeris A. Short-chain fatty acids (SCFAs) alone or in combination regulate select immune functions of microglia-like cells. Mol Cell Neurosci. 2020; 105: 103493. https://doi.org/10.1016/j.mcn.2020.103493.
98. Yamawaki Y., Yoshioka N., Nozaki K., et al. Sodium butyrate abolishes lipopolysaccharide-induced depression-like behaviors and hippocampal microglial activation in mice. Brain Res. 2018; 1680: 13–38. https://doi.org/10.1016/j.brainres.2017.12.004.
99. Wang P., Zhang Y., Gong Y., et al. Sodium butyrate triggers a functional elongation of microglial process via Akt-small RhoGTPase activation and HDACs inhibition. Neurobiol Dis. 2018; 111: 12–25. https://doi.org/10.1016/j.nbd.2017.12.006.
100. Kossoff E.H., Zupec-Kania B.A., Auvin S., et al. Optimal clinical management of children receiving dietary therapies for epilepsy: updated recommendations of the international ketogenic diet study group. Epilepsia Open. 2018; 3 (2): 175–92. https://doi.org/10.1002/epi4.12225.
101. Sondhi V., Agarwala A., Pandey R.M., et al. Efficacy of ketogenic diet, modified atkins diet, and low glycemic index therapy diet among children with drug-resistant epilepsy: a randomized clinical trial. JAMA Pediatr. 2020; 174 (10): 944–51. https://doi.org/10.1001/jamapediatrics.2020.2282.
102. Wu H.C., Dachet F., Ghoddoussi F., et al. Altered metabolomic-genomic signature: a potential noninvasive biomarker of epilepsy. Epilepsia. 2017; 58 (9): 1626–36. https://doi.org/10.1111/epi.13848.
103. Murgia F., Muroni A., Puligheddu M., et al. Metabolomics as a tool for the characterization of drug-resistant epilepsy. Front Neurol. 2017; 8: 459. https://doi.org/10.3389/fneur.2017.00459.
104. Juge N., Gray J.A., Omote H., et al. Metabolic control of vesicular glutamate transport and release. Neuron. 2010; 68 (1): 99–112. https://doi.org/10.1016/j.neuron.2010.09.002.
105. Dahlin M., Elfving A., Ungerstedt U., Amark P. The ketogenic diet influences the levels of excitatory and inhibitory amino acids in the CSF in children with refractory epilepsy. Epilepsy Res. 2005; 64 (3): 115–25. https://doi.org/10.1016/j.eplepsyres.2005.03.008.
106. Freeman J., Veggiotti P., Lanzi G., et al. The ketogenic diet: from molecular mechanisms to clinical effects. Epilepsy Res. 2006; 68 (2): 145–80. https://doi.org/10.1016/j.eplepsyres.2005.10.003.
107. Gómez-Eguílaz M., Ramón-Trapero J.L., Pérez-Martínez L., Blanco J.R. The beneficial effect of probiotics as a supplementary treatment in drug-resistant epilepsy: a pilot study. Benef Microbes. 2018; 9 (6): 875–81. https://doi.org/10.3920/BM2018.0018.
108. Tahmasebi S., Oryan S., Mohajerani H.R., et al. Probiotics and Nigella sativa extract supplementation improved behavioral and electrophysiological effects of PTZ-induced chemical kindling in rats. Epilepsy Behav. 2020; 104 (Pt A): 106897. https://doi.org/10.1016/j.yebeh.2019.106897.
109. Wei S., Mortensen M.S., Stokholm J., et al, Short- and long-term impacts of azithromycin treatment on the gut microbiota in children: a double-blind, randomized, placebo-controlled trial. EBioMedicine. 2018; 38: 265–72. https://doi.org/10.1016/j.ebiom.2018.11.035.
110. Schmidt E.K.A., Raposo P.J.F., Torres-Espin A., et al. Beyond the lesion site: minocycline augments inflammation and anxiety-like behavior following SCI in rats through action on the gut microbiota. J Neuroinflammation. 2021; 18 (1): 144. https://doi.org/10.1186/s12974-021-02123-0.
111. Braakman H.M.H., van Ingen J. Can epilepsy be treated by antibiotics? J Neurol. 2018; 265 (8): 1934–6. https://doi.org/10.1007/107s00415-018-8943-3.
112. Cheraghmakani H., Rezai M.S., Valadan R., et al. Ciprofloxacin for treatment of drug-resistant epilepsy. Epilepsy Res. 2021; 176: 106742. https://doi.org/10.1016/j.eplepsyres.2021.106742.
113. Nowak M., Strzelczyk A., Reif P.S., et al. Minocycline as potent anticonvulsant in a patient with astrocytoma and drug resistant epilepsy. Seizure. 2012; 21 (3): 227–8. https://doi.org/10.1016/j.seizure.2011.12.009.
114. Sutter R., Rüegg S., Tschudin-Sutter S. Seizures as adverse events of antibiotic drugs: a systematic review. Neurology. 2015; 85 (15): 1332–41. https://doi.org/10.1212/WNL.0000000000002023.
115. Wanleenuwat P., Suntharampillai N., Iwanowski P. Antibiotic-induced epileptic seizures: mechanisms of action and clinical considerations. Seizure. 2020; 81: 167–74. https://doi.org/10.1016/j.seizure.2020.08.012.
116. Amlerova J., Šroubek J., Angelucci F., Hort J. Evidences for a role of gut microbiota in pathogenesis and management of epilepsy. Int J Mol Sci. 2021; 22 (11): 5576. https://doi.org/10.3390/ijms22115576.
117. Imani S., Buscher H., Marriott D., et al. Too much of a good thing: a retrospective study of β-lactam concentration-toxicity relationships. J Antimicrob Chemother. 2017; 72 (10): 2891–7. https://doi.org/10.1093/jac/dkx209.
118. Mazarati A., Medel-Matus J.S., Shin D., et al. Disruption of intestinal barrier and endotoxemia after traumatic brain injury: implications for post-traumatic epilepsy. Epilepsia. 2021; 62 (6):1472–81. https://doi.org/10.1111/epi.16909.
119. Medel-Matus J.S., Lagishetty V., Santana-Gomez C., et al. Susceptibility to epilepsy after traumatic brain injury is asso- ciated with preexistent gut microbiome profile. Epilepsia. 2022; 63 (7): 1835–48. https://doi.org/10.1111/epi.17248.
120. Dong L., Zheng Q., Cheng Y., et al. Gut microbial characteristics of adult patients with epilepsy. Front Neurosci. 2022; 16: 803538. https://doi.org/10.3389/fnins.2022.803538.
121. Russo E. The gut microbiota as a biomarker in epilepsy. Neurobiol Dis. 2022; 163: 105598. https://doi.org/10.1016/j.nbd.2021.105598.
Об авторах
А. С. ЧередниченкоРоссия
Чередниченко Алина Сергеевна
ул. Куйбышева, д. 136, Батайск 346880, Ростовская обл.
П. В. Моздор
Россия
Моздор Павел Владимирович
ул. Просвещения, д. 59, корп. 3, ст-ца Полтавская 353800, Красноармейский р-н, Краснодарский край
Т. К. Олейникова
Россия
Олейникова Татьяна Константиновна
ул. Карла Маркса, д. 3, Курск 305000
П. А. Хатам
Россия
Хатам Псэнэф Абдуллах
ул. Первомайская, д. 191, Майкоп 385000, Республика Aдыгея
Ф. М. Настуева
Россия
Настуева Фарида Мухарбиевна
ул. Мира, д. 310, Ставрополь 355017
К. О. Коваленков
Россия
Коваленков Кирилл Олегович
ул. Мира, д. 310, Ставрополь 355017
А. С. Сердинова
Россия
Сердинова Анастасия Сергеевна
Нахичеванский пер., д. 29, Ростов-на-Дону 344022
А. Х. Осмаева
Россия
Осмаева Амина Хусайновна
Нахичеванский пер., д. 29, Ростов-на-Дону 344022
А. И. Ровчак
Россия
Ровчак Анна Игоревна
Нахичеванский пер., д. 29, Ростов-на-Дону 344022
Ю. Ю. Есикова
Россия
Есикова Юлия Юрьевна
Нахичеванский пер., д. 29, Ростов-на-Дону 344022
М. Х. Шогенова
Россия
Шогенова Мадина Хасановна
ул. Долгоруковская, д. 4, Москва 127006
К. И. Ахмедов
Россия
Ахмедов Курбанмагомед Икрамович
ул. Долгоруковская, д. 4, Москва 127006
М. Р. Амиргамзаев
Россия
Амиргамзаев Магнидин Ризванович
ул. Пушкинская, д. 40, Владикавказ 362019, Республика Северная Осетия – Алания
Э. Р. Батыршина
Россия
Батыршина Эндже Ривалевна
ул. Блюхера, д. 3, Уфа 450075, Республика Башкортостан
Рецензия
Для цитирования:
Чередниченко А.С., Моздор П.В., Олейникова Т.К., Хатам П.А., Настуева Ф.М., Коваленков К.О., Сердинова А.С., Осмаева А.Х., Ровчак А.И., Есикова Ю.Ю., Шогенова М.Х., Ахмедов К.И., Амиргамзаев М.Р., Батыршина Э.Р. Взаимосвязь кишечного микробиома и эпилепсии: потенциальные возможности терапии фармакорезистентной эпилепсии. Эпилепсия и пароксизмальные состояния. 2024;16(3):250-265. https://doi.org/10.17749/2077-8333/epi.par.con.2024.190
For citation:
Cherednichenko A.S., Mozdor P.V., Oleynikova T.K., Khatam P.A., Nastueva F.M., Kovalenkov K.O., Serdinova A.S., Osmaeva A.Kh., Rovchak A.I., Esikova Yu.Yu., Shogenova M.Kh., Akhmedov K.I., Amirgamzaev M.R., Batyrshina E.R. A relationship between intestinal microbiome and epilepsy: potential treatment options for drug-resistant epilepsy. Epilepsy and paroxysmal conditions. 2024;16(3):250-265. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2024.190
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































