Перейти к:
Случаи фармакорезистентной эпилепсии при хромосомной патологии
https://doi.org/10.17749/2077-8333/epi.par.con.2024.187
Аннотация
Представлено два случая эпилепсии у больных с редкой наследственной патологией, связанной с хромосомной мутацией – делецией хромосомы 14. В первом случае у ребенка данная патология проявлялась генерализованными тонико-клоническими приступами, задержкой психоречевого развития и микроаномалиями лицевого черепа, во втором случае – тоническими эпилептическими приступами, задержкой психоречевого развития, микроаномалиями развития, пирамидно-атактическим синдромом и гипермобильностью суставов кистей. Данные клинические наблюдения представляют профессиональный и научный интерес, т.к. относятся к раритетной неврологической патологии, ведущим проявлением которой была фармакорезистентная эпилепсия.
Ключевые слова
Для цитирования:
Новикова Л.Б., Акопян А.П., Латыпова Р.Ф., Файзуллина Н.М. Случаи фармакорезистентной эпилепсии при хромосомной патологии. Эпилепсия и пароксизмальные состояния. 2024;16(3):223–230. https://doi.org/10.17749/2077-8333/epi.par.con.2024.187
For citation:
Novikova L.B., Akopyan A.P., Latypova R.F., Faizullina N.M. Drug-resistant epilepsy cases in chromosomal pathology. Epilepsy and paroxysmal conditions. 2024;16(3):223–230. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2024.187
ВВЕДЕНИЕ / INTRODUCTION
В последние десятилетия развитие генетической науки привело к открытию ряда заболеваний с хромосомными мутациями. Среди последних выделяют делеции, дупликации, транслокации и инверсии.
При делеции аномальное развитие клетки связано с недостатком генетической информации из-за потери удаленных участков генетической цепи. У носителя такой мутации находят моносомию по концевым участкам в связи с концевыми делециями, при которых может сформироваться кольцевая хромосома. Представителем этих патологических состояний является такое редкое генетическое заболевание, как синдром кольцевой хромосомы 14.
Синдром кольцевой хромосомы 14 вызван одной аберрантной хромосомой 14, сломанные концы которой срастаются вместе, образуя кольцо [1]. Больные с таким синдромом имеют одну копию аномальной хромосомы в некоторых или во всех клетках. У большинства пациентов не удается обнаружить семейный анамнез по этому заболеванию, хотя представлены два случая, когда кольцевая хромосома 14 была передана ребенку от матери. Чаще мутация хромосомы возникает как случайное событие во время раннего эмбрионального развития или формирования мужских и женских половых клеток. Первые научные данные об этой патологии появились в 1971 г. [2]. Поскольку во всем мире зарегистрировано менее 100 случаев с синдромом кольцевой хромосомы 14, заболевание представляет медицинский и научный интерес в связи с недостаточной изученностью.
Фенотип хромосомы 14 характеризуется дисморфическими чертами лица, рефрактерной эпилепсией с ранним началом, задержкой развития, умственной отсталостью и расстройством аутистического спектра [1][3–7]. Дети с таким синдромом, как правило, невысокого роста, для них характерны микроцефалия, ретинопатия, рецидивирующие респираторные инфекции, вызванные проблемами с иммунитетом [1]. Начало эпилепсии при синдроме кольцевой хромосомы 14 приходится на первый год жизни ребенка [8][9], обычно в первый месяц [10]. Эпилептические приступы (ЭП) могут быть генерализованными или фокальными, реже носят миоклонический характер. Фокальные приступы характеризуются пристальным взглядом, отклонением глаз или головы, остановкой дыхания, глотанием и гипертонусом/гипотонусом или клоническими судорогами. Приступы могут проявляться в виде сенсорных или поведенческих нарушений, потери сознания, а также утраты контроля над функциями тазовых органов [1].
Для иллюстрации изложенного материала приводим два клинических случая синдрома кольцевой хромосомы 14 с рефрактерной эпилепсией.
КЛИНИЧЕСКИЕ СЛУЧАИ / CASE REPORTS
Представлены клинические наблюдения детей, поступивших в психоневрологическое отделение (ПНО) № 1 Детского центра психоневрологии и эпилептологии (ДЦПНиЭ) ГБУЗ «Республиканская детская клиническая больница» (РДКБ) (г. Уфа, Республика Башкортостан). Генетические исследования проводились в ГБУЗ «Республиканский медико-генетический центр» (РМГЦ) (г. Уфа).
Случай 1 / Case 1
Пациент К. в возрасте 11 мес (родился 02.02.2018 г.) экстренно поступил в ПНО № 1 ДЦПНиЭ РДКБ из г. Кумертау Республики Башкортостан (находился в стационаре с 08.01.2019 по 08.02.2019 гг.). Со слов матери, у ребенка на фоне полного благополучия возникли приступы судорог во сне и при засыпании с подергиванием конечностей, нарушением сознания.
Анамнез заболевания
Ребенок от третьей беременности, вторых родов. Во время беременности мать принимала эутирокс по поводу диффузного узлового зоба. Роды на 38–39-й неделе завершились плановым кесаревым сечением. При рождении масса тела ребенка 3190 г. Выписан на 8-е сутки. Раннее развитие соответствовало возрасту.
Неврологический статус
На момент поступления общее состояние пациента средней степени тяжести. Сознание ясное. Окружность головы 43 см, микроцефальной конфигурации. Большой родничок закрыт. Имеются особенности строения лицевого черепа и скелета: эпикант, антимонголоидный разрез глаз (опущены наружные углы глазных щелей), плоская спинка носа, вывернутые ноздри, узкое небо, короткая шея, воронкообразная грудь, аномалии пигментации кожи и сетчатки. Зрачки D=S, реакция на свет живая. Взор фиксирует, за предметами следит. Глотание и фонация не нарушены. Голову держит, переворачивается, сидит, встает у опоры, передвигается у опоры, ходит с поддержкой. Тонус мышц – гипотония с обеих сторон. Опора на полные стопы. Патологические знаки отсутствуют. Менингеальных знаков нет. Познавательно-ориентировочная деятельность с отставанием по возрасту. Задержка речевого развития.
Инструментальные методы обследования
На электроэнцефалограмме (ЭЭГ) при поступлении эпилептиформная активность отсутствует. Во время пребывания в стационаре запись проводилась неоднократно. Перед выпиской из отделения на 30-й день пребывания в стационаре на фоне противосудорожной терапии во время сна у ребенка произошел генерализованный тонический приступ. На ЭЭГ во время приступа зарегистрированы редуцированные комплексы «пик – волна» амплитудой 40 мкВ по всем отведениям длительностью 6 с, заканчивающиеся волнами дельта-диапазона амплитудой до 500 мкВ с преобладанием в передних отведениях (рис. 1).
На ночном видео-ЭЭГ-мониторинге через 2 нед после выписки из стационара регистрируется бета-ритм по всем отведениям с амплитудным преобладанием в передних отведениях амплитудой 25–40 мкВ в сочетании с билатерально-синхронными вспышками в альфа-ритме амплитудой до 55 мкВ (сонные веретена), а также К-комплексы в лобных, затылочных областях по всем отведениям. Эпилептиформная активность не зарегистрирована.
На магнитно-резонансной томографии головного мозга (МРТ ГМ) при поступлении обнаружены косвенные признаки последствия гипоксически-ишемического поражения головного мозга с признаками внутричерепной гипертензии, кисты кармана Ратке в виде образования жидкостной кистоподобной структуры размерами до 2×3×4 мм между аденогипофизом и нейрогипофизом (рис. 2). Через 2 нед после выписки из стационара на МРТ ГМ с контрастированием подтверждена киста кармана Ратке.
Проводилась тандемная масс-спектрометрия, наследственных болезней обмена веществ не обнаружено.
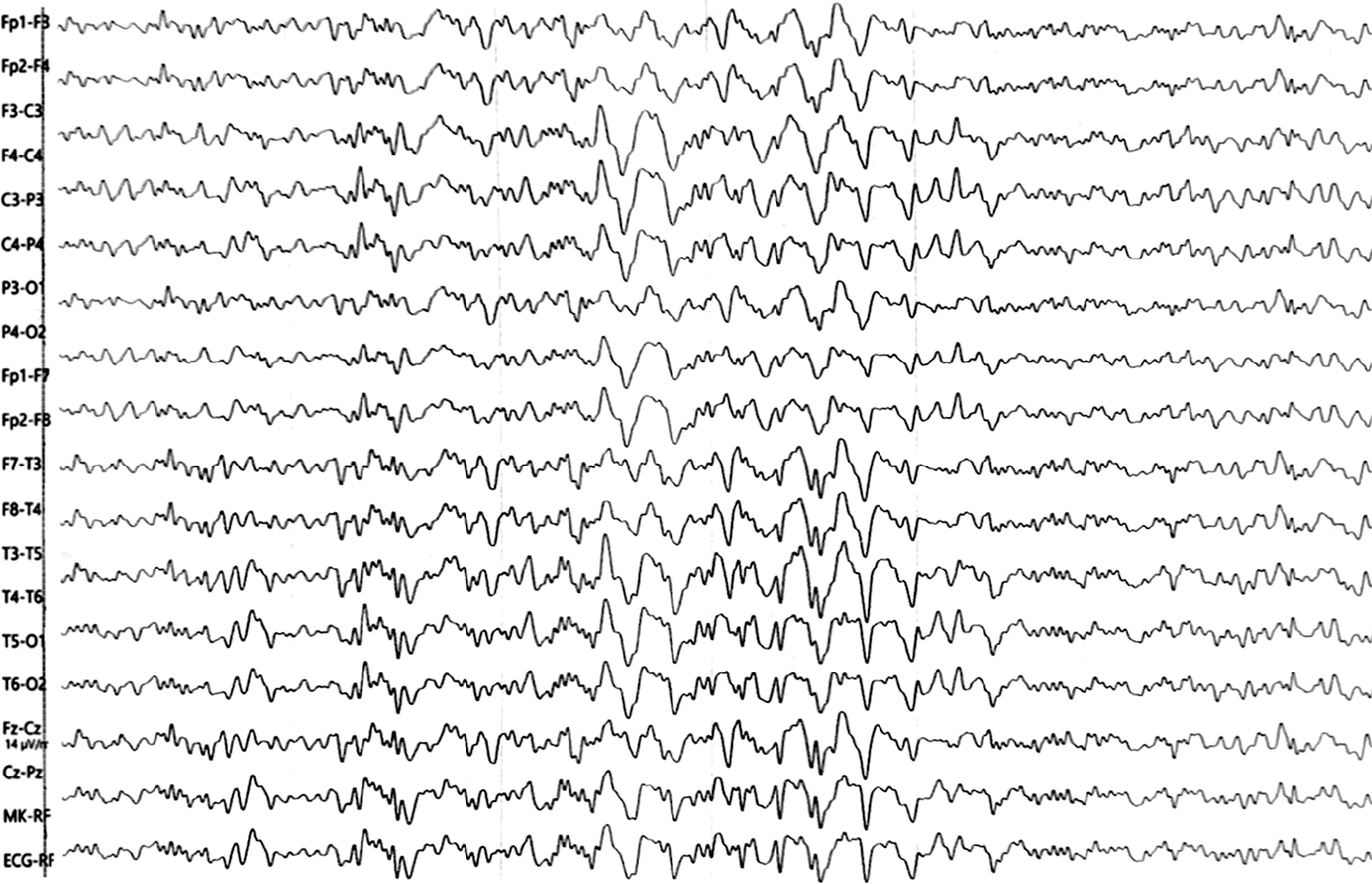
Рисунок 1. Электроэнцефалограмма пациента К. (возраст 11 мес) в период эпиприступа
Figure 1. Patient K. (age 11 months) electroencephalogram during epileptic seizure
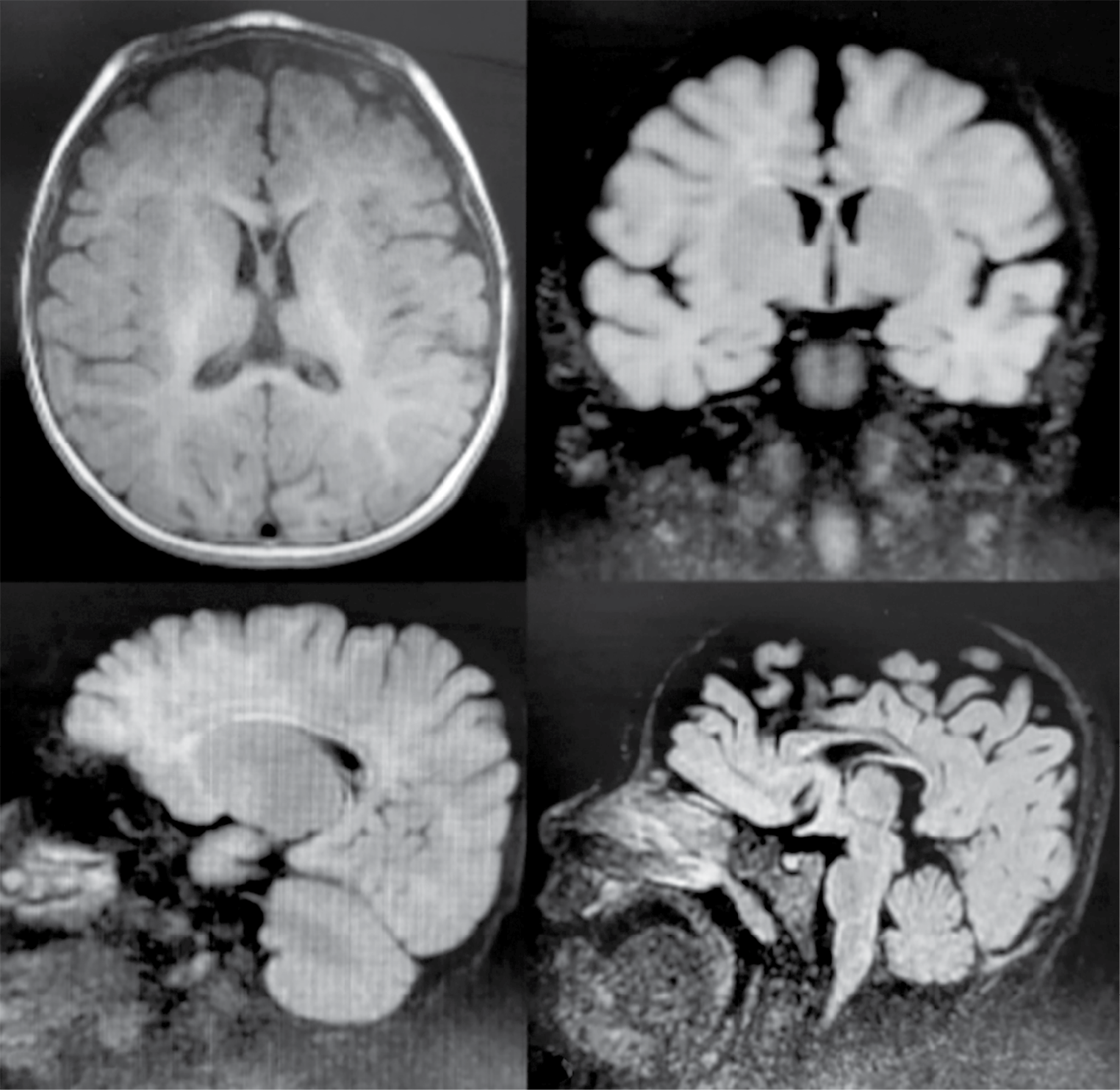
Рисунок 2. Магнитно-резонансные томограммы головного мозга пациента К. (возраст 11 мес): a, b – признаки внутричерепной гипертензии; c, d – киста кармана Ратке
Figure 2. Patient K. (age 11 months) brain magnetic resonance images: a, b – signs of intracranial hypertension; c, d – Rathke’s cleft cyst
Генетическое исследование
В связи с неоднозначной клинической картиной в январе 2019 г. было решено провести кариотипирование в РМГЦ с целью выявления возможной хромосомной патологии. Обнаружен кариотип мужской аномальный – кольцевая хромосома 14 (46XY, r(14)(p12q32)).
Выставлен диагноз: «Q99.8 хромосомное заболевание, кольцевая хромосома 14. Генерализованные тонико-клонические приступы, генерализованная генетическая эпилепсия. Задержка психоречевого развития, микроаномалии лицевого черепа».
Особенности течения эпилепсии
В отделении наблюдались ЭП, носившие серийный характер – несколько приступов с интервалом 5 мин, в течение которых сознание относительно восстанавливалось, с периодичностью каждые 2–3 дня. Во время приступа зрачки расширены, лицо гиперемировано, клонико-тонические судороги в течение нескольких секунд. При нарушении дневного сна (чуткий, беспокойный сон) приступы учащались.
Одной из основных задач терапевтической тактики было купирование приступов. Монотерапия вальпроевой кислотой не дала ожидаемого результата, и ребенок был переведен на политерапию противосудорожными препаратами: вальпроевая кислота (по 127 мг 3 раза в день), леветирацетам (по 200 мг 2 раза в день), окскарбазепин (по 165 мг 2 раза в день). Несмотря на комбинированную противосудорожную терапию тремя препаратами, у ребенка сохранялись серийные эпиприступы, но уменьшилась их периодичность: они стали возникать каждые 3–4 дня. Было решено отменить окскарбазепин и ввести в терапию фенобарбитал по 5 мг 1 раз в сутки, что дало положительный эффект. Приступы купировались, общее состояние пациента несколько улучшилось: ребенок стал более активным в психоэмоциональной сфере.
На 31-е сутки пребывания в стационаре пациент выписан домой с рекомендацией продолжать противосудорожную терапию под наблюдением невролога по месту жительства, при необходимости обращаться за консультацией к эпилептологу.
Случай 2 / Case 2
Пациент Х. в возрасте 4 года 3 мес (родился 29.03.2019 г.) поступил в ПНО № 1 ДЦПНиЭ РДКБ из Балтачевского района Республики Башкортостан в плановом порядке в июне 2023 г. с жалобами на неустойчивую походку, приступы судорог с февраля 2023 г., по поводу которых ребенок госпитализировался в отделение неоднократно.
Анамнез заболевания
Ребенок от четвертой беременности, вторых родов. Во время беременности мать перенесла острую респираторную вирусную инфекцию, были изменения в анализах (анемия, протеинурия), отрицательный резус крови. Роды на 38-й неделе, масса тела ребенка 3900 г, окружность груди 34 см, оценка по шкале Апгар 7/9 баллов. Из роддома выписан на 4-е сутки. Задержка моторного развития с 6 мес, задержка речевого развития с 11 мес. Ходит самостоятельно с 1 года 6 мес. Первые слова с 1 года.
Неврологический статус
На момент поступления общее состояние пациента средней степени тяжести. Сознание ясное. Окружность груди 48 см, большой родничок закрыт. Менингеальных знаков нет. Черепно-мозговые нервы: глазные щели D=S, зрачки D=S, фотореакция живая, следит за предметами, альтернирующее косоглазие. Глотание и фонация не нарушены. Гипотония мышц, D=S. Сухожильные рефлексы живые, D=S. Рефлекс Бабинского положительный с обеих сторон. Сидит, переворачивается, ходит самостоятельно с широкой базой. Гипермобильность суставов кистей. Познавательно-ориентировочная деятельность умеренно снижена, задержка речевого развития.
Инструментальные методы обследования
На ЭЭГ через 20 дней после первого приступа (в возрасте 10 мес) во время сна регистрировались группы «сонных веретен» частотой 12–13 Гц в сочетании с К-комплексами, вертекс-потенциалами в центральных областях с переходом в дельта-сон в виде высокоамплитудных (до 550 мкВ) медленных волн, синхронных по всем областям.
В возрасте 1 года 7 мес на ЭЭГ в состоянии сна регистровалась полиморфная медленноволновая активность, преобладающая по периоду и амплитуде до 350 мкВ в теменно-затылочных и височных областях, без асимметрии. Вторая стадия фазы медленного сна характеризовалась появлением билатерально-синхронных вспышек частотой 11–13 Гц, К-комплексов в виде полифазных потенциалов с преобладанием в лобных, затылочных отделах полушарий амплитудой до 200 мкВ как изолированно, так и в сочетании с «сонными веретенами» в виде вспышек по всем отведениям. Глубокая фаза сна с медленными дельта-волнами амплитудой до 300 мкВ занимала до 40% записи. Эпилептиформная активность не зарегистрирована.
На ЭЭГ в 3 года 2 мес при открытых глазах с эпизодами двигательных артефактов зональные различия ослаблены, отмечаны группы альфа-волн частотой 8–9 Гц, амплитудой до 50 мкВ, медленные волны тета-диапазона амплитудой до 120 мкВ в теменных, затылочных областях, умеренно выраженный бета-ритм частотой 20–25 Гц амплитудой до 20 мкВ в передних отделах, без признаков эпилептических паттернов. После фотостимуляции частотой 3–5–7–11–15–20 Гц реакция активации удовлетворительная. Эпилептиформная активность не зарегистрирована.
ЭЭГ в 4 года 3 мес: во время сна регистрируются синхронные группы волн тета-диапазона амплитудой до 140 мкВ в теменно-затылочно-задневисочных областях, пробеги волн тета-диапазона амплитудой до 110 мкВ, группы «сонных веретен» частотой 13–14 Гц, амплитудой до 30 мкВ в передних отделах, К-комплексы в виде вспышек полифазных потенциалов амплитудой до 120 мкВ. Во время записи произошел приступ длительностью до 2 мин с появлением на ЭЭГ миографических артефактов в височных областях, диффузными, ритмичными, редуцированными (замедленными) комплексами «острая –медленная волна» амплитудой до 300 мкВ в лобно-височных областях (рис. 3).
На МРТ ГМ в возрасте 10 мес картина гипоксически-ишемического поражения вещества ГМ, внутричерепная гипертензия. На МРТ ГМ в 1 год 5 мес признаки гипоксически-ишемического поражения ГМ, внутричерепной гипертензии, локальное расширение большой цистерны мозга.
На МРТ ГМ в 3 года 2 мес (рис. 4) все отделы мозга сформированы. Мозолистое тело неравномерно умеренно истончено. Боковые желудочки асимметричны, передние рога сужены. Перивентрикулярно в белом веществе отмечались диффузные зоны повышения МР-сигнала в режиме FLAIR. Наблюдалось незаращение прозрачной перегородки с образованием ликворосодержащей полости между передними рогами боковых желудочков шириной до 4 мм. Между треугольниками боковых желудочков определялась ликворная полость шириной до 8 мм. Субарахноидальные пространства конвекситальной поверхности полушарий большого мозга в лобно-теменных областях и передних отделах височных областей умеренно неравномерно расширены. Борозды лобных и теменных долей углублены. Сильвиевы щели несколько расширены. Срединные структуры не смещены. Визуализировался умеренный периневральный отек по ходу зрительных нервов. Отмечалось низкое расположение синусного стока. Большая цистерна мозга локально расширена до 27×52×20 мм (нижняя ретроцеребеллярная киста?). Заключение: «Изолированная гипоплазия нижних отделов червя мозжечка. Гипогенезия мозолистого тела. Незаращение прозрачной перегородки».
Во время последней госпитализации МРТ ГМ не проводилась.
Выполнялась тандемная масс-спектрометрия в возрасте 10 мес: наследственных болезней обмена веществ не обнаружено.
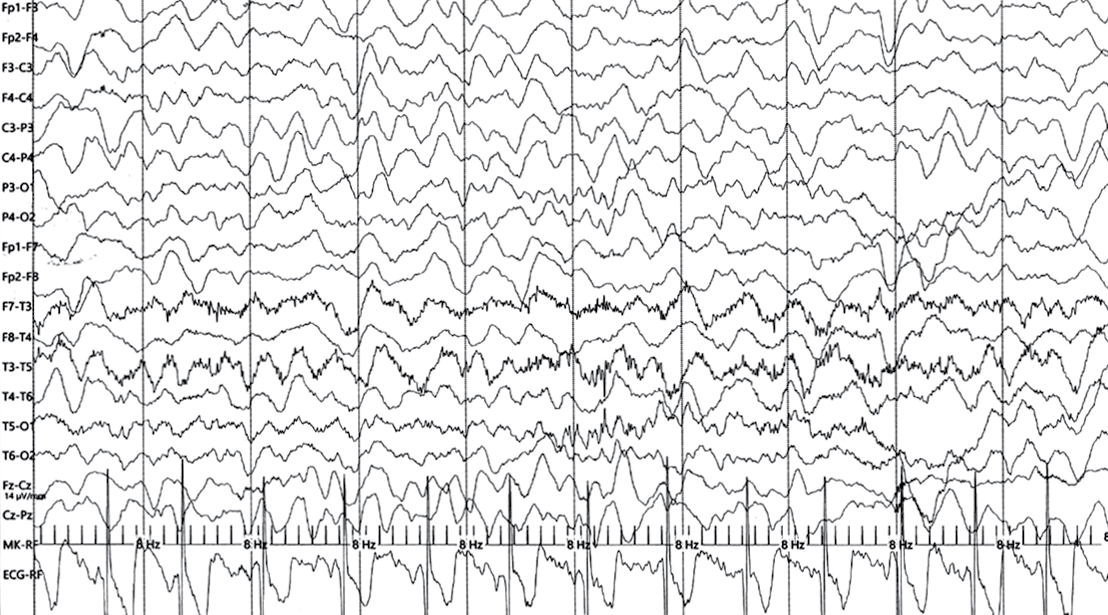
Рисунок 3. Электроэнцефалограмма пациента Х. (возраст 4 года 3 мес) во время эпиприступа
Figure 3. Patient X. (age 4 years 3 months) electroencephalogram during epileptic seizure
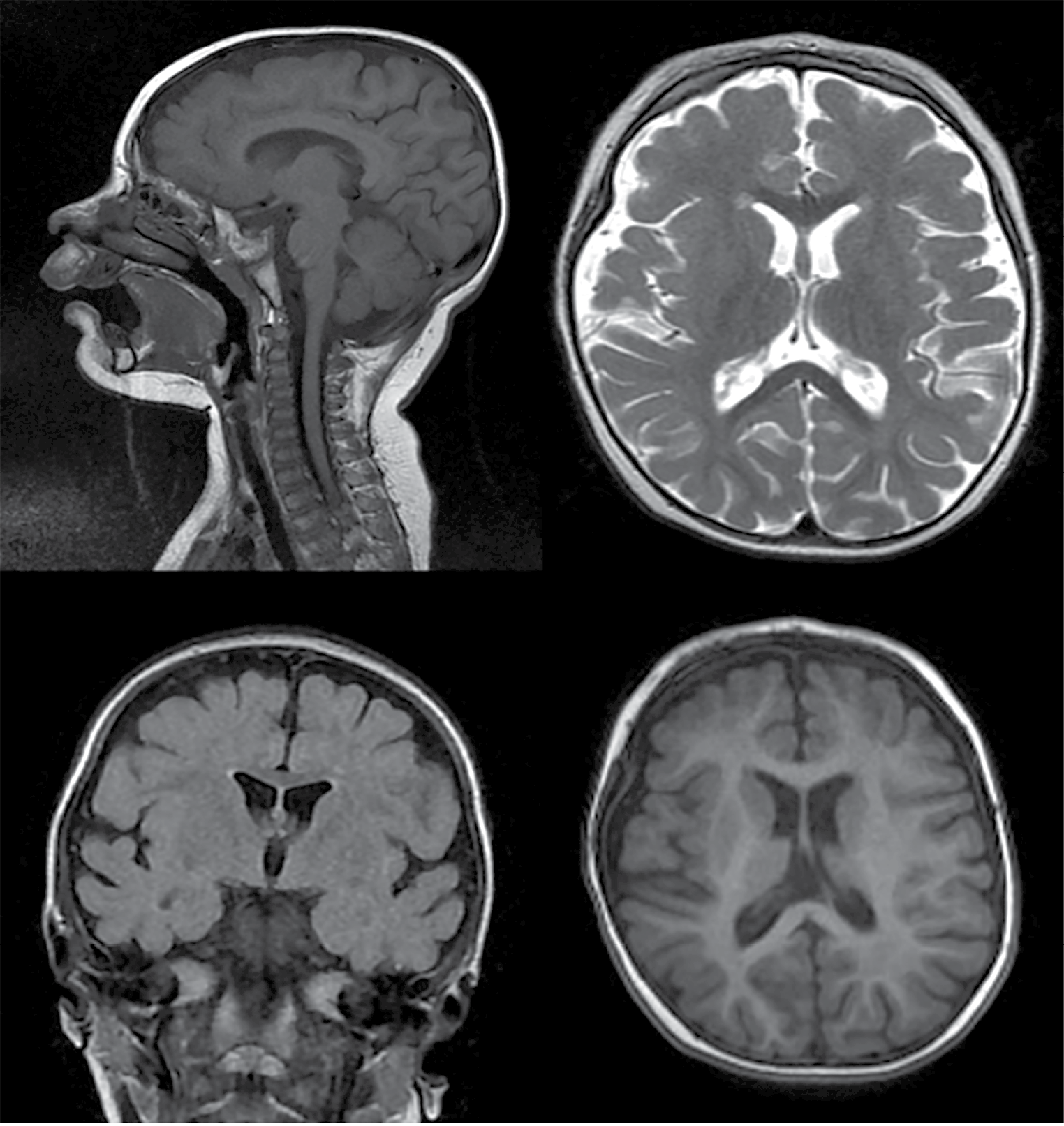
Рисунок 4. Магнитно-резонансные томограммы головного мозга пациента Х. (возраст 3 года и 2 мес): a – изолированная гипоплазия нижних отделов червя мозжечка, гипогенезия мозолистого тела; b, c, d – незаращение прозрачной перегородки
Figure 4. Patient X. (age 3 years and 2 months) brain magnetic resonance images: a – isolated hypoplasia of the lower cerebellar vermis parts, corpus callosum hypogenesis; b, c, d – non-closure of the septum pellucidum
Генетическое исследование
Кариотипирование проведено в ГМГЦ в ноябре 2020 г. Выявлен кариотип мужской аномальный – кольцевая хромосома 14 (XY, r(14)(р11.1q32)).
Консультация логопеда: общее недоразвитие речи I уровня. Консультация психолога: задержка психического развития. Осмотр окулиста: OU альтернирующее косоглазие, ангиопатия сетчатки.
Выставлен диагноз: «Q99.8 хромосомное заболевание, кольцевая хромосома 14. Тонические эпилептические приступы, генерализованная генетическая эпилепсия. Пирамидно-атактический синдром. Задержка психоречевого развития. Микроаномалии развития. Изолированная гипоплазия нижних отделов червя мозжечка. Гипогенезия мозолистого тела. Гипермобильность суставов кистей».
Особенности течения эпилепсии
Первый судорожный приступ наблюдался в 10 мес: внезапная потеря сознания, тонические судороги в конечностях, глазные яблоки заведены вверх. Длительность приступа от 1 до 2 мин. Приступы повторялись ежедневно первые 10 дней, затем 1–2 раза в неделю. Лечился в центральной районной больнице. Проводилась противосудорожная терапия леветирацетамом в растворе и суспензиями окскарбазепина – без эффекта. Ребенок был переведен в ПНО № 1 ДЦПНиЭ РДКБ, где терапия была изменена: отменены прежние препараты, назначены вальпроевая кислота в сиропе по 3,5 мл 3 раза в день, топирамат по 2 таблетки (50 мг) 2 раза в день. Данная схема оказалась эффективной, судороги прекратились, наблюдалась ремиссия с 15.11.2020 г. до 12.02.2023 г., когда приступы возобновились, но протекали мягче по выраженности судорожного компонента и продолжительности. Пациент был вновь госпитализирован в ПНО № 1 ДЦПНиЭ РДКБ (июнь 2023 г.), к лечению добавлен фенобарбитал 6,25 мг утром и 13 мг вечером, что привело к ремиссии. С июля 2023 г. приступов не наблюдалось.
Во время последней госпитализации в июне 2023 г. продолжалась противосудорожная терапия: вальпроевая кислота в сиропе по 2,2 мл (125 мг) 3 раза в день внутрь, топирамат 0,025 мг по 1 ¼ таблетки (31,25 мг) 2 раза в день внутрь. Кроме того, назначались этилметилгидроксипиридин 1,0 (50 мг) внутримышечно № 10, биоптрон по полям (на область лица, шеи, область печени, область кистей), переменное магнитное поле на шейный отдел позвоночника, соллюкс на область икроножных мышц. В динамике улучшились эмоциональный фон, тонус в конечностях. Приступов в отделении не было. Ребенок был выписан с рекомендацией наблюдения невролога по месту жительства.
ОБСУЖДЕНИЕ / DISCUSSION
Поскольку другие хромосомные нарушения могут иметь сходные клинические признаки, для идентификации заболевания и подтверждения диагноза необходимо проводить хромосомное тестирование. Метод цитогенетического исследования обычно может идентифицировать кольцевую хромосому после того, как с помощью молекулярного кариотипирования устанавливается терминальная делеция хромосомы 14q. В некоторых случаях синдром кольцевой хромосомы 14 может быть диагностирован внутриутробно с помощью ультразвука, амнио- центеза и/или взятия пробы ворсинок хориона [1]. Однако дороговизна и сложность инвазивной пренатальной диагностики, возможность осложнений при ее проведении, редкость микроделеций с образованием кольцевых хромосом, при которых отсутствуют тяжелые врожденные пороки развития у детей, ограничивают применение данного метода.
Клинические проявления синдрома кольцевой хромосомы 14 отличаются полиморфизмом, ЭП в рамках данной патологии могут быть генерализованными и фокальными. Эпилепсия при хромосомной патологии по этиопатогенезу относится к наследственным эпилепсиям и, как показывают данные литературы и наши наблюдения, отличается фармакорезистентностью [11–13]. Характеристикой резистентной (рефрактерной) эпилепсии является трудность достижения стойкой ремиссии и регресс ЭП на фоне адекватной терапии двумя противосудорожными средствами [11].
В наших клинических наблюдениях диагноз хромосомного заболевания (мутация хромосомы 14) был выставлен на 11–12-м месяце жизни пациентов после дебюта ЭП, которые в обоих случаях имели генерализованный характер. Учитывая генерализованный тип эпилепсии, в первом случае была начата монотерапия вальпроевой кислотой, но даже добавление двух противосудорожных средств (леветирацетам и окскарбазепин) не привело к ожидаемому результату – купированию судорожных приступов. У второго пациента стартовая терапия начата двумя препаратами (леветирацетам и окскарбазепин), которая оказалась неэффективной, в связи с чем проведена замена на два других противосудорожных средства (вальпроевая кислота и топирамат). В обоих случаях положительный эффект был достигнут при добавлении к лечению фенобарбитала и отмене окскарбазепина.
ЗАКЛЮЧЕНИЕ / CONCLUSION
ЭП являются одним из наиболее распространенных клинических симптомов у больных с кольцевой хромосомой 14. Эпилепсия при этой патологии отличается тяжестью течения и фармакорезистентностью. Исходя из этого, целесообразно начинать противосудорожную терапию препаратами вальпроевой кислоты как средствами первой линии, однако такая монотерапия и последующее добавление второго и третьего препаратов не была эффективной. В обоих случаях окскарбазепин в качестве дополнительной противосудорожной терапии не дал позитивного результата. Фенобарбитал оказался средством достижения ремиссии в сочетании с проводимой противоэпилептической терапией.
Учитывая редкую встречаемость кольцевой хромосомы 14, мы представили наши клинические наблюдения с целью повышения осведомленности врачей различных специальностей (неврологов, эпилептологов, педиатров) с этой патологией.
Таким образом, при наличии рефрактерной эпилепсии и симптомов задержки развития в младенческом возрасте, характерных для хромосомных микроделеций, следует проводить генетическое консультирование и обследование с целью поиска хромосомной патологии, что позволит диагностировать ее на ранней стадии заболевания.
Список литературы
1. Ivanoff A.E., Ivanoff C.S. Ring chromosome 14 syndrome: what the dentist should know to manage children with r(14) effectively. Folia Med. 2023; 65 (1): 20–9. https://doi.org/10.3897/folmed.65.e71784.
2. Rinaldi B., Vaisfeld A., Amarri S., et al. Guideline recommendations for diagnosis and clinical management of Ring14 syndrome-first report of an ad hoc task force. Orphanet J Rare Dis. 2017; 12 (1): 69. https://doi.org/10.1186/s13023-017-0606-4.
3. Vaisfeld A., Spartano S., Gobbi G., et al. Chromosome 14 deletions, rings, and epilepsy genes: a riddle wrapped in a mystery inside an enigma. Epilepsia. 2021; 62 (1): 25–40. https://doi.org/10.1111/epi.16754.
4. Vasconcelos H.M. Jr., Vargas M.E., Pennesi M.E. Multimodal imaging of ring 14 syndrome associated maculopathy. Ophthalmic Genet. 2019; 40 (6): 541–4. https://doi.org/10.1080/13816810.2019.1688839.
5. Zollino M., Ponzi E., Gobbi G., Neri G. The ring 14 syndrome. Eur J Med Genet. 2012; 55 (5): 374–80. https://doi.org/10.1016/j.ejmg.2012.03.009.
6. Incecik F., Hergüner M.O., Mert G., et al. Ring chromosome 14 syndrome presenting with intractable epilepsy: a case report. Turk J Pediatr. 2013; 55 (5): 549–51.
7. Zampini L., Zanchi P., Rinaldi B., et al. Developmental trends of communicative skills in children with chromosome 14 aberrations. Eur J Pediatr. 2017; 176 (4): 455–64. https://doi.org/10.1007/s00431017-2859-2.
8. Specchio N., Trivisano M., Serino D., et al. Epilepsy in ring 14 chromosome syndrome. Epilepsy Behav. 2012; 25 (4): 585–92. https://doi.org/10.1016/j.yebeh.2012.09.032.
9. Giovannini S., Marangio L., Fusco C., et al. Epilepsy in ring 14 syndrome: a clinical and EEG study of 22 patients. Epilepsia. 2013; 54 (12): 2204–13. https://doi.org/10.1111/epi.12393.
10. Specchio N. Epilepsy in ring 14 chromosome syndrome. Epilepsy Behav. 2012; 25 (4): 585–92. https://doi.org/10.1016/j.yebeh.2012.09.032.
11. Котов А.С., Фирсов К.В., Санду Е.А. Фармакорезистентная эпилепсия. Клиническая лекция. Русский медицинский журнал. 2021; 29 (6): 33–9.
12. Эпилепсия и эпилептический статус у взрослых и детей. Клинические рекомендации. 2022. URL: https://cr.minzdrav.gov.ru/schema/741_1 (дата обращения 02.04.2024).
13. Imataka G., Noguchi M., Tsukada K., et al. Partial epilepsy and developmental delay in infant with ring chromosome 14. Genet Couns. 2013; 24 (1): 81–3.
Об авторах
Л. Б. НовиковаРоссия
Новикова Лилия Бареевна, д.м.н., проф.
ул. Ленина, д. 3, г. Уфа, 450008
А. П. Акопян
Россия
Акопян Анаит Погосовна, к.м.н., доцент
ул. Ленина, д. 3, г. Уфа, 450008
Р. Ф. Латыпова
Россия
Латыпова Раушания Фанисовна
ул. Ленина, д. 3, г. Уфа, 450008
Н. М. Файзуллина
Россия
Файзуллина Наиля Мухаметовна
ул. Ленина, д. 3, г. Уфа, 450008
Рецензия
Для цитирования:
Новикова Л.Б., Акопян А.П., Латыпова Р.Ф., Файзуллина Н.М. Случаи фармакорезистентной эпилепсии при хромосомной патологии. Эпилепсия и пароксизмальные состояния. 2024;16(3):223–230. https://doi.org/10.17749/2077-8333/epi.par.con.2024.187
For citation:
Novikova L.B., Akopyan A.P., Latypova R.F., Faizullina N.M. Drug-resistant epilepsy cases in chromosomal pathology. Epilepsy and paroxysmal conditions. 2024;16(3):223–230. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2024.187

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































