Перейти к:
Электроэнцефалографический мониторинг в выявлении и прогнозировании отсроченной церебральной ишемии вследствие нетравматического субарахноидального кровоизлияния
https://doi.org/10.17749/2077-8333/epi.par.con.2024.192
Аннотация
Диагностика отсроченной церебральной ишемии (ОЦИ) является важнейшим этапом интенсивного лечения пациентов в острой стадии нетравматического субарахноидального кровоизлияния. Наибольшая сложность в выявлении ОЦИ возникает при угнетении бодрствования, когда клиническая оценка нарастающего неврологического дефицита затруднена. Широко распространенная транскраниальная допплерография помогает лишь установить факт развития вазоспазма, который не всегда приводит к ОЦИ, имеющей полифакторный механизм развития. Электроэнцефалография (ЭЭГ) – единственный широкодоступный инструментальный метод, позволяющий непрерывно мониторировать функциональное состояние головного мозга, в т.ч. в отделениях реанимации и интенсивной терапии. К настоящему времени определены неспецифические показатели ЭЭГ, указывающие на развитие острого церебрального повреждения, которые имеют различную информативность для диагностики и прогнозирования ОЦИ. Представляем обзор публикаций, посвященных изучению информативности параметров визуальной и количественной ЭЭГ, таких как региональное замедление, спектральная мощность и относительная вариабельность альфа-ритма, отношение мощностей альфа- и дельта-ритмов, выявление эпилептиформной активности. Проведя поиск в международных и отечественных базах медицинской литературы, мы установили лишь 7 публикаций с количественной оценкой диагностической значимости мониторинга ЭЭГ, которые показали, что для диагностики ОЦИ его чувствительность лежит в диапазоне от 76% до 100%, а специфичность – от 54% до 100%. Также приводим клинический случай пациентки 70 лет, оперированной по поводу нетравматического субарахноидального кровоизлияния вследствие разрыва аневризмы коммуникативного сегмента правой внутренней сонной артерии. При проведении продолженного видео-ЭЭГ-мониторинга за 2 сут до клинического ухудшения и появления ишемических изменений в правом полушарии головного мозга, выявленных на компьютерных томограммах, отмечено появление паттерна иктально-интериктального континуума. Будущие исследования должны быть направлены на уточнение наиболее информативных биомаркеров ОЦИ, подтверждение их значимости, в т.ч. при регистрации ЭЭГ внутричерепными электродами, и способствовать разработке автоматизированных алгоритмов детекции ОЦИ.
Ключевые слова
Для цитирования:
Окунева И.В., Синкин М.В., Евдокимов А.И., Природов А.В. Электроэнцефалографический мониторинг в выявлении и прогнозировании отсроченной церебральной ишемии вследствие нетравматического субарахноидального кровоизлияния. Эпилепсия и пароксизмальные состояния. 2024;16(3):231-240. https://doi.org/10.17749/2077-8333/epi.par.con.2024.192
For citation:
Okuneva I.V., Sinkin M.V., Evdokimov A.I., Prirodov A.V. Electroencephalographic monitoring in detection and prediction of delayed cerebral ischemia due to non-traumatic subarachnoid hemorrhage. Epilepsy and paroxysmal conditions. 2024;16(3):231-240. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2024.192
ВВЕДЕНИЕ / INTRODUCTION
Нетравматическое субарахноидальное кровоизлияние (САК) наиболее часто возникает у лиц среднего и пожилого возраста и является одной из самых тяжелых форм нарушений мозгового кровообращения. На САК приходится от 4% до 10% всех случаев острого нарушения мозгового кровообращения и 8% летальных исходов инсульта. Встречаемость САК лежит в диапазоне от 6 до 16 случаев на 100 тыс. населения в год, соотношение женщин и мужчин составляет 1,6–1,7:1. Ведущей причиной нетравматического САК выступает разрыв артериальной аневризмы головного мозга [1].
Одним из самых опасных осложнений САК является отсроченная церебральная ишемия (ОЦИ), которая на фоне развивающегося сосудистого спазма вызывает стойкий неврологический дефицит у 30% выживших [2]. Обычно ОЦИ появляется на 4–14-е сутки у 30% пациентов после первичного САК, а ее возникновение в первые 7 сут указывает на высокую вероятность развития инфаркта мозга и сопровождается повышенной смертностью [3]. Прогнозирование или максимально раннее выявление начала ОЦИ позволяет немедленно приступить к медикаментозному или хирургическому воздействию на церебральные сосуды.
В 2010 г. M.D. Vergouwen et al. предложили стандартизированное определение ОЦИ, которое используют и в настоящее время: возникновение новой неврологической симптоматики или снижение количества баллов по шкале комы Глазго на 2 и более в течение более 1 ч, которые не связаны с другими причинами (повторный разрыв аневризмы, повышение внутричерепного давления, послеоперационные осложнения, системные или метаболические нарушения), или появление новой зоны инфаркта на компьютерной томографии (КТ) или магнитно-резонансной томографии (МРТ) в течение 6 нед после САК [4]. Церебральный вазоспазм встречается у 50–70% пациентов с САК, но только у 20–40% развивается ОЦИ [5].
Современная концепция патогенеза ОЦИ мультифакторна и основывается на неспособности церебральной перфузии соответствовать метаболическим потребностям нейронов. Предшественником ОЦИ является повреждение мозга с резким повышением внутричерепного давления, глобальной церебральной гипоперфузией, активацией симпатической нервной системы, что приводит к спазму артерий. Высвобождение эндотелиальных факторов и цитокинов способствует возникновению микротромбозов и воспаления, усугубляя церебральный ангиоспазм (ЦА). Прогрессирующий ионный дисбаланс с повышением уровня внутриклеточного кальция, высвобождением калия и глутамата вызывает появление медленно распространяющейся кортикальной деполяризации и эпилептиформной активности (ЭА). Нейроэлектрические нарушения сопровождаются увеличением метаболических потребностей в поврежденных тканях, ухудшая тем самым кортикальную перфузию [6][7].
Несмотря на большое количество исследований, посвященных возникновению ОЦИ, ее клиническая диагностика нередко затруднена, особенно у пациентов с угнетенным бодрствованием или уже развившимся вследствие САК неврологическим дефицитом [8]. В этом случае основная роль диагностики ОЦИ ложится на инструментальные методы, информативность которых остается предметом изучения.
Существует два основных подхода к инструментальной диагностике ОЦИ – раннее выявление ЦА, который предшествует развитию ОЦИ, и применение методик, непосредственно отражающих ишемизацию церебральной ткани. К последним относят методы нейровизуализации, анализ церебрального метаболизма и регистрацию биоэлектрической активности головного мозга с помощью электроэнцефалографии (ЭЭГ) [9][10]. Преимуществами ЭЭГ являются широкая распространенность методики и относительная дешевизна аппаратуры, возможность длительного прикроватного мониторирования [11].
ЭЛЕКТРОЭНЦЕФАЛОГРАФИЯ ПРИ ОТСРОЧЕННОЙ ЦЕРЕБРАЛЬНОЙ ИШЕМИИ / ELECTROENCEPHALOGRAPHY IN DELAYED CEREBRAL ISCHEMIA
Мы провели анализ публикаций, посвященных информативности ЭЭГ в прогнозировании и детекции ОЦИ. Поиск проводили на русском и английском языках в базах данных PubMed/MEDLINE, Академия Google (Google Scholar) и eLibrary по запросам «электроэнцефалография», «количественная ЭЭГ», «инвазивная ЭЭГ», «прогнозирование и диагностика ОЦИ при нетравматическом САК».
Паттерны визуального анализа ЭЭГ / Patterns of EEG visual analysis
ЭЭГ представляет собой двумерное изображение колебаний суммированных возбуждающих и тормозных постсинаптических потенциалов на дендритах пирамидных нейронов, крайне чувствительных к изменению содержания кислорода в крови, что проявляется немедленными изменениями на ЭЭГ при развитии церебральной гипоксемии [12]. In vitro доказана достоверная связь между частотно-амплитудными показателями ЭЭГ и объемным кровотоком в мозговых сосудах [13][14] (табл. 1).
Как периодические неврологические осмотры, так и нейровизуализация могут установить уже свершившийся факт ОЦИ. В отличие от них, мониторинг ЭЭГ позволяет оценивать функциональное состояние головного мозга в реальном времени и выявлять ранние признаки ОЦИ до возникновения необратимых клинических и рентгенологических изменений [15].
Установлено прогностическое и диагностическое значение замедления фоновой активности при ОЦИ: зарегистрированные в 1-й день САК бифронтальные короткие вспышки дельта-волн, периодическое региональное и диффузное дельта-замедление предшествуют появлению отсроченных ишемических очагов на КТ в 97% случаев. Появление продолженного регионального замедления, ритмичной дельта-активности к 5-му дню после САК соответствует зоне ишемии на КТ [16].
Публикации последних лет уделяют особое внимание связи ишемических изменений при САК с появлением на ЭЭГ спорадических эпилептиформных разрядов и ритмичных и периодических паттернов.
Исследование J.A. Kim et al. (n=124) показало, что у большой доли пациентов с САК наблюдается по крайней мере одно из ЭЭГ-проявлений иктально-интериктального континуума (ИИК). За исключением генерализованной ритмичной дельта-активности, паттерны ИИК встречались с достоверно большей кумулятивной частотой в подгруппе пациентов с последующим развитием ОЦИ. Взаимо- связь латерализованной ритмичной дельта-активности (ЛРДА) с началом ОЦИ была вариабельна: у 35% пациентов ЛРДА возникла уже после развития ОЦИ. Клинически судорожные приступы также чаще отмечали у пациентов с ОЦИ (7 из 124) [17].
В работе Е.S. Rosenthal et al. (n=103) при изучении прогностической ценности эпилептиформных разрядов с учетом их временного распределения поздние новые или нарастающие по количеству, частоте и распространенности разряды были значимым предиктором надвигающейся ОЦИ и появлялись за 1–9 сут до ее развития [18].
Таблица 1. Зависимость доминирующей частоты фонового ритма от показателей объемного кровотока
Table 1. A relation between dominant frequency (background rhythm) and volumetric blood flow indicators
|
Кровоток, мл/100 мг/мин // Blood flow, ml/100 mg/min |
Изменения на ЭЭГ / EEG data change |
Клеточные изменения / Cellular alterations |
Обратимость повреждения / Reversibility of damage effect |
|
35–50 |
Отсутствуют / None |
Снижение синтеза белка / Decreased protein production |
Нет повреждения / No damage |
|
25–35 |
Редукция быстрых частот (8–14 Гц) / Reduction of fast frequencies (8–14 Hz) |
Анаэробный гликолиз, высвобождение глутамата / Anaerobic glycolysis, glutamate release |
Обратимое / Reversible |
|
18–25 |
Нарастание частот тета-диапазона (4–7 Гц) / Increase in theta frequencies (4–7 Hz) |
Лактат-ацидоз, нарушение синтеза АТФ / Lactic acidosis, impaired ATP synthesis |
Потенциально обратимое / Potentially reversible |
|
12–18 |
Нарастание частот дельта-диапазона (0,5–3 Гц) / Increase in delta frequencies (0.5–3 Hz) |
Нарушение Na/K помпы, внутриклеточный отек // Na/K pump alteration, intracellular edema |
Потенциально обратимое / Potentially reversible |
|
<8–12 |
Подавление всех диапазонов частот / Suppression of all frequency ranges |
Повышение уровня внутриклеточного кальция, аноксическая деполяризация, гибель клеток / Increased intracellular calcium level, anoxic depolarization, cell death |
Необратимое / Irreversible |
Примечание. ЭЭГ – электроэнцефалография; АТФ – аденозинтрифосфат.
Note. EEG – electroencephalography; ATP – adenosine triphosphate.
Клинический случай
Пациентка А. 70 лет была госпитализирована в ГБУЗ «Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского ДЗМ» по поводу нетравматического САК (Hunt–Hess III, Fisher III) вследствие разрыва аневризмы коммуникатного сегмента правой внутренней сонной артерии (ВСА).
В течение 1-х суток после САК выполнены декомпрессивная трепанация черепа, клипирование аневризмы развилки правой ВСА. Начиная со 2-х суток после операции и далее в течение 1 нед проводили непрерывный скальповый видео-ЭЭГ-мониторинг (рис. 1).
На 6-е сутки в связи с устойчивым ухудшением в неврологическом статусе в виде нарастания выраженности гемипареза и угнетения уровня бодрствования была проведена мультисрезовая КТ головного мозга, показавшая признаки ишемических изменений в правых височной и затылочной долях, что соответствовало ранее выявленным изменениям на ЭЭГ (рис. 2).
Таким образом, электрографические признаки ОЦИ были выявлены за 2 сут до нейровизуализационного подтверждения.
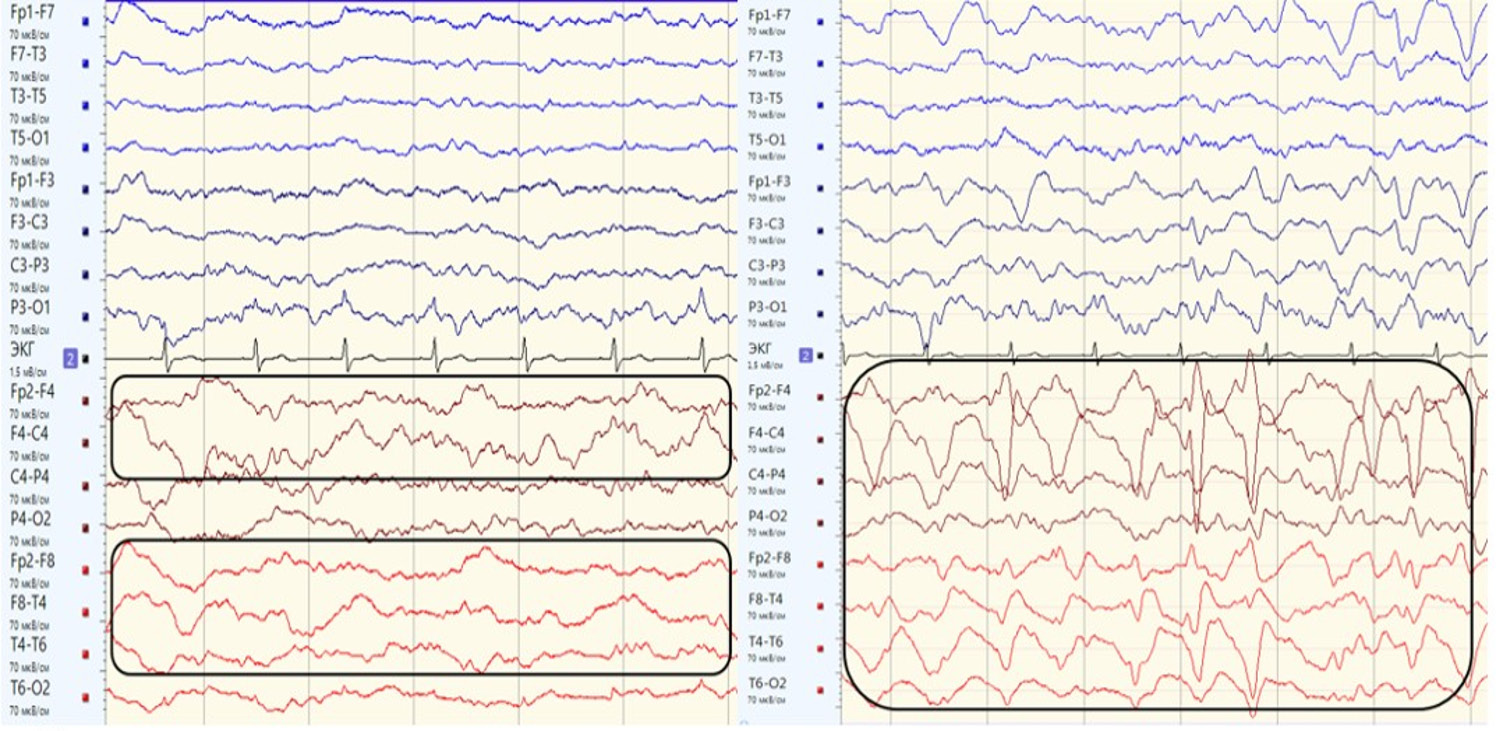
Рисунок 1. Фрагменты электроэнцефалограммы пациентки А. (21 электрод с установкой по международной схеме «10–20», монтаж double banana, фильтр низких частот 70 Гц, фильтр высоких частот 0,53 Гц, чувствительность 70 мкВ, развертка 30 мм/с): а – на 2-е сутки после субарахноидального кровоизлияния (САК) на фоне ритма бреши регистрируется продолженное региональное дельта-замедление в правой лобно-височной области (выделено рамками); b – на 4-е сутки после САК на фоне ритма бреши отмечен паттерн иктально-интериктального континуума – правополушарная латерализованная ритмичная дельта-активность с модификатором «плюс» (включение спайков) частотой 1,5–2 Гц (выделена рамкой)
Figure 1. Fragments of electroencephalogram of Patient A. (21 electrodes placed according to the international 10–20 scheme, double banana montage, low-frequency filter 70 Hz, high-frequency filter 0.53 Hz, sensitivity 70 μV, scan 30 mm/sec): a – 2 days after subarachnoid hemorrhage (SAH), a prolonged regional delta slowing in the right frontotemporal region is recorded along with a breach rhythm (highlighted in boxes); b – 4 days after SAH, pattern of ictal-interictal continuum is recorded: a right-hemisphere lateralized rhythmic delta activity with a “plus” modifier (inclusion of spikes) with a frequency of 1.5–2 Hz (highlighted in box)
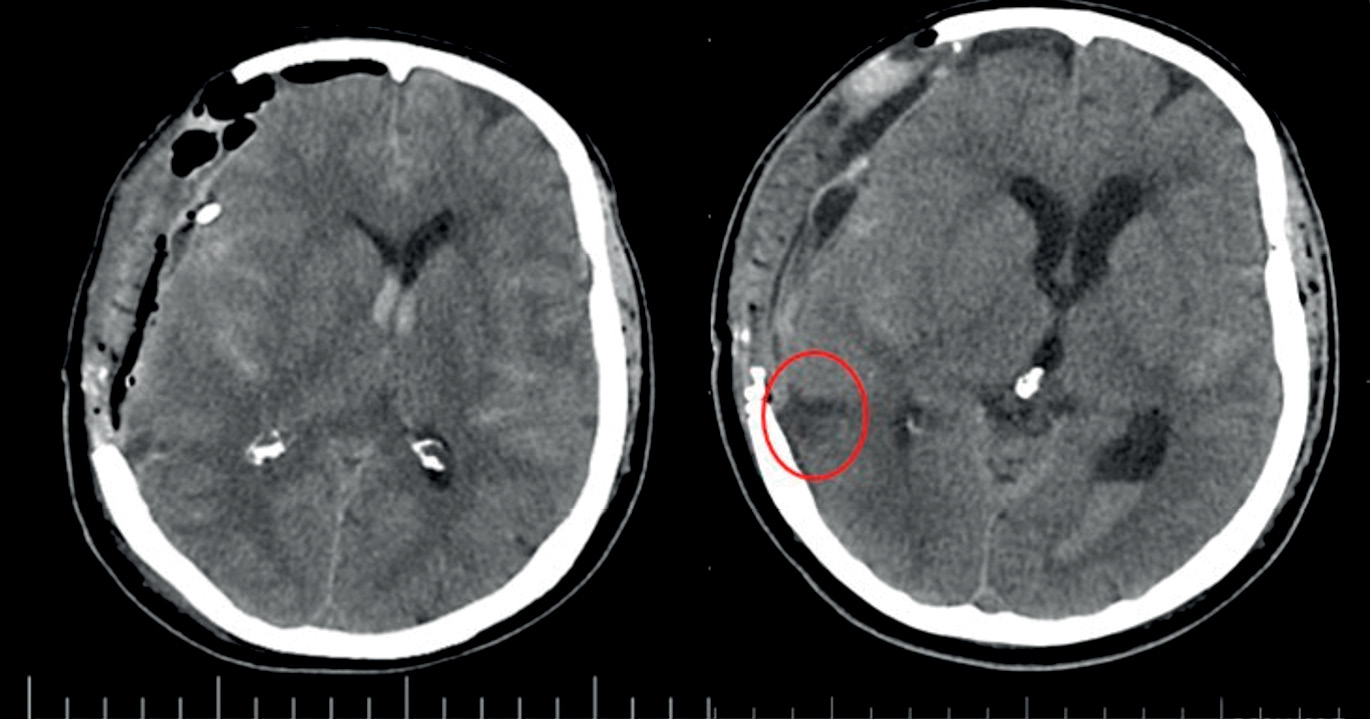
Рисунок 2. Нативные мультисрезовые томограммы головного мозга пациентки А., аксиальная проекция: а – на 2-е сутки после субарахноидального кровоизлияния (САК) отмечен костный дефект и неоднородное содержимое в области операционного доступа, поперечная дислокация до 8 мм влево, конвекситальное и базальное САК, внутрижелудочковое кровоизлияние; b – на 6-е сутки после САК регистрируются признаки ишемических изменений в правых височной и затылочной долях (выделены овалом)
Figure 2. Native brain multislice computed tomography scans of Patient A., axial projection: а – 2 days after subarachnoid hemorrhage (SAH), a skull defect and heterogeneous contents in the area of surgery is recorded, transverse dislocation up to 8 mm to the left, convexital and basal SAH, intraventricular hemorrhage; b – 6 days after SAH, ischemic signs in the right temporal and occipital lobes are recorded (highlighted in oval)
Изменения ЭЭГ на фоне седации / EEG changes during sedation
В комплекс лечебных мероприятий у пациентов с САК часто включают медикаментозную седацию. Такие препараты, как пропофол, дексмедетомидин, бензодиазепины, вызывают последовательные изменения биоэлектрической активности головного мозга, визуально схожие с ЭЭГ-картиной при ишемии.
Так, при умеренной седации отмечается нарастание представленности веретенообразной активности, а при глубокой повышается количество диффузных дельта-волн с дальнейшим появлением паттерна «вспышка – подавление». Однако, в отличие от региональных и латерализованных изменений ЭЭГ, характерных для ОЦИ, медикаментозно индуцированные изменения ЭЭГ носят преимущественно диффузный характер [19].
Количественная ЭЭГ / Quantitative EEG
Основной причиной ограниченности применения мониторинга ЭЭГ является высокая трудоемкость оценки такого исследования, по сути требующей непрерывного нахождения специалиста у экрана электроэнцефалографа непосредственно у постели больного в отделении реанимации и интенсивной терапии (ОРИТ). При этом ретроспективный анализ ЭЭГ не имеет смысла, поскольку возникающие изменения требуют немедленной корректировки хода интенсивной терапии.
Для упрощения представления большого количества визуальных данных ЭЭГ разработаны способы их математической обработки и упрощенной визуализации ЭЭГ-картины, которые принято объединять под термином «количественная ЭЭГ» (кЭЭГ).
Существует множество видов математической обработки ЭЭГ, среди которых наиболее часто используемыми является количественный анализ [20][21]:
– амплитуд волн;
– мощности спектра всей активности или отдельных отведений;
– корреляции (когерентности) колебаний ЭЭГ, регистрируемых под разными электродами.
На этой основе разработаны многочисленные графические интерфейсы кЭЭГ, но для оценки записей продолжительностью несколько десятков часов и даже дней удобнее всего оказался формат тренда, когда по оси абсцисс отображается астрономическое время, а по оси ординат – соответствующие количественные показатели.
Возможность представления кЭЭГ в виде трендов реализована практически во всех современных энцефалографах. Кроме того, в качестве дополнительных надстроек существует несколько оболочек, расширяющих возможности стандартного программного обеспечения и позволяющих настраивать визуализацию и мониторировать одновременно множество отдельных показателей кЭЭГ (рис. 3).
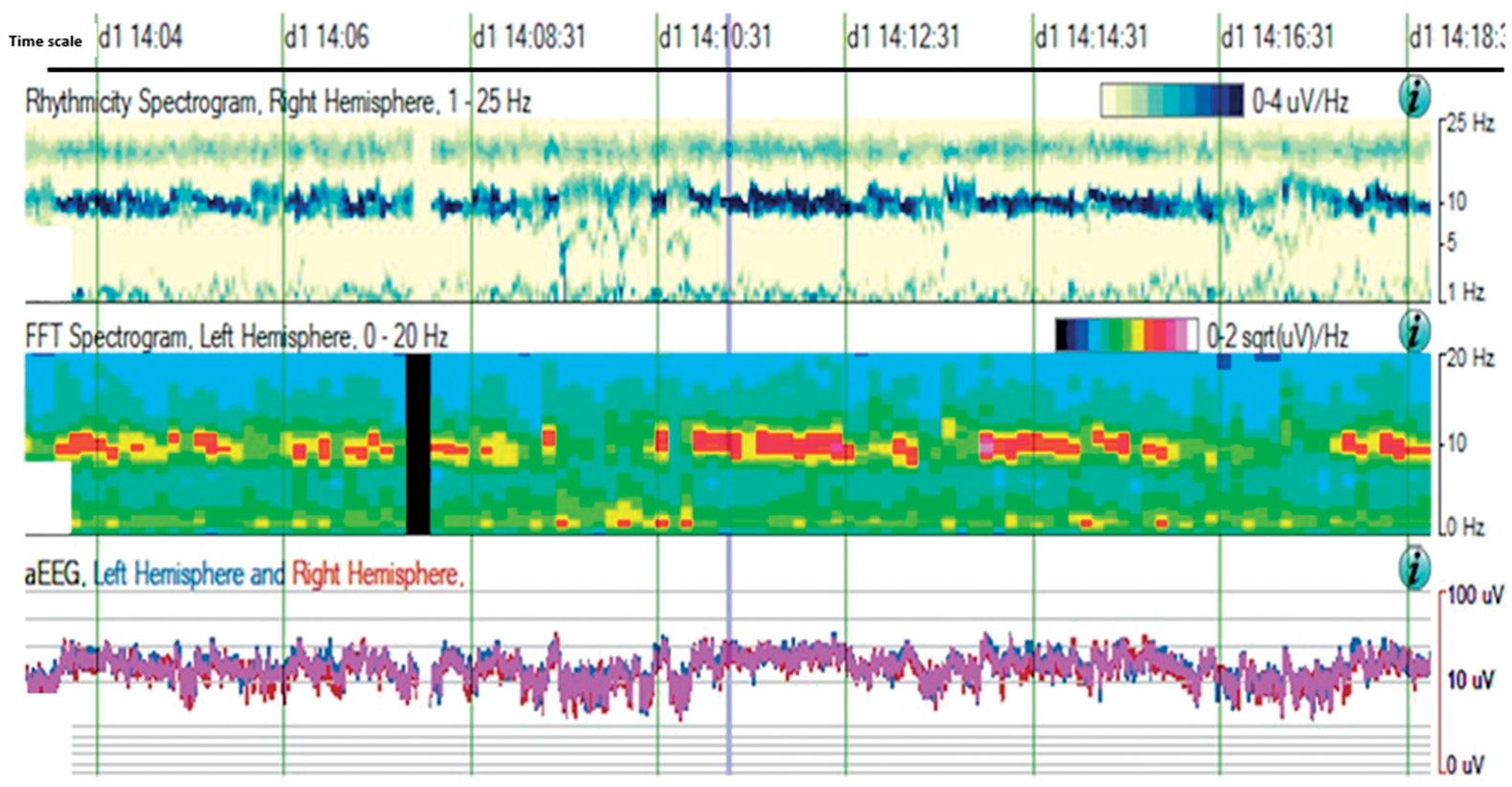
Рисунок 3. Тренды количественной электроэнцефалографии (ЭЭГ) в представлении программной оболочки Persyst 14 (Persyst Development Corporation, США). Нормальная фоновая ЭЭГ бодрствования (фрагмент записи из архива лаборатории нейрофизиологии ГБУЗ «НИИ СП им. Н.В. Склифосовского ДЗМ»): a – тренд ритмичности фоновой активности: темно-синяя полоса в частоте 10 Гц указывает на хорошо выраженный фоновый ритмичный альфа-ритм; b – тренд спектральной мощности: ось ординат соответствует частоте колебаний, а яркость цвета – мощности; c – тренд амплитуды ЭЭГ, разделенной по полушариям: ось ординат отражает амплитуду, цвет кривой кодирует полушарие, с проекции которого происходит регистрация ЭЭГ (синий для левого и красный для правого)
Figure 3. Quantitative electroencephalographic (EEG) trends assessed by Persyst 14 software package (Persyst Development Corporation, USA). Normal background EEG of wakefulness (a fragment of EEG record from the archive of neurophysiological laboratory of Sklifosovsky Research Institute of Emergency Medicine): a – trend of rhythmic background activity: a dark blue band at a frequency of 10 Hz indicates a well-defined background alpha rhythm; b – spectral power trend: Y-axis corresponds to oscillation frequency, and color brightness shows the power; c – trend of EEG amplitude divided by hemispheres: Y-axis corresponds to amplitude, curve color denotes hemisphere (blue and red color – left and right hemisphere, respectively)
Поскольку в процессе развития ОЦИ в первую очередь происходит изменение доминирующей частоты ритма в проекции соответствующей ишемизирующейся области головного мозга, для ее выявления наиболее востребованным видом кЭЭГ является анализ мощности спектра. В клинической практике для количественной оценки замедления и редукции более быстрых частот в ЭЭГ используют расчет абсолютных и относительных параметров мощности в различных частотных диапазонах (дельта, тета, альфа и бета).
Снижение как абсолютных, так и относительных значений мощности альфа-ритма высоко информативно для развития ишемии. S. Gollwitzer et al. выявили, что снижение мощности альфа-ритма более чем на 40%, сохраняющееся в течение 5 ч и более, и снижение мощности тета-ритма в течение более 6 ч являются надежными предикторами возникновения ОЦИ (чувствительность 89%, специфичность 77%) [22]. Постепенное уменьшение мощности альфа-ритма может предшествовать клиническому ухудшению более чем за 24 ч до развития ОЦИ [16][23]. Появление регионального замедления вследствие ишемии может быть охарактеризовано абсолютными значениями тета- и дельта-мощности, повышение значений которых имеет выраженную корреляцию с возникновением ОЦИ [24], тогда как повышение тета-мощности достоверно не подтверждено [22].
Относительная вариабельность альфа-ритма определяется как процентное соотношение спектральной мощности частот 8–12,5 Гц к общей мощности спектра частот 1–30 Гц. Многие исследования показывают, что значения этого параметра снижаются во время ЦА или за 48 ч до его возникновения, а также предшествуют возникновению ОЦИ за 7 ч у пациентов с массивным САК [15][16][24].
Отношение мощностей альфа- и дельта-ритмов (АДО) является одним из наиболее распространенных показателей, используемых для раннего выявления ОЦИ. Во многих публикациях описана высокая чувствительность и специфичность снижения АДО для диагностики ОЦИ. Также установлено, что появление изменений на ЭЭГ предшествует дебюту клинических проявлений ОЦИ и появлению изменений на КТ [16][24][25]. Исследование B. Balança et al. с участием 15 пациентов показало, что региональное снижение АДО на 30%, продолжавшееся 3,7 ч, достигло 100% чувствительности и 88,9% специфичности для выявления ОЦИ [26].
Е.S. Rosenthal et al. продемонстрировали, что многокомпонентная кЭЭГ, совмещенная с выявлением ЭА и анализом динамики изменений во времени, может улучшить прогностическую ценность «классического» мониторинга ЭЭГ. Нарастание изменений фона (диффузное замедление активности, снижение АДО, снижение вариабельности альфа-ритма), появление ЭА вне зависимости от изменений ЭЭГ, возникших сразу после хирургического вмешательства, предсказывают ОЦИ с чувствительностью 96,2% и специфичностью 80,4% (положительная прогностическая ценность 83,3%, отрицательная прогностическая ценность 95,4%). Средний срок клинического развития ОЦИ после появления ее ЭЭГ-признаков составил 1,9 сут. Также авторы выдвинули гипотезу о возможности профилактики ОЦИ путем подавления ЭА противоэпилептическими препаратами [18].
В таблице 2 суммированы исследования, посвященные анализу информативности кЭЭГ в оценке и прогнозировании ОЦИ.
Таблица 2. Публикации, посвященные раннему выявлению отсроченной церебральной ишемии с помощью электроэнцефалографического мониторинга и содержащие расчет показателей чувствительности и специфичности метода
Table 2. Studies assessing early detection of delayed cerebral ischemia via electroencephalographic monitoring and calculating method sensitivity and specificity
|
№ / No. |
Авторы (год) / Authors (year) |
Число пациентов, n / Number of patients, n |
Параметры ЭЭГ / EEG parameters |
Чувствитель- ность, % / Sensitivity, % |
Специфич- ность, % / Specificity, % |
|
1 |
P.M. Vespa et al. (1997) [15] |
32 |
Вариабельность альфа-ритма / Alpha rhythm variability |
76 |
100 |
|
2 |
E.S. Rosenthal et al. (2018) [18] |
103 |
АДО, вариабельность альфа-ритма, региональное замедление, поздняя ЭА / ADR, alpha rhythm variability, regional slowing, late EA |
96,2 |
80,4 |
|
3 |
S. Gollwitzer et al. (2015) [22] |
12 |
Альфа-ритм / Alpha rhythm |
89 |
77 |
|
4 |
M.L. Rots et al. (2016) [23] |
20 |
АДО, вариабельность альфа-ритма / ADR, alpha rhythm variability |
100 |
83.3 |
|
5 |
J. Claassen et al. (2004) [24] |
48 |
АДО / ADR |
100 |
76 |
|
6 |
B. Balança et al. (2018) [26] |
15 |
АДО / ADR |
100 |
89 |
|
7 |
J.A. Kim et al. (2022) [27] |
113 |
Поздняя ЭА / Late EA |
73 |
54 |
Примечание. ЭЭГ – электроэнцефалография; АДО – отношение мощностей альфа- и дельта-ритмов; ЭА – эпилептиформная активность.
Note. EEG – electroencephalography; ADR – alpha-to-delta power ratio; EA – epileptiform activity.
Разрабатываемые методики / Methods being developed
Для упрощения и ускорения анализа данных продолжительных записей разрабатывают автоматизированные алгоритмы анализа параметров ЭЭГ, позволяющие выявлять и классифицировать изменения, характерные для ОЦИ. Для анализа используют представленные выше количественные параметры фоновой активности и ЭА с учетом локализации, встречаемости в определенном временном промежутке, эпохи записи с артефактами выбраковываются.
Автоматический анализ ЭЭГ-трендов АДО показал чувствительность 80% и специфичность 27% по сравнению со значениями 100% и 76% соответственно при анализе ЭЭГ в неавтоматическом режиме. При автоматизированном анализе тренда на основе относительной вариабельности альфа-ритма чувствительность оказалась равной 65%, а специфичность – 43% (по сравнению со 100% и 46% соответственно, указанными в исследовании с использованием неавтоматического анализа) [28]. Целью другой работы было определение эффективности прогнозирования ОЦИ с применением комбинаций различных параметров ЭЭГ с учетом пространственной локализации согласно зонам основных сосудистых бассейнов [29]. Было достоверно установлено возникновение и нарастание межполушарной асимметрии с одновременным снижением АДО, относительной вариабельности альфа-ритма и нарастанием количества ЭА в проекциях коры, кровоснабжаемой из сосудистых бассейнов, в которых развилась ОЦИ с соответствующими клиническими проявлениями [29].
При ретроспективном автоматическом поиске ЭА с помощью программы Persyst 14 (Persyst Development Corporation, США) обнаружено, что у многих больных, у которых впоследствии развилась ОЦИ, количество разрядов ЭА в час нарастает в течение первых 3–10 сут после САК и оно значительно выше, чем у пациентов из контрольной группы без ОЦИ [28].
Ученые из ФГБУН «Институт радиотехники и электроники им. В.А. Котельникова» Российской академии наук предложили новый подход к детекции ОЦИ с помощью анализа хребтов вейвлет-спектрограмм, в основе которого лежит сочетание амплитудного и спектрального анализа ЭЭГ. Алгоритм выявления межканальной синхронизации позволил определять такие формы ЭА, как спорадические эпилептиформные разряды, ЛРДА, латерализованные и генерализованные периодические разряды [30].
Инвазивная регистрация ЭЭГ / Invasive EEG registration
При САК инвазивные методики ЭЭГ лишь изредка применяют для регистрации эпилептических приступов из-за значительной технической сложности установки и дороговизны электродов. С этой целью возможно использовать как субдуральные, так и глубинные электроды. С учетом риска повреждения коры последние устанавливают в проекции наименее функционально значимых зон (точке Кохера) [31].
Диагностике и прогнозированию ЦА и ОЦИ при САК с помощью инвазивной ЭЭГ посвящено небольшое количество исследований на малых выборках. Так, в публикации A. Waziri et al. сообщается, что у 2 из 10 пациентов с САК изменения на инвазивной ЭЭГ возникали за 8 ч до клинической манифестации ОЦИ [32]. В исследовании R.M. Stuart et al. с участием 5 пациентов устойчивое снижение АДО на инвазивной ЭЭГ было зарегистрировано за 1–3 сут до ангиографического подтверждения ЦА [33].
Для определения информативности и полезности применения инвазивной регистрации ЭЭГ необходимо проведение исследований на больших когортах пациентов.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Для мониторирования функционального состояния головного мозга с целью раннего выявления ОЦИ, вызванной нетравматическим САК, наиболее доступна и информативна скальповая ЭЭГ, которая может быть включена в структуру мультимодального мониторинга пациентов ОРИТ. Это позволит выявлять ранние доклинические признаки ОЦИ и своевременно начинать лечебные мероприятия. Применение графического представления кЭЭГ облегчает анализ результатов, что может помочь в обучении дежурных врачей-реаниматологов базовым принципам детекции ОЦИ по данным трендов кЭЭГ.
Использование инвазивной регистрации ЭЭГ в настоящее время ограничено в связи с небольшим количеством исследований на малых выборках.
Основным преимуществом ЭЭГ в диагностике ОЦИ является возможность непрерывного мониторирования функционального состояния головного мозга у пациентов с угнетением бодрствования и затрудненной оценкой неврологического статуса. К недостаткам относят большое количество артефактов технического и физиологического характера, сложность интерпретации динамики фоновой активности на фоне применения антиконвульсантов и седативных препаратов, необходимость прерывать запись с переустановкой электродов для выполнения КТ или МРТ. Для упрощения и ускорения анализа данных, повышения доступности метода следует продолжать разработку методик автоматизированной обработки данных кЭЭГ.
Список литературы
1. Крылов В.В., Природов А.В., Петриков С.С. Нетравматическое субарахноидальное кровоизлияние: диагностика и лечение. Неврология и ревматология. Приложение к журналу Consilium Medicum. 2008; 1: 14–8.
2. Macdonald R.L. Delayed neurological deterioration after subarachnoid haemorrhage. Nat Rev Neurol. 2014; 10 (1): 44–58. https://doi.org/10.1038/nrneurol.2013.246.
3. Schmidt T.P., Weiss M., Hoellig A., et al. Revisiting the timeline of delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage: toward a temporal risk profile. Neurocrit Care. 2022; 37 (3): 735–43. https://doi.org/10.1007/s12028-022-01545-9.
4. Vergouwen M.D., Vermeulen M., van Gijn J., et al. Definition of delayed cerebral ischemia after aneurysmal subarachnoid hemorrhage as an outcome event in clinical trials and observational studies: proposal of a multidisciplinary research group. Stroke. 2010; 41 (10): 2391–5. https://doi.org/10.1161/STROKEAHA.110.589275.
5. Sehba F.A., Hou J., Pluta R.M., Zhang J.H. The importance of early brain injury after subarachnoid hemorrhage. Prog Neurobiol. 2012; 97 (1): 14–37. https://doi.org/10.1016/j.pneurobio.2012.02.003.
6. Dodd W.S., Laurent D., Dumont A.S., et al. Pathophysiology of delayed cerebral ischemia after subarachnoid hemorrhage: a review. J Am Heart Assoc. 2021; 10 (15): e021845. https://doi.org/10.1161/jaha.121.021845.
7. Alsbrook D.L., Di Napoli M., Bhatia K., et al. Pathophysiology of early brain injury and its association with delayed cerebral ischemia in aneurysmal subarachnoid hemorrhage: a review of current literature. J Clin Med. 2023; 12 (3): 1015. https://doi.org/10.3390/jcm12031015.
8. Tjerkstra M.A., Verbaan D., Coert B.A., et al. Large practice variations in diagnosis and treatment of delayed cerebral ischemia after subarachnoid hemorrhage. World Neurosurg. 2022; 160: e412–20. https://doi.org/10.1016/j.wneu.2022.01.033.
9. Washington C.W., Zipfel G.J. Detection and monitoring of vasospasm and delayed cerebral ischemia: a review and assessment of the literature. Neurocrit Care. 2011; 15 (2): 312–7. https://doi.org/10.1007/s12028-011-9594-8.
10. Chen H.Y., Elmer J., Zafar S.F., et al. Combining transcranial Doppler and EEG data to predict delayed cerebral ischemia after subarachnoid hemorrhage. Neurology. 2022; 98 (5): e459–69. https://doi.org/10.1212/WNL.0000000000013126.
11. Muniz C.F., Shenoy A.V., OʼConnor K.L., et al. Clinical development and implementation of an institutional guideline for prospective EEG monitoring and reporting of delayed cerebral ischemia. J Clin Neurophysiol. 2016; 33 (3): 217–26. https://doi.org/10.1097/WNP.0000000000000281.
12. Jordan K.G. Emergency EEG and continuous EEG monitoring in acute ischemic stroke. J Clin Neurophysiol. 2004; 21 (5): 341–52.
13. Ingvar D.H., Sjölund B., Ardö A. Correlation between dominant EEG frequency, cerebral oxygen uptake and blood flow. Electroencephalogr Clin Neurophysiol. 1976; 41 (3): 268–76. https://doi.org/10.1016/00134694(76)90119-X.
14. Meyer J.S., Gotoh F., Favale E. Effects of carotid compression on cerebral metabolism and electroencephalogram. Electroencephalogr Clin Neurophysiol. 1965; 19 (4): 362–76. https://doi.org/10.1016/00134694(65)90161-6.
15. Vespa P.M., Nuwer M.R., Juhász C., et al. Early detection of vasospasm after acute subarachnoid hemorrhage using continuous EEG ICU monitoring. Electroencephalogr Clin Neurophysiol. 1997; 103 (6): 607– 15. https://doi.org/10.1016/s0013-4694(97)00071-0.
16. Rivierez M., Landau-Ferey J., Grob R., et al. Value of electroencephalogram in prediction and diagnosis of vasospasm after intracranial aneurysm rupture. Acta Neurochir. 1991; 110 (1-2): 17–23. https://doi.org/10.1007/BF01402042.
17. Kim J.A., Rosenthal E.S., Biswal S., et al. Epileptiform abnormalities predict delayed cerebral ischemia in subarachnoid hemorrhage. Clin Neurophysiol. 2017; 128 (6): 1091–9. https://doi.org/10.1016/j.clinph.2017.01.016.
18. Rosenthal E.S., Biswal S., Zafar S.F., et al. Continuous electroencephalography predicts delayed cerebral ischemia after subarachnoid hemorrhage: a prospective study of diagnostic accuracy. Ann Neurol. 2018; 83 (5): 958–69. https://doi.org/10.1002/ana.25232.
19. Xi C., Sun S., Pan C., et al. Different effects of propofol and dexmedetomidine sedation on electroencephalogram patterns: wakefulness, moderate sedation, deep sedation and recovery. PLoS One. 2018; 13 (6): e0199120. https://doi.org/10.1371/journal.pone.0199120.
20. Thakor N.V., Tong S. Advances in quantitative electroencephalogram analysis methods. Annu Rev Biomed Eng. 2004; 6: 453–95. https://doi.org/10.1146/annurev.bioeng.5.040202.121601.
21. Иванов А.А. Обзор методов математического анализа ЭЭГ. Количественная ЭЭГ. Эпилепсия и пароксизмальные состояния. 2023; 15 (2): 171–92. https://doi.org/10.17749/2077-8333/epi.par.con.2023.154.
22. Gollwitzer S., Groemer T., Rampp S., et al. Early prediction of delayed cerebral ischemia in subarachnoid hemorrhage based on quantitative EEG: a prospective study in adults. Clin Neurophysiol. 2015; 126 (8): 1514–23. https://doi.org/10.1016/j.clinph.2014.10.215.
23. Rots M.L., van Putten M.J., Hoedemaekers C.W., Horn J. Continuous EEG monitoring for early detection of delayed cerebral ischemia in subarachnoid hemorrhage: a pilot study. Neurocrit Care. 2016; 24 (2): 207–16. https://doi.org/10.1007/s12028-015-0205-y.
24. Claassen J., Hirsch L.J., Kreiter K.T., et al. Quantitative continuous EEG for detecting delayed cerebral ischemia in patients with poor-grade subarachnoid hemorrhage. Clin Neurophysiol. 2004; 115 (12): 2699–710. https://doi.org/10.1016/j.clinph.2004.06.017.
25. Yu Z., Wen D., Zheng J., et al. Predictive accuracy of alpha-delta ratio on quantitative electroencephalography for delayed cerebral ischemia in patients with aneurysmal subarachnoid hemorrhage: metaanalysis. World Neurosurg. 2019 126: e510–6. https://doi.org/10.1016/j.wneu.2019.02.082.
26. Balança B., Dailler F., Boulogne S., et al. Diagnostic accuracy of quantitative EEG to detect delayed cerebral ischemia after subarachnoid hemorrhage: a preliminary study. Clin Neurophysiol. 2018; 129 (9): 1926–36. https://doi.org/10.1016/j.clinph.2018.06.013.
27. Kim J.A., Zheng W.L., Elmer J., et al. High epileptiform discharge burden predicts delayed cerebral ischemia after subarachnoid hemorrhage. Clin Neurophysiol. 2022; 141: 139–46. https://doi.org/10.1016/j.clinph.2021.01.022.
28. Wickering E., Gaspard N., Zafar S., et al. Automation of classical QEEG trending methods for early detection of delayed cerebral ischemia: more work to do. J Clin Neurophysiol. 2016; 33 (3): 227–34. https://doi.org/10.1097/WNP.0000000000000278.
29. Zheng W.L., Kim J.A., Elmer J., et al. Automated EEG-based prediction of delayed cerebral ischemia after subarachnoid hemorrhage. Clin Neurophysiol. 2022; 143: 97–106. https://doi.org/10.1016/j.clinph.2022.08.023.
30. Обухов Ю.В., Кершнер И.А., Синкин М.В. Новый подход к автоматизированному обнаружению диагностических показателей отсроченной ишемии головного мозга после субарахноидального кровоизлияния в данных длительного ЭЭГ мониторинга. Журнал радиоэлектроники. 2022; 10: 1–19. https://doi.org/10.30898/1684-1719.2022.10.11.
31. Mikell C.B., Dyster T.G., Claassen J. Invasive seizure monitoring in the critically-ill brain injury patient: current practices and a review of the literature. Seizure. 2016; 41: 201–5. https://doi.org/10.1016/j.seizure.2016.05.017.
32. Waziri A., Claassen J., Stuart R.M., et al. Intracortical electroencephalography in acute brain injury. Ann Neurol. 2009; 66 (3): 366–77. https://doi.org/10.1002/ana.21721.
33. Stuart R.M., Waziri A., Weintraub D., et al. Intracortical EEG for the detection of vasospasm in patients with poor-grade subarachnoid hemorrhage. Neurocrit Care. 2010; 13 (3): 355–8. https://doi.org/10.1007/s12028-010-9414-6.
Об авторах
И. В. ОкуневаРоссия
Окунева Ирина Владимировна
Большая Сухаревская пл., д. 3, Москва 107045
М. В. Синкин
Россия
Синкин Михаил Владимирович, д.м.н.
Большая Сухаревская пл., д. 3, Москва 107045
WoS ResearcherID: AAJ-3157-2021. Scopus Author ID: 12775157800
А. И. Евдокимов
Россия
Евдокимов Артём Игоревич
Большая Сухаревская пл., д. 3, Москва 107045
А. В. Природов
Россия
Природов Александр Владиславович, д.м.н., проф.
Большая Сухаревская пл., д. 3, Москва 107045
ул. Островитянова, д. 1, Москва 117997
Рецензия
Для цитирования:
Окунева И.В., Синкин М.В., Евдокимов А.И., Природов А.В. Электроэнцефалографический мониторинг в выявлении и прогнозировании отсроченной церебральной ишемии вследствие нетравматического субарахноидального кровоизлияния. Эпилепсия и пароксизмальные состояния. 2024;16(3):231-240. https://doi.org/10.17749/2077-8333/epi.par.con.2024.192
For citation:
Okuneva I.V., Sinkin M.V., Evdokimov A.I., Prirodov A.V. Electroencephalographic monitoring in detection and prediction of delayed cerebral ischemia due to non-traumatic subarachnoid hemorrhage. Epilepsy and paroxysmal conditions. 2024;16(3):231-240. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2024.192
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































