Перейти к:
Течение мигрени на фоне коррекции вторичной гипергомоцистеинемии
https://doi.org/10.17749/2077-8333/epi.par.con.2025.217
Аннотация
Мигрень – частая причина головной боли, ее распространенность достигает 21% среди женщин и 6% среди мужчин, поэтому большое внимание уделяется исследованию ее патогенеза. В статье представлен клинический случай улучшения течения мигрени у пациентки на фоне коррекции гипергомоцистеинемии, возникшей вследствие выраженного дефицита фолиевой кислоты. Особенностью данного случая также является асимметрия венозных синусов, выявленная по данным бесконтрастной магнитно-резонансной ангиографии, что обусловливает церебральную венозную дисгемию. Гипергомоцистеинемия – один из факторов эндотелиальной дисфункции, чей вклад в развитие различных заболеваний, в т.ч. цереброваскулярных, обсуждается. Накоплены данные, свидетельствующие о более частом выявлении данного нарушения у пациентов с мигренью по сравнению со здоровыми лицами. Поскольку гипергомоцистеинемия поддается снижению с помощью лекарственной терапии, ее выявление и коррекция могут улучшить течение мигрени, что требует дальнейших исследований.
Для цитирования:
Беденко А.С. Течение мигрени на фоне коррекции вторичной гипергомоцистеинемии. Эпилепсия и пароксизмальные состояния. 2025;17(1):54-58. https://doi.org/10.17749/2077-8333/epi.par.con.2025.217
For citation:
Bedenko A.S. Migraine manifestations due to correction of secondary hyperhomocysteinaemia. Epilepsy and paroxysmal conditions. 2025;17(1):54-58. https://doi.org/10.17749/2077-8333/epi.par.con.2025.217
ВВЕДЕНИЕ / INTRODUCTION
Мигрень – частая причина головной боли, ее распространенность достигает 21% у женщин и 6% у мужчин, и среди первичных причин цефалгий она уступает по частоте лишь головной боли напряжения [1]. На данный момент общепринятой считается патогенетическая концепция мигрени как периодически возникающего нейрогенного асептического воспаления сосудистой стенки мелких сосудов твердой мозговой оболочки [1][2].
Особое место в исследовании патогенеза мигрени отводится поиску биомолекул, ассоциированных с развитием головной боли при мигрени и другими ее проявлениями. Иногда, как в случае с пептидом, связанным с геном кальцитонина (англ. сalcitonin gene-related peptide, CGRP), выявление такого биологически активного вещества приводит к принципиально новой терапевтической стратегии [2], но чаще повышение уровня тех или иных биомолекул не вносит принципиальных изменений в подходы к терапии. Так, в некоторых исследованиях продемонстрировано, что при приступе мигрени возникает повышение цитокинов, пентраксина-3 и металлопротеиназы-9 [3], что, безусловно, подтверждает концепцию нейрогенного асептического воспаления, но едва ли может привести к принципиально новым терапевтическим подходам.
В этой связи особый интерес представляет изучение таких метаболических изменений при мигрени, выявление и коррекция которых могут быть доступны в широкой клинической практике и, соответственно, успешно внедрены в протоколы оказания медицинской помощи при мигрени. Потенциально таким метаболитом может оказаться гомоцистеин (серосодержащая аминокислота, метаболит метионина). Известно, что гомоцистеин является одним из факторов эндотелиальной дисфункции, а также атерогенеза [4]. Опубликованы данные, свидетельствующие о его повышении при цереброваскулярной патологии и аутоиммунных заболеваниях головного мозга (рассеянный склероз) [5, 6].
В статье представлен случай улучшения течения мигрени у пациентки на фоне коррекции впервые выявленной гипергомоцистеинемии.
КЛИНИЧЕСКИЙ СЛУЧАЙ / CASE REPORT
Пациентка П. 1987 г.р. обратилась с жалобами на двусторонние головные боли (7–8 баллов по визуально-аналоговой шкале (ВАШ)), которые могли сопровождаться тошнотой, невращательным головокружением на пике головной боли, непостоянным звоном в ушах. Рвоты, фото- и фонофобии не отмечалось.
Анамнез / Medical history
Цефалгический синдром наблюдался в течение многих лет, ухудшение возникло в течение 3–4 нед – головные боли стали ежедневными, двусторонними, наиболее интенсивно выраженными в утренние часы, сопровождались тошнотой, усиливались при физической нагрузке. Интенсивность болевого синдрома варьировалась от 5 до 8 баллов по ВАШ. Ранее отмечалось ухудшение цефалгического синдрома в ответ на прием эстрогеносодержащих препаратов. На момент осмотра пациентка ежедневно принимала комбинированные анальгетики (ацетилсалициловая кислота + парацетамол + кофеин). Из анамнеза жизни известно об удалении эндометриоидной кисты в 2014 г.
Неврологический статус / Neurological status
В неврологическом статусе общемозговой, очаговой и менингеальной симптоматики на момент осмотра не выявлено.
Предварительный диагноз / Preliminary diagnosis
С учетом клинико-анамнестических данных сформулирован предварительный диагноз: «Цефалгический синдром смешанного генеза (церебральная венозная дисгемия + головная боль напряжения). Дифференциальный диагноз с трансформированной мигренью».
Пациентке назначено дообследование с целью исключения либо верификации вторичных цефалгий.
Инструментальные исследования / Instrumental examinations
По данным магнитно-резонансной томографии головного мозга и магнитно-резонансной венографии (1,5 Тл с контрастным усилением) патологических очагов в головном мозге не обнаружено, асимметрия поперечных и сигмовидных синусов без признаков тромбоза (рис. 1).
По результатам дуплексного исследования брахиоцефальных артерий и транскраниальной допплерографии ультразвуковых признаков патологии сосудов виллизиева круга на момент исследования не выявлено. Индексы, характеризующие периферическое сосудистое сопротивление, в пределах нормы. Непрямолинейность хода позвоночных артерий между поперечными отростками шейных позвонков, очевидно, обусловлена остеохондрозом шейного отдела позвоночника.
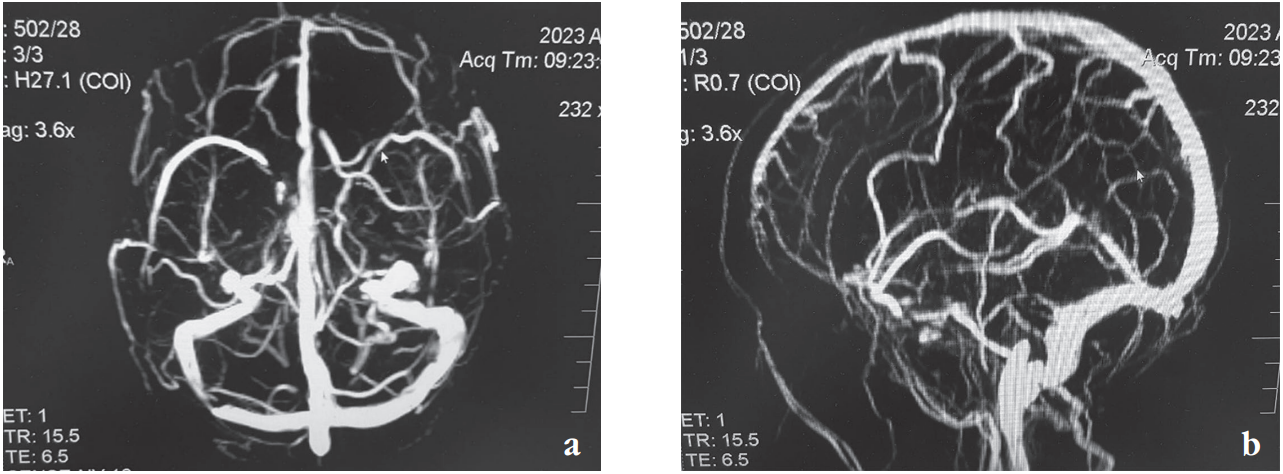
Рисунок 1. Магнитно-резонансная венография внутричерепных синусов: а – аксиальная проекция; b – сагиттальная проекция
Figure 1. Magnetic resonance venography of intracranial sinuses: а – axial plane; b – sagittal plane
Лабораторные исследования / Laboratory tests
В клиническом анализе крови патологических изменений не обнаружено. Коагулограмма без отклонений. Анализ сыворотки крови на гомоцистеин выявил гипергомоцистеинемию (25,35 мкмоль/л). Пациентка была направлена на консультацию гематолога, назначившего дополнительные лабораторные исследования.
В общей коагулограмме отклонений не зарегистрировано: D-димер 110,41 нг/мл, фибриноген 2,91 г/л, протромбиновое время 11,4 с, международное нормализованное отношение 1,05, активированное частичное тромбопластиновое время 23,1 с, тромбиновое время 13,6 с, антитромбин III 105%, волчаночный антикоагулянт 0,73 у.е., протеин С 76% и протеин S 84,5% (что соответствует нормальным значениям). Выявлен дефицит фолиевой кислоты – 2 нг/мл (витамин В12 – 311 пг/мл, что соответствует нормальным значениям).
Проведено исследование на антифосфолипидный синдром: антитела к кардиолипину суммарные – 6,3 ОЕд/мл, антитела к бета-2-гликопротеину I – 12,33 ОЕд/мл, что также соответствует нормальным значениям.
Также выполнено генетическое исследование на выявление дефектов ферментов фолатного цикла: мутаций в генах MTR, MTRR, MTHFR не выявлено.
Пациентка была проконсультирована гастроэнтерологом, установлен диагноз атрофического гастрита.
Терапия / Therapy
В качестве средства для купирования головной боли предложен золмитриптан перорально в дозировке 2,5 мг. В процессе динамического наблюдения отмечен положительный эффект приема триптанов на головную боль. Также в связи с формирующимся абузусом проведена терапия дексаметазоном внутривенно на растворе Рингера по схеме: 1-й день – 8 мг, 2-й день – 4 мг, 3-й день – 4 мг.
После этого назначена терапия, направленная на снижение уровня гомоцистеина (препарат ангиовит по 2 таблетки 2 раза в сутки в течение 1 мес), а также венотонизирующий препарат, содержащий комбинацию диосмина и гесперидина. На фоне приема этого препарата частота головной боли сократилась с ежедневной до 10–15 дней в месяц. При контрольном исследовании выявлено снижение уровня гомоцистеина до 7,29 мкмоль/л, что соответствует нормальным значениям.
Окончательный диагноз / Final diagnosis
На основании жалоб, анамнестических и клинических данных, лабораторных и инструментальных исследований установлен окончательный диагноз: «Мигрень без ауры с ежедневными приступами, декомпенсация».
Сопутствующий диагноз: «Церебральная венозная дисгемия, асимметрия внутричерепных синусов. Гипергомоцистеинемия на фоне дефицита фолиевой кислоты».
С целью сокращения частоты приступов пациентке была назначена профилактическая терапия венлафаксином на полгода. В дальнейшем она к врачу не обращалась, при активном телефонном опросе спустя 1 год после первичного обращения выяснилось, что пациентка самостоятельно прекратила терапию через 4 мес в связи с наступлением стойкой ремиссии. Повторного контроля показателей фолиевой кислоты и гомоцистеина не проводилось.
ОБСУЖДЕНИЕ / DISCUSSION
Диагноз мигрени у пациентки установлен в соответствии с международными критериями мигрени [7]:
а) по меньшей мере 5 приступов, отвечающих критериям b–d;
b) продолжительность приступов 4–72 ч (без лечения или при отсутствии эффекта от него);
c) головная боль имеет как минимум две из следующих четырех характеристик: односторонняя локализация, пульсирующий характер, средняя или выраженная интенсивность боли, головная боль усиливается от обычной физической активности или требует прекращения обычной физической активности (например, ходьба или подъем по лестнице);
d) головная боль сопровождается как минимум одним из следующих симптомов: тошнота и/или рвота, фотофобия и фонофобия;
e) головная боль не соответствует в большей степени другому диагнозу по Международной классификации головных болей 3-го пересмотра.
Особенностями представленного клинического случая являются повышение уровня гомоцистеина, а также структурные изменения внутричерепных синусов, способствующие развитию церебральной венозной дисгемии.
Эндотелиальная дисфункция – универсальный и многофакторный патогенетический механизм при многих заболеваниях. Существуют данные о более высокой вероятности развития сердечно-сосудистых заболеваний у пациентов с мигренью (в особенности мигренью с аурой), что с высокой вероятностью может быть обусловлено именно эндотелиальной дисфункцией. Это подтверждается результатами нескольких исследований: получены данные о более высоком содержании эндотелина-1 у пациентов с мигренью, о повышении во время приступа мигрени фактора активации тромбоцитов и фактора фон Виллебранда [1][3].
Одним из хорошо изученных факторов эндотелиальной дисфункции является гомоцистеин. Сведения о повышении его уровня при мигрени несколько противоречивы. Есть исследования, свидетельствующие об увеличении концентрации гомоцистеина в цереброспинальной жидкости при мигрени по сравнению с группой контроля [8]. Опубликованы данные о более высоких значениях гомоцистеина в плазме крови у пациентов с мигренью с аурой по сравнению с группой контроля [3][9]. Однако другие авторы не выявили статистически значимой взаимосвязи между мигренью и гипергомоцистеинемией [3]. Между тем, если ориентироваться на результаты метаанализов как более достоверные, то в метаанализе, опубликованном в 2020 г. Американским обществом по изучению головной боли (англ. American Headache Society), показана положительная взаимосвязь между гипергомоцистеинемией и мигренью [10]. Примечательно, что в этой же статье приведены данные нескольких независимых исследований, продемонстрировавших, что уровень фолатов в плазме крови ниже у пациентов с мигренью по сравнению со здоровыми добровольцами.
Гипергомоцистеинемия может быть как вторичной (вследствие дефицита фолиевой кислоты или витаминов В12, В6), так и первичной, генетически обусловленной. Идентифицировано несколько генов (преимущественно фолатного цикла), мутации в которых ведут к развитию гипергомоцистеинемии. У нашей пациентки гипергомоцистеинемия оказалась вторичной, обусловленной дефицитом фолиевой кислоты. Между тем необходимо отметить, что наследственная гипергомоцистеинемия зачастую возникает в результате мутации в гене метилентетрагидрофолатредуктазы (MTHFR). По некоторым данным, частота такой мутации среди детей, страдающих мигренью, достигает 53,3% [11]. Несколько независимых исследований продемонстрировали, что пациенты с мигренью чаще, чем в популяции, оказывались гомозиготны по аллелю MTHFR С677T (точечная миссенс-мутация) [3]. З.Г. Тадтаева и др. (2021 г.) сделали вывод, что мутации в нескольких генах фолатного цикла (MTHFD1, MTHFR, MTRR, MTR) можно рассматривать как маркеры, ассоциированные с мигренью [11].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Эндотелиальная дисфункция относится к универсальным патогенетическим механизмам при различных патологиях, повышение гомоцистеина – одно из звеньев формирования этого состояния. Накоплены данные, свидетельствующие о более частом выявлении гипергомоцистеинемии у пациентов с мигренью. В отличие от многих других факторов эндотелиальной дисфункции, гипергомоцистеинемия хорошо поддается коррекции с помощью препаратов витаминов группы В. В приведенном клиническом случае отмечено улучшение проявлений мигрени (возврат к приступообразному течению вместо ежедневного) на фоне коррекции гипергомоцистеинемии. Это дает основания предполагать, что выявление и коррекция таких нарушений у пациентов с мигренью могут привести к улучшению течения заболевания, однако требуются дальнейшие исследования на соответствующей выборке пациентов.
Список литературы
1. Табеева Г.Р. Цереброваскулярные расстройства, ассоциированные с мигренью. Медицинский Совет. 2017; 10: 32–5. https://doi.org/10.21518/2079-701X-2017-10-32-35.
2. Азимова Ю.Э., Амелин А.В., Алферова В.В. и др. Клинические рекомендации «Мигрень». Журнал неврологии и психиатрии им. С.С. Корсакова. 2022; 122 (1-3): 4–36. https://doi.org/10.17116/jnevro20221220134.
3. Demartini C., Francavilla M., Zanaboni A.M., et al. Biomarkers of migraine: an integrated evaluation of preclinical and clinical findings. Int J Mol Sci. 2023; 24 (6): 5334. https://doi.org/10.3390/ijms24065334.
4. Ефимов В.С., Озолиня Л.А., Кажешева А.З., Макаров О.В. Гипергомоцистеинемия в клинической практике. М.: ГЭОТАР-Медиа; 2013: 79 с.
5. Cordaro M., Siracusa R., Fusco R., et al. Involvements of hyperhomocysteinemia in neurological disorders. Metabolites. 2021; 11 (1): 37. https://doi.org/10.3390/metabo11010037.
6. Дубченко Е.А., Иванов А.В., Бойко А.Н. и др. Гипергомоцистеинемия и эндотелиальная дисфункция при сосудистых и аутоиммунных заболеваниях головного мозга. Журнал неврологии и психиатрии им. С.С. Корсакова. 2019; 119 (11): 133–8. https://doi.org/10.17116/jnevro2019119111133.
7. Headache Classification Committee of the International Headache Society (IHS). The International Classification of Headache Disorders, 3rd edition. Cephalalgia. 2018; 38 (1): 1-211. https://doi.org/10.1177/0333102417738202.
8. Isobe C., Terayama Y. A remarkable increase in total homocysteine concentrations in the CSF of migraine patients with aura. Headache. 2010; 50 (10): 1561–9. https://doi.org/10.1111/j.1526-4610.2010.01713.x.
9. Moschiano F., D’Amico D., Usai S., et al. Homocysteine plasma levels in patients with migraine with aura. Neurol Sci. 2008; 29 (Suppl. 1): S173–5. https://doi.org/10.1007/s10072-008-0917-2.
10. Liampas I., Siokas V., Mentis A.A., et al. Serum homocysteine, pyridoxine, folate, and vitamin B12 levels in migraine: systematic review and meta-analysis. Headache. 2020; 60 (8): 1508–34. https://doi.org/10.1111/head.13892.
11. Тадтаева З.Г., Яковлева Е.Е., Амелин А.В. Полиморфизм гена фолатного обмена метилентетрагидрофолат-редуктазы (MTHFR) и гипергомоцистеинемия при мигрени. Патологическая физиология и экспериментальная терапия. 2021; 65 (4): 109–15. https://doi.org/10.25557/0031-2991.2021.04.109-115.
Об авторе
А. С. БеденкоРоссия
Беденко Анна Сергеевна, к.м.н.
Scopus Author ID: 57220812877
ул. Красная Пресня, д. 16, Москва 123242
Рецензия
Для цитирования:
Беденко А.С. Течение мигрени на фоне коррекции вторичной гипергомоцистеинемии. Эпилепсия и пароксизмальные состояния. 2025;17(1):54-58. https://doi.org/10.17749/2077-8333/epi.par.con.2025.217
For citation:
Bedenko A.S. Migraine manifestations due to correction of secondary hyperhomocysteinaemia. Epilepsy and paroxysmal conditions. 2025;17(1):54-58. https://doi.org/10.17749/2077-8333/epi.par.con.2025.217

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































