Перейти к:
Посттравматическая эпилепсия у детей: предикторы развития и лечебная стратегия
https://doi.org/10.17749/2077-8333/epi.par.con.2025.236
Аннотация
Актуальность. Посттравматическая эпилепсия (ПТЭ) у детей является значимой медико-социальной проблемой, влияющей на качество жизни пациентов. В развитии заболевания выделяют периоды ранних и поздних судорожных приступов (СП), которые имеют разную патофизиологическую основу. Фармакорезистентность, формируемая за счет структурно обусловленных зон эпилептогенеза при ПТЭ, создает предпосылки для увеличения частоты хирургических вмешательств как единственного метода лечения, эффективного в части достижения свободы от приступов. Цель: проанализировать литературные данные по предикторам развития ПТЭ у детей, эффективности консервативного и хирургического лечения.
Материал и методы. В соответствии с подходом PRISMA в анализ включены 29 зарубежных и отечественных литературных источников, найденных в базах данных PubMed/MEDLINE, eLibrary и опубликованных в период 2014–2024 гг., в т.ч. 7 систематических обзоров и метаанализов. Критерием отбора служило соответствие темы публикации поисковому запросу «посттравматическая эпилепсия у детей».
Результаты. Согласно современным представлениям выделяют четыре направления исследования потенциальных рисков развития ПТЭ при черепно-мозговой травме средней и тяжелой степеней у детей: биомаркеры, генетическая предрасположенность, нейровизуализационные и нейрофизиологические предикторы. Отсутствует доказанный терапевтический способ профилактики возникновения ранних СП, при этом в ряде исследований отмечается эффективность профилактического применения противоэпилептических препаратов в отношении частоты возникновения поздних СП при ПТЭ в детской популяции. Высок потенциал использования хирургических методов лечения ПТЭ как разновидности структурной формы эпилепсии в части достижения свободы от приступов.
Заключение. Анализ данных демонстрирует расширение клинико-диагностического подхода в определении факторов риска развития ПТЭ у детей, а также структурирует понимание возможностей и эффективности консервативного и хирургического методов лечения.
Ключевые слова
Для цитирования:
Каньшина Д.С., Ахадов Т.А., Мельников И.А., Манушакян Г.А., Зыков В.П. Посттравматическая эпилепсия у детей: предикторы развития и лечебная стратегия. Эпилепсия и пароксизмальные состояния. 2025;17(2):227-233. https://doi.org/10.17749/2077-8333/epi.par.con.2025.236
For citation:
Kanshina D.S., Akhadov T.A., Mel'nikov I.A., Manushakyan G.A., Zykov V.P. Post-traumatic epilepsy in children: developmental predictors and treatment strategy. Epilepsy and paroxysmal conditions. 2025;17(2):227-233. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2025.236
ВВЕДЕНИЕ / INTRODUCTION
Посттравматическая эпилепсия (ПТЭ) – хорошо известный синдромокомплекс, возникающий в результате умеренной и тяжелой черепно-мозговой травмы (ЧМТ) и описываемый как повторяющиеся, неспровоцированные судорожные приступы (СП), которые возникают спустя 7 дней и более после острого повреждения головного мозга [1][2].
В течении ЧМТ средней и тяжелой степеней выделяют два периода, сопряженных с развитием СП. Ранние СП появляются как неспецифическая диффузная реакция в результате острой энцефалопатии и являются самоограниченными. СП, возникающие спустя недели и месяцы после ЧМТ, в литературе описаны как поздние и отражают глубинный процесс перестройки с формированием рубцовых изменений и зон эпилептогенеза. Ряд авторов выделяет острый период – длительностью первые 24 ч после ЧМТ [3].
У 50–65% пациентов ПТЭ манифестирует в течение 1-го года, у 75% – в течение первых 2 лет после получения травмы [3]. ПТЭ утяжеляет состояние пациентов и ассоциируется с усилением неврологических нарушений, снижением когнитивных функций и более высокой смертностью [4][5].
Частота ПТЭ в детской популяции составляет 10% [2]. Ключевыми факторами, отличающими детскую популяцию с ПТЭ, являются [6–9]:
– возраст на момент получения ЧМТ, соответствующий периоду развития головного мозга ребенка, который влияет на течение окислительного стресса, нейровоспаления и эксайтотоксичности при структурном повреждении;
– диспропорциональное соотношение размеров головы и тела и недоразвитие мышц плечевого пояса, что делает головной мозг ребенка более уязвимым к травматическому воздействию, особенно при механизмах повреждения, сопряженных с ускорением/торможением (дорожно-транспортные происшествия и кататравмы).
Цель – проанализировать литературные данные по предикторам развития ПТЭ у детей, эффективности консервативного и хирургического лечения.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Поиск публикаций / Search of publications
При введении поискового запроса «посттравматическая эпилепсия у детей» за период 2014–2024 гг. база данных PubMed/MEDLINE предоставляет доступ к 158 публикациям, eLibrary – к 32 источникам.
Отбор публикаций / Selection of publications
Критериями отбора публикаций для включения в обзор были: подтвержденный диагноз ПТЭ, возраст до 18 лет, указание в анамнезе на ранние и поздние СП, оценка предикторов формирования ПТЭ, фармакотерапия и/или хирургия ПТЭ у детей. Исключались работы с несоответствующим дизайном (глава книги, диссертация и т.д.), а также с низком качеством методологии.
При использовании подхода PRISMA (рис. 1) 12 публикаций были удалены из-за дублирования в базах данных. Подвергнуты скринингу 178 статей, 109 из них исключены по причине несоответствия содержания данным запроса, 25 – в связи с несоответствием дизайна. Оценены в полнотекстовым варианте 44 публикации, в 2 случаях полный текст был недоступен. Исключены в связи с несоответствием критериям 13 источников и 5 – по причине низкого методологического качества. В итоге в анализ включены 29 исследований.
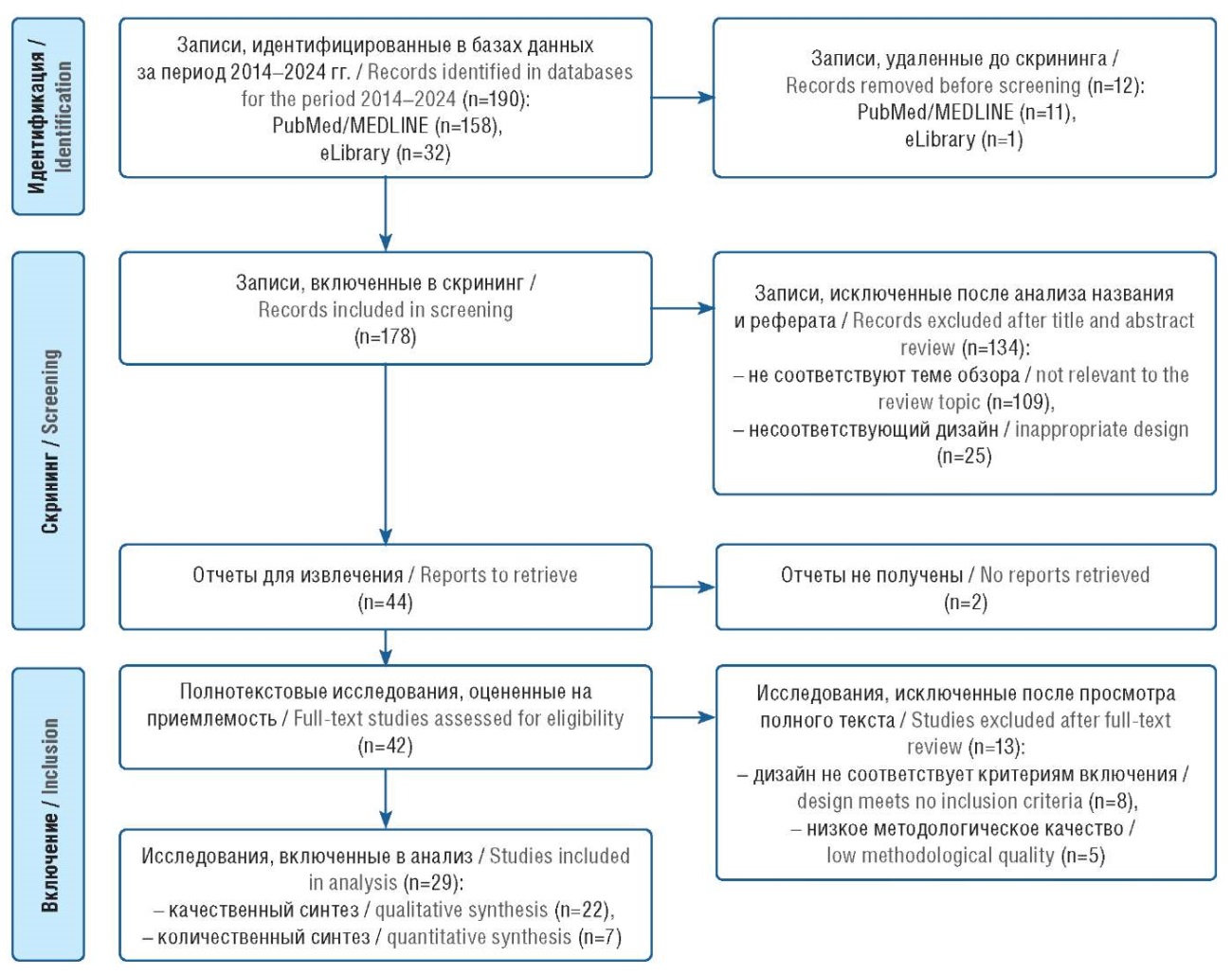
Рисунок 1. Блок-схема отбора исследований
Figure 1. Study flow diagram
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Предикторы развития ПТЭ / Predictors of PTE development
Стратификация факторов риска развития ПТЭ у детей является одной из значимых проблем современной медицины. По данным исследований, факторами риска развития ПТЭ в динамике служат ЧМТ тяжелой степени, наличие судорог в течение первых 7 сут после травмы, внутричерепные и внутримозговые кровоизлияния, вовлечение коры головного мозга, наличие дефекта твердой мозговой оболочки и перелома черепа [3][6][10][11].
В систематическом обзоре и метаанализе 2024 г. [12] выделены четыре направления исследования потенциальных рисков развития ПТЭ при ЧМТ средней и тяжелой степеней, некоторые из которых оценивалась ранее по отдельности или совместно в других исследовательских работах: биомаркеры, генетическая предрасположенность, нейровизуализационные и нейрофизиологические предикторы.
Биомаркеры
У пациентов c СП отмечен значительно более высокий уровень интерлейкина-6 (ИЛ-6) в спинномозговой жидкости, однако исследование было популяционным – оценивалась индийская популяция, что не позволяет делать однозначных выводов [12]. Также показано, что еженедельно измеряемое соотношение концентраций ИЛ-1β в спинномозговой жидкости и сыворотке крови выше среди выживших после ЧМТ с развитием ПТЭ [13].
Генетические маркеры
Гены – транспортеры глутамата (ген SLC1A1 при наличии однонуклеотидных полиморфизмов rs10974620 и rs7858819 и ген SLC1A3 при наличии однонуклеотидного полиморфизма rs4869682, особенно у лиц с гомозиготным вариантом GG) связаны с повышенным риском развития поздних СП. Ген A1AR (ген аденозинового рецептора A1) при последовательности rs3766553 имеет взаимосвязь с риском развития как ранних (генотип АА), так и поздних (генотип GG) СП. Генотип CT при последовательности rs10920573 также коррелирует с поздними СП. Мультигеномный анализ показал, что варианты rs3766553 и rs10920573 независимо и суммарно повышают предрасположенность к позднему и отсроченному началу ПТЭ [12][14].
Ген GAD1 (ген декарбоксилазы глутаминовой кислоты) с однонуклеотидной последовательностью rs3791878 (генотип GG) и rs769391 (генотип AA), ген IL1B (кодирует цитокин семейства ИЛ-1β) с однонуклеотидной последовательностью rs1143634 (генотип СС в 17,6%, генотип СТ в 47,7% случаев) также связаны с риском развития ПТЭ [12][14].
Ген ADK (ген аденозинкиназы) rs11001109/NT5E с гомозиготным минорным аллелем rs11001109 и гетерозиготные индивидуумы rs9444348 ассоциированы с риском развития ПТЭ, ген GRIN2A (кодирует субъединицу GluN2 ионотропного глутаматного рецептора N-метил-D-аспартата) при последовательности rs11074504 создает предрасположенность к развитию ПТЭ, однако наличие металла в головном мозге снижает этот риск среди носителей [12][15].
Мутация C677T гена MTHFR (метилентетрагидрофолат редуктаза – внутриклеточный фермент, играющий ключевую роль в метаболизме фолата и метионина) доказанно сопряжена с риском развития ПТЭ [3].
В отношении гена APOE исследования последних лет не подтверждают значимую взаимосвязь между его носительством и риском развития ПТЭ [12].
Нейровизуализационные предикторы
Обзор и метаанализ исследований демонстрирует следующие закономерности [12]:
– уменьшение объема височной доли (объемный анализ T1W 3D gradient echo) сопряжено с большей частотой встречаемости ПТЭ у детей;
– на магнитно-резонансной томографии в состоянии покоя пациенты с ПТЭ имели нарушенный баланс между интеграцией и сегрегацией, а также гиперсвязанные, гиперинтегрированные и гипосегрегированные функциональные сети (функциональная коннективность);
– с помощью однофотонной эмиссионной компьютерной томографии доказано, что степень гипоперфузии в височных долях достоверно коррелирует с ПТЭ (p<0,004) через 1 год после травмы, причем в группе ПТЭ более высокие показатели гипоперфузии наблюдаются в правой передней, правой задней и левой передней височных долях;
– ПТЭ коррелирует со степенью выраженности гидроцефалии и наличием внутримозговых гематом;
– больший балл по шкале CT Marshall scores (комбинации смещения средней линии и объема поражения) связан с риском развития ПТЭ.
Нейрофизиологические предикторы
Анализ двух нейрофизиологических исследований позволил выявить электрофизиологические маркеры скальповой электроэнцефалографии (ЭЭГ) для ПТЭ [12]:
– спектральная мощность на дельта-частотах (особенно в первые 3–5 дней после ЧМТ);
– мощность дисперсии дельта- и тета-частот;
– пиковая огибающая (амплитуда ЭЭГ в широком частотном диапазоне);
– межприступные эпилептиформные разряды;
– процент времени с СП на скальповой ЭЭГ и аномальные сонные веретена.
Изучение особенностей нарушения архитектуры сна в работе Р. Andrade и A. Pitkänen, в т.ч. на экспериментальных моделях ЧМТ, подтвердило взаимосвязь между структурными изменениями таламокортикальных проекций и частотой регистрации аномальных сонных веретен [16].
Следует учитывать ограничения скальповой ЭЭГ как диагностического метода исследования при остром повреждении головного мозга. Применение инвазивных электродов и регистрация кортикографии позволили доказать возможность выявления эпилептиформной активности в качестве маркера нарастающих вторичных изменений [17]. Однако риски, связанные с инвазивной записью, ограничивают использование ЭЭГ, в т.ч. в детской популяции.
Терапевтическая стратегия / Therapeutic strategy
За концепцией профилактики ПТЭ стоит надежда на то, что период затишья в течение нескольких недель и месяцев после травмы до возникновения приступа – это окно возможностей, позволяющее остановить процесс с помощью соответствующих интервенционных стратегий лечения [18].
Консервативный подход
Противоэпилептические препараты (ПЭП) могут подавлять СП, однако вопрос о том, способны ли они также оказывать положительное влияние в части профилактики, является предметом дискуссий. Экспериментальные исследования, в которых изучались нейропротекторные агенты, такие как антиоксиданты и свободные радикалы, также дали многообещающие результаты, но исторически сложилось так, что они не нашли широкого применения в клинической практике [19].
Кокрейновский обзор 2015 г. [20] охватывает 10 рандомизированных клинических исследований (2326 пациентов), представленных в 12 публикациях. Из них только 5 исследований включали детей, и лишь работа K. Young et al. (2004 г.) была сосредоточена исключительно на детской популяции [21].
Согласно полученным результатам применение ПЭП и/или нейропротекторов не снижало риск развития ранних СП по сравнению с плацебо или обычным лечением. Использование ПЭП при условии достижения терапевтических концентраций и приверженности к терапии уменьшало риск развития поздних СП, однако высокая предвзятость в оценке и гетерогенность выборок не позволили считать это преимущество достоверным (отношение рисков (ОР) 0,91; 95% доверительный интервал (ДИ) 0,57–1,46; 1029 участников). Не было отмечено существенного различия в смертности между пациентами, принимавшими ПЭП, и участниками, получавшими плацебо или обычное лечение (ОР 1,08; 95% ДИ 0,79–1,46; р=0,64). Не получено также доказательств влияния эффективности нейропротекторной терапии на поздние СП (ОР 1,07; 95% ДИ 0,53–2,17) или смертность от всех причин (ОР 1,20; 95% ДИ 0,80–1,81) по сравнению с плацебо или обычным лечением. Показана эффективность фенитоина в сравнении с леветирацетамом или вальпроатами в части снижения риска смерти (ОР 0,53; 95% ДИ 0,30–0,94), но результат был основан только на 2 исследованиях. Отмечены нежелательные побочные явления в виде кожной сыпи при сравнении ПЭП с плацебо, однако статистической достоверности в отношении повышенного риска нежелательных явлений в группе, принимавшей ПЭП, достигнуто не было (ОР 1,63; 95% ДИ 0,73–3,66) [20].
Авторы систематических обзоров 2022 и 2024 гг. выдвинули предположение о большей эффективности леветирацетама в детской популяции в части профилактики ранних СП: при его использовании сокращались сроки пребывания в отделении анестезиологии, реанимации и интенсивной терапии и наблюдалось меньшее количество нежелательных побочных явлений в сравнении с фенитоином при сопоставимых показателях смертности [22][23].
Соответственно, на сегодняшний день можно констатировать отсутствие доказанного терапевтического способа профилактики возникновения ранних СП, при этом в ряде исследований отмечается эффективность профилактического использования ПЭП в отношении частоты возникновения поздних СП при ПТЭ в детской популяции. Фармакорезистентность ПТЭ, составляющая до 20% от всех структурных форм эпилепсии, предполагает применение в качестве потенциально эффективного метода лечения нейрохирургическое вмешательство.
Хирургические вмешательства
В метаанализ X. Wang et al. (2023 г.) были включены 14 исследований, из них 12 публикаций посвящены резекционной нейрохирургии и 2 – установке стимулятора блуждающего нерва (СБН). Снижение частоты приступов при всех видах хирургических операций составило 77,1%. При анализе подгрупп эффективность 79,4% достигнута в срок наблюдения до 5 лет и 71,9% – после 5-летнего периода. Частота снижения приступов 89,9% получена при височной лобэктомии, 54,5% – при установке СБН [24].
При этом следует учитывать, что в качестве критерия эффективности лечения оценивается свобода от приступов, что не исключает сохранения когнитивных, поведенческих, эндокринных и иных нарушений в отдаленные периоды после ЧМТ у пациентов детского возраста.
В части эндокринных нарушений в литературных источниках нами не найдено указаний на частоту их встречаемости среди детей с ПТЭ. Однако известно, что клинические проявления могут дебютировать как в остром, так и в хроническом периоде, в связи с чем целесообразно проводить эндокринологическое обследование детей через 6 и 12 мес после травмы, а затем ежегодно [25–29].
Ограничения исследований / Limitations of the studies
При анализе публикаций мы обратили внимание на ряд ограничений, которые могли повлиять на результаты: недостаточный катамнез наблюдения, гетерогенность выборки (оценка детской и взрослой популяции совместно), методологические ограничения (недостаточная длительность ЭЭГ-мониторинга или вариабельность его сроков, отсутствие контроля достижения терапевтической дозы лекарственных препаратов). В качестве эффективности терапии рассматривается достижение свободы от приступов, при этом уделяется недостаточно внимания оценке высших психических функций и иным соматическим состояниям, в частности эндокринопатиям.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Анализ литературных источников позволил установить четыре направления оценки потенциального риска развития ПТЭ у детей: биомаркеры, генетика, нейровизуализация и нейрофизиология. Совокупное рассмотрение предикторов помогает повысить их предсказательную способность в отношении возможности развития ранних и поздних СП. Имеющиеся данные свидетельствуют в пользу снижения риска появления поздних СП при фармакологическом контроле ранних СП. Применение нейрохирургических методов лечения обосновано при структурной форме эпилепсии и является эффективным способом достижения свободы от приступов у пациентов детского возраста с ПТЭ.
Список литературы
1. Fisher R., Cross H., French J., et al. An overview of the 2017 ILAE operational classification of seizure types. Epilepsy. 2017; 58 (4): 522–30. https://doi.org/10.1111/epi.13670.
2. Fisher R., Emde Boas W., Blume W., et al. Epileptic seizures and epilepsy: definitions proposed by the International League Against Epilepsy (ILAE) and the International Bureau for Epilepsy (IBE).Epilepsia. 2005; 46 (4): 470–2. https://doi.org/10.1111/j.0013-9580.2005.66104.x.
3. Крюкова К.К., Александрова Е.В., Воскресенская О.Н. и др. Ранние предиктивные биомаркеры посттравматической эпилепсии. Журнал «Вопросы нейрохирургии» имени Н.Н. Бурденко. 2021; 85 (5): 110–5. https://doi.org/10.17116/neiro202185051110.
4. Englander J., Bushnik T., Duong T., et al. Analyzing risk factors for late posttraumatic seizures: a prospective, multicenter investigation. Arch Phys Med Rehabil. 2003; 84 (3): 365–73. https://doi.org/10.1053/apmr.2003.50022.
5. Mazzini L., Cossa F.M., Angelino E., et al. Posttraumatic epilepsy: neuroradiologic and neuropsychological assessment of long-term outcome. Epilepsia. 2003; 44 (4): 569–74. https://doi.org/10.1046/j.1528-1157.2003.34902.x.
6. Mariajoseph F., Chen Z., Sekhar P., et al. Incidence and risk factors of posttraumatic epilepsy following pediatric traumatic brain injury: a systematic review and meta-analysis. Epilepsia. 2022; 63 (11): 2802–12. https://doi.org/10.1111/epi.173982022.
7. Potts M., Koh S.E., Whetstone W., et al. Traumatic injury to the immature brain: inflammation, oxidative injury, and iron-mediated damage as potential therapeutic targets. NeuroRx. 2006; 3 (2): 143–53. https://doi.org/10.1016/j.nurx.2006.01.006.
8. Sharma S., Tiarks G., Haight J., et al. Neuropathophysiological mechanisms and treatment strategies for post-traumatic epilepsy. Front Mol Neurosci. 2021: 14: 612073. https://doi.org/10.3389/fnmol.2021.612073.
9. Semple B., O'Brien T., Gimlin K., et al. Interleukin-1 receptor in seizure susceptibility after traumatic injury to the pediatric brain. J Neurosci. 2017; 37 (33): 7864–77. https://doi.org/10.1523/JNEUROSCI.0982-17.2017.
10. Jennett B. Epilepsy after non-missile head injuries. Scott Med J. 1973; 18 (1): 8–13. https://doi.org/10.1177/003693307301800103.
11. Annegers J., Coan S. The risks of epilepsy after traumatic brain injury. Seizure. 2000; 9 (7): 453–7. https://doi.org/10.1053/seiz.2000.0458.
12. Bruckhaus А., Asifriyaz T., Kriukova K., et al. Exploring multimodal biomarker candidates of post-traumatic epilepsy following moderate to severe traumatic brain injury: a systematic review and meta-analysis. Epilepsia. 2025; 66 (1): 6–32. https://doi.org/10.1111/epi.18131.
13. Diamond M., Ritter A., Failla M., et al. IL-1β associations with posttraumatic epilepsy development: a genetics and biomarker cohort study. Epilepsia. 2014; 55 (7): 1109–19. https://doi.org/10.1111/epi.12628.
14. Darrah S., Miller M., Ren D., et al. Genetic variability in glutamic acid decarboxylase genes: associations with post-traumatic seizures after severe TBI. Epilepsy Res. 2013; 103 (2–3): 180–94. https://doi.org/10.1016/j.eplepsyres.2012.07.006.
15. Diamond M., Ritter A., Jackson E., et al. Genetic variation in the adenosine regulatory cycle is associated with posttraumatic epilepsy development. Epilepsia. 2015; 56 (8): 1198–206. https://doi.org/10.1111/epi.13044.
16. Andrade P., Pitkänen A. O212 Shortening of the duration of sleep spindles; a diagnostic biomarker for post-traumatic epilepsy. Clin Neurophysiol. 2017; 128 (9): e246. https://doi.org/10.1016/j.clinph.2017.07.220.
17. Waziri A., Claassen J., Stuart R., et al. Intracortical electroencephalography in acute brain injury. Ann Neurol. 2009; 66 (3): 366–77. https://doi.org/10.1002/ana.21721.
18. Temkin N. Preventing and treating posttraumatic seizures: the human experience. Epilepsia. 2009; 50 (Suppl. 2): 10–3. https://doi.org/10.1111/j.1528-1167.2008.02005.x.
19. Slemmer J., Shacka J., Sweeney M., Weber J.T. Antioxidants and free radical scavengers for the treatment of stroke, traumatic brain injury and aging. Curr Med Chem. 2008; 15 (4): 404–14. https://doi.org/10.2174/092986708783497337.
20. Thompson K., Pohlmann-Eden B., Campbell L., Abel H. Pharmacological treatments for preventing epilepsy following traumatic head injury. Cochrane Database Syst Rev. 2015; 2015 (8): CD009900. https://doi.org/10.1002/14651858.CD009900.pub2.
21. Young K., Okada P., Sokolove P., et al. A randomized, doubleblinded, placebocontrolled trial of phenytoin for the prevention of earlyposttraumatic seizures in children with moderate to severe blunt head injury. Ann Emerg Med. 2004; 43 (4): 435–46. https://doi.org/10.1016/j.annemergmed.2003.09.016.
22. Samara Q., Ifraitekh A., Jayyousi O., et al. Use of antiepileptic drugs as prophylaxis against posttraumatic seizures in the pediatric population: a systematic review and meta-analysis. Neurosurg Rev. 2023; 46 (1): 49. https://doi.org/10.1007/s10143-023-01963-z.
23. Karamian A., Farzaneh H., Taheri M., Seifi A. Effectiveness of levetiracetam versus phenytoin in preventing seizure in traumatic brain injury patients: a systematic review and meta-analysis. Clin Neurol Neurosurg. 2024: 240: 108251. https://doi.org/10.1016/j.clineuro.2024.108251.
24. Wang X., Han P., Wang Q., et al. Efficiency of surgery on posttraumatic epilepsy: a systematic review and meta-analysis. Neurosurg Rev. 2023; 46 (1): 91. https://doi.org/10.1007/s10143-023-01997-3.
25. Kaulfers A., Backeljauw P., Reifschneider K., et al. Endocrine dysfunction following traumatic brain injury in children. J Pediatr. 2010; 157 (6): 894–9. https://doi.org/10.1016/j.jpeds.2010.07.004.
26. Reifschneider K., Auble B., Rose S. Update of endocrine dysfunction following pediatric traumatic brain injury. J Clin Med. 2015; 4 (8): 1536–60. https://doi.org/10.3390/jcm4081536.
27. Rose S.R., Auble B.A. Endocrine changes after pediatric traumatic brain injury. Pituitary. 2012; 15 (3): 267–75. https://doi.org/10.1007/s11102-011-0360-x.
28. Mariajoseph F., Chen Z., Sekhar P., et al. Incidence and risk factors of posttraumatic epilepsy following pediatric traumatic brain injury: a systematic review and meta-analysis. Epilepsia. 2022; 63 (11): 2802–12. https://doi.org/10.1111/epi.17398.
29. Vlad R., Albu A., Nicolaescu I., et al. An approach to traumatic brain injury-related hypopituitarism: overcoming the pediatric challenges. Diagnostics. 2023; 13 (2): 212. https://doi.org/10.3390/diagnostics13020212.
Об авторах
Д. С. КаньшинаРоссия
Каньшина Дарья Сергеевна, к.м.н.
Scopus Author ID: 57221390389
ул. Большая Полянка, д. 22, Москва 119180
Т. А. Ахадов
Россия
Ахадов Толибджон Абдуллаевич, д.м.н., проф.
ул. Большая Полянка, д. 22, Москва 119180
И. А. Мельников
Россия
Мельников Илья Андреевич, к.м.н.
ул. Большая Полянка, д. 22, Москва 119180
Г. А. Манушакян
Россия
Манушакян Григорий Арамович
ул. Полтавская, д. 2, Москва 127220
В. П. Зыков
Россия
Зыков Валерий Петрович, д.м.н., проф.
ул. Баррикадная, д. 2/1, стр. 1, Москва 125993
Рецензия
Для цитирования:
Каньшина Д.С., Ахадов Т.А., Мельников И.А., Манушакян Г.А., Зыков В.П. Посттравматическая эпилепсия у детей: предикторы развития и лечебная стратегия. Эпилепсия и пароксизмальные состояния. 2025;17(2):227-233. https://doi.org/10.17749/2077-8333/epi.par.con.2025.236
For citation:
Kanshina D.S., Akhadov T.A., Mel'nikov I.A., Manushakyan G.A., Zykov V.P. Post-traumatic epilepsy in children: developmental predictors and treatment strategy. Epilepsy and paroxysmal conditions. 2025;17(2):227-233. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2025.236
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































