Перейти к:
Амплитудно-интегрированная электроэнцефалография как дополнительный метод исследования у новорожденных детей с судорогами
https://doi.org/10.17749/2077-8333/epi.par.con.2022.098
Аннотация
Цель: сравнение методов электроэнцефалографии (ЭЭГ) и амплитудно-интегрированной электроэнцефалографии (аЭЭГ), их технических особенностей, клинического применения для новорожденных в отделении интенсивной терапии, а также корреляции аЭЭГ с другими методами диагностики (неврологический статус, нейросонография).
Материал и методы. Обследованы 52 новорожденных ребенка. Дети чаще были доношенными или имели начальную степень недоношенности. У 29 младенцев регистрировались судороги, которые отмечались 1–5 раз. Проводилась ЭЭГ в течение 107,7±32,7 мин с дальнейшей программной аЭЭГ-обработкой.
Результаты. При анализе аЭЭГ найдены достоверные различия между индексами дельта-2-активности в процентах у недоношенных младенцев относительно других ритмов по сравнению с доношенными детьми. Показано, что представленность на протяжении всей записи в процентах высокоамплитудной дельта-2-активности выше у новорожденных с судорогами по сравнению с младенцами без них.
Заключение. Таким образом, аЭЭГ уточняет и дополняет данные, полученные с помощью рутинной ЭЭГ, и может использоваться не только в качестве метода непрерывного мониторинга функций мозга у новорожденных детей, но и как дополнительная программа к стандартному ЭЭГ-исследованию. Метод имеет большой потенциал для уточнения диагноза и дальнейшей неврологической поддержки новорожденных в отделениях интенсивной терапии.
Ключевые слова
Для цитирования:
Кощавцев А.Г. Амплитудно-интегрированная электроэнцефалография как дополнительный метод исследования у новорожденных детей с судорогами. Эпилепсия и пароксизмальные состояния. 2022;14(1):8-14. https://doi.org/10.17749/2077-8333/epi.par.con.2022.098
For citation:
Koshchavtsev A.G. Amplitude-integrated electroencephalography as an additional research method in newborns with seizures. Epilepsy and paroxysmal conditions. 2022;14(1):8-14. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.098
ВВЕДЕНИЕ / INTRODUCTION
В отделениях реанимации и интенсивной терапии непривычная среда не только нарушает нормальное развитие новорожденного, но в некотором смысле разрушает диадические материнско-детские отношения, приобретение ряда навыков ребенком по импринтинговому типу [1][2]. Улучшение неонатологических навыков и инструментария для новорожденных с помощью нейрофизиологического мониторинга контролирует интенсивную терапию и может улучшить долгосрочный прогноз.
Непрерывный мониторинг функции мозга у новорожденных детей дает важную информацию для уточнения нюансов неврологического лечения во время интенсивной и неотложной неонатальной помощи. Электроэнцефалография (ЭЭГ) была основой диагностики судорожных состояний у детей и подростков на протяжении десятилетий. Хотя паттерны ЭЭГ у недоношенных младенцев с разными неврологическими исходами определены достаточно давно, многие данные были ограничены из-за сложности использования ЭЭГ у этих детей [3–5]. ЭЭГ в сочетании с амплитудно-интегрированной ЭЭГ (аЭЭГ), т.е. ЭЭГ с небольшим количеством каналов, в последнее время получила широкое распространение в отделениях реанимации и интенсивной терапии.
Рутинная ЭЭГ регистрирует электрическую активность головного мозга, обеспечивая точную оценку функции мозга новорожденных, и полезна для прогнозирования последствий нарушенного развития у детей после травмы или гипоксически-ишемического воздействия. Стандартная ЭЭГ регистрирует электрокортикальный сигнал с помощью электродов, прикрепленных к коже головы. ЭЭГ у новорожденных имеет несколько каналов и требует использования не менее 9 и не более 40 электродов на голове, одновременно отслеживая функцию мозга, движения глаз, функцию мышц, частоту сердечных сокращений, дыхательные движения и запись поведенческого видео [6]. Рутинная ЭЭГ – это преимущественный метод для оценки неврологического функционального статуса новорожденных в отделении интенсивной терапии [7][8].
Однако регистрация ЭЭГ в отделении интенсивной терапии представляет трудности, поскольку сигнал ЭЭГ имеет низкую амплитуду, особенно у недоношенных и маловесных детей. Амплитудные показатели ЭЭГ связаны с мощностью электрокортикального сигнала и степенью его изменения. Он измеряется в микровольтах и представляет собой общее количество электрической энергии, затрачиваемой на функционирование нейронов. Недоношенные дети имеют более низкий уровень электрических сигналов и более длительные периоды электрического «молчания» мозга, чем доношенные здоровые младенцы. Активность мозга со временем увеличивается, что приводит к более сильному общему сигналу и более упорядоченному паттерну изменения амплитуды. «Зашумленная» электрическая среда в реанимации и интенсивной терапии новорожденных легко искажает сигнал артефактами. Кроме того, неонатологам и специалистам по ЭЭГ трудно отличить возникающие артефакты от ряда паттернов неонатальной ЭЭГ [9][10].
Амплитудно-интегрированная ЭЭГ, в отличие от рутинной, представляет собой простой непрерывный мониторинг активности мозга, который отражает тенденции (тренды) биоэлектрической активности. Она состоит из одноили двухканальных ЭЭГ, записанных с помощью 3–5 электродов, прикрепленных к коже головы. Амплитудно-интегрированная ЭЭГ фиксирует фоновый рисунок активности мозга в реальном времени в течение длительного периода. Запись может длиться 24 ч и более по мере необходимости. Использование электродов и интерпретация аЭЭГ не требуют длительной подготовки и опыта. Обычно установка электродов занимает менее 10 мин. Применяют различные электроды, включая самоклеящиеся гидрогелевые пластыри, внутрикожные иглы и используемые нами серебряные или золотые чашечковые электроды под пасту [11].
Многочисленные исследования показали, что аЭЭГ чувствительна к прогнозированию неврологических исходов как у доношенных, так и у недоношенных детей. Аномальные паттерны аЭЭГ связаны с неблагоприятными исходами для нервно-психического развития ребенка [12][16–18]. Так, показаны корреляции данных аЭЭГ с показателями цитокинов и других воспалительных маркеров и исходом развития недоношенных детей, рожденных на 24–28-й неделе беременности, к 2-летнему возрасту [19]. В другой работе с недоношенными младенцами исследователи показали, что непрерывность аЭЭГ предсказывает краткосрочный исход (смерть или внутрижелудочковое кровоизлияние III–IV ст.) с точностью до 83% [17].
Цель – сравнение методов ЭЭГ и аЭЭГ, их технических особенностей, клинического применения для новорожденных в отделении интенсивной терапии, а также корреляции аЭЭГ с другими методами диагностики (неврологический статус, нейросонография).
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Проведено проспективное наблюдательное исследование, в рамках которого обследованы 52 новорожденных ребенка в палатах интенсивной терапии отделения патологии новорожденных детской многопрофильной больницы.
Этические аспекты / Ethical aspects
Исследование соответствовало международным этическим нормам и принципам Хельсинкской декларации Всемирной медицинской ассоциации. Родители в обязательном порядке подписывали информированное согласие. Исследование было одобрено этическим комитетом при ФГБОУ ВО «Санкт-Петербургский педиатрический медицинский университет» Минздрава России (решение № 2/6 от 25.02.2019 г.).
Описание группы пациентов / Description of the patient group
Средний возраст детей составлял 20,3±14,2 дня. Новорожденные чаще были доношенными или имели начальную степень недоношенности (35–37 нед). у 29 младенцев регистрировались судороги, которые отмечались 1–5 раз, без тенденции к статусному течению. У 14 детей был установлен диагноз гипоксическиишемической энцефалопатии (ГИЭ) тяжелой степени, у 27 – средней степени тяжести, у 3 – легкой степени тяжести. у 8 младенцев не отмечалось признаков ГИЭ.
Нейросонография / Neurosonography
При нейросонографии (НСГ) либо не наблюдалось анатомических изменений (30 детей), либо регистрировались субэпендимальные кисты в незначительном количестве (9 младенцев). Внутрижелудочковые кровоизлияния наблюдались у 7 детей, грубое органическое или дизонтогенетическое поражение мозга – у 6 младенцев. Расширение боковых желудочков по данным НСГ отмечалось у 12 новорожденных, преимущественно до 0,6–0,7 см.
Методы электроэнцефалографии / Electroencephalography methods
Проводилась ЭЭГ в течение 107,7±32,7 мин с дальнейшей программной аЭЭГ-обработкой. Регистрация ЭЭГ выполнялась на компьютерном энцефалографе «Энцефалан-ЭЭГР-19/26» (Россия). Для отведения ЭЭГ использовались детские золотые чашечковые электроды фирмы Nicolet Biomedical (США) диаметром 0,6 см, которые крепились на пасту. Запись осуществлялась в 10 пунктах, по международной схеме «10–20»: лобные (Fp1, Fp2), центральные (C3, C4), затылочные (O1, O2), передневисочные (F7, F8) и задневисочные (T5, T6) отведения, монополярно, с объединенным референтом на мостовидных отростках.
Методы статистического анализа / Methods of statistical analysis
Для статистической обработки данных использовалась программа Statistica 10 (StatSoft, Inc. США). Применялись методы описательной статистики и непараметрический корреляционный анализ.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Интерпретация аЭЭГ / Interpretation of aEEG
Как известно, аЭЭГ коррелирует со стандартной (рутинной) ЭЭГ [12]. При отслеживании биоэлектрической активности у новорожденных, имеющих судороги, корреляция между аЭЭГ и ЭЭГ составляет 100% [12], что подтверждается нашим исследованием. Амплитудноинтегрированный электроэнцефалографический сигнал выглядит как черная полоса с синусоидальными периодами расширения и сжатия. Как правило, отслеживание аЭЭГ интерпретируется визуально путем обнаружения паттернов в соответствии с пятью основными переменными: непрерывность (плотность трассы, прерывистость дорожки с повышенной вариабельностью), наличие цикличности (периоды расширения и сжатия), амплитуда (в микровольтах) для нижней границы (минимальная полоса) и верхней границы (максимальная полоса), а также ширина полосы (разница между нижним и верхним краями самой узкой части графика) [13–15].
Наиболее часто используемый показатель аЭЭГ – непрерывность сигнала, тренд которого показывает плотный узкий паттерн, распределенный между низкой и высокой амплитудами. у доношенных новорожденных периоды активного сна сопровождаются более низкой амплитудой нижнего и верхнего края тренда, по сравнению с высокими амплитудными показателями аЭЭГ глубокого сна, что в нашем исследовании наблюдается в виде статистической тенденции.
В целом показатели амплитуды верхнего и нижнего края полосы аЭЭГ у доношенных и недоношенных детей в нашей работе не отличаются, поскольку гестация недоношенных была 35–37 нед, т.е. близка к 40 нед. Известно [10], что основной активностью ЭЭГ у новорожденных детей является дельта, которую мы разделили на два диапазона: дельта-1 0,5–2,0 Гц и дельта-2 2,0– 4,0 Гц. При расчете процентов индексов этих диапазонов в аЭЭГ оказалось, что индексы дельта-1-активности недоношенных и доношенных не отличаются, тогда как имеются достоверные различия между индексами дельта-2-активности у недоношенных младенцев в процентах относительно других ритмов: 8,7±2,3% по сравнению с 13,7±9,0% у доношенных детей. Созревание мозга сопровождается повышением частоты биоэлектрической активности у детей со сменой ритмов от дельта к альфа, что и отмечается в нашей выборке в виде большей процентной представленности высокочастотной дельта-активности у доношенных детей.
Судороги на аЭЭГ / Seizures on aEEG
Судороги на участках аЭЭГ регистрируются как повторяющееся, внезапное, кратковременное повышение нижней и верхней части тренда [9]. При сравнении новорожденных с судорогами (29 детей) и без судорог (23 ребенка) оказалось, что ГИЭ у первых достоверно чаще была тяжелой или средней степени тяжести (р<0,05). у новорожденных без судорог преобладала ГИЭ легкой или средней степени тяжести. Эпилептиформные и пароксизмальные графоэлементы у детей с судорогами отмечались 2–3 и более раза в минуту, тогда как у младенцев без судорог их либо не было вообще, либо имели место 1–2 эпизода за тот же период (р<0,05).
При анализе индексов аЭЭГ оказалось, что представленность на протяжении всей записи в процентах высокоамплитудной дельта-2-активности выше у детей с судорогами (14,68±9,97%) по сравнению с младенцами без судорог (10,53±5,39%) на уровне статистической тенденции. Это можно объяснить, если расценивать пробеги высокоамплитудной дельта-2активности в качестве подпороговой пароксизмальной активности. На рисунке 1 показана эпоха анализа ЭЭГ и соответствующий ей эпизод записи тренда аЭЭГ у ребенка Г. с судорогами на 68-й минуте мониторинговой записи. Отмечаются среднеи высокоамплитудная дельта-1–2-активность на ЭЭГ и видимый на аЭЭГ подъем тренда CNV (англ. continuous normal voltage) с двумя пароксизмальными элементами. На рисунке 2 представлена эпоха анализа ЭЭГ и соответствующий ей эпизод записи тренда аЭЭГ у ребенка К. без судорог на 29-й минуте мониторинговой записи. Наблюдается более плоская ЭЭГ, за исключением одного канала, и соответствующий ей эпизод аЭЭГ с регулярным, не увеличенным по амплитуде паттерном CNV.
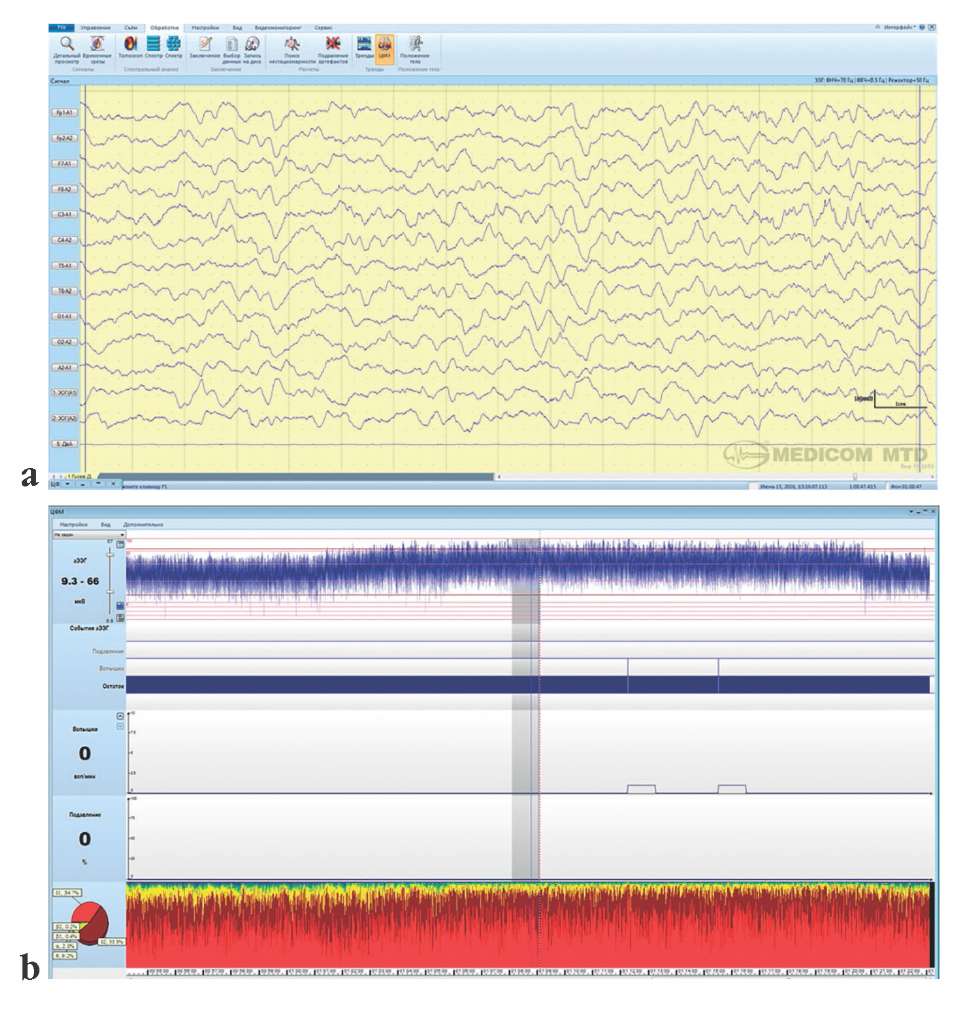
Рисунок 1. Электроэнцефалограмма (ЭЭГ) и амплитудно-интегрированная электроэнцефалограмма (аЭЭГ) у ребенка Г. с судорогами: а – эпоха анализа ЭЭГ; b – эпизод тренда аЭЭГ, обозначенный серой полосой, соответствует эпохе анализа ЭЭГ
Figure 1. Electroencephalography (EEG) and amplitude-integrated EEG (aEEG) in the neonate G. with seizures: a – epoch of EEG analysis; b – episode of aEEG trend denoted as grey strip corresponding to epoch of EEG analysis

Рисунок 2. Электроэнцефалограмма (ЭЭГ) и амплитудно-интегрированная электроэнцефалограмма (аЭЭГ) у ребенка К. без судорог: а – эпоха анализа ЭЭГ; b – эпизод тренда аЭЭГ, обозначенный серой полосой, соответствует эпохе анализа ЭЭГ
Figure 2. Electroencephalography (EEG) and amplitude-integrated EEG (aEEG) in the seizure-free neonate К.: a – epoch of EEG analysis; b – episode of aEEG trend denoted as grey strip corresponding to epoch of EEG analysis
Таким образом, исследование показало, что аЭЭГ уточняет и дополняет данные, полученные с помощью ЭЭГ с тенденцией к мониторинговому исследованию, и может использоваться не только в качестве метода непрерывного мониторинга функций мозга у новорожденных детей, но и как дополнительная программа к стандартному ЭЭГ-исследованию.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Амплитудно-интегрированная ЭЭГ – это клинически доступный метод непрерывного мониторинга функций мозга у новорожденных детей. В дополнение к использованию рутинной ЭЭГ aЭЭГ имеет большой потенциал для уточнения диагноза и дальнейшей неврологической поддержки младенцев в отделениях интенсивной терапии. Кроме того, ЭЭГ с привязкой к амплитуде хорошо идентифицирует сон и бодрствование ребенка. Необходимы дальнейшие исследования для изучения эффектов различных видов ухода и вмешательств (например, ряда процедур, родительских прикосновений и т.д.), в т.ч. на циклы сна и бодрствования, у доношенных и недоношенных новорожденных детей.
Список литературы
1. Black J.E. How a child builds its brain: some lessons from animal studies of neural plasticity. Prev Med. 1998; 27 (2): 168–71. https://doi.org/10.1006/pmed.1998.0271.
2. Батуев А.С., Кощавцев А.Г., Соболева М.В. Зрительное предпочтение как проявление привязанности у детей первого года жизни. Вопросы психологии. 1996; 4: 34–41.
3. Selton D., Andre M., Hascoët J. Normal EEG in very premature infants: reference criteria. Clin Neurophysiol. 2000; 111 (12): 2116–24. https://doi.org/10.1016/s1388-2457(00)00440-5.
4. Selton D., André M., Debruille C., et al. EEG at 6 weeks of life in very premature neonates. Clin Neurophysiol. 2010; 121 (6): 818–22. https://doi.org/10.1016/j.clinph.2009.11.006.
5. Vecchierini M., André M., d'Allest A. Normal EEG of premature infants born between 24 and 30 weeks gestational age: terminology, definitions and maturation aspects. Neurophysiol. Clin. 2007; 37 (5): 311–23. https://doi.org/10.1016/j.neucli.2007.10.008.
6. Boylan G. Principles of EEG. In: Rennie J., Hagmann C., Robertson N. (Eds). Neonatal cerebral investigation. New York: Cambridge University Press; 2008: 9–21.
7. El-Dib M., Chang T., Tsuchida T., Clancy R. Amplitude-integrated electroencephalography in neonates. Pediatr Neurol. 2009; 41 (5): 315–26. https://doi.org/10.1016/j.pediatrneurol.2009.05.002.
8. Clancy R., Dicker L., Cho S., et al. Agreement between long-term neonatal background classification by conventional and amplitude-integrated EEG. J Clin Neurophysiol. 2011; 28 (1): 1–9. https://doi.org/10.1097/WNP.0b013e3182051105.
9. Hellstrom-Westas L., De Vries L., Rosen I. Atlas of amplitude-integrated EEGs in the newborn. 2nd ed. London, UK: Informa Healthcare; 2008: 187.
10. Кощавцев А.Г., Гречаный С.В. Интерпретация электроэнцефалографии у детей раннего возраста. Эпилепсия и пароксизмальные состояния. 2020; 12 (1): 9–25. https://doi.org/10.17749/2077-8333.2020.12.1.9-25.
11. Foreman S.W., Thorngate L., Burr R.L., Thomas K.A. Electrode challenges in amplitude-integrated EEG: research application of a novel noninvasive measure of brain function in preterm infants. Biol Res Nurs. 2011; 13 (3): 251–9. https://doi.org/10.1177/1099800411403468.
12. Klebermass K., Kuhle S., Kohlhauser-Vollmuth C., et al. Evaluation of the cerebral function monitor as a tool for neurophysiological surveillance in neonatal intensive care patients. Childs Nerv Syst. 2001; 17 (9): 544–50. https://doi.org/10.1007/s003810100488.
13. Kuint J., Turgeman A., Torjman A., Maayan-Metzger A. Characteristics of amplitude-integrated electroencephalogram in premature infants. J Child Neurol. 2007; 22 (3): 277–81. https://doi.org/10.1177/0883073807299860.
14. Burdjalov V.F., Baumgart S., Spitzer A.R. Cerebral function monitoring: a new scoring system for the evaluation of brain maturation in neonates. Pediatrics. 2003; 112 (4): 855–61. https://doi.org/10.1542/peds.112.4.855.
15. Olischar M., Klebermass K., Kuhle S., et al. Reference values for amplitude-integrated electroencephalographic activity in preterm infants younger than 30 weeks' gestational age. Pediatrics. 2004; 113 (1 Pt. 1): e61–6. https://doi.org/10.1542/peds.113.1.e61.
16. Archbald F., Verma U., Tejani N., Handwerker S. Cerebral function monitor in the neonate. II: Birth asphyxia. Dev Med Child Neurol. 1984; 26 (2): 162–8. https://doi.org/10.1111/j.1469-8749.1984.tb04427.x.
17. Bowen J., Paradisis M., Shah D. Decreased aEEG continuity and baseline variability in the first 48 hours of life associated with poor short-term outcome in neonates born before 29 weeks gestation. Pediatr Res. 2010; 67 (5): 538–44. https://doi.org/10.1203/PDR.0b013e3181d4ecda.
18. El-Dib M., Massaro A., Glass P., et al. Early amplitude integrated EEG and outcome of very low birth weight infants. Pediatr Int. 2011; 53 (3): 315–21. https://doi.org/10.1111/j.1442-200X.2010.03270.x.
19. Wikström S., Ley D., Hansen-Pupp I., et al. Early amplitude-integrated EEG correlates with cord TNF-alpha and brain injury in very preterm infants. Acta Pеdiatr. 2008; 97 (7): 915–9. https://doi.org/10.1111/j.1651-2227.2008.00787.x.
Об авторе
А. Г. КощавцевРоссия
Кощавцев Андрей Гелиевич – кандидат медицинских наук, доцент кафедры психиатрии и наркологии, координатор направления «Психическое здоровье младенцев».
ул. Литовская, д. 2, Санкт-Петербург 194100.
Scopus Author ID: 6504425924
РИНЦ SPIN-код: 5449-3953
Рецензия
Для цитирования:
Кощавцев А.Г. Амплитудно-интегрированная электроэнцефалография как дополнительный метод исследования у новорожденных детей с судорогами. Эпилепсия и пароксизмальные состояния. 2022;14(1):8-14. https://doi.org/10.17749/2077-8333/epi.par.con.2022.098
For citation:
Koshchavtsev A.G. Amplitude-integrated electroencephalography as an additional research method in newborns with seizures. Epilepsy and paroxysmal conditions. 2022;14(1):8-14. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.098
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.







































