Перейти к:
Стереоэлектроэнцефалография в прехирургическом обследовании пациентов с фармакорезистентной фокальной эпилепсией
https://doi.org/10.17749/2077-8333/epi.par.con.2022.090
Аннотация
Актуальность. Хирургическое лечение показало свою эффективность у пациентов с лекарственно-устойчивой фокальной эпилепсией: удаление или дисконнекция эпилептогенной зоны приводит к избавлению больного от эпилептических приступов. Однако в части случаев неинвазивных обследований бывает недостаточно для локализации границ эпилептогенной зоны. Таким пациентам проводится инвазивная электроэнцефалография для уточнения расположения зоны, ответственной за развитие приступов.
Цель: оценить эффективность инвазивной стереоэлектроэнцефалографии (сЭЭГ) в предоперационном обследовании пациентов с фармакорезистентной фокальной эпилепсией.
Материал и методы. Ретроспективно проанализированы данные 65 больных, которым с 2016 по 2019 гг. была проведена сЭЭГ в ходе прехирургического обследования по поводу фармакорезистентной фокальной эпилепсии. По результатам магнитно-резонансной томографии (МРТ) 34 пациента имели МР-негативные формы эпилепсии, 31 – МРпозитивные формы с множественными структурными изменениями головного мозга или расхождениями между электроклиническими данными и МРТ-находками.
Результаты. На основании полученной при сЭЭГ информации 49 (75,4%) пациентам были выполнены резекционные операции. В 16 (24,6%) случаях хирургическое лечение не проводилось в связи с выявлением двусторонней локализации эпилептогенной зоны, отсутствием убедительных данных о ее расположении или обнаружением эпилептогенной зоны в функционально значимой области. У 44 прооперированных больных отслежен катамнез дольше 12 мес, с 5 пациентами связаться не удалось. Исходы по классификации J. Engel: I класс – 27 (61,3%) пациентов, II класс – 7 (15,9%), III класс – 4 (9,1%), IV класс – 6 (13,6%). В результате проведения сЭЭГ геморрагические осложнения развились у 2 (3,1%) больных: по 1 (1,5%) случаю внутричерепной гематомы и субдуральной гематомы. Стойкого неврологического дефицита в последующем не отмечено.
Заключение. Метод сЭЭГ эффективен для определения границ эпилептогенной зоны у пациентов с фармакорезистентной фокальной эпилепсией.
Ключевые слова
Для цитирования:
Балацкая А.С., Педяш Н.В., Головтеев А.Л., Калыбаева Н.А., Утяшев Н.П., Одениязова М.А., Бронов О.Ю., Зуев А.А. Стереоэлектроэнцефалография в прехирургическом обследовании пациентов с фармакорезистентной фокальной эпилепсией. Эпилепсия и пароксизмальные состояния. 2022;14(2):183-194. https://doi.org/10.17749/2077-8333/epi.par.con.2022.090
For citation:
Balatskaya A.S., Pedyash N.V., Golovteev A.L., Kalybaeva N.A., Utyashev N.P., Odeniyazova M.A., Bronov O.Yu., Zuev A.A. Stereoelectroencephalography in pre-surgical evaluation of patients with drug-resistant focal epilepsy. Epilepsy and paroxysmal conditions. 2022;14(2):183-194. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.090
ВВЕДЕНИЕ / INTRODUCTION
Несмотря на расширение арсенала противосудорожных препаратов в последние десятилетия, стойкой ремиссии приступов у больных эпилепсией не удается достичь примерно в 30% случаев [1][2]. Хирургическое лечение показало свою эффективность у пациентов с фармакорезистентной фокальной эпилепсией [3–5].
Концепция прехирургического обследования эпилепсии подразумевает поиск так называемой эпилептогенной зоны (ЭЗ) – участка головного мозга, ответственного за развитие эпилептических приступов [6]. Удаление или дисконнекция ЭЗ приводит к избавлению больных от приступов [7]. Прехирургическое обследование пациентов с фармакорезистентной эпилепсией преследует две главные цели: во-первых, выявить и локализовать ЭЗ, а во-вторых, спланировать зону резекции так, чтобы сохранить функционально значимые зоны [8].
Первый этап диагностического поиска объединяет неинвазивные методы обследования, сфокусированные на определении границ ЭЗ. Он базируется на нахождении взаимосвязи между особенностями анатомии, клинических и электрофизиологических данных [9]. Появление метода магнитно-резонансной томографии (МРТ) в конце ХХ в. послужило толчком к развитию хирургического лечения эпилепсии, а благодаря возрастающему опыту радиологов и совершенствованию новых технологий визуализации мозга (МРТ высокого разрешения) количество пациентов, которые могут быть прооперированы после неинвазивных исследований, прогрессивно увеличивается [10–12].
Инвазивный электроэнцефалографический (ЭЭГ) мониторинг применяется на втором этапе прехирургического обследования. Он используется, когда оценка семиологии приступов, иктальных и интериктальных данных скальповой ЭЭГ не позволяет точно определить локализацию зоны начала приступов, когда видимые изменения на МРТ головного мозга кажутся не связанными с электро-клиническими данными или при отсутствии явных изменений на МРТ головного мозга [13–15]. Существует два метода инвазивного обследования: субдуральные полоски (или решетки) и глубинные стереоэлектроды [16][17].
Уникальность стереоэлектроэнцефалографии (сЭЭГ) заключается в том, что она позволяет записать электрическую активность практически с любого участка коры головного мозга [6], в т.ч. с глубоко расположенных, таких как инсула, лимбические структуры (амигдала, гиппокамп), поверхность коры головного мозга, расположенной в дне борозд. Кроме того, метод дает возможность регистрировать электрическую активность одновременно со многих структур головного мозга и оценивать каждый приступ как функцию сложной нейрональной сети. Установка сЭЭГ-электродов происходит стереотаксически и не требует трепанации черепа, а их удаление осуществляется под местной анестезией, без повторного оперативного вмешательства. Последующее хирургическое лечение эпилепсии может быть выполнено без ограничений по времени. По сравнению с инвазивными хроническими субдуральными гридами, сЭЭГ – более безопасное и комфортное для пациента обследование, которое реже приводит к развитию осложнений [18][19].
Цель – оценить эффективность инвазивной сЭЭГ в предоперационном обследовании пациентов с фармакорезистентной фокальной эпилепсией.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Сбор данных / Data collection
Ретроспективно проанализированы данные 65 пациентов (29 женщин и 36 мужчин), которым в ходе прехирургического обследования проведена сЭЭГ в ФГБУ «Национальный медико-хирургический центр им. Н.И. Пирогова» Минздрава России по поводу фармакорезистентной фокальной эпилепсии с октября 2016 г. по май 2019 г.
Характеристика пациентов / Patient сharacteristics
Общие характеристики больных представлены в таблице 1. Средний возраст дебюта эпилепсии составил 8,9 года (диапазон 1–28 лет), средний возраст на момент проведения сЭЭГ – 25,3 года (диапазон 18–51 год). Продолжительность заболевания до проведения сЭЭГ в среднем составила 16,4 года (диапазон 2–48 лет). У 34 пациентов не было обнаружено видимых изменений на МРТ головного мозга (МР-негативная группа). В МР-позитивную группу вошли: 9 больных с множественными изменениями на МРТ головного мозга и 22 пациента, у которых при прехирургическом обследовании найдены расхождения между данными неинвазивных методов обследования и МРТ-находками.
Таблица 1. Сводные данные о пациентах с фармакорезистентной фокальной эпилепсией, вошедших в исследование (n=65)
Table 1. Summary data on studied patients with pharmacoresistant focal epilepsy (n=65)
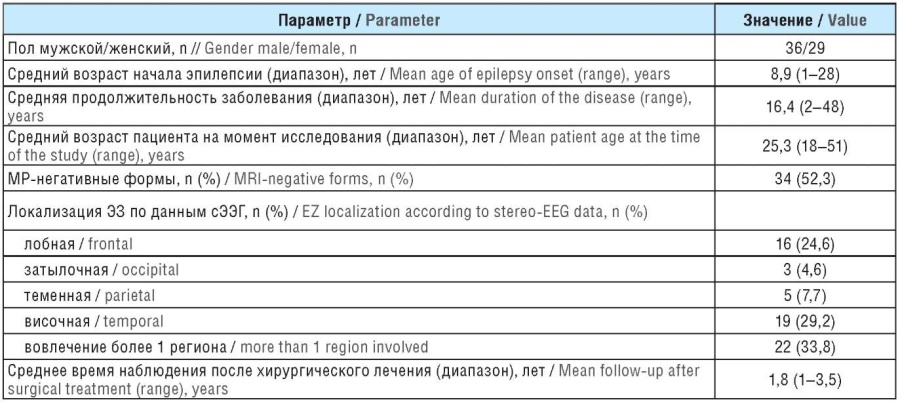
Примечание. МР – магнитно-резонансные; ЭЗ – эпилептогенная зона; сЭЭГ – стереоэлектроэнцефалография.
Note. MRI – magnetic resonance imaging; EZ – epileptogenic zone; EEG – electroencephalography.
Неинвазивные обследования / Non-invasive examinations
Все пациенты прошли подробный сбор анамнеза, неврологический осмотр, скальповый видео-ЭЭГ-мониторинг с видеорегистрацией приступов, МРТ головного мозга по эпилептологическому протоколу (3 Тл). Для верификации ЭЗ на прехирургическом этапе у 25 (38%) больных выполнена интериктальная позитронноэмиссионная томография (ПЭТ) головного мозга с 18F-фтордезоксиглюкозой, у 5 (7,7%) пациентов проведена иктальная однофотонно-эмиссионная компьютерная томография головного мозга с протоколом SISCOM [20–22].
На первом этапе у каждого больного провели анализ семиологии приступов, оценку изменений биоэлектрической активности головного мозга в момент развития приступа, локализацию эпилептиформной активности между приступами. Анализ всех данных выносили на консилиум до имплантации и после нее.
В случаях, когда собранных данных было недостаточно для определения границ ЭЗ, а предположение о фокальной природе приступов оставалось, эпилептолог составлял предимплантационную карту сЭЭГ на основании анатомо-электро-клинической гипотезы о локализации ЭЗ, полученной в результате неинвазивных обследований [23]. После обработки данных сЭЭГ вновь проводили консилиум, в ходе которого принимали решение о возможности и объеме хирургического вмешательства.
Информация об исходах хирургического лечения эпилепсии собрана при последующих визитах пациентов в центр или по телефону через 6, 12, 18 мес.
Стереоэлектроэнцефалография / Stereoelectroencephalography
Установку электродов осуществляли с помощью стереотаксической роботической станции ROSA ONE Brain (Zimmer Biomet Holdings, США, Швейцария) под общей анестезией. В обследовании использовали глубинные полугибкие платиноиридиевые мультиконтактные электроды (6–12 контактов, длина 2 мм, диаметр 0,8 мм, шаг 1,5 мм). Расположение каждого электрода и наличие осложнений в процессе имплантации оценивали на контрольной МРТ головного мозга, выполненной в 1-е сутки после имплантации. Более подробно процедура имплантации описана в работе А.А. Зуева и др. [24].
Исследование продолжалось до регистрации 2–3 типичных эпилептических приступов. Средняя длительность инвазивного мониторинга составила 7 сут (от 3 до 14 сут). Устанавливали от 5 до 16 электродов (в среднем 10,5 на пациента).
Исходы хирургического лечения, основанного на данных сЭЭГ, оценивали минимум через 12 мес после операции с использованием классификации J. Engel [25].
Этические аспекты / Ethical aspects
Исследование проведено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации ВМА (2013 г., Форталеза, Бразилия). У всех пациентов при поступлении в лечебное учреждение было взято информированное согласие на проведение диагностических и лечебных процедур в соответствии с законодательством Российской Федерации.
Методы статистического анализа / Methods of statistical analysis
Статистическую обработку результатов исследования выполняли с помощью программы Statistica 8.0 (StatSoft Inc., США). Использовали методы описательной статистики: вычисляли среднее значение и медиану, процентные значения.
РЕЗУЛЬТАТЫ / RESULTS
Локализация эпилептогенной зоны / Epileptogenic zone localization
У 16 (24,6%) пациентов выявлена лобная локализация ЭЗ, у 19 (29,2%) – височная, у 5 (7,7%) – теменная, у 3 (4,6%) – затылочная. Вовлечение в ЭЗ более одного анатомического региона определено у 22 (33,8%) больных (см. табл. 1).
По результатам сЭЭГ были прооперированы 49 (75,4%) пациентов. Отказано в резективном хирургическом лечении 16 (24,6%) больным из-за двусторонней локализации ЭЗ у 6 (37,5%) человек, отсутствия убедительных данных о расположении ЭЗ в 4 (25%) случаях и обнаружения ЭЗ в функционально значимой зоне у 6 (37,5%) больных. В последующем 7 (43,8%) пациентам этой группы был имплантирован стимулятор блуждающего нерва. Остальные больные отказались от стимуляционного лечения.
Исходы хирургического лечения / Outcomes of surgical treatment
Исходы хирургического лечения оценивали минимум через 12 мес после операции с помощью классификации J. Engel [25]. Катамнез изучен у 44 больных (табл. 2). С 5 пациентами связаться не удалось. Полное отсутствие приступов (I класс по классификации J. Engel) достигнуто в 27 (61,3%) случаях. В эту группу вошли 11 (40,7%) МР-негативных больных и 16 (59,3%) МР-позитивных. Редкие приступы (II класс) остались в 7 (15,9%) наблюдениях. Существенного снижения частоты приступов (III класс) удалось достигнуть у 4 (9,1%) пациентов. Несущественные улучшения после хирургического лечения (IV класс) были выявлены в 6 (13,6%) случаях.
Таблица 2. Исходы хирургического вмешательства по классификации J. Engel, n (%)
Table 2. Outcomes of surgery according to the Engel classification, n (%)
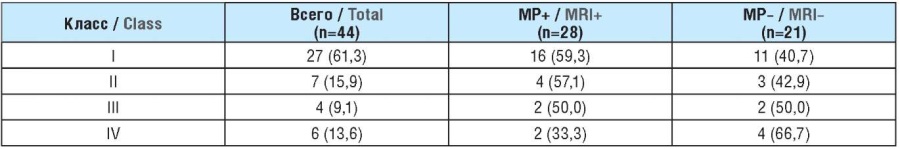
Примечание. МР+: магнитно-резонансно-позитивные; МР–: магнитно-резонансно-негативные.
Note. MRI+: magnetic-resonance-positive; MRI–: magnetic-resonance-negative.
Патоморфологическое обследование / Pathomorphological examination
Данные патоморфологического обследования приведены в таблице 3. Признаки фокальной кортикальной дисплазии (ФКД) I типа [26] обнаружены у 9 (18,4%) больных, ФКД II типа – у 26 (53,1%), ФКД III типа – у 5 (10,2%), дисэмбриопластической нейроэпителиальной опухоли (ДНЭО) – у 2 (4,1%). Отсутствие патологических изменений выявлено у 7 (14,3%) пациентов.
Таблица 3. Данные патоморфологического обследования (n=49)
Table 3. Pathomorphological examination data (n=49)
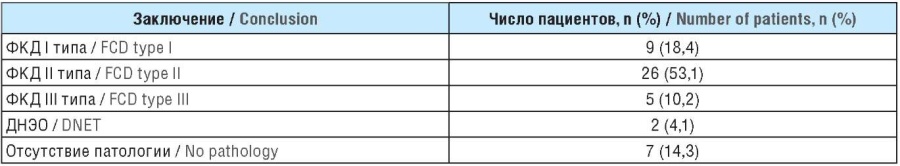
Примечание. ФКД – фокальная кортикальная дисплазия; ДНЭО – дисэмбриопластическая нейроэпителиальная опухоль.
Note. FCD – focal cortical dysplasia; DNET – dysembryoplastic neuroepithelial tumor
Среди разных патоморфологических групп исходы I класса по классификации J. Engel составили: ДНЭО – 2 случая, ФКД II типа – 23, без патоморфологической верификации – 2. Исходы II класса: ФКД I типа – 4 пациента, ФКД II типа – 2, ФКД III типа – 1. Исходы III класса: ФКД II типа – 1 больной, ФКД III типа – 1, без патологических изменений – 2. Исходы IV класса: ФКД I типа – 3 наблюдения, ФКД III типа – 3. Среди пациентов без катамнеза ФКД I типа выявлены в 2 случаях, без патологических изменений – в 3.
Осложнения / Complications
В результате проведения сЭЭГ осложнения развились у 3 (4,6%) пациентов. Геморрагические осложнения отмечены у 2 (3,1%) больных: по 1 (1,5%) случаю внутричерепной гематомы и субдуральной гематомы. Стойкого неврологического дефицита в последующем не отмечено. Кроме того, в 1 (1,5%) наблюдении развился бактериальный менингит.
Клинический случай / Case report
В качестве примера приведем клиническое наблюдение пациента П., 23 года.
Анамнез
Дебют эпилептических приступов произошел в 15 лет, когда появились приступы в виде остановки произвольной деятельности, иногда с эволюцией в билатеральные тонико-клонические. На фоне подбора противосудорожной терапии удалось добиться временной ремиссии в течение последующих 3,5 лет. Затем приступы возобновились с частотой до 6–8 раз в месяц. Фармакоанамнез: топирамат, вальпроевая кислота, ламотриджин, лакосамид. На момент обследования: леветирацетам 3000 мг/сут, карбамазепин 800 мг/сут.
МРТ и ЭЭГ
При МРТ головного мозга (3 Тл) по эпилептологическому протоколу убедительных данных за наличие структурных изменений головного мозга не получено. При видео-ЭЭГ-мониторинге зарегистрированы приступы из левого полушария головного мозга (рис. 1, а). Интериктальная активность выявлена в левой теменновисочной области (рис. 1, b).
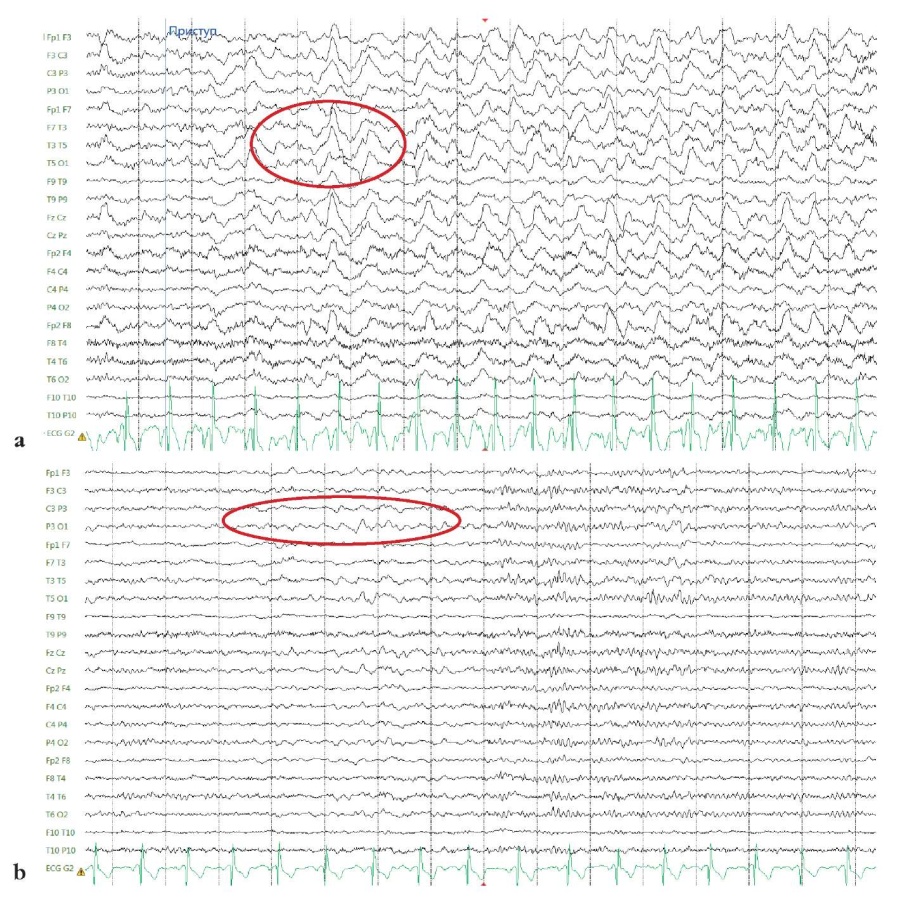
Рисунок 1. Пациент П., 23 года. Фрагменты электроэнцефалограммы. Биполярный монтаж по полушариям (double banana): a – начало приступа из сна, дельта-замедление в левой лобно-теменно-височной области, региональный акцент по левому полушарию; b – интериктальная активность, региональное дельта-замедление в левой теменно-височной области
Figure 1. Patient P., 23 years old. Fragments of an electroencephalogram. Hemispheric bipolar montage (double banana): a – the onset of seizure from sleep, delta slowing in the left fronto-parietal-temporal region, regional focus in the left hemisphere; b – interictal activity, regional delta slowing in the left parietotemporal region
В связи с отсутствием убедительных изменений по данным МРТ головного мозга пациенту имплантировано 12 стерео-ЭЭГ-электродов в левые теменную, височную, лобную, затылочную доли головного мозга для уточнения границ эпилептогенной зоны. Зарегистрировано три приступа с фокальным паттерном начала (рис. 2).
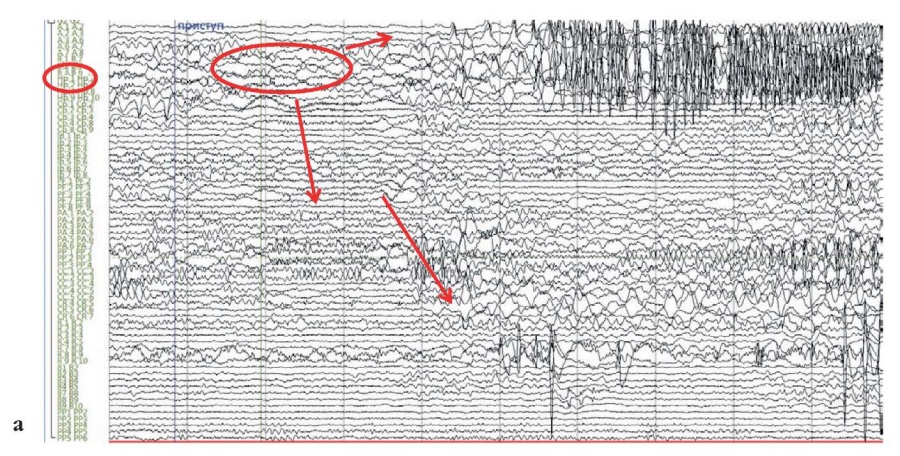
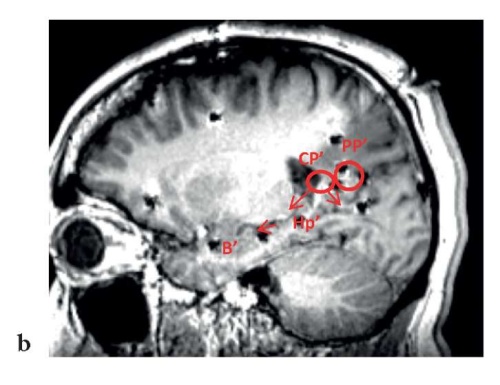
Рисунок 2. Пациент П., 23 года. Зоны начала и распространения паттерна эпилептического приступа на иктальном фрагменте стереоэлектроэнцефалограммы (a) и магнитно-резонансной томограммы (b) головного мозга. Появление низкоамплитудной быстроволновой активности под электродами CP’, PP’, расположенными в задних отделах левой поясной извилины, и быстрое распространение паттерна приступа на электроды, расположенные в левой височной доле
Figure 2. Patient P., 23 years old. Zones of the onset and spread of the epileptic seizure pattern on the ictal fragment of the stereoelectroencephalogram (a) and brain magnetic resonance image (b). The appearance of low-amplitude fast-wave activity under the CP', PP' electrodes located in the posterior sections of the left cingulate gyrus, and rapid spread of the seizure pattern to the electrodes located in the left temporal lobe
Хирургическое вмешательство
Пациенту выполена резекция коры вокруг теменнозатылочной борозды, задней половины парагиппокампальной извилины и гиппокампа (рис. 3). Данные гистологии отсутствуют. Исход I класса по классификации J. Engel. Катамнез 18 мес.
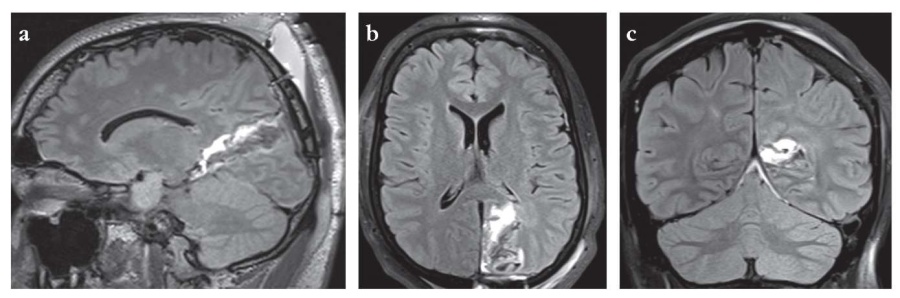
Рисунок 3. Пациент П., 23 года. Послеоперационные магнитно-резонансные томограммы головного мозга: сагиттальная (a), аксиальная (b) и коронарная (c) проекции. Режим FLAIR. Выполена резекция коры вокруг теменно-затылочной борозды, задней половины парагиппокампальной извилины и гиппокампа
Figure 3. Patient P., 23 years old. Postoperative brain magnetic resonance images: sagittal (a), axial (b) and coronal (c) projections. FLAIR mode. The cortex was resected around the parietal-occipital sulcus, the posterior half of parahippocampal gyrus, and hippocampus
ОБСУЖДЕНИЕ / DISCUSIION
Главная задача сЭЭГ – локализовать ЭЗ и определить ее границы. Данный метод исследования вносит весомый вклад в подтверждение того, что конкретные структуры являются эпилептогенными, запускают развитие приступов. Удаление этих структур предполагает высокую вероятность того, что оставшаяся часть мозга не будет вызывать приступов, а риск развития послеоперационного неврологического дефицита минимален.
Диагностический метод сЭЭГ следует рассматривать как дополнительный, когда данные семиологии или ЭЭГ не дают единой картины о локализации ЭЗ, когда предполагается, что изменения на МРТ имеют неэпилептическую природу или что ЭЗ больше, чем видимый субстрат на МРТ головного мозга [27]. Даже в случаях хирургического лечения самой распространенной формы эпилепсии (височной) у пациентов с признаками односторонней ЭЗ в височной доле часть больных не достигает контроля над приступами после операции [28][29].
В нашем исследовании оценивалась эффективность сЭЭГ в определении границ ЭЗ в МР-негативных и МРпозитивных случаях с множественным поражением вещества головного мозга или при расхождении данных неинвазивных методов обследования (см. табл. 2). Среди пациентов, проходивших прехирургическое обследование, включавшее сЭЭГ, и последующее хирургическое лечение эпилепсии по поводу лекарственно-устойчивой фокальной эпилепсии, в 61% случаев удалось достичь стойкой ремиссии эпилептических приступов, еще в 25% наблюдений отмечено сокращение еженедельных или ежемесячных приступов как минимум на 80%. По данным литературы, полного отсутствия приступов достигают от 50% до 88% больных [18][30][31]. На результаты влияют такие факторы, как критерии отбора пациентов, точность предимплантационной гипотезы, а также опыт в технике установки и интерпретации сЭЭГ.
В зависимости от природы видимых изменений на МРТ по-прежнему остается спорным вопрос о необходимости проведения сЭЭГ при определении границ резекции у МРпозитивных пациентов [32]. Например, согласно инвазивным исследованиям роль полимикрогирии в анатомофункциональной организации приступов аберрантна. В некоторых случаях полимикрогирия принимает участие в развитии эпилептичеcкого приступа лишь частично, а в некоторых может вовлекаться в эпилептическую сеть вторично [33]. Если полимикрогирия расположена в одном полушарии, сЭЭГ позволяет определить ее участие в организации ЭЗ и помогает локализовать границы будущей резекции, несмотря на широко распространенную аномалию на МРТ. В случае двусторонней полимикрогирии сЭЭГ может быть использована, если по результатам неинвазивных методов обследования есть основания предполагать одностороннюю локализацию ЭЗ [33–35].
В литературе описаны особенно сложные взаимоотношения между унилатеральной или билатеральной перивентрикулярной нодулярной гетеротопией и корой головного мозга, расположенной удаленно или над гетеротопией. По данным сЭЭГ, перивентрикулярная нодулярная гетеротопия может быть вовлечена в инициацию эпилептических приступов как изолированно, так и вместе с вышележащей корой. Кроме того, представлены случаи полного отсутствия патологической активности из зоны гетеротопии [36–38]. Этим фактом объясняются публикации о неудачном хирургическом лечении эпилепсии, ассоциированной с гетеротопиями [39].
При фармакорезистентной эпилепсии, связанной с множественными пороками развития, такими как туберозный склероз, множественные кавернозные ангиомы или множественные кортикальные дисплазии, может быть трудно определить, опираясь только на данные неинвазивных методов обследования, один или несколько очагов либо только часть одного МР-позитивного очага ответственны за возникновение приступов [40]. Наряду с этим нами, а также рядом авторов [41][42] было продемонстрировано, что ЭЗ при нейрональных опухолях, каверномах, фокальных кортикальных дисплазиях может не ограничиваться видимыми на МРТ границами. Образуются более крупные нейрональные сети с ЭЗ, распространяющейся за пределы поражения.
В нашем исследовании среди прооперированных МРнегативных пациентов (с отслеженным катамнезом) у 70% отмечено существенное снижение частоты приступов (I–II классы по J. Engel). Результаты хирургического лечения в группе МР-позитивных больных (с отслеженным катамнезом) оказались несколько выше: в 83,6% случаев достигнуто существенное снижение частоты приступов (I–II классы). Полученные нами данные в целом схожи с исходами хирургического лечения фармакорезистентной фокальной эпилепсии по результатам сЭЭГ, описанными в мировой литературе [14][43][ 44]. В ретроспективном анализе 215 пациентов в возрасте от 2 до 56 лет, которым была проведена сЭЭГ для уточнения границ эпилептогенной зоны, 165 (87%) больным в последующем выполнено хирургическое лечение эпилепсии. Среди них у 56,4% отмечен исход I класса по J. Engel (катамнез не менее 1 года) [43]. В публикации М. Guenot et al. [45] из 100 пациентов сЭЭГ помогла спланировать объем резекции и определить границы эпилептогенной зоны у 84% больных, в т.ч. у 14% МР-негативных, прооперировать которых без сЭЭГ было бы невозможно. F. Chassoux et al. [46] опубликовали результаты хирургического лечения эпилепсии при ФКД II типа: исходы I класса по J. Engel достигнуты в 88% случаев среди МР-негативных пациентов и в 94% случаев среди МР-позитивных. В МРнегативных случаях сЭЭГ, спланированная после ПЭТ, позволила ограничить резекцию одной извилиной более чем у половины больных.
В публикациях о результатах хирургического лечения эпилепсии после инвазивного мониторинга с использованием субдуральных электродов [47][48] исходы в МРнегативной группе пациентов менее благоприятны по сравнению с МР-позитивной группой. Этого и следовало ожидать, поскольку метод имеет ограничения в локализации эпилептогенной зоны, расположенной в глубинных отделах головного мозга.
Что касается частоты осложнений в результате проведения сЭЭГ или длительного сЭЭГ-мониторинга, по данным разных авторов она составляет от 0% до 7,5% [49]. Наиболее часто в результате сЭЭГ развиваются геморрагические осложнения. Некоторые исследователи описывают также появление стойкого неврологического дефицита после процедуры [17]. В нашей работе геморрагические осложнения выявлены в 3,1% случаев. У 1 (1,5%) пациента развилось инфекционное осложнение. Общая доля осложнений составила 4,6%. Однако к отдаленному стойкому неврологическому дефициту ни одно из них не привело.
Благодарности / Acknowledgments
Коллектив авторов выражает благодарность всему нейрохирургическому отделению ФГБУ «Национальный медико-хирургический центр им. Н.И. Пирогова» Минздрава России за вклад в подготовку данной статьи. Авторы также благодарят анонимных рецензентов за полезные комментарии и предложения.
ЗАКЛЮЧЕНИЕ / CONCLUSION
По результатам проведенного исследования, хирургическое лечение фармакорезистентной фокальной эпилепсии, основанное на данных cЭЭГ, в 55% случаев избавляет пациентов от приступов, а еще в 14% наблюдений существенно сокращает их количество. Риск хирургических осложнений при проведении cЭЭГ составляет 4,6%.
Таким образом, cЭЭГ является высокоэффективным и безопасным методом верификации эпилептогенной зоны у пациентов, которым неинвазивными методами ее выявить не удалось. Без данного обследования им было бы отказано в хирургическом лечении эпилепсии.
Список литературы
1. Remy S., Beck H. Molecular and cellular mechanisms of pharmacoresistance in epilepsy. Brain. 2006; 129 (Pt. 1): 18–35. https://doi.org/10.1093/brain/awh682.
2. Mula M., Cock H.R. More than seizures: improving the lives of people with refractory epilepsy. Eur J Neurol. 2015; 22 (1): 24–30. https://doi.org/10.1111/ene.12603.
3. Wiebe S., Blume W.T., Girvin J.P., Eliasziw M. A randomized, controlled trial of surgery for temporal-lobe epilepsy. N Engl J Med. 2001; 345 (5): 311–8. https://doi.org/10.1056/NEJM200108023450501.
4. Крылов В.В., Гехт А.Б., Трифонов И.С. Исходы хирургического лечения пациентов с фармакорезистентными формами эпилепсии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2016; 116 (9-2): 13–8. https://doi.org/10.17116/jnevro20161169213-18.
5. Dwivedi R., Ramanujam B., Chandra P.S., et al. Surgery for drugresistant epilepsy in children. N Engl J Med. 2017; 377 (17): 1639–47. https://doi.org/10.1056/NEJMoa1615335.
6. Bancaud J., Talairach J. Epilepsy of the supplementary motor area: a particularly difficult diagnosis in children. Rev Neuropsychiatr Infant. 1965; 13 (6): 483–99 (на фр. яз.).
7. Lüders H.O., Engel J. Jr., Munari C. General principles. In: Engel J. Jr. (Ed.) Surgical treatment of the epilepsies. 2nd ed. New York, NY: Raven Press, Ltd; 1993: 137–53.
8. Duncan J.S. Selecting patients for epilepsy surgery: synthesis of data. Epilepsy Behav. 2011; 20 (2): 230–2. https://doi.org/10.1016/j.yebeh.2010.06.040.
9. Ryvlin P., Cross J.H., Rheims S. Epilepsy surgery in children and adults. Lancet Neurol. 2014; 13 (11): 1114–26. https://doi.org/10.1016/S1474-4422(14)70156-5.
10. Thadani V.M., Williamson P.D., Berger R., et al. Successful epilepsy surgery without intracranial EEG recording: criteria for patient selection. Epilepsia. 1995; 36 (1): 7–15. https://doi.org/10.1111/j.1528-1157.1995.tb01658.x.
11. Kilpatrick C., Cook M., Kaye A., et al. Non-invasive investigations successfully select patients for temporal lobe surgery. J Neurol Neurosurg Psychiatry. 1997; 63 (3): 327–33. https://doi.org/10.1136/jnnp.63.3.327.
12. Diehl B., Lüders H.O. Temporal lobe epilepsy: when are invasive recordings needed? Epilepsia. 2000; 41 (Suppl. 3): S61–74. https://doi.org/10.1111/j.1528-1157.2000.tb01536.x.
13. Chapman K., Wyllie E., Najm I., et al. Seizure outcome after epilepsy surgery in patients with normal preoperative MRI. J Neurol Neurosurg Psychiatry. 2005; 76 (5): 710–3. https://doi.org/10.1136/jnnp.2003.026757.
14. McGonigal A., Bartolomei F., Régis J., et al. Stereoelectroencephalography in presurgical assessment of MRInegative epilepsy. Brain. 2007; 130 (Pt. 12): 3169–83. https://doi.org/10.1093/brain/awm218.
15. Jayakar P., Gotman J., Harvey A.S., et al. Diagnostic utility of invasive EEG for epilepsy surgery: indications, modalities, and techniques. Epilepsia. 2016; 57 (11): 1735–47. https://doi.org/10.1111/epi.13515.
16. Fountas K.N. Implanted subdural electrodes: safety issues and complication avoidance. Neurosurg Clin N Am. 2011; 22 (4): 519–31, vii. https://doi.org/10.1016/j.nec.2011.07.009.
17. Cardinale F., Cossu M., Castana L., et al. Stereoelectroencephalography: surgical methodology, safety, and stereotactic application accuracy in 500 procedures. Neurosurgery. 2013; 72 (3): 353–66. https://doi.org/10.1227/NEU.0b013e31827d1161.
18. González-Martínez J., Bulacio J., Thompson S., et al. Technique, results, and complications related to robot-assisted stereoelectroencephalography. Neurosurgery. 2016; 78 (2): 169–80. https://doi.org/10.1227/NEU.0000000000001034.
19. Bourdillon P., Ryvlin P., Isnard J., et al. Stereotactic electroencephalography is a safe procedure, including for insular implantations. World Neurosurg. 2017; 99: 353–61. https://doi.org/10.1016/j.wneu.2016.12.025.
20. von Oertzen T.J., Mormann F., Urbach H., et al. Prospective use of subtraction ictal SPECT coregistered to MRI (SISCOM) in presurgical evaluation of epilepsy. Epilepsia. 2011; 52 (12): 2239–48. https://doi.org/10.1111/j.1528-1167.2011.03219.x.
21. Chen T., Guo L. The role of SISCOM in preoperative evaluation for patients with epilepsy surgery: a meta-analysis. Seizure. 2016; 41: 43–50. https://doi.org/10.1016/j.seizure.2016.06.024.
22. Карпов О.Э., Бронов О.Ю., Вахромеева М.Н. и др. Протокол SISCOM в диагностике эпилепсии (первые данные). Вестник национального медико-хирургического центра им. Н.И. Пирогова. 2018; 13 (3): 75–8. https://doi.org/10.25881/BPNMSC.2018.33.29.016.
23. Chassoux F., Navarro V., Catenoix H., et al. Planning and management of SEEG. Neurophysiol Clin. 2018; 48 (1): 25–37. https://doi.org/10.1016/j.neucli.2017.11.007.
24. Зуев А.А., Головтеев А.Л., Педяш Н.В. и др. Возможности хирургического лечения фармакорезистентной эпилепсии с использованием робот-ассистированной имплантации глубинных электродов для проведения инвазивной стереоэлектроэнцефалографии. Нейрохирургия. 2020; 22 (1): 12–20. https://doi.org/10.17650/1683-3295-2020-22-1-12-20.
25. Engel J. Jr., Van Ness P.C., Rasmussen T.B., Ojemann L.M. Outcome with respect to epileptic seizures. In: Engel J. Jr. (Ed.) Surgical treatment of the epilepsies. 2nd ed. New York, NY: Raven Press; 1993: 609–21.
26. Blümcke I., Thom M., Aronica E., et al. The clinicopathologic spectrum of focal cortical dysplasias: a consensus classification proposed by an ad hoc Task Force of the ILAE Diagnostic Methods Commission. Epilepsia. 2011; 52 (1): 158–74. https://doi.org/10.1111/j.1528-1167.2010.02777.x.
27. Téllez-Zenteno J.F., Hernández Ronquillo L., Moien-Afshari F., Wiebe S. Surgical outcomes in lesional and non-lesional epilepsy: a systematic review and meta-analysis. Epilepsy Res. 2010; 89 (2-3): 310–8. https://doi.org/10.1016/j.eplepsyres.2010.02.007.
28. Engel J. Jr., McDermott M.P., Wiebe S., et al. Early surgical therapy for drug-resistant temporal lobe epilepsy: a randomized trial. JAMA. 2012; 307 (9): 922–30. https://doi.org/10.1001/jama.2012.220.
29. Jobst B.C., Cascino G.D. Resective epilepsy surgery for drug-resistant focal epilepsy: a review. JAMA. 2015; 313 (3): 285–93. https://doi.org/10.1001/jama.2014.17426.
30. Vadera S., Mullin J., Bulacio J., et al. Stereoelectroencephalography following subdural grid placement for difficult to localize epilepsy. Neurosurgery. 2013; 72 (5): 723–9. https://doi.org/10.1227/NEU.0b013e318285b4ae.
31. Serletis D., Bulacio J., Bingaman W., et al. The stereotactic approach for mapping epileptic networks: a prospective study of 200 patients. J Neurosurg. 2014; 121 (5): 1239–46. https://doi.org/10.3171/2014.7.JNS132306.
32. Jehi L.E., Silveira D.C., Bingaman W., Najm I. Temporal lobe epilepsy surgery failures: predictors of seizure recurrence, yield of reevaluation, and outcome following reoperation. J Neurosurg. 2010; 113 (6): 1186–94. https://doi.org/10.3171/2010.8.JNS10180.
33. Ramantani G., Koessler L., Colnat-Coulbois S., et al. Intracranial evaluation of the epileptogenic zone in regional infrasylvian polymicrogyria. Epilepsia. 2013; 54 (2): 296–304. https://doi.org/10.1111/j.1528-1167.2012.03667.x.
34. Chassoux F., Landre E., Rodrigo S., et al. Intralesional recordings and epileptogenic zone in focal polymicrogyria. Epilepsia. 2008; 49 (1): 51–64. https://doi.org/10.1111/j.1528-1167.2007.01267.x.
35. Maillard L., Koessler L., Colnat-Coulbois S., et al. Combined SEEG and source localisation study of temporal lobe schizencephaly and polymicrogyria. Clin Neurophysiol. 2009; 120 (9): 1628–36. https://doi.org/10.1016/j.clinph.2009.06.022.
36. Scherer C., Schuele S., Minotti L., et al. Intrinsic epileptogenicity of an isolated periventricular nodular heterotopia. Neurology. 2005; 65 (3): 495–6. https://doi.org/10.1212/01.wnl.0000172350.25380.c7.
37. Tassi L., Colombo N., Cossu M., et al. Electroclinical, MRI and neuropathological study of 10 patients with nodular heterotopia, with surgical outcomes. Brain. 2005; 128 (Pt. 2): 321–37. https://doi.org/10.1093/brain/awh357.
38. Pizzo F., Roehri N., Catenoix H., et al. Epileptogenic networks in nodular heterotopia: a stereoelectroencephalography study. Epilepsia. 2017; 58 (12): 2112–23. https://doi.org/10.1111/epi.13919.
39. Valton L., Guye M., McGonigal A., et al. Functional interactions in brain networks underlying epileptic seizures in bilateral diffuse periventricular heterotopia. Clin Neurophysiol. 2008; 119 (1): 212–23. https://doi.org/10.1016/j.clinph.2007.09.118.
40. Curatolo P., Jóźwiak S., Nabbout R. Management of epilepsy associated with tuberous sclerosis complex (TSC): clinical recommendations. Eur J Paediatr Neurol. 2012; 16 (6): 582–6. https://doi.org/10.1016/j.ejpn.2012.05.004.
41. Aubert S., Wendling F., Regis J., et al. Local and remote epileptogenicity in focal cortical dysplasias and neurodevelopmental tumours. Brain. 2009; 132 (Pt. 11): 3072–86. https://doi.org/10.1093/brain/awp242.
42. Sevy A., Gavaret M., Trebuchon A., et al. Beyond the lesion: the epileptogenic networks around cavernous angiomas. Epilepsy Res. 2014; 108 (4): 701–8. https://doi.org/10.1016/j.eplepsyres.2014.02.018.
43. Cossu M., Cardinale F., Castana L., et al. Stereoelectroencephalography in the presurgical evaluation of focal epilepsy: a retrospective analysis of 215 procedures. Neurosurgery. 2005; 57 (4): 706–18.
44. Shi J., Lacuey N., Lhatoo S. Surgical outcome of MRI-negative refractory extratemporal lobe epilepsy. Epilepsy Res. 2017; 133: 103–8. https://doi.org/10.1016/j.eplepsyres.2017.04.010.
45. Guenot M., Isnard J., Ryvlin P., et al. Neurophysiological monitoring for epilepsy surgery: the Talairach SEEG method. Indications, results, complications and therapeutic applications in a series of 100 consecutive cases. Stereotact Funct Neurosurg. 2001; 77 (1-4): 29–32. https://doi.org/10.1159/000064595.
46. Chassoux F., Landré E., Mellerio C., et al. Type II focal cortical dysplasia: electroclinical phenotype and surgical outcome related to imaging. Epilepsia. 2012; 53 (2): 349–58. https://doi.org/10.1111/j.1528-1167.2011.03363.x.
47. Nair D.R., Burgess R., McIntyre C.C., Lüders H. Chronic subdural electrodes in the management of epilepsy. Clin Neurophysiol. 2008; 119 (1): 11–28. https://doi.org/10.1016/j.clinph.2007.09.117.
48. Bulacio J.C., Jehi L., Wong C., et al. Long-term seizure outcome after resective surgery in patients evaluated with intracranial electrodes. Epilepsia. 2012; 53 (10): 1722–30. https://doi.org/10.1111/j.1528-1167.2012.03633.x.
49. Mullin J.P., Shriver M., Alomar S., et al. Is SEEG safe? A systematic review and meta-analysis of stereo-electroencephalography-related complications. Epilepsia. 2016; 57 (3): 386–401. https://doi.org/10.1111/epi.13298.
Об авторах
А. С. БалацкаяРоссия
Балацкая Александра Сергеевна – невролог отделения нейрохирургии
Москва
Н. В. Педяш
Россия
Педяш Никита Витальевич – нейрохирург отделения нейрохирургии
Москва
РИНЦ SPIN-код: 4659-3419.
А. Л. Головтеев
Россия
Головтеев Александр Леонидович – невролог
Москва
Н. А. Калыбаева
Россия
Калыбаева Назгуль Ашимбековна – невролог
Москва
Н. П. Утяшев
Россия
Утяшев Никита Павлович – невролог отделения нейрохирургии
Москва
М. А. Одениязова
Россия
Одениязова Мадина Анварбековна – невролог отделения нейрохирургии
Москва
О. Ю. Бронов
Россия
Бронов Олег Юрьевич – к.м.н., заведующий отделением рентгенорадиологии
Москва
Scopus Author ID: 57215892759;
РИНЦ SPIN-код: 7429-7993.
А. А. Зуев
Россия
Зуев Андрей Александрович – к.м.н., нейрохирург, заведующий отделением нейрохирургии
Москва
РИНЦ SPIN-код: 9377-4574.
Рецензия
Для цитирования:
Балацкая А.С., Педяш Н.В., Головтеев А.Л., Калыбаева Н.А., Утяшев Н.П., Одениязова М.А., Бронов О.Ю., Зуев А.А. Стереоэлектроэнцефалография в прехирургическом обследовании пациентов с фармакорезистентной фокальной эпилепсией. Эпилепсия и пароксизмальные состояния. 2022;14(2):183-194. https://doi.org/10.17749/2077-8333/epi.par.con.2022.090
For citation:
Balatskaya A.S., Pedyash N.V., Golovteev A.L., Kalybaeva N.A., Utyashev N.P., Odeniyazova M.A., Bronov O.Yu., Zuev A.A. Stereoelectroencephalography in pre-surgical evaluation of patients with drug-resistant focal epilepsy. Epilepsy and paroxysmal conditions. 2022;14(2):183-194. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.090

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































