Перейти к:
Роль экспрессии глутамин-синтетазы и транспортера цистин/глутамата (SLC7A11, xCT) в патогенезе развития эпилепсии у пациентов с супратенториальными глиомами головного мозга
https://doi.org/10.17749/2077-8333/epi.par.con.2022.118
Аннотация
Актуальность. Эпилептические приступы являются одним из ведущих клинических проявлений глиальных опухолей головного мозга и развиваются в среднем в 51% случаев. Эпилептогенез при глиомах достаточно сложный и многофакторный.
Цель: изучить роль экспрессии фермента глутамин-синтетазы, а также цистин-глутаматного переносчика (системы xCT, SLC7A11) в патогенезе развития эпилепсии у пациентов с глиомами головного мозга.
Материал и методы. В исследование включены 32 пациента с глиомами головного мозга супратенториальной локализации. Средний возраст начала заболевания (постановки диагноза) составил 50,69±18,01 года. Все больные проходили стационарное обследование и лечение в клиниках нейрохирургии и нервных болезней Военно-медицинской академии им. С.М. Кирова в период с 2018 по 2020 гг. Во всех случаях выполнено взятие биопсийного материала ткани опухоли. Проводились гистологическое и иммуногистохимическое исследования (экспрессия глутамин-синтетазы и транспортера цистин/глутамата (SLC7A11, xCT)).
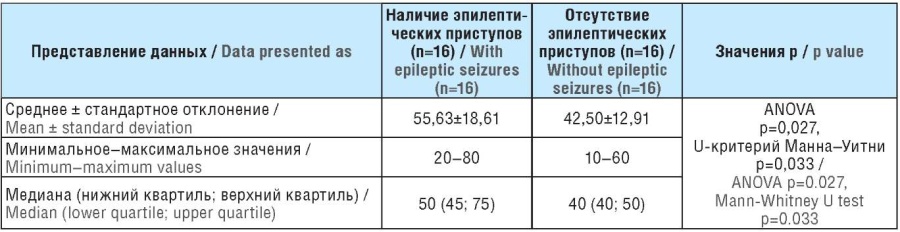
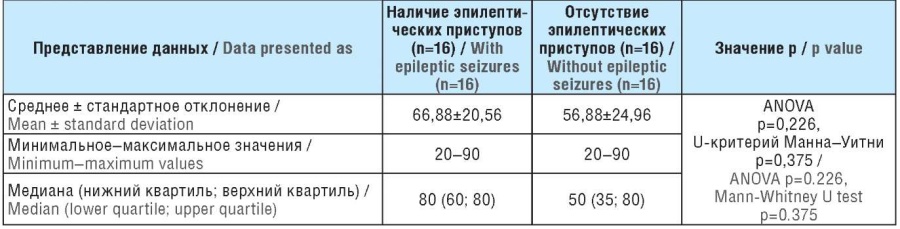
Результаты. Получены статистически значимые (ANOVA p=0,027, U-критерий Манна–Уитни p=0,033) различия в экспрессии цистин-глутаматного переносчика (система xCT, SLC7A11). Значения медианы (нижнего квартиля; верхнего квартиля): 50% (45; 75) в группе пациентов с наличием приступов, 40% (40; 50) в группе с отсутствием приступов. Уровень экспрессии глутамин-синтетазы статистически значимо не отличался в группах больных с наличием и отсутствием приступов.
Заключение. Полученные данные подтвердили, что одним из патогенетических механизмов развития эпилепсии у пациентов с глиомами головного мозга является высокая экспрессия цистин-глутаматного переносчика (система xCT, SLC7A11) и, как следствие, повышение внеклеточного уровня глутамата.
Ключевые слова
Для цитирования:
Прокудин М.Ю., Мартынов Б.В., Яковенко А.И., Литвиненко И.В., Лобзин В.Ю., Свистов Д.В., Чирский В.С., Чемодакова К.А., Клиценко О.А. Роль экспрессии глутамин-синтетазы и транспортера цистин/глутамата (SLC7A11, xCT) в патогенезе развития эпилепсии у пациентов с супратенториальными глиомами головного мозга. Эпилепсия и пароксизмальные состояния. 2022;14(2):204-213. https://doi.org/10.17749/2077-8333/epi.par.con.2022.118
For citation:
Prokudin M.Yu., Martynov B.V., Yakovenko A.I., Litvinenko I.V., Lobzin V.Yu., Svistov D.V., Chirskiy V.S., Chemodakova K.A., Klitsenko O.А. The role of glutamine synthetase expression and cystine/glutamate transporter (SLC7A11, xCT) in epilepsy pathogenesis of patients with supratentorial brain gliomas. Epilepsy and paroxysmal conditions. 2022;14(2):204-213. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.118
ВВЕДЕНИЕ / INTRODUCTION
Заболеваемость раком и смертность от него быстро увеличивается во всем мире. По оценкам Всемирной организации здравоохранения в 2015 г. рак выступал ведущей (1-е и 2-е места) причиной смертности у лиц в возрасте до 70 лет в 91 из 172 стран мира. Во всем мире в 2018 г. было выявлено около 18,1 млн новых случаев рака и 9,6 млн летальных случаев. Из них опухоли головного мозга и нервной системы составили 296 851 случай (1,6%), а умерли от них 241 037 человек (2,5%) [1].
Среди опухолей головного мозга и других новообразований центральной нервной системы нейроэпителиальные опухоли составляют 27,7%. Астроцитарные опухоли (пилоцитарная астроцитома, анапластическая астроцитома, диффузная астроцитома, глиобластома, другие глиомы) составляют 76,4% всех глиом. Среди злокачественных опухолей глиобластомы являются наиболее распространенными (48,3% случаев), среди глиом головного мозга они составляют 57,3% [2].
Эпилептические приступы являются одним из ведущих клинических проявлений глиальных опухолей головного мозга и возникают в среднем в 51% случаев. К факторам, которые оказывают влияние на их развитие, относятся возраст пациента, гистологическая характеристика опухоли, степень злокачественности, локализация и распространенность онкологического процесса, вовлечение коры головного мозга [3].
В литературе используется термин «опухоль-ассоциированная эпилепсия», которая определяется как эпилептические приступы, напрямую вызванные наличием глиомы головного мозга супратенториальной локализации [4]. Выделение термина «опухоль-ассоциированная эпилепсия» связано, в частности, и со специфическими патогенетическими механизмами развития эпилептических приступов, характерных для глиом головного мозга.
Патогенез развития эпилепсии при глиомах головного мозга достаточно сложен, включает отек и ишемические изменения вокруг опухоли, изменение pH, перестройку в нейрональных и глиальных ионных каналах, изменение экспрессии транспортных белков, нейродегенерацию и дисбаланс между возбуждающими и ингибиторными медиаторными системами, осуществляемый посредством изменения концентрации глутамата и гамма-аминомасляной кислоты [4]. Важную роль в развитии эпилептогенеза при глиомах головного мозга отводят именно нарушению гомеостаза глутамата [5]. В этой связи актуальна оценка в ткани опухоли экспрессии глутамин-синтетазы (внутриклеточного астроцитарного фермента, осуществляющего метаболизм глутамата в глютамин), а также экспрессии цистин-глутаматного переносчика (система xCT, SLC7A11), который осуществляет выведение глутамата из глиальной клетки.
Цель – изучить роль экспрессии фермента глутаминсинтетазы, а также экспрессии цистин-глутаматного переносчика (системы xCT, SLC7A11) в патогенезе развития эпилепсии у пациентов с глиомами головного мозга.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
В проспективное наблюдательное сравнительное исследование включены 32 пациента с глиомами головного мозга супратенториальной локализации. Возраст начала заболевания составлял от 18 до 81 года (медиана 53,5 года). Все пациенты проходили стационарное обследование и лечение в клиниках нейрохирургии и нервных болезней ФГБВОУ ВО «Военно-медицинская академия им. С.М. Кирова» Минобороны России в период с 2018 по 2020 гг.
Критерии включения и исключения / Inclusion and exclusion criteria
Критериями включения являлись:
- возраст 18 лет и старше;
- опухоли головного мозга, гистологическая характеристика которых соответствует диффузным астроцитомам и олигодендроглиомам.
Критерии исключения:
- возраст младше 18 лет;
- опухоли головного мозга, гистологическая характеристика которых соответствует другим астроцитарным, эпендимарным опухолям, другим глиомам, опухолям сосудистого сплетения, нейрональным и смешанным нейронально-глиальным, опухолям пинеальной области, эмбриональным, опухолям черепных и спинальных нервов, менингиомам, мезенхимальным, неменинготелиальным опухолям, меланоцитарным опухолям, лимфомам, гистиоцитарным, герминогенным опухолям, опухолям области турецкого седла, метастатическим опухолям головного мозга;
- отсутствие гистологического подтверждения диагноза.
Этические аспекты / Ethical aspects
Исследование проведено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации Всемирной медицинской ассоциации (2013 г., Форталеза, Бразилия) и одобрено этическим комитетом (протокол от 21 февраля 2017 г. № 186). Все пациенты подписали информированное согласие на лечение и использование данных в научной работе.
МРТ / MRI examination
Всем пациентам выполнена магнитно-резонансная томография головного мозга на аппарате Magnetom Symphony с напряженностью магнитного поля 1,5 Тл (Siemens, Германия). Локализация новообразования соответствовала лобной доле головного мозга у 18 (56,25%) больных, височной доле – у 14 (43,75%), затылочной – у 2 (6,25%), островковой – у 8 (25%), теменной – у 8 (25%), проводящим путям – у 3 (9,38%). Изолированное поражение одной доли головного мозга наблюдалось в 17 случаях (53,13%), поражение двух и более долей – в 15 (46,88%). По латерализации: правое полушарие было вовлечено у 10 (31,25%) пациентов, левое – у 20 (62,50%), двустороннее поражение отмечено у 2 (6,25%) больных.
Хирургическое лечение / Surgery
Всем пациентам проведено хирургическое лечение: костно-пластическая трепанация черепа, микрохирургическое удаление опухоли – в 30 случаях (93,75%), костно-пластическая трепанация черепа, парциальное удаление опухоли с последующей стереотаксической криодеструкцией – в 1 (3,13%), стереотаксическая биопсия и криодеструкция опухоли – в 1 (3,13%). Во всех случаях выполнено взятие биопсийного материала ткани опухоли для гистологического и иммуногистохимического исследования.
Гистологическое исследование / Histological study
Материал при получении в лаборатории описывали и измеряли, затем предварительно фиксировали в течение 16–24 ч в 10% забуференном нейтральном формалине. Далее проводили вырезку: для исследования забирали фрагменты ткани размерами 1,5×1,5×0,3 см, укладывали в гистологические кассеты стандартного размера, в которых фиксировали в течение 24 ч. Затем материал проводили в гистологическом процессоре вакуумного типа Tissue-Tek VIP6 AI (Sakura, Япония) по программе из 9 циклов с абсолютизированным изопропиловым спиртом, 10% забуференным нейтральным формалином и парафином. Для формирования гистологического блока материал заливали в парафин с использованием заливочной станции. Далее с готовых парафиновых блоков изготавливали срезы толщиной 4–5 мкм на полуавтоматическом роторном микротоме RM2255 (Leica, Германия), которые окрашивали гематоксилином и эозином.
Изготовленные срезы изучали в светлом поле с использованием микроскопа Eclipse Ni (Nikon, Япония).
Иммуногистохимическое исследование / Immunohistochemical study
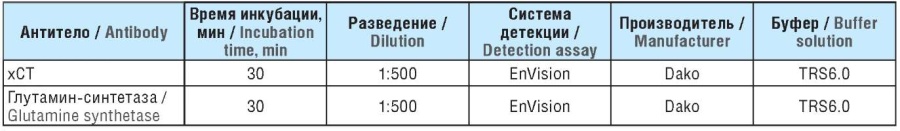
На микротоме изготавливали срезы толщиной 4–5 мкм и высушивали их в термостате при 37 °С. Высушенные срезы прогревали в термостате при температуре 60 °С в течение 30 мин, затем подвергали депарафинизации и дегидратации в абсолютизированном этиловом спирте. Ингибирование активности эндогенной пероксидазы осуществляли в растворе 3% перекиси водорода в течение 6 мин. Термическую демаскировку антигенов выполняли в модуле предподготовки PTLink (Dako, Дания) в цитратном буфере с рН 6 при температуре 95– 99 °С в течение 20 мин. Срезы остужали при комнатной температуре и помещали в дистиллированную воду, затем в промывочный буфер, далее инкубировали с первичными антителами в течение 1 ч при 20 °С. После этого срезы промывали в промывочном буфере трижды и инкубировали с вторичными антителами и стрептавидин-пероксидазным комплексом в составе соответствующей системы детекции согласно инструкции. Далее срезы промывали в буфере и проявляли при помощи раствора диаминобензидина в субстратном буфере, проводили по батарее из 4 спиртов и 2 ксилолов и заключали под покровное стекло (табл. 1).
Таблица 1. Характеристика использованных антител
Table 1. Characteristics of the applied antibodies
Результаты иммуногистохимического исследования (окрашивания) оценивали в светлом поле с использованием микроскопа Eclipse Ni (Nikon, Япония).
Статистический анализ / Statistical analysis
Статистический анализ полученных клинических данных выполняли средствами системы Statistica (версия 10) (StatSoft Inc., США). Сравнение количественных параметров (экспрессия цистин-глутаматного переносчика и глутамин синтетазы) в группах пациентов осуществляли с использованием критериев Манна–Уитни, Колмогорова–Смирнова, медианного χ2 по критерию Манна–Уитни, т.к. распределение всех показателей (за исключением возраста) не соответствовало нормальному.
РЕЗУЛЬТАТЫ / RESULTS
Клинико-инструментальная характеристика пациентов / Clinical and instrumental characteristics of patients
Клинический симптомокомплекс у пациентов с глиомами головного мозга был представлен следующими синдромами и симптомами: эпилептические приступы у 16 (50%) больных, головная боль – у 11 (34,38%), пирамидный синдром – у 9 (28,13%), нарушение речи – у 9 (28,13%), астенические проявления – у 9 (28,13%), гемианопсия – у 5 (15,63%), мозжечковый синдром – у 4 (12,5%), рассеянная неврологическая симптоматика – у 4 (12,5%), тошнота и рвота – у 3 (9,38%), поражение черепных нервов – у 3 (9,38%), нарушения чувствительности – у 1 (3,13%).
В зависимости от факта наличия эпилепсии и эпилептических приступов пациенты были распределены на две группы по 16 человек (50%) – с наличием и отсутствием эпилептических приступов. При этом эпилептические приступы являлись единственным клиническим проявлением заболевания в 8 случаях (25%). По клинической семиологии в группе больных эпилепсией приступы были представлены: фокальными с сохранной осознанностью (моторные, сенсорные, вкусовые, обонятельные, слуховые галлюцинации, афатические, головокружение, вегетативно-висцеральные) у 11 (84,62%) пациентов, фокальными с нарушением осознанности (когнитивными) – у 1 (7,69%), билатеральными тоникоклоническими с фокальным началом – у 9 (69,23%). По частоте приступов больные были распределены следующим образом: однократный приступ – 3 (18,75%), редкие (менее 1 раза в месяц) – 6 (37,5%), частые (1 раз в месяц и более) – 3 (18,75%), очень частые (более 1 раза в неделю) – 4 (25%). Диагноз эпилепсии подтвержден по результатам электроэнцефалографии.
Морфолого-генетическое исследование / Morphological and genetic study
Гистологическая характеристика была представлена следующими типами глиальных опухолей головного мозга: диффузная астроцитома – 5 (15,63%) пациентов (IDH1/2 положительная мутация – 1, IDH1/2 отрицательная мутация – 1, без дополнительного уточнения (БДУ) – 3), анапластическая астроцитома – 7 (21,86%) (IDH1/2 положительная мутация – 2, IDH1/2 отрицательная мутация – 1, БДУ – 4), глиобластома – 16 (50%) (IDH1/2 положительная мутация – 1, IDH1/2 отрицательная мутация – 2, БДУ – 13), олигодендроглиома – 4 (12,5%) (IDH1/2 положительная мутация, 1p/19q положительная – 3, БДУ – 1). По степени злокачественности: grade II – 9 (28,13%) больных, grade III – 7 (21,89%), grade IV – 16 (50%).
Результаты оценки экспрессии цистин-глутаматного переносчика (системы xCT, SLC7A11) в группах с наличием эпилептических приступов (эпилепсией, однократным приступом) и отсутствием приступов у пациентов с глиомами головного мозга супратенториальной локализации представлены в таблице 2.
Таблица 2. Экспрессия цистин-глутаматного переносчика (система xCT, SLC7A11) у пациентов с глиомами головного мозга с наличием и отсутствием эпилептических приступов, %
Table 2. Cystine/glutamate transporter (SLC7A11, xCT) expression in patients with brain gliomas with/without seizures, %
Результаты оценки экспрессии глутамин-синтетазы у пациентов с глиомами головного мозга с наличием и отсутствием эпилептических приступов отражены в таблице 3.
Таблица 3. Экспрессия глутамин-синтетазы у пациентов с глиомами головного мозга с наличием и отсутствием эпилептических приступов, %
Table 3. Glutamine synthetase expression in patients with brain gliomas with/without seizures, %
Наиболее показательные изменения экспрессии глутамин-синтетазы и цистин-глутаматного переносчика (системы xCT, SLC7A11) показаны на примере больного с глиобластомой правой затылочной доли с отсутствием эпилептических приступов (рис. 1–3), а также больной с анапластической астроцитомой левой теменной доли со структурной теменной эпилепсией (рис. 4–6).
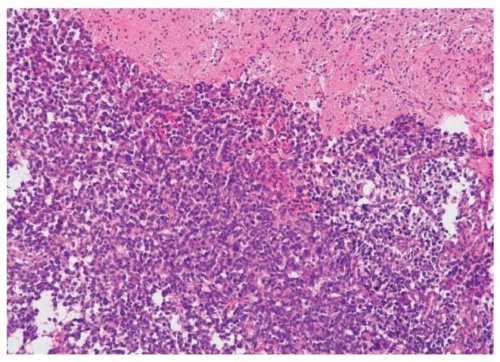
Рисунок 1. Пациент К., 61 год. Диагноз: глиобластома правой затылочной доли головного мозга. В клинической картине эпилептические приступы отсутствуют. Опухоль представлена солидными полями полиморфных, гиперхромных клеток, митотическая активность выражена, очаговые некробиотические изменения в тканях. Периферическая зона опухоли головного мозга с перифокальным отеком и очаговой глиозноклеточной пролиферацией (окраска гематоксилином и эозином, увеличение ×100)
Figure 1. Patient K., 61 years old. Diagnosis: glioblastoma of the right occipital lobe of the brain. No epileptic seizures were observed in the clinical picture. The tumor is presented as solid areas of polymorphic, hyperchromic cells, with prominent mitotic activity, and focal tissue necrobiotic changes. Peripheral zone of the brain tumor with perifocal edema and focal glial cell proliferation (stained with hematoxylin and eosin, magnification ×100)
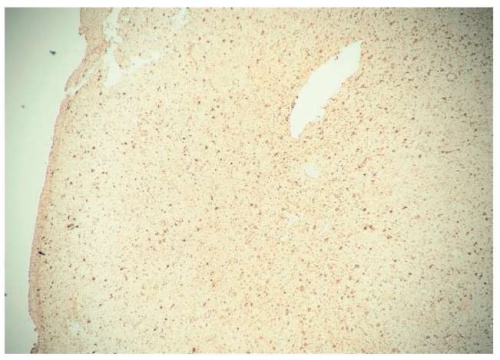
Рисунок 2. Пациент К., 61 год. Иммуногистохимическое исследование: экспрессия глутамин-синтетазы 90% (увеличение ×100)
Figure 2. Patient K., 61 years old. Immunohistochemical examination: glutamine synthetase expression comprised 90% (magnification ×100)
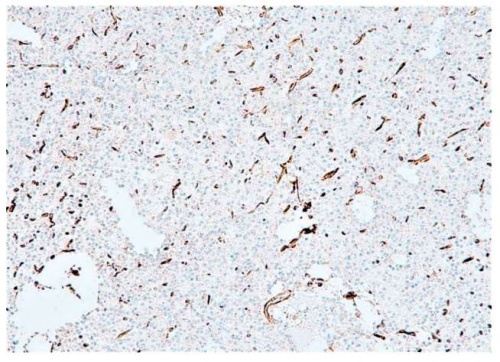
Рисунок 3. Пациент К., 61 год. Иммуногистохимическое исследование: экспрессия цистин-глутаматного переносчика (система xCT, SLC7A11) 40% (увеличение ×100)
Figure 3. Patient K., 61 years old. Immunohistochemical examination: expression of cystine-glutamate transporter (xCT system, SLC7A11) comprised 40% (magnification ×100)
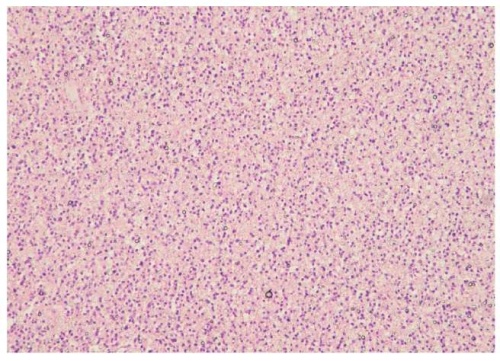
Рисунок 4. Пациентка Р., 55 лет. Диагноз: анапластическая астроцитома левой теменной доли головного мозга. Структурная теменная эпилепсия. Опухоль представлена скоплением полиморфных, гиперхромных клеток, митотическая активность умеренная, очаговые некробиотические изменения в тканях (окраска гематоксилином и эозином, увеличение ×100)
Figure 4. Patient R., 55 years old. Diagnosis: anaplastic astrocytoma of the left parietal lobe of the brain. Structural parietal epilepsy. The tumor is presented by accumulated polymorphic, hyperchromic cells, with moderate mitotic activity, and focal tissue necrobiotic changes (stained with hematoxylin and eosin, magnification ×100)
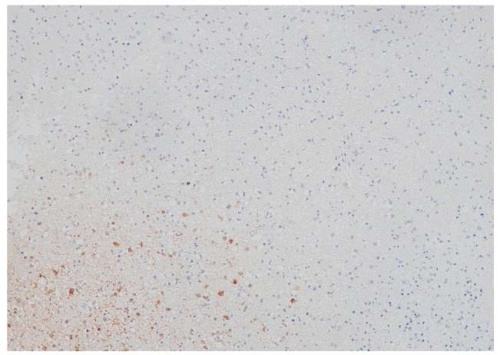
Рисунок 5. Пациентка Р., 55 лет. Иммуногистохимическое исследование: экспрессия глутамин-синтетазы 20% (увеличение ×100)
Figure 5. Patient R., 55 years old. Immunohistochemical study: glutamine synthetase expression comprised 20% (magnification ×100)
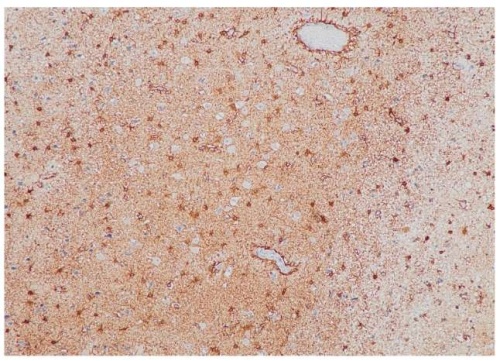
Рисунок 6. Пациентка Р., 55 лет. Иммуногистохимическое исследование: экспрессия цистин-глутаматного переносчика (система xCT, SLC7A11) 80% (увеличение ×100)
Figure 6. Patient R., 55 years old. Immunohistochemical study: expression of cystine-glutamate transporter (xCT system, SLC7A11) comprised 80% (magnification ×100)
ОБСУЖДЕНИЕ / DISCUSIION
Эпилепсия и эпилептические приступы являются одним из ведущих клинических проявлений глиом головного мозга, а у 27–50% пациентов c глиобластомами могут выступать первым (и у ряда из них единственным) клиническим проявлением заболевания [3][6]. Развитие приступов приводит к снижению качества жизни, высокому риску травматизации, социальной дезадаптации больных. Понимание патогенеза развития эпилепсии позволит разработать новые подходы к медикаментозному лечению, обосновать необходимость радикального удаления опухоли.
Важную роль в развитии эпилептогенеза при глиомах головного мозга отводят нарушению гомеостаза глутамата [5]. Как известно, глутамат относится к возбуждающему нейротрансмиттеру центральной нервной системы у млекопитающих, он играет решающую роль в синаптической пластичности и памяти. Однако при избыточном его накоплении помимо механизмов эпилептогенеза проявляется эффект эксайтотоксичности. Механизмы эксайтотоксичности характеризуются длительной активацией NMDA-рецепторов, длительным током кальция в клетку, Са-нейрональной гибелью и являются общими для многих заболеваний центральной нервной системы [7][8]. Таким образом, эксайтотоксичность можно отнести к типовому патологическому процессу, одна из характеристик которого – универсальность (протекание как интегральной части патогенеза разных нозологических форм на разных уровнях организации биологической системы) [7]. Представляется, что гибель нейронов приводит к «освобождению свободного пространства» и дальнейшему росту и экспансии опухоли.
В норме после окончания взаимодействия с рецепторами глутамат удаляется из синаптической щели с помощью специального натрий-зависимого транспортера. При этом бóльшая часть медиатора захватывается глиальными клетками, а часть возвращается в пресинаптическую терминаль. В последующем глутамат, находящийся в глиальных клетках, превращается в глутамин, который перемещается также в пресинаптическое окончание. Последний при участии переносчика, используя энергию аденозинтрифосфата, переходит в везикулы для последующего повторного использования [7][8].
Глутамин-синтетаза является ферментом, который содержится в астроцитах и превращает глутамат в глутамин и аммоний. По литературным данным, низкая экспрессия этого фермента у больных с глиобластомами приводит к накоплению глутамата и развитию эпилепсии. Также низкая экспрессия глутамин-синтетазы ассоциируется с более высокой продолжительностью жизни у больных с глиобластомами [9]. Предполагается, что возрастание уровня глутамата и, как следствие, дефицита глутамин-синтетазы в опухолевых клетках играет ключевую роль в патогенезе приступов [10]. Однако по результатам нашего исследования уровень экспрессии глутамин-синтетазы статистически значимо не отличался в группах больных с наличием и отсутствием приступов. Это может быть связано с тем, что в группе помимо глиобластом были и другие гистологические типы глиальных опухолей головного мозга.
Существенную роль в развитии эпилептогенеза отводят Na+-зависимым цистин-глутаматным антипортерам (системе xCT), которые ответственны за выведение глутамата из глиальной клетки. Высокая экспрессия цистин-глутаматного антипортера xCT (SLC7A11) является независимым биологическим маркером развития опухоль-ассоциированной эпилепсии [11]. В отдельных работах помимо участия в механизмах эпилептогенеза показано и прогностическое неблагоприятное значение высокой экспрессии SLC7A11 в отношении продолжительности жизни [12]. По результатам нашего исследования, в группе пациентов с эпилепсией наблюдалось статистически значимое повышение уровня экспрессии переносчика цистин/глутамата (системы xCT, SLC7A11), что хорошо согласуется с указанными литературными данными.
В экспериментальных исследованиях на крысах было показано, что содержание глутамата в 3,9 раза выше в ткани опухоли и в 2 раза выше в перитуморозной области в сравнении с неизмененной корой головного мозга (p<0,01) [13]. Повышение уровня глутамата подтверждается и в работах in vivo, в частности по результатам магнитно-резонансной спектроскопии. Повышение уровня глутамата вокруг опухоли (перитуморозной области) ассоциировалось с недавно перенесенным эпилептическим приступом (p=0,038) и фармакорезистентной эпилепсией (p=0,003) [14].
Необходимо отметить, что патогенез развития эпилепсии при глиомах головного мозга сложный и многофакторный. Помимо глутаматергических механизмов он включает отек вокруг опухоли, изменение pH, изменение в работе ионных каналов и т.д. Особую роль в развитии эпилептогенеза принадлежит перитуморозной области. Гипоксия и ацидоз приводят к дальнейшему повреждению клеток глии и росту опухоли [15]. По результатам позитронной эмиссионной томографии были выявлены гетерогенные изменения в перитуморозной области, включая повышение pH и лактата, снижение кровотока и метаболизма глюкозы [16]. Проведение магнитоэнцефалографии и электроэцефалографии у пациентов с глиобластомами позволило выявить межприступную эпилептиформную активность на расстоянии до 20 мм от границы опухоли [17].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Понимание патогенетических механизмов развития эпилепсии при глиомах головного мозга является обоснованием необходимости радикального удаления опухоли не только для увеличения продолжительности жизни, но и с целью достижения контроля над эпилептическими приступами после оперативного лечения и улучшения качества жизни пациентов.
Мы установили, что одним из патогенетических механизмов развития эпилепсии у пациентов с глиомами головного мозга является высокая экспрессия цистинглутаматного переносчика (система xCT, SLC7A11) и, как следствие, повышение внеклеточного уровня глутамата. Фармакологические воздействия на этот механизм являются многообещающим направлением в борьбе как с эпилепсией, так и с прогрессированием опухоли.
Список литературы
1. Bray F., Ferlay J., Soerjomataram I., et al. Global cancer statistics 2018: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin. 2018; 68 (6): 394–424. https://doi.org/10.3322/caac.21492.
2. Ostrom Q.T., Cioffi G., Gittleman H., et al. CBTRUS Statistical Report: Primary brain and other central nervous system tumors diagnosed in the United States in 2012–2016. Neuro Oncol. 2019; 21 (Suppl. 5): v1–100. https://doi.org/10.1093/neuonc/noz150.
3. Прокудин М.Ю., Одинак М.М., Литвиненко И.В. и др. Клинико-морфологические факторы риска развития эпилепсии у больных с глиальными и метастатическими опухолями головного мозга. Журнал неврологии и психиатрии им. С.С. Корсакова. 2020; 120 (11): 22–8. https://doi.org/10.17116/jnevro202012011122.
4. Liubinas S.V., O’Brien T.J., Moffat B.M., et al. Tumour associated epilepsy and glutamate excitotoxicity in patients with gliomas. J Clin Neurosci. 2014; 21 (6): 899–908. https://doi.org/10.1016/j.jocn.2014.02.012.
5. Buckingham S.C., Campbell S.L, Haas B.R., et al. Glutamate release by primary brain tumors induces epileptic activity. Nat Med. 2011; 17 (10): 1269–74. https://doi.org/10.1038/nm.2453.
6. Toledo M., Sarria-Estrada S., Quintana M., et al. Prognostic implications of epilepsy in glioblastomas. Clin Neurol Neurosurg. 2015; 139: 166–71. https://doi.org/10.1016/j.clineuro.2015.10.002.
7. Литвиненко И.В., Воробьев С.В., Лобзин В.Ю., Лупанов И.А. Возможности фармакологической модуляции церебральной глутаматергической системы в терапии сосудистых когнитивных нарушений. Журнал неврологии и психиатрии им. С.С. Корсакова. 2013; 113 (9): 29–35.
8. Литвиненко И.В., Красаков И.В., Бисага Г.Н. и др. Современная концепция патогенеза нейродегенеративных заболеваний и стратегия терапии. Журнал неврологии и психиатрии им. С.С. Корсакова. 2017; 117 (6-2): 3–10. https://doi.org/10.17116/jnevro2017117623-10.
9. Rosati A., Poliani P.L., Todeschini A., et al. Glutamine synthetase expression as a valuable marker of epilepsy and longer survival in newly diagnosed glioblastoma multiforme. Neuro Oncol. 2013; 15 (5): 618–25. https://doi.org/10.1093/neuonc/nos338.
10. Rosati A., Marconi S., Pollo B., et al. Epilepsy in glioblastoma multiforme: correlation with glutamine synthetase levels. J Neurooncol. 2009; 93 (3): 319–24. https://doi.org/10.1007/s11060-008-9794-z.
11. Sørensen M.F., Heimisdόttir S.B., Sørensen M.D., et al. High expression of cystin-glutamate antiporter xCT (SLC7A11) is an independent biomarker for epileptic seizures at diagnosis in glioma. J Neurooncol. 2018; 138 (1): 49–53. https://doi.org/10.1007/s11060018-2785-9.
12. Robert S.M., Buckingham S.C., Campbell S.L., et al. SLC7A11 expression is associated with seizures and predicts poor survival in patients with malignant glioma. Sci Transl Med. 2015; 7 (289): 289ra86. https://doi.org/10.1126/scitranslmed.aaa8103.
13. Behrens P.F., Langemann H., Strohschein R., et al. Extracellular glutamate and other metabolites in and around RG2 rat glioma: an intracerebral microdialysis study. J Neurooncol. 2000; 47 (1): 11–22. https://doi.org/10.1023/a:1006426917654.
14. Neal A., Moffat B.A., Stein J.M., et al. Glutamate weighted imaging contrast in gliomas with 7 Tesla magnetic resonance imaging. Neuroimage Clin. 2019; 22: 101694. https://doi.org/10.1016/j.nicl.2019.101694.
15. Kempski O., Staub F., Jansen M., Baethmann A. Molecular mechanisms of glial cell swelling in acidosis. Adv Neurol. 1990; 52: 39–45.
16. Beaumont A., Whittle I.R. The pathogenesis of tumour associated epilepsy. Acta Neurochir (Wien). 2000; 142 (1): 1–15. https://doi.org/10.1007/s007010050001.
17. Patt S., Steenbeck J., Hochstetter A., et al. Source localization and possible causes of interictal epileptic activity in tumor-associated epilepsy. Neurobiol Dis. 2000; 7 (4): 260–9. https://doi.org/10.1006/nbdi.2000.0288.
Об авторах
М. Ю. ПрокудинРоссия
Прокудин Михаил Юрьевич – к.м.н., преподаватель кафедры нервных болезней им. М.И. Аствацатурова
Санкт-Петербург
РИНЦ SPIN-код: 4021-4432
Б. В. Мартынов
Россия
Мартынов Борис Владимирович – д.м.н., доцент, врач-нейрохирург
Санкт-Петербург
РИНЦ SPIN-код: 9953-3997.
А. И. Яковенко
Россия
Яковенко Андрей Игоревич – к.м.н., начальник патоморфологического отдела Центральной патологоанатомической лаборатории
Санкт-Петербург
РИНЦ SPIN-код: 5937-8120.
И. В. Литвиненко
Россия
Литвиненко Игорь Вячеславович – д.м.н., профессор, начальник кафедры нервных болезней им. М.И. Аствацатурова
Санкт-Петербург
WoS ResearcherID: F-9120-2013;
Scopus Author ID: 35734354000;
РИНЦ SPIN-код: 6112- 2792.
В. Ю. Лобзин
Россия
Лобзин Владимир Юрьевич – д.м.н., профессор кафедры нервных болезней им. М.И. Аствацатурова; профессор кафедры неврологии им. акад. С.Н. Давиденкова; старший научный сотрудник научно-исследовательского отдела нейроинфекций и органической патологии нервной системы
Санкт-Петербург
WoS ResearcherID: I-4819-2016;
Scopus Author ID: 57203881632;
РИНЦ SPIN-код: 7779-3569.
Д. В. Свистов
Россия
Свистов Дмитрий Владимирович – к.м.н., доцент, начальник кафедры нейрохирургии; главный нейрохирург Минобороны России
Санкт-Петербург
РИНЦ SPIN-код: 3184-5590.
В. С. Чирский
Россия
Чирский Вадим Семенович – д.м.н., начальник кафедры патологической анатомии; начальник отдела Центральной патологоанатомической лаборатории Минобороны России
Санкт-Петербург
Москва
РИНЦ SPIN-код: 7295-3369.
К. А. Чемодакова
Россия
Чемодакова Ксения Андреевна – врач-нейрохирург клиники нейрохирургии
Санкт-Петербург
РИНЦ SPIN-код: 8425-1808.
О. А. Клиценко
Россия
Клиценко Ольга Анатольевна – к.б.н., доцент кафедры педагогики, философии и права
Санкт-Петербург
РИНЦ SPIN-код: 7354-3080
Рецензия
Для цитирования:
Прокудин М.Ю., Мартынов Б.В., Яковенко А.И., Литвиненко И.В., Лобзин В.Ю., Свистов Д.В., Чирский В.С., Чемодакова К.А., Клиценко О.А. Роль экспрессии глутамин-синтетазы и транспортера цистин/глутамата (SLC7A11, xCT) в патогенезе развития эпилепсии у пациентов с супратенториальными глиомами головного мозга. Эпилепсия и пароксизмальные состояния. 2022;14(2):204-213. https://doi.org/10.17749/2077-8333/epi.par.con.2022.118
For citation:
Prokudin M.Yu., Martynov B.V., Yakovenko A.I., Litvinenko I.V., Lobzin V.Yu., Svistov D.V., Chirskiy V.S., Chemodakova K.A., Klitsenko O.А. The role of glutamine synthetase expression and cystine/glutamate transporter (SLC7A11, xCT) in epilepsy pathogenesis of patients with supratentorial brain gliomas. Epilepsy and paroxysmal conditions. 2022;14(2):204-213. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.118

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































