Перейти к:
Проводящие пути белого вещества височной доли: клинико-анатомическое исследование применительно к хирургии фармакорезистентной структурной фокальной эпилепсии
https://doi.org/10.17749/2077-8333/epi.par.con.2022.126
Аннотация
Актуальность. Наличие фокальной кортикальной дисплазии (ФКД) темпоральной локализации зачастую приводит к развитию фармакорезистентной эпилепсии, требующей хирургического лечения. В свою очередь, темпоральная лобэктомия, несмотря на высокую эффективность, может вызывать определенный дефицит, связанный с прямым или опосредованным повреждением проводящих путей головного мозга.
Цель: описать основные анатомические особенности проводящих путей, входящих в состав височной доли, и клинические исходы хирургического лечения фармакорезистентной эпилепсии, развившейся на фоне ФКД темпоральной локализации.
Материал и методы. Проведен ретроспективный анализ лечения 14 пациентов с фармакорезистентной структурной фокальной эпилепсией (ФКД темпоральной локализации), которым проводилось хирургическое лечение (передняя темпоральная лобэктомия). Для локализации эпилептогенной зоны специалисты мультидисциплинарной группы проводили всем пациентам комплексное прехирургическое обследование. Операционный материал был исследован нейроморфологом, диагноз был верифицирован. В послеоперационном периоде пациенты проходили комплекс контрольных обследований в стандартные временные промежутки (через 3, 6, 12, 36 мес). Минимальный период наблюдения составил 12 мес. В рамках анатомического исследования было изучено 6 полушарий головного мозга, подготовленных к диссекции волокон белого вещества по методу Клинглера. Избирательно изучали основные проводящие пути, которые проходят в пределах либо вблизи височной доли: нижний продольный, медиальный продольный, нижний лобно-затылочный и крючковидный пучки.
Результаты. У 14,3% пациентов после резекции височной доли субдоминантного полушария протяженностью 4 см какие-либо осложнения в послеоперационном периоде отсутствовали. Речевые расстройства (в основном преходящего характера) наблюдались у 35,7% исследуемых, нарушения полей зрения (в основном преходящего характера) – у 21,4%, нейропсихиатрические расстройства – у 43,9%. Общая частота контроля над приступами: у 93% пациентов достигнут класс I по шкале исходов хирургического лечения эпилепсии Энгеля.
Заключение. Передняя темпоральная лобэктомия может считаться высокоэффективным методом хирургического лечения структурных форм фармакорезистентной фокальной эпилепсии с высокой частотой достижения контроля над эпилептическими приступами в послеоперационном периоде. Однако обязательными условиями для поддержания качества жизни пациента, перенесшего такое хирургическое вмешательство, являются предоперационный анализ мультидисциплинарной командой риска возникновения нежелательных эффектов, а также послеоперационное ведение и реабилитация.
Ключевые слова
Для цитирования:
Суфианов А.А., Шелягин И.С., Симфукве К., Маркин Е.С., Стефанов С.Ж., Якимов Ю.А., Акимова П.О., Суфианов Р.А. Проводящие пути белого вещества височной доли: клинико-анатомическое исследование применительно к хирургии фармакорезистентной структурной фокальной эпилепсии. Эпилепсия и пароксизмальные состояния. 2022;14(3):242-253. https://doi.org/10.17749/2077-8333/epi.par.con.2022.126
For citation:
Sufianov A.A., Shelyagin I.S., Simfukwe K., Markin E.S., Stefanov S.Zh., Yakimov Yu.A., Akimova P.O., Sufianov R.A. Temporal lobe white matter pathways: clinical and anatomical examination related to surgery of drug-resistant structural focal epilepsy. Epilepsy and paroxysmal conditions. 2022;14(3):242-253. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.126
ВВЕДЕНИЕ / INTRODUCTION
Врожденные пороки развития головного мозга, в частности фокальные кортикальные дисплазии (ФКД), могут оказаться причинами развития эпилепсии с эпилептическими приступами, достичь контроля над которыми с помощью приема противоэпилептических препаратов зачастую не удается [1]. Хирургическое лечение с предварительно проведенным комплексным прехирургическим обследованием может быть методом выбора в тактике ведения таких пациентов [2].
Височная доля является наиболее частой локализацией ФКД. Также в ней могут локализоваться иные структурные изменения, провоцирующие эпилептические приступы (гиппокампальный склероз, объемные образования, иные пороки развития и сосудистые мальформации, сопровождающиеся развитием эпилептических приступов, и т.д.) [3–5]. В таком случае передняя темпоральная лобэктомия (ПТЛ) с резекцией протяженностью от 3 до 6 см, по данным различных авторов, может быть наиболее эффективным типом оперативного вмешательства с частотой благоприятных результатов 70–90% [3][6–9].
Тем не менее, несмотря на высокую эффективность ПТЛ, после хирургического лечения может возникать определенный дефицит [7]. В абсолютном большинстве случаев подобные последствия ПТЛ связаны с прямым или опосредованным повреждением проводящих путей головного мозга, которые проходят в пределах либо вблизи височной доли. Поэтому основные проводящие пути височной доли и клиника их поражения становятся актуальными для исследования.
Цель – описать основные анатомические особенности проводящих путей, входящих в состав височной доли, и клинические исходы хирургического лечения фармакорезистентной эпилепсии, развившейся на фоне ФКД темпоральной локализации.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Дизайн исследования / Study design
Выполнен ретроспективный анализ лечения 14 пациентов с фармакорезистентной структурной фокальной эпилепсией (ФКД темпоральной локализации), которым проводилось хирургическое лечение (ПТЛ) в ФГБУ «Федеральный центр нейрохирургии» Минздрава России (г. Тюмень) в 2018–2021 гг.
Для локализации эпилептогенной зоны специалисты мультидисциплинарной группы (невролог-эпилептолог, нейрофизиолог, врач лучевой диагностики, нейропсихолог) проводили всем пациентам комплексное прехирургическое обследование с использованием необходимых неинвазивных и инвазивных методов. Операционный материал был исследован нейроморфологом.
В послеоперационном периоде пациенты проходили комплекс контрольных обследований в стандартные временные промежутки. Минимальный период послеоперационного наблюдения составил 12 мес.
Пациенты / Patients
В исследуемой группе было 8 (57,1%) женщин и 6 (42,9%) мужчин, средний возраст составил 17,2±9,23 года. Все пациенты имели ФКД различных форм.
Этические аспекты / Ethical aspects
Исследование выполнено в соответствии со стандартами надлежащей клинической практики и принципами Хельсинкской декларации Всемирной медицинской ассоциации 2013 г. Все участники подписали добровольное информированное согласие.
Магнитно-резонансная томография / Magnetic resonance imaging
Перед оперативным вмешательством (не более чем за 1 мес) всем пациентам исследуемой группы выполняли магнитно-резонансную томографию (МРТ) по специализированному протоколу «эпилепсия» на аппарате Discovery MR750 3.0 T (General Electric, США). В раннем послеоперационном периоде (через 1–3 сут), а также в рамках контрольного послеоперационного обследования (через 3, 6, 12, 36 мес) МРТ-исследование проводили для оценки послеоперационных изменений.
Электроэнцефалография / Electroencephalography
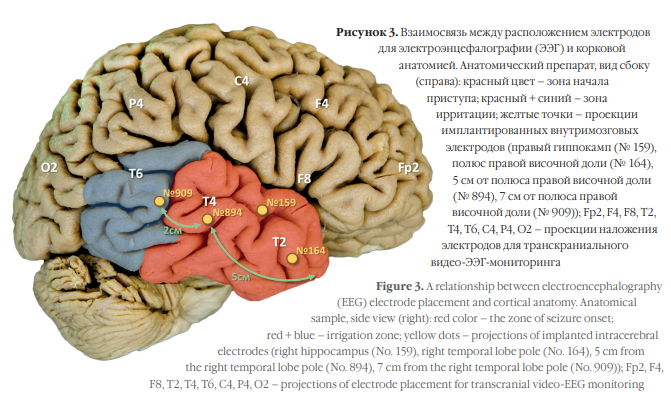
Неинвазивный транскраниальный электроэнцефалографический (ЭЭГ) видеомониторинг с фиксацией эпилептических приступов (рис. 1) проводили всем пациентам с использованием следующих систем: стационарный 32-канальный аппарат Nicolet ONE (Natus, США), портативные 16- и 32-канальные аппараты Nicolet ONE (Natus, США), стационарный 64-канальный аппарат Cadwell Easy III (Cadwell, США), стационарный 128-канальный аппарат BE Plus EBNeuro/Ates (ATES Medica Device, Италия). При необходимости выполняли инвазивный видео-ЭЭГмониторинг с имплантацией внутримозговых электродов (рис. 2, 3).
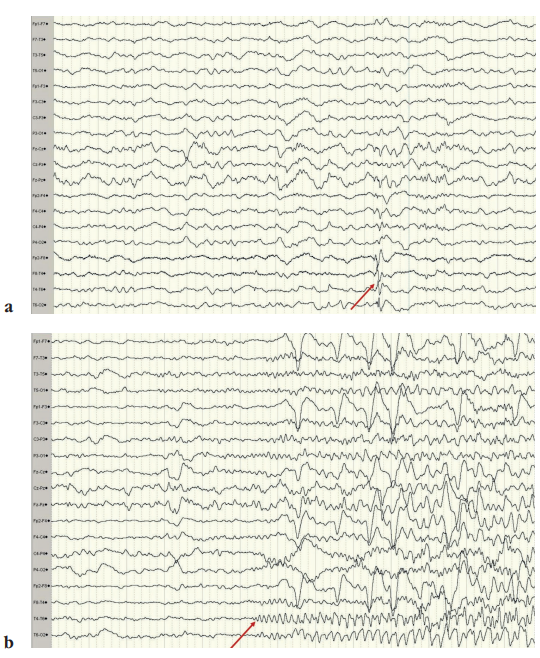
Рисунок 1. Биоэлектрическая активность головного мозга в интериктальный и иктальный периоды при регистрации по 19 скальповым отведениям, установленным по системе «10–20»: а – стрелкой указана зона ирритации (интериктальная активность в виде одиночных и сгруппированных полиморфных комплексов «острая–медленная волна») в правой височной области (Fp2-, F8-, T4-, T6-, O2-отведения); b – стрелкой указана зона начала приступа (иктальная активность в виде ритмичной заостренной активности тета-диапазона) в правой височной области (F8-, T4-, T6-, O2-отведения)
Figure 1. Bioelectrical brain activity in the interictal and ictal periods during registration with 19 scalp channels according to the 10–20 system of electrode placement: a – the arrow indicates the area of irrigation (interictal activity in the form of single and grouped polymorphic acute-slow wave complexes) in the right temporal region (Fp2-, F8-, T4-, T6-, O2-leads); b – the arrow indicates the zone of seizure onset (ictal activity in the form of theta rhythmic pointed activity) in the right temporal region (F8-, T4-, T6-, O2-leads)
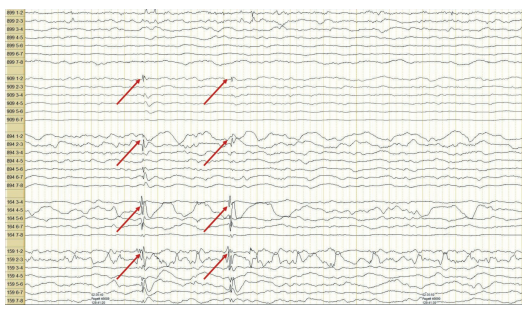
Рисунок 2. Биоэлектрическая активность головного мозга в интериктальный период при регистрации по отведениям пяти 8-канальных глубинных внутримозговых электродов, имплантированных в левый гиппокамп (№ 899), в 7 см от полюса правой височной доли (№ 909), в 5 см от полюса правой височной доли (№ 894), в полюс правой височной доли (№ 164), в правый гиппокамп (№ 159). Стрелками указана интериктальная активность в виде одиночных и сгруппированных полиморфных синхронных комплексов «спайк–волна» с первичной генерацией в отведениях электродов, имплантрованных в правый гиппокамп и передние отделы правой височной доли, с распространением в отведения электродов, импланированных в задние отделы правой височной доли
Figure 2. Bioelectrical brain activity in the interictal period during registration with five 8-channel deep intracerebral electrodes implanted in the left hippocampus (No. 899), 7 cm from the right temporal lobe pole (No. 909), 5 cm from the right temporal lobe pole (No. 894), in the right temporal lobe pole (No. 164), in the right hippocampus (No. 159). Arrows indicate interictal activity in the form of single and grouped polymorphic synchronous spike-wave complexes with primary generation in leads of electrodes implanted in the right hippocampus and anterior parts of the right temporal lobe with spreading to leads of electrodes implanted in the posterior parts of the right temporal lobe
Нейропсихологическое обследование / Neuropsychological examination
Нейропсихологическое обследование пациентов проводил нейропсихолог на дооперационном этапе (не позднее 1 мес и не ранее 7 сут до хирургического вмешательства), в раннем послеоперационном периоде (через 7–14 сут), а также в рамках контрольного послеоперационного осмотра (через 3, 6, 12, 36 мес).
В ходе обследования осуществлялась оценка следующих высших психических функций:
- память (слухоречевая, зрительная, на текущие события и упрочненные знания);
- внимание (объем, концентрация, устойчивость);
- речь (импрессивная, экспрессивная);
- двигательные навыки (конструктивный, динамический, кинестетический, пространственный, оральный праксис);
- высшие кожно-кинестетические функции (осязательная и кинестетическая чувствительность, стереогнозис);
- высшие зрительные функции (оптический гнозис, ориентировка в пространстве, пространственное мышление);
- чтение и письмо;
- мышление.
В план обследования также были включены сбор анамнеза, оценка состояния сознания и психоэмоционального профиля, способности пациента ориентироваться в пространстве и времени, определялся профиль функциональной асимметрии.
Хирургическое лечение / Surgical treatment
Всем пациентам исследуемой группы профессором А.А. Суфиановым была проведена ПТЛ под нейрофизиологическим контролем двигательных функций.
Оперативные вмешательства выполняли с использованием интраоперационной ультрасонографии (ИОУСГ). При проведении ИОУСГ определяли гиперэхогенный патологический очаг, соответствующий локализации ФКД, на фоне здорового серого и белого вещества головного мозга. Основная цель применения ИОУСГ заключалась в визуализации зоны ФКД до и после вскрытия твердой мозговой оболочки (ТМО) в условиях смещения анатомических структур после вскрытия ТМО, а также для контроля радикальности резекции.
Всем пациентам выполняли также интраоперационную электрокортикографию (ИОЭКоГ) для контроля радикальности резекции эпилептогенного очага. Во всех случаях после резекции ФКД патологической активности в окружающих тканях при проведении ИОЭКоГ не регистрировалось.
Анатомическое исследование / Anatomical study
В рамках анатомического исследования было изучено 6 полушарий головного мозга, подготовленных к диссекции волокон белого вещества по методу Клинглера. Диссекцию волокон белого вещества проводили с применением экзоскопа 4K 3D Vitom (Karl Storz, Германия) и микроскопа OPMI Vario S8 (Carl Zeiss, Германия). Избирательно изучали основные проводящие пути, которые проходят в пределах либо вблизи височной доли: нижний продольный, медиальный продольный, нижний лобно-затылочный и крючковидный пучки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Пациентам выполняли ПТЛ под нейрофизиологическим, ИОУСГ-, ИОЭКоГ-контролем. Протяженность резекции височной доли определяли индивидуально в каждом случае на основании выявленной по результатам прехирургического исследования эпилептогенной зоны (зона структурных изменений + зона функционального дефицита + симптоматогенная зона + зона начала приступа + зона ирритации), анатомического расположения патологического очага, а также профиля функциональной асимметрии пациента (рис. 4). В среднем протяженность резекции височной доли в исследуемой группе составила 4,42±0,84 см.
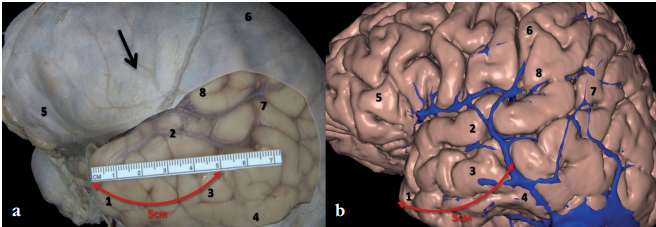
Рисунок 4. Предоперационное планирование протяженности резекции височной доли: a – анатомический препарат, вид сбоку (справа), черной стрелкой указана твердая мозговая оболочка, красной – предполагаемая протяженность резекции височной доли; b – сегментация головного мозга (совмещение данных магнитнорезонансной томографии головного мозга и компьютерной томографической ангиографии сосудов головного мозга в венозную фазу), вид сбоку (справа), красной стрелкой указана предполагаемая протяженность резекции височной доли. 1 – полюс височной доли; 2 – верхняя височная извилина; 3 – средняя височная извилина; 4 – нижняя височная извилина; 5 – лобная доля; 6 – височная доля; 7 – угловая извилина; 8 – надкраевая извилина
Figure 4. Preoperative planning of temporal lobe resection extent: a – anatomical preparation, side view (right), the black arrow indicates the dura mater, the red arrow shows the estimated extent of temporal lobe resection; b – segmentation of the brain (combined data from brain magnetic resonance imaging and cerebral vessels computed tomographic angiography in the venous phase), side view (right), the red arrow indicates the estimated extent of temporal lobe resection. 1 – temporal lobe pole; 2 – superior temporal gyrus; 3 – middle temporal gyrus; 4 – inferior temporal gyrus; 5 – frontal lobe; 6 – temporal lobe; 7 – angular gyrus; 8 – supracranial gyrus
Сводные данные по исходам хирургического лечения и клинике поражения проводящих путей белого вещества височной доли у пациентов исследуемой группы до и после оперативного вмешательства представлены в таблице 1.
Таблица 1. Исходы хирургического лечения и клиника поражения проводящих путей белого вещества височной доли у пациентов исследуемой группы до и после оперативного вмешательства
Table 1. Outcomes of surgical treatment and clinical signs of temporal lobe white matter pathways before and after surgery
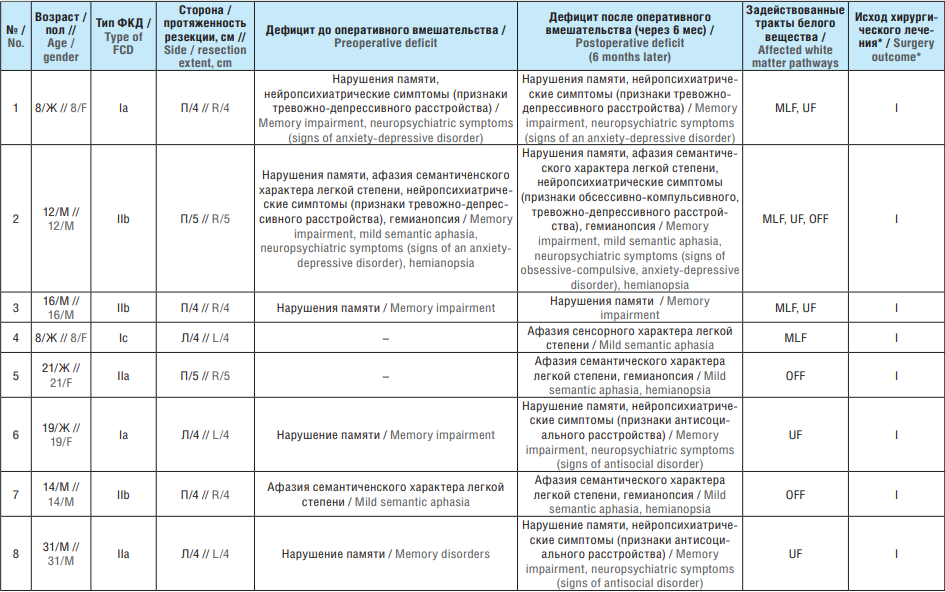
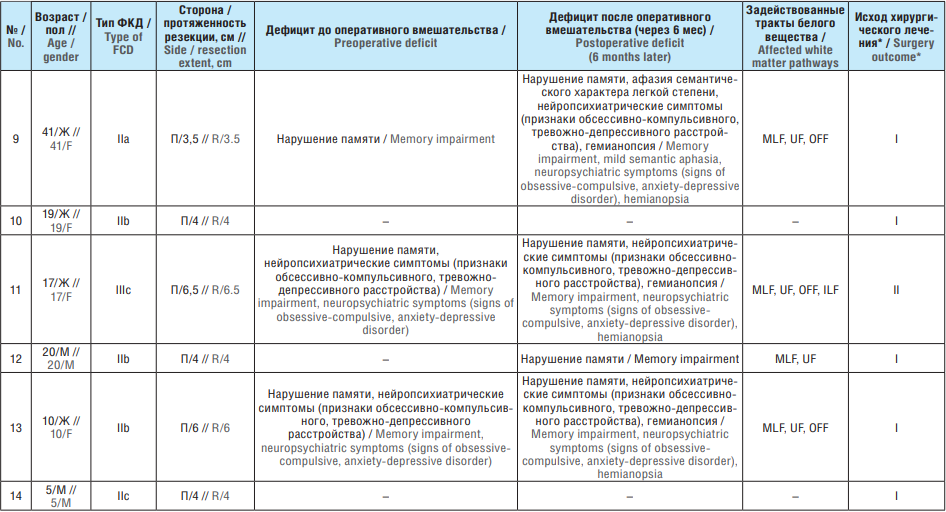
Примечание. ФКД – фокальная кортикальная дисплазия; Ж – женский; М – мужской; П – правая; Л – левая; MLF (англ. medial longitudinal fasciculus) – средний продольный пучок, OFF (англ. occipitofrontal fasciculus) – затылочно лобный пучок, ILF (англ. inferior longitudinal fasciculus) – нижний продольный пучок, UF (англ. uncinate fasciculus) – крючковидный пучок. * Класс по шкале исходов хирургического лечения эпилепсии Энгеля.
Note. FCD – focal cortical dysplasia; F – female; M – male; R – right; L – left; MLF – medial longitudinal fasciculus, OFF – occipitofrontal fasciculus, ILF – inferior longitudinal fasciculus, UF – uncinate fasciculus. * Engel Epilepsy Surgery Outcome Scale class.
Затылочно-лобный пучок представляет собой длинный ассоциативный тракт белого вещества, который соединяет префронтальную и орбитофронтальную кору с теменной, затылочной долями и заднебоковыми участками коры головного мозга [10][11]. Его можно разделить на три основных сегмента:
- вертикальный сегмент, который берет начало в средней части средней лобной извилины и проходит вдоль лобной доли;
- передний горизонтальный сегмент, который начинается от глазничной и треугольной частей нижней лобной извилины и проходит вдоль лобной доли;
- задний горизонтальный сегмент, который проходит от порога островка, входит в височную ножку и оканчивается в теменных и затылочных долях [10][12][13].
Нарушение целостности нижнего лобно-затылочного пучка может приводить к нарушениям полей зрения и предиктивной составляющей речевых функций (упрощение форм контактного предложения, затруднения в анализе логико-грамматических построений), а также к нейропсихиатрическим нарушениям (обсессивно-компульсивные расстройства, антисоциальные расстройства личности с признаками девиантного поведения) [14–16].
Крючковидный пучок соединяет полюс лобной доли (орбитофронтальная область коры) с передней частью височной доли, а также с миндалевидным телом и гиппокампом. Клиника его поражения может включать ряд нейропсихиатрических симптомов (обсессивно-компульсивное расстройство, тревога, депрессия, биполярное расстройство, антисоциальное расстройство личности с признаками девиантного поведения), нарушения памяти различных типов) [17]. Известно, что пациенты могут иметь характерную клиническую картину поражения крючковидного пучка и до хирургического лечения [13][18][19]. Так, у 8 пациентов в нашем исследовании имелись симптомы, связанные с нарушением функционирования крючковидного пучка до оперативного вмешательства (см. табл. 1).
Средний продольный пучок представляет собой длинный ассоциативный тракт белого вещества, который расположен в латеральной части головного мозга и соединяет верхнюю височную извилину с теменной и затылочной долями. Он проходит медиальнее от ассоциативных волокон в переднем сегменте верхней височной извилины, а также под ассоциативными волокнами верхнего продольного пучка и аркуатного пучка в задней области височной доли и нижней области теменной доли (в переднелатерально-заднемедиальном направлении). Средний продольный пучок соединяет верхнюю височную извилину с верхней частью теменной доли и теменно-затылочной зоной, проходя через поперечные извилины Гешля, а также верхнюю височную извилину с задней областью затылочной коры посредством угловой извилины [12][20]. При его поражении могут развиваться нарушения понимания сложных обобщенных конструкций и их связей, пациент может испытывать затруднения в анализе логико-грамматических построений (доминантное полушарие) или нарушения памяти различных типов и пространственного восприятия (недоминантное полушарие).
Нижний продольный пучок соединяет полюс височной доли с затылочной долей [21]. Он берет начало во вторичных зрительных областях и проходит через средние и нижние височные извилины к полюсу височной доли, миндалевидному телу и гиппокампу [22]. Клиника поражения нижнего продольного пучка может включать гемиагнозию на противоположной стороне. Это подтверждает важную роль проводящих путей головного мозга в обработке зрительной информации, поступающей от первичных затылочных структур в затылочной области, в частности веретенообразной извилины, к полюсам височных долей [22][23]. Следует отметить, что у большинства пациентов исследуемой группы отмечалась преходящая или необратимая гемиагнозия после хирургического лечения (см. табл. 1). Пересечение нижнего продольного пучка с обеих сторон может вызывать другие формы зрительной агнозии, например прозопагнозию (нарушение узнавания лиц) [21][22][24].
На рисунке 5 представлены различные этапы диссекции проводящих путей височной доли.
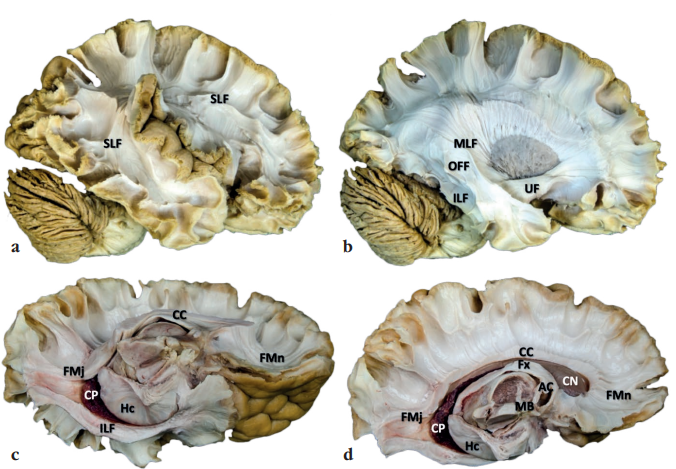
Рисунок 5. Различные этапы диссекции проводящих путей височной доли (анатомический препарат, диссекция волокон белого вещества по методу Клинглера): a – латеральный аспект диссекции белого вещества, диссекция верхнего продольного пучка вокруг латеральной борозды; b – латеральный аспект диссекции белого вещества, диссекция среднего продольного, нижнего продольного, затылочно-лобного и крючковидного пучков; c – медиальный аспект диссекции белого вещества, диссекция медиобазальных структур височной доли (базальная поверхность); d – медиальный аспект диссекции белого вещества, диссекция медиобазальных структур височной доли (медиальная поверхность). SLF (англ. superior longitudinal fasciculus) – верхний продольный пучок; МLF (англ. medial longitudinal fasciculus) – средний продольный пучок; ILF (англ. inferior longitudinal fasciculus) – нижний продольный пучок; OFF (лат. occipitofrontal fasciculus) – затылочно-лобный пучок; UF (лат. uncinate fasciculus) – крючковидный пучок; CC (лат. corpus callosum) – мозолистое тело; FMj (англ. major forceps) – большие щипцы; FMn (англ. minor forceps) – малые щипцы; CP (лат. choroid plexus) – сосудистое сплетение бокового желудочка; Hс (лат. hippocampus) – гиппокамп; Fx (лат. fornix) – свод; AC (лат. anterior commissure) – передняя спайка; MB (англ. mammillary body) – сосцевидное тело; CN (лат. caudate nucleus) – хвостатое ядро
Figure 5. Different stages of temporal lobe pathway dissection (anatomical preparation, white matter pathways dissection according to Klingler technique): a – lateral aspect of white matter dissection, superior longitudinal fasciculus dissection around the lateral sulcus; b – lateral aspect of white matter dissection, middle longitudinal, inferior longitudinal, occipitofrontal and uncinate fasciculi dissection; c – medial aspect of white matter dissection, temporal lobe mediobasal structures dissection (basal surface); d – medial aspect of white matter dissection, temporal lobe mediobasal structures dissection (medial surface). SLF – superior longitudinal fasciculus; МLF – medial longitudinal fasciculus; ILF – inferior longitudinal fasciculus; OFF – occipitofrontal fasciculus; UF – uncinate fasciculus; CC – corpus callosum; FMj – major forceps; FMn – minor forceps; CP – choroid plexus; Hс – hippocampus; Fx – fornix; AC – anterior commissure; MB – mammillary body; CN – caudate nucleus
У 14,3% пациентов исследуемой группы после резекции височной доли субдоминантного полушария протяженностью 4 см какие-либо осложнения в послеоперационном периоде отсутствовали. Речевые расстройства (в основном преходящего характера) наблюдались в 35,7% случаев, нарушения полей зрения (в основном преходящего характера) – в 21,4%, нейропсихиатрические расстройства – в 43,9%. Общая частота контроля над приступами: у 93% пациентов достигнут класс I по шкале исходов хирургического лечения эпилепсии Энгеля (англ. Engel Epilepsy Surgery Outcome Scale) (см. табл. 1).
ЗАКЛЮЧЕНИЕ / CONCLUSION
ПТЛ может считаться высокоэффективным методом хирургического лечения фармакорезистентной структурной фокальной эпилепсии с высокой частотой достижения контроля над эпилептическими приступами в послеоперационном периоде. Однако такое вмешательство сопряжено с риском возникновения дефицита, связанного с прямым или опосредованным повреждением проводящих путей головного мозга. Наиболее часто после ПТЛ могут возникать или усугубляться имевшиеся ранее нарушения памяти, речевые дисфункции различных типов, нарушения анализа зрительной информации и полей зрения, а также различные нейропсихиатрические симптомы. Поэтому обязательными условиями для поддержания качества жизни пациента, перенесшего резекционное хирургическое вмешательство для лечения фармакорезистентной эпилепсии, являются анализ риска возникновения нежелательных эффектов мультидисциплинарной командой в предоперационном периоде, а также послеоперационное ведение и реабилитация.
Список литературы
1. Choi S.A., Kim S.Y., Kim H., et al. Surgical outcome and predictive factors of epilepsy surgery in pediatric isolated focal cortical dysplasia. Epilepsy Res. 2018; 139: 54–9. https://doi.org/10.1016/j.eplepsyres.2017.11.012.
2. Hirfanoglu T., Serdaroglu A., Kurt G., et al. Outcomes of resective surgery in children and adolescents with focal lesional epilepsy: the experience of a tertiary epilepsy center. Epilepsy Behav. 2016; 63: 67–72. https://doi.org/10.1016/j.yebeh.2016.07.039.
3. Bartolini L., Whitehead M.T., Ho C.Y., et al. Temporal lobe epilepsy and focal cortical dysplasia in children: a tip to find the abnormality. Epilepsia. 2017; 58 (1): 113–22. https://doi.org/10.1111/epi.13615.
4. Cossu M., d’Orio P., Barba C., et al. Focal cortical dysplasia IIIa in hippocampal sclerosis-associated epilepsy: anatomo-electro-clinical profile and surgical results from a multicentric retrospective study. Neurosurgery. 2021; 88 (2): 384–93. https://doi.org/10.1093/neuros/nyaa369.
5. He X., Liu D., Yang Z., et al. Side of lesions predicts surgical outcomes in patients with drug-resistant temporal lobe epilepsy secondary to focal cortical dysplasia type IIIa. Front Neurol. 2020; 11: 580221. https://doi.org/10.3389/fneur.2020.580221.
6. Wagstyl K., Whitaker K., Raznahan A., et al. Atlas of lesion locations and postsurgical seizure freedom in focal cortical dysplasia: a MELD study. Epilepsia. 2022; 63 (1): 61–74. https://doi.org/10.1111/epi.17130.
7. Shamim S., Wiggs E., Heiss J., et al. Temporal lobectomy: resection volume, neuropsychological effects, and seizure outcome. Epilepsy Behav. 2009; 16 (2): 311–4. https://doi.org/10.1016/j.yebeh.2009.07.040.
8. Jones J.E., Blocher J.B., Jackson D.C. Life outcomes of anterior temporal lobectomy: serial long-term follow-up evaluations. Neurosurgery. 2013; 73 (6): 1018–25. https://doi.org/10.1227/NEU.0000000000000145.
9. Taylor P.N., Sinha N., Wang Y., et al. The impact of epilepsy surgery on the structural connectome and its relation to outcome. Neuroimage Clin. 2018; 18: 202–14. https://doi.org/10.1016/j.nicl.2018.01.028.
10. Briggs R.G., Lin Y.H., Dadario N.B., et al. Anatomy and white matter connections of the middle frontal gyrus. World Neurosurg. 2021; 150: e520–9. https://doi.org/10.1016/j.wneu.2021.03.045.
11. Conner A.K., Briggs R.G., Sali G., et al. A connectomic atlas of the human cerebrum – Chapter 13: Tractographic description of the inferior fronto-occipital fasciculus. Oper Neurosurg (Hagerstown). 2018; 15 (Suppl. 1): S436–43. https://doi.org/10.1093/ons/opy267.
12. Martino J., De Lucas E.M. Subcortical anatomy of the lateral association fascicles of the brain: a review. Clin Anat. 2014; 27 (4): 563–9. https://doi.org/10.1002/ca.22321.
13. McDonald C.R., Ahmadi M.E., Hagler D.J., et al. Diffusion tensor imaging correlates of memory and language impairments in temporal lobe epilepsy. Neurology. 2008; 71 (23): 1869–76. https://doi.org/10.1212/01.wnl.0000327824.05348.3b.
14. Malmgren K., Thom M. Hippocampal sclerosis – origins and imaging. Epilepsia. 2012; 53 (Suppl. 4): 19–33. https://doi.org/10.1111/j.1528-1167.2012.03610.x.
15. Maynard L.M., Leach J.L., Horn P.S., et al. Epilepsy prevalence and severity predictors in MRI-identified focal cortical dysplasia. Epilepsy Res. 2017; 132: 41–9. https://doi.org/10.1016/j.eplepsyres.2017.03.001.
16. Yogarajah M., Focke N.K., Bonelli S., et al. Defining Meyer’s looptemporal lobe resections, visual field deficits and diffusion tensor tractography. Brain. 2009; 132 (6): 1656–68. https://doi.org/10.1093/brain/awp114.
17. Von Der Heide R.J., Skipper L.M., Klobusicky E., Olson I.R. Dissecting the uncinate fasciculus: disorders, controversies and a hypothesis. Brain. 2013; 136 (Pt. 6): 1692–707. https://doi.org/10.1093/brain/awt094.
18. Briggs R.G., Rahimi M., Conner A.K., et al. A connectomic atlas of the human cerebrum – Chapter 15: Tractographic description of the uncinate fasciculus. Oper Neurosurg (Hagerstown). 2018; 15 (Suppl. 1): S450–5. https://doi.org/10.1093/ons/opy269.
19. Riley J.D., Franklin D.L., Choi V., et al. Altered white matter integrity in temporal lobe epilepsy: association with cognitive and clinical profiles. Epilepsia. 2010; 51 (4): 536–45. https://doi.org/10.1111/j.1528-1167.2009.02508.x.
20. Latini F., Trevisi G., Fahlström M., et al. New insights into the anatomy, connectivity and clinical implications of the middle longitudinal fasciculus. Front Neuroanat. 2020; 14: 610324. https://doi.org/10.3389/fnana.2020.610324.
21. Herbet G., Zemmoura I., Duffau H. Functional anatomy of the inferior longitudinal fasciculus: from historical reports to current hypotheses. Front Neuroanat. 2018; 12: 77. https://doi.org/10.3389/fnana.2018.00077.
22. Catani M., Jones D.K., Donato R., Ffytche D.H. Occipito-temporal connections in the human brain. Brain. 2003; 126 (Pt. 9): 2093–107. https://doi.org/10.1093/brain/awg203.
23. Imamura H., Matsumoto R., Takaya S., et al. Network specific change in white matter integrity in mesial temporal lobe epilepsy. Epilepsy Res. 2016; 120: 65–72. https://doi.org/10.1016/j.eplepsyres.2015.12.003.
24. Catani M., Dell’acqua F., Vergani F., et al. Short frontal lobe connections of the human brain. Cortex. 2012; 48 (2): 273–91. https://doi.org/10.1016/j.cortex.2011.12.001.
Об авторах
А. А. СуфиановРоссия
Суфианов Альберт Акрамович – д.м.н., профессор, член-корреспондент РАН, заведующий кафедрой нейрохирургии; главный врач
Scopus Author ID: 6603558501; РИНЦ SPIN-код: 1722-0448
ул. Трубецкая, д. 8, стр. 2, Москва 119048; ул. 4-й км Червишевского тракта, д. 5, Тюмень 625032
И. С. Шелягин
Россия
Шелягин Иван Сергеевич – врач-нейрохирург
SPIN-код: 4188-2029
ул. 4-й км Червишевского тракта, д. 5, Тюмень 625032
К. Симфукве
Россия
Симфукве Кейт – аспирант кафедры нейрохирургии
ул. Трубецкая, д. 8, стр. 2, Москва 119048
Е. С. Маркин
Россия
Маркин Егор Сергеевич – врач-нейрохирург
РИНЦ SPIN-код: 4743-9361
ул. 4-й км Червишевского тракта, д. 5, Тюмень 625032
С. Ж. Стефанов
Россия
Стефанов Стефан Живков – аспирант кафедры нейрохирургии
ул. 4-й км Червишевского тракта, д. 5, Тюмень 625032
Ю. А. Якимов
Россия
Якимов Юрий Алексеевич – к.м.н., доцент кафедры нейрохирургии ; врач-нейрохирург
Scopus Author ID: 6602436163; WoS ResearcherID: A-5261-2018; РИНЦ SPIN-код: 7835-6062
ул. Трубецкая, д. 8, стр. 2, Москва 119048; ул. 4-й км Червишевского тракта, д. 5, Тюмень 625032
П. О. Акимова
Россия
Акимова Полина Олеговна – врач-нейропсихолог
ул. 4-й км Червишевского тракта, д. 5, Тюмень 625032
Р. А. Суфианов
Россия
Суфианов Ринат Альбертович – ассистент кафедры нейрохирургии
Scopus Author ID: 56001416700; РИНЦ SPIN-код: 1204-2994
ул. Трубецкая, д. 8, стр. 2, Москва 119048
Рецензия
Для цитирования:
Суфианов А.А., Шелягин И.С., Симфукве К., Маркин Е.С., Стефанов С.Ж., Якимов Ю.А., Акимова П.О., Суфианов Р.А. Проводящие пути белого вещества височной доли: клинико-анатомическое исследование применительно к хирургии фармакорезистентной структурной фокальной эпилепсии. Эпилепсия и пароксизмальные состояния. 2022;14(3):242-253. https://doi.org/10.17749/2077-8333/epi.par.con.2022.126
For citation:
Sufianov A.A., Shelyagin I.S., Simfukwe K., Markin E.S., Stefanov S.Zh., Yakimov Yu.A., Akimova P.O., Sufianov R.A. Temporal lobe white matter pathways: clinical and anatomical examination related to surgery of drug-resistant structural focal epilepsy. Epilepsy and paroxysmal conditions. 2022;14(3):242-253. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.126

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.











































