Перейти к:
Частота встречаемости антиконвульсант-индуцированного дефицита витамина D
https://doi.org/10.17749/2077-8333/epi.par.con.2022.117
Аннотация
Актуальность. Эпилепсия – распространенное заболевание у детей и взрослых, в 60% случаев требующее длительного или пожизненного приема противоэпилептических препаратов (ПЭП). Энзим-индуцирующие и энзим-ингибирующие ПЭП могут оказывать негативное влияние на обмен витамина D. Однако в настоящее время в стандартные протоколы лечения пациентов с эпилепсией не включены нутриенты и витаминно-минеральные комплексы, содержащие витамин D.
Цель: анализ исследований частоты встречаемости дефицита витамина D, индуцированного приемом ПЭП, у пациентов с эпилепсией.
Материал и методы. Проведен поиск полнотекстовых публикаций на русском и английском языках в базах данных еLibrary, PubMed/MEDLINE, ClinicalKey, Google Scholar за последние 5 лет. Проанализировано 9 отечественных и 54 зарубежных эпидемиологических исследования частоты встречаемости ПЭП-индуцированного дефицита витамина D и, как следствие, нарушения минерализации костной ткани и развития остеомаляции/остеопороза.
Результаты. Частота встречаемости ПЭП-индуцированного дефицита витамина D достигает 40% и выше как у детей, так и у взрослых. Регион проживания пациентов с эпилепсией значимо не влияет на этот показатель. Нарушение минерализации костной ткани ассоциировано с ПЭП-индуцированным дефицитом витамина D и требует его включения в протоколы болезнь-модифицирующей терапии эпилепсии у детей и взрослых.
Заключение. Результаты проведенного обзора свидетельствуют о высокой актуальности рассматриваемой междисциплинарной проблемы и необходимости внедрения лабораторного скрининга недостаточности и дефицита витамина D среди детей и взрослых пациентов, страдающих эпилепсией.
Ключевые слова
Для цитирования:
Донцева Е.А., Пилипенко П.И., Шнайдер Н.А., Петрова М.М., Насырова Р.Ф. Частота встречаемости антиконвульсант-индуцированного дефицита витамина D. Эпилепсия и пароксизмальные состояния. 2022;14(3):304-315. https://doi.org/10.17749/2077-8333/epi.par.con.2022.117
For citation:
Dontseva E.A., Pilipenko P.I., Shnayder N.A., Petrova M.M., Nasyrova R.F. Prevalence of anticonvulsant-induced vitamin D deficiency. Epilepsy and paroxysmal conditions. 2022;14(3):304-315. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.117
ВВЕДЕНИЕ / INTRODUCTION
Научные исследования последних лет существенно расширили представления о роли витамина D в организме человека. Первой и важной предпосылкой для суждения о широком внескелетном спектре его эффектов явилось то, что рецепторы витамина D экспрессируются практически во всех тканях [1]. Это свидетельствует о важной роли витамина D в различных физиологических процессах. В настоящее время показано, что витамин D через свои рецепторы участвует в регуляции до 10% всех генов человека [2–5].
Известно, что противоэпилептические препараты (ПЭП) могут изменять обмен витамина D у пациентов, страдающих эпилепсией. В связи с этим препараты витамина D предлагают рассматривать как компонент симптоматической терапии ПЭП-индуцированных нежелательных реакций (НР), а также болезнь-модифицирующей терапии эпилепсии, поскольку на животной модели и на людях показан потенциальный противоэпилептический эффект этого нутриента [6–10].
В последние годы стало очевидно, что длительное (более 2 лет) применение ПЭП ассоциировано со снижением минеральной плотности костей (МПК), особенно при использовании энзим-индуцирующих ПЭП у детей и у лиц старше 40 лет. ПЭП-индуцированные дефицит витамина D и остеопороз отмечены и у пациентов, принимающих энзим-ингибирующие ПЭП. Описано усиление обмена витамина D в костной ткани и повышение костной резорбции у больных на фоне приема ПЭП [11–15].
Цель – анализ исследований частоты встречаемости дефицита витамина D, индуцированного приемом ПЭП, у пациентов с эпилепсией.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Проведен поиск полнотекстовых публикаций на русском и английском языках в базах данных еLibrary, PubMed/MEDLINE, ClinicalKey, Google Scholar за последние 5 лет (с января 2016 г. по декабрь 2021 г.). Поиск осуществляли с использованием ключевых слов и их комбинаций на русском и английском языках: «эпилепсия» (“epilepsy”), «антиконвульсант» (“anticonvulsant”), «противоэпилептический препарат» (“antiepileptic drug”), «нежелательная реакция» (“adverse reaction”), «дефицит витамина D» (“vitamin D deficiency”), «минеральная плотность костей» (“bone mineral density”). Анализировали оригинальные исследования, систематические обзоры, метаанализы, кокрейновские обзоры. Исключали абстракты, если отсутствовал полный доступ к публикации, тезисы конференций, постеры, исследования с сомнительными результатами. Для подготовки систематического обзора использовали руководство PRISMA (англ. Preferred Reporting Items for Systematic reviews and MetaAnalyses) 2020 г.
После получения результатов поиска в указанных базах данных исключали вручную дублирующие публикации. На этом этапе была сформирована первичная база текстов. Затем проведен поиск среди списков литературы отобранных эпидемиологических, клинических и экспериментальных исследований, что позволило выявить дополнительные источники.
В базе данных PubMed/MEDLINE идентифицировано 425 публикаций, среди которых требуемым характеристикам соответствовала 61, из них 7 были квалифицированы как дублирующие. В базе данных еLibrary найдено 23 статьи, среди которых искомым характеристикам соответствовали 11, из них 2 были дублирующие. Таким образом, в анализ включено 54 зарубежных и 9 отечественных публикаций.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Антиконвульсант-индуцированный дефицит витамина D у детей / Аnticonvulsant-induced vitamin D deficiency in children
Целью исследования Y.J. Lee et al. (2015 г.) [16], проведенного в Таиланде, было изучение распространенности и факторов риска дефицита витамина D у детей с эпилепсией на фоне приема ПЭП. Сывороточный уровень 25(ОН)D3 изучали на старте приема ПЭП и в динамике с интервалом 6 и 12 мес. За дефицит витамина D принимали уровень 25(ОН)D3 25 нг/мл и ниже, а за недостаточность – уровень 21–29 нг/мл. Средний возраст детей составил 7,4±5,4 года, средняя продолжительность приема ПЭП – 1,8±0,8 года. По сравнению со стартом приема ПЭП к окончанию периода наблюдения дефицит и недостаточность витамина D были диагностированы в 56,6% и 79,0% случаев соответственно. Средний сывороточный уровень 25(ОН)D3 на старте приема ПЭП составил 31,1±14,7 нг/мл, а к концу периода исследования статистически значимо снизился до 22,2±14,9 нг/мл (р<0,01). Негативный эффект на уровень 25(ОН)D3 в сыворотке крови оказывали следующие факторы: политерапия ПЭП (–16,0±13,6 нг/мл), длительность приема ПЭП 2 года и более (–23,5±9,1 нг/мл). Возраст, этиология эпилепсии, исходы эпилептических приступов, а также тип ПЭП (энзим-индуцирующие и неэнзим-индуцирующие) не оказывали статистически значимого отдаленного эффекта на степень выраженности снижения 25(ОН)D3 в сыворотке крови у детей с эпилепсией. По мнению авторов, высокая пропорция детей с ПЭП-индуцированным дефицитом витамина D и статистически значимое снижение уровня его активного метаболита в сыворотке крови при длительном приеме ПЭП, особенно в режиме политерапии, объясняют важность динамического контроля сывороточного уровня 25(ОН)D3 у детей с эпилепсией как на старте назначения ПЭП, так и в динамике через 6 и 12 мес для своевременного назначения и индивидуального (персонализированного) подхода к выбору дозы препаратов витамина D [16].
C.Y. Fong et al. (2014 г.) [17] исследовали распространенность и факторы риска дефицита витамина D среди детей с эпилепсией на фоне длительного приема ПЭП в Австралии зимой 2011 г. Дефицит витамина D диагностировался при уровне 25(ОН)D3 20 нг/мл и ниже, недостаточность – при диапазоне 21–29 нг/мл. Дефицит витамина D идентифицирован в 22% случаев, недостаточность – в 41% случаев. В результате статистического анализа с использованием множественной логистической регрессии было показано, что дети, получающие более двух ПЭП, или с генетической предрасположенностью статистически значимо чаще имели дефицит витамина D (p<0,01). Авторы обратили внимание на то, что пропорция детей с эпилепсией, длительно принимающих ПЭП, высока независимо от их проживания в субтропиках. Таким образом, мониторинг витамина D в сыворотке крови и дополнительное назначение препаратов витамина D важны при ведении детей с эпилепсией, проживающих в Австралии [17].
C.Y. Fong et al. (2016 г.) [18] провели кросс-секционное исследование роли длительного приема ПЭП как фактора риска развития дефицита витамина D у детей, страдающих эпилепсией, в Малайзии. Все пациенты наблюдались амбулаторно около 1 года (с апреля 2014 г. по апрель 2015 г.). Авторы детально анализировали пубертатный статус, степень пигментации кожи, продолжительность пребывания на солнце, физическую активность, особенности диеты (поступление витамина D, кальция (Са) и фосфора (Р) с пищей), антропометрию и результаты биохимических исследований (25(ОН)D3, щелочная фосфатаза (ЩФ), Са, Р, паратгормон) у всех включенных в исследование пациентов. Дефицит витамина D устанавливали в случае выявления уровня 25(ОН)D3 в сыворотке крови ниже 30 нмоль/л. Медиана возраста детей составила 12,3 года. Сывороточный уровень 25(ОН)D3 варьировал от 7,5 до 140,9 нмоль/л. Дефицит витамина D идентифицирован в 22,5% случаев, недостаточность – в 19,7%. Авторами показано, что политерапия (более одного ПЭП) статистически значимо (p<0,01) повышает риск развития дефицита витамина D у детей с эпилепсией (отношение шансов (ОШ) 2,16). Кроме того, предикторами дефицита витамина D у детей с эпилепсией в Малайзии были: возраст старше 12 лет (ОШ 4,16; индийская этническая группа – ОШ 6,97), длительность пребывания на солнце 30–60 мин в день (ОШ 2,44), длительность экспозиции солнечных лучей менее 30 мин в день (ОШ 3,83), женский пол (ОШ 2,61). Исследователи пришли к выводу, что, несмотря на проживание в тропиках, высока пропорция малайзийских детей с эпилепсией, имеющих риск ПЭП-индуцированного развития дефицита витамина D. Целевые стратегии, включающие адъювантную терапию препаратами витамина D, и изменение стиля жизни, в т.ч. увеличение продолжительности пребывания детей на солнце, могут снизить частоту развития дефицита витамина D, индуцированного приемом ПЭП [18].
Негативное влияние препаратов вальпроевой кислоты (ВК) на уровень 25(ОН)D3 в сыворотке крови у детей в исследовании, описанном ранее, подтверждено и в метаанализе Z. Xu et al. (2019 г.) [19]. Показано статистически значимое снижение сывороточного уровня 25(ОН)D3 у детей, получающих монотерапию ВК. При этом метаанализ показал прогрессирующий кумулятивный негативный эффект ВК на сывороточный уровень 25(ОН)D3 у детей с эпилепсией. Авторы продемонстрировали, что длительная терапия ВК является причиной дефицита витамина D как ПЭП-индуцированной НР у детей различных этнических групп, проживающих в различных странах (независимо от уровня инсоляции) [19].
E.P. Vildiz et al. (2017 г.) [20] провели ретроспективное исследование дефицита витамина D как потенциальной ПЭП-индуцированной НР у детей на основании продолженного определения уровня 25(ОН)D3 в сыворотке крови. Для реализации поставленной цели авторы включили в исследование пациентов, которым впервые назначались ПЭП только в осенние месяцы в период между 2000 и 2014 гг. Выполняли анализ неврологического статуса, результатов магнитно-резонансной томографии (МРТ) головного мозга, соматического статуса, типа и длительности приема ПЭП и сывороточного уровня 25(ОН)D3, а также биохимических маркеров минерального обмена в сыворотке (ЩФ, Са, Р) у всех пациентов. Дефицит витамина D идентифицировали в случае регистрации уровня 25(ОН)D3 ниже 20 нг/мл, а недостаточность – при уровне 21–29 нг/мл. Средний возраст детей составил 9,6±4,3 года. Снижение среднего сывороточного уровня 25(ОН)D3 на фоне приема ПЭП от базового уровня варьировало от 24,4±1,6 до 19,6±10,7 нг/мл к окончанию периода исследования. При этом к концу периода наблюдения дефицит витамина D диагностировался в 54% случаев, а недостаточность – в 25%. Статистически значимыми факторами риска дефицита витамина D у наблюдаемых детей была монотерапия препаратами ВК, карбамазепина (КМЗ), леветирацетама (ЛЕВ) и фенобарбитала (ФБ) [20].
В работе M. Sreedharan et al. (2018 г.) [21] представлены результаты кросс-секционного исследования, проведенного у детей с эпилепсией в Индии с июня 2012 г. по май 2013 г. Целью было изучение эффекта монотерапии КМЗ и препаратами ВК на уровень 25(ОН)D3 в сыворотке крови. Возраст детей варьировал от 2 до 12 лет. Все они получали монотерапию КМЗ или ВК в течение 6 мес. Авторы показали, что 60,7% детей, принимающих КМЗ, и 35,7% детей, получающих ВК, имели признаки дефицита витамина D (уровень 25(ОН)D3 ниже 25 нг/мл) по сравнению с 27,8% в группе контроля. Уровень ЩФ в сыворотке крови по сравнению с контролем повышался только у детей, получавших КМЗ. Таким образом, оба изучаемых ПЭП негативно влияют на сывороточный уровень витамина D. При этом статистически значимо чаще дефицит витамина D как ПЭП-индуцированная НР развивается на фоне длительного приема КМЗ по сравнению с ВК (p<0,05) [21].
T. Durá-Travé et al. (2018 г.) [22] изучили влияние монотерапии ВК и ЛЕВ на развитие дефицита витамина D у детей с эпилепсией в Испании. Средняя доза ВК и ЛЕВ составила 20,7±4,7 и 24,1±7,9 мг/кг/сут соответственно, средняя длительность приема ВК – 2,5±1,4 года, ЛЕВ – 2,3±1,6 года. Средний уровень Ca и 25(ОН)D3 в сыворотке крови у детей с эпилепсией был статистически значимо ниже по сравнению с группой контроля (р<0,05). Авторами найдена отрицательная корреляционная связь (р<0,01) между уровнем 25(ОН)D3 и уровнем ВК в сыворотке (OШ 1,9; 95% ДИ 1,1–3,8). Частота встречаемости дефицита витамина D у детей, получавших ВК (24,1%) и ЛЕВ (35,5%), была статистически значимо выше (р<0,05), чем в группе контроля (14%). Статистический анализ с использованием метода множественной логистической регрессии показал, что монотерапия ЛЕВ (ОШ 3,3) или препаратами ВК (ОШ 1,9) ассоциирована с высоким риском дефицита витамина D [22]. Обращает на себя внимание то, что риск развития дефицита витамина D у детей, получавших ЛЕВ, был выше по сравнению с принимавшими ВК. Эти выводы коррелируют с результатами исследования A. Attilakos et al. (2018 г.) в Греции, изучавших статус витамина D у детей с эпилепсией, получавших монотерапию ЛЕВ [23].
Использование топирамата (ТПМ) у детей приводит к изменению содержания Са, Р и ЩФ в сыворотке крови, а также к снижению МПК, что связывают с изменением обмена витамина D [24].
Антиконвульсант-индуцированный дефицит витамина D и остеопороз у взрослых / Аnticonvulsant-induced vitamin D deficiency and osteoporosis in adults
У взрослых пациентов с эпилепсией, получающих различные ПЭП, также развивается дефицит витамина D. Так, длительное лечение габапентином (ГПН) может привести к статистически и клинически значимому снижению МПК в тазобедренном суставе и поясничном отделе позвоночника [25–31].
В нескольких исследованиях сообщалось о снижении сывороточного уровня 25(ОН)D3, повышении маркеров резорбции костей [32] и значительном снижении МПК при применении окскарбазепина (ОКС) [33].
Показано, что долгосрочный (более 1 года) прием препаратов ВК приводит к уменьшению МПК у взрослых пациентов, страдающих эпилепсией, хотя мультивариантный анализ не продемонстрировал статистически значимой ассоциации между изменениями МПК и паратгормоном, а также уровнем ЩФ и Р в сыворотке крови [34]. Другие авторы связывают эффект ВК со снижением уровня Са и уменьшением активности остеобластов [35].
S. Nagarjukonda et al. (2016 г.) [36] провели исследование уровня 25(ОН)D3 в сыворотке крови у пациентов с эпилепсией на фоне моно- и политерапии ПЭП и в группе контроля. Авторы анализировали также степень экспозиции солнечных лучей, физическую активность и особенности диеты у лиц, включенных в исследование. Среди больных эпилепсией 41% имел дефицит витамина D, 49% – умеренное снижение сывороточного уровня 25(ОН)D3, и лишь в 9% случаев отмечался нормальный уровень этого метаболита. Однако статистически значимых различий сывороточного уровня 25(ОН)D3 в зависимости от пола пациентов с эпилепсией и людей без эпилепсии найдено не было, как и в зависимости от моно- и политерапии ПЭП и степени резистентности эпилептических приступов к ПЭП (p>0,05). Авторы пришли к выводу, что люди, страдающие эпилепсией, нуждаются в коррекции дефицита витамина D более чем в 40% случаев [36].
У пациентов с эпилепсией, получавших ТПМ, сообщалось о легком или умеренном метаболическом ацидозе, приводящем к появлению камней в почках, ТПМиндуцированных остеомаляции и/или остеопороза [37]. Другое исследование с участием 36 женщин, длительное время получавших монотерапию ТПМ, продемонстрировало более низкий уровень паратгормона, умеренную гипокальциемию и повышение метаболизма костной ткани [38].
V. Chandrasekaran et al. (2001 г.) [39] провели кросссекционное исследование ПЭП-индуцированного остеопороза. Было показано, что качество костной ткани, оцененное с помощью показателей МПК и количественного ультразвукового исследования пяточной кости, ниже у мужчин (возраст 24–73 года) по сравнению с женщинами (21–94 года), принимающими ПЭП. Авторы пришли к выводу, что мониторинг здоровья костей, ранняя диагностика ПЭП-индуцированного дефицина витамина D и ПЭП-индуцированного остеопороза у пользователей ПЭП является оправданным [39]. H.A. Valsamis et al. [40] продемонстрировали, что эпилептические приступы не объясняют большинство падений у больных эпилепсией, при этом 2/3 падений происходят в отсутствие судорожных приступов. Падения приводят к высокому риску переломов позвоночника и шейки бедра у пациентов с эпилепсией, имеющих ПЭПиндуцированный остеопороз [40]. Это может быть связано с тем, что некоторые ПЭП имеют неврологические НР, включая сонливость, атаксию, тремор [41].
Антиконвульсант-индуцированное нарушение минеральной плотности костной ткани / Аnticonvulsant-induced bone mineral density disorders
Дефицит витамина D, вызванный приемом ПЭП, является одной из ведущих причин антиконвульсант-индуцированного нарушения минеральной плотности и роста костей у детей и остеопороза у взрослых (рис. 1) [31][42]. Дефицит витамина D, необходимого для роста и ремоделирования костей, обычно рассматривается как причина потери костной массы у пациентов с эпилепсией [43].
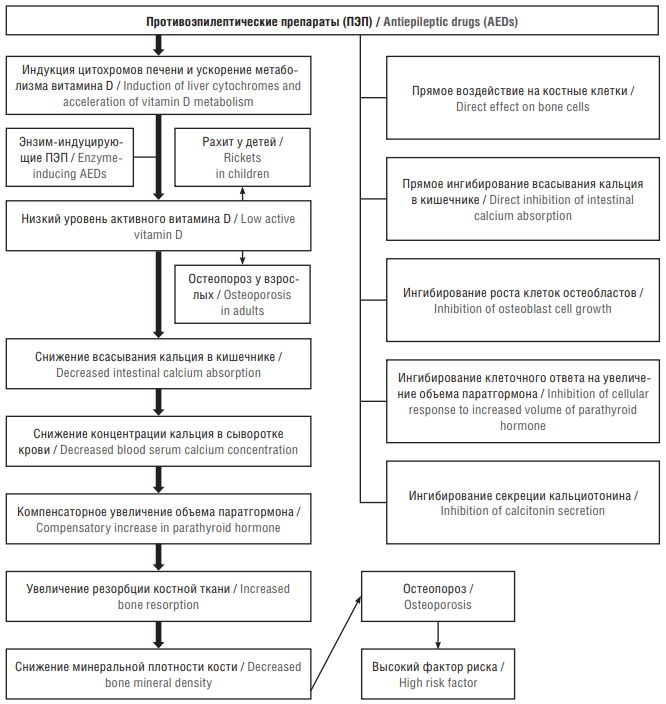
Рисунок 1. Роль дефицита витамина D в развитии остеопороза, индуцированного приемом противоэпилептических препаратов, у детей и взрослых [31]
Figure 1. The role of vitamin D deficiency in development of antiepileptic drugs-induced osteoporosis in children and adults [31]
Показано, что индукция системы цитохрома Р450 печени (CYP450) ускоряет катаболизм витамина D в его полярные неактивные метаболиты и ослабляет биологически активные формы. Пониженные сывороточные уровни 25(OH)D отмечаются как у взрослых, так и у детей, страдающих эпилепсией [44–48]. Однако обнаружение дефицита витамина D наблюдается не во всех исследованиях, оценивающих влияние ПЭП на здоровье костей, а некоторые авторы приводят доказательства увеличения метаболизма костной ткани даже при отсутствии дефицита витамина D [49–50]. Высказано предположение, что ПЭП первой и второй генераций могут влиять на метаболизм костей через механизмы, связанные не только с индукцией печеночных ферментов.
В исследовании H.C. Fan et al. (2016 г.) [51] более 50% пациентов с эпилепсией, принимающих ПЭП, сообщали о костных аномалиях. Изоферменты CYP450 индуцируются различными группами ПЭП, особенно классическими, такими как бензодиазепины, КМЗ, фенитоин (ФТ) и ВК. Индукция изоферментов CYP450 может вызывать дефицит витамина D, гипокальциемию, повышенный риск переломов и изменение костного обмена, что приводит к нарушению МПК. Новые ПЭП, такие как ЛЕВ, ОКС, ламотриджин, TПМ, ГПН и вигабатрин (ВБ), имеют более широкий спектр безопасности и лучше переносятся, чем классические препараты. Однако влияние этих ПЭП на обмен витамина D и здоровье костей противоречиво. Особое внимание авторы уделили изучению влияния ПЭП на рост костей и метаболизм Са и Р в костях скелета и подчеркнули необходимость настороженности врачей общей практики, неврологов и психиатров в отношении своевременного выявления клинически значимого снижения сывороточного уровня витамина D у больных эпилепсией, требующего назначения препаратов витамина D для коррекции его дефицита, снижения дозы или отмены ПЭП во избежание серьезных нарушений здоровья пациентов и качества их жизни [51].
В связи с тем что низкий уровень 25(ОН)D3 в сыворотке крови часто индуцируется приемом ПЭП, остеопения/ остеопороз являются частым коморбидным эпилепсии состоянием. При этом у детей до 12 лет и у пожилых пациентов с эпилепсией частота ПЭП-индуцированного остеопороза выше, чем в среднем в популяции. Несмотря на растущие с возрастом показатели распространенности и частоты развития остеопороза, исследований, специально изучающих риск снижения МПК и остеопороза позвоночника у людей, принимающих ПЭП, мало [52]. Биологический механизм еще полностью не изучен, но может включать взаимодействие ПЭП с метаболизмом витамина D и последующим метаболизмом костей [39]. Малоподвижность и сниженный уровень инсоляции наряду с приемом ПЭП повышают риск дефицита витамина D у детей и взрослых с фармакорезистентной (труднокурабельной) эпилепсией, длительно пребывающих в стационаре или дома. Показано, что более чем у половины взрослых пациентов стационаров регистрируется дефицит витамина D и ПЭП-индуцированный остеопороз. Больные эпилепсией с частыми приступами, которые вынуждены долго оставаться в домашних условиях, подвержены более высокому риску ПЭПиндуцированного дефицита витамина D из-за недостаточного воздействия солнечного света. Кроме того, пребывание на солнце часто ограничивают у пациентов, которые принимают энзим-индуцирующие ПЭП, такие как КМЗ и ОКЗ, чтобы уменьшить возникновение сыпи, вызванной солнечным светом [53].
Эта совокупность эффектов была продемонстрирована как у детей, так и у взрослых и обычно наблюдается при применении ПЭП, которые индуцируют изоферменты цитохрома CYP450, особенно дифенина, КМЗ и ФБ [41]. Ряд энзим-индуцирующих ПЭП могут увеличивать катаболизм витамина D, что приводит к гипофосфатемии и гипокальциемии [54–56]. Основные негативные эффекты ПЭП в аспекте рассматриваемой нами междисциплинарной проблемы включают гипокальциемию, гипофосфатемию, снижение уровня активных метаболитов витамина D в сыворотке крови, повышение уровня паратгормона и изменение маркеров метаболизма костной ткани. ПЭП, индуцирующие изоферменты CYP450, такие как ФТ, ФБ, КМЗ и примидон, являются наиболее распространенными препаратами, связанными с нарушением МПК (табл. 1). В то же время данные о влиянии ВК и новых ПЭП, таких как ЛМТ, ГПН, ВБ, ЛЕВ и ТПМ (табл. 2), на костный метаболизм и МПК продолжают активно изучаться, поскольку являются противоречивыми [31].
Таблица 1. Энзим-индуцирующие противоэпилептические препараты, которые могут предрасполагать к остеопорозу
Table 1. Enzyme-inducing antiepileptic drugs predisposing to osteoporosis
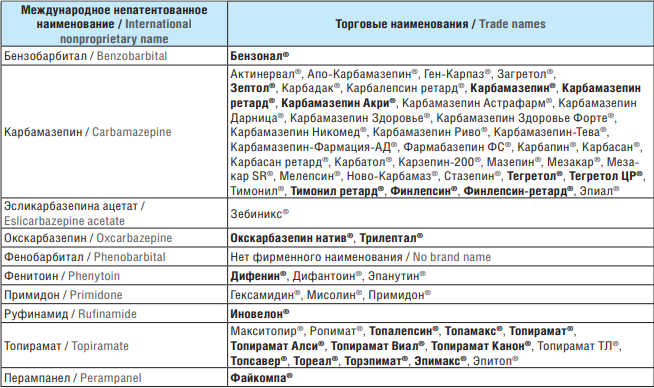
Примечание. Жирным шрифтом выделены торговые наименования, зарегистрированные в Российской Федерации. Торговые наименования, не выделенные жирным шрифтом, не зарегистрированы в Российской Федерации.
Note. Trade names registered in the Russian Federation are highlighted in bold. Trade names not highlighted in bold are not registered in the Russian Federation.
Таблица 2. Энзим-неиндуцирующие противоэпилептические препараты, которые могут предрасполагать к остеопорозу
Table 2. Enzyme non-inducing antiepileptic drugs predisposing to osteoporosis
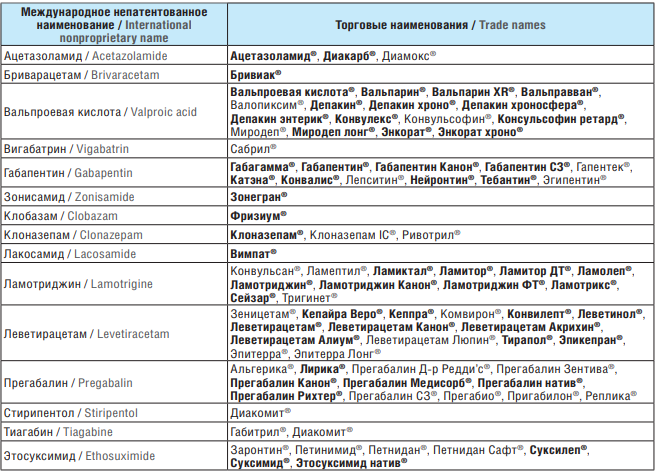
Примечание. Жирным шрифтом выделены торговые наименования, зарегистрированные в Российской Федерации. Торговые наименования, не выделенные жирным шрифтом, не зарегистрированы в Российской Федерации.
Note. Trade names registered in the Russian Federation are highlighted in bold. Trade names not highlighted in bold are not registered in the Russian Federation.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Эпилепсия – распространенное заболевание у детей и взрослых. Энзим-индуцирующие и энзим-ингибирующие ПЭП, а также ПЭП, не метаболизирующиеся в печени, могут оказывать негативное влияние на обмен витамина D у больных эпилепсией. Однако в настоящее время в стандартные протоколы лечения таких пациентов не включены нутриенты и витаминно-минеральные комплексы, содержащие витамин D. Результаты проспективных эпидемиологических и клинико-лабораторных исследований свидетельствуют о том, что частота встречаемости ПЭП-индуцированного дефицита витамина D высока и достигает 40% и более как у детей, так и у взрослых. Регион проживания пациентов с эпилепсией значимо не влияет на данный показатель, хотя факт низкой инсоляции необходимо учитывать.
В целом проведенный нами обзор исследований, посвященных ПЭП-индуцированному дефициту витамина D и, как следствие, нарушению минерализации костной ткани и остеомаляции/остеопороза, свидетельствует о высокой актуальности рассматриваемой междисциплинарной проблемы и необходимости внедрения лабораторного скрининга недостаточности и дефицита витамина D среди детей и взрослых пациентов, страдающих эпилепсией. Особое внимание следует уделять маломобильным пациентам с фармакорезистентной (труднокурабельной) эпилепсией, а также больным, проживающим в регионах с низким уровнем инсоляции. Своевременное назначение витамина D пациентам с эпилепсией является оправданным. Такой подход позволит снизить риск ПЭП-индуцированных нарушений минерализации, развития и роста костей у детей, а также остеопороза и низкоэнергетических переломов костей, в т.ч. шейки бедра и позвоночника, у взрослых больных эпилепсией.
Список литературы
1. Шнайдер Н.А., Донцева Е.А., Насырова Р.Ф. Витамин Д и болезнь Альцгеймера. Вестник Смоленской государственной медицинской академии. 2021; 20 (2): 66–76. https://doi.org/10.37903/vsgma.2021.2.9.
2. Morris H.A., Anderson P.H. Autocrine and paracrine actions of vitamin D. Clin Biochem Rev. 2010; 31 (4): 129–38.
3. Поворознюк В.В., Резниченко Н.А., Майлян Э.А. Внескелетные эффекты витамина D. Боль. Суставы. Позвоночник. 2014; 1 (2): 19–25.
4. Holick M.F., Binkley N.C., Bischoff-Ferrari H.A., et al. Evaluation, treatment, and prevention of vitamin D deficiency: an Endocrine Society clinical practice guideline. J Clin Endocrin Metab. 2011; 96 (7): 1911–30. https://doi.org/10.1210/jc.2011-0385.
5. Pannu P.K., Calton E.K., Soares M.J. Calcium and vitamin D in obesity and related chronic disease. Adv Food Nutr Res. 2016; 77: 57–100. https://doi.org/10.1016/bs.afnr.2015.11.001.
6. Williams C., Netzloff M., Folkerts L., et al. Vitamin D metabolism and anticonvulsant therapy: effect of sunshine on incidence of osteomalacia. South Med J. 1984; 77 (7): 834–6, 842. https://doi.org/10.1097/00007611-198407000-00011.
7. Robien K., Oppeneer S.J., Kelly J.A., Hamilton-Reeves J.M. Drugvitamin D interactions: a systematic review of the literature. Nutr Clin Pract. 2013; 28 (2): 194–208. https://doi.org/10.1177/0884533612467824.
8. Khalifah R.A., Hudairi A., Homyani D.A., et al. Vitamin D supplementation to prevent vitamin D deficiency for children with epilepsy: randomized pragmatic trial protocol. Medicine (Baltimore). 2018; 97 (40): 12734. https://doi.org/10.1097/MD.0000000000012734.
9. Stephen L.J., Harden C., Tomson T., Brodie M.J. Management of epilepsy in women. Lancet Neurol. 2019; 18 (5): 481–91. https://doi.org/10.1016/S1474-4422(18)30495-2.
10. Holló A., Clemens Z., Lakatos P. Epilepsy and vitamin D. Int J Psychol Neurosci. 2014; 124 (6): 387–93. https://doi.org/10.3109/00207454.2013.847836.
11. Tombini M., Palermo A., Assenza G., et al. Calcium metabolism serum markers in adult patients with epilepsy and the effect of vitamin D supplementation on seizure control. Seizure. 2018; 58: 75–81. https://doi.org/10.1016/j.seizure.2018.04.008.
12. Dussault P.M., Lazzari A.A. Epilepsy and osteoporosis risk. Curr Opin Endocrinol Diabetes Obes. 2017; 24 (6): 395–401. https://doi.org/10.1097/MED.0000000000000366.
13. Diemar S.S., Sejling A.S., Eiken P., et al. An explorative literature review of the multifactorial causes of osteoporosis in epilepsy. Epilepsy Behav. 2019; 100 (Pt. A): 106511. https://doi.org/10.1016/j.yebeh.2019.106511.
14. Parveen B., Tripathi M., Vohora D. A cross-sectional study to assess the modulation of Wnt inhibitors following anti-epileptic drug therapy and their correlation with vitamin D and receptor activator of nuclear factor κB ligand in Indian women with epilepsy. Basic Clin Pharmacol Toxicol. 2018; 123 (3): 271–6. https://doi.org/10.1111/ bcpt.12996.
15. Teagarden D.L., Meador K.J., Loring D.W. Low vitamin D levels are common in patients with epilepsy. Epilepsy Res. 2014; 108 (8): 1352–6. https://doi.org/10.1016/j.eplepsyres.2014.06.008.
16. Lee Y.J., Park K.M., Kim Y.M., et al. Longitudinal change of vitamin D status in children with epilepsy on antiepileptic drugs: prevalence and risk factors. Pediatr Neurol. 2015; 52 (2): 153–9. https://doi.org/10.1016/j.pediatrneurol.2014.10.008.
17. Fong C.Y., Riney C.J. Vitamin D deficiency among children with epilepsy in South Queensland. J Child Neurol. 2014; 29 (3): 368–73. https://doi.org/10.1177/0883073812472256.
18. Fong C.Y., Kong A.N., Poh B.K., et al. Vitamin D deficiency and its risk factors in Malaysian children with epilepsy. Epilepsia. 2016; 57 (8): 1271–9. https://doi.org/10.1111/epi.13443epilepsy.
19. Xu Z., Jing X., Li G., et al. Valproate decreases vitamin D levels in pediatric patients with epilepsy. Seizure. 2019; 71: 60–5. https://doi.org/10.1016/j.seizure.2019.06.009.
20. Yildiz E.P., Poyrazoglu Ş., Bektas G., et al. Potential risk factors for vitamin D levels in medium- and long-term use of antiepileptic drugs in childhood. Acta Neurol Belg. 2017; 117 (2): 447–53. https://doi.org/10.1007/s13760-017-0775-x.
21. Sreedharan M., Devadathan K., Mohammed Kunju P.A., et al. Vitamin D deficiency in ambulant children on carbamazepine or sodium valproate monotherapy. Indian Pediatr. 2018; 55 (4): 307–10.
22. Durá-Travé T., Gallinas-Victoriano F., Malumbres-Chacón M., et al. Vitamin D deficiency in children with epilepsy taking valproate and levetiracetam as monotherapy. Epilepsy Res. 2018; 139: 80–4. https://doi.org/10.1016/j.eplepsyres.2017.11.013.
23. Attilakos A., Tsirouda M., Dinopoulos A., et al. Vitamin D status in children with epilepsy treated with levetiracetam monotherapy. Epilepsy Res. 2018; 148: 116. https://doi.org/10.1016/j.eplepsyres.2018.09.003.
24. Zhang J., Wang K.X., Wei Y., et al. Effect of topiramate and carbamazepine on bone metabolism in children with epilepsy. Zhongguo Dang Dai Er Ke Za Zhi. 2010; 12 (2): 96–8 (на кит. яз.).
25. Rowan A.J., Ramsay R.E., Collins J.F., et al. New onset geriatric epilepsy: a randomized study of gabapentin, lamotrigine, and carbamazepine. Neurology. 2005; 64 (11): 1868–73. https://doi.org/10.1212/01.WNL.0000167384.68207.3E.
26. Mattson R.H., Gidal B.E. Fractures, epilepsy, and antiepileptic drugs. Epilepsy Behav. 2004; 5 (2): 36–40. https://doi.org/10.1016/j.yebeh.2003.11.030.
27. Vestergaard P., Tigaran S., Rejnmark L., et al. Fracture risk is increased in epilepsy. Acta Neurol Scand. 1999; 99 (5): 269–75. https://doi.org/10.1111/j.1600-0404.1999.tb00675.x.
28. Espallargues M., Sampietro-Colom L., Estrada M.D., et al. Identifying bone-mass-related risk factors for fracture to guide bone densitometry measurements: a systematic review of the literature. Osteoporos Int. 2001; 12 (10): 811–22. https://doi.org/10.1007/s001980170031.
29. Meier C., Kraenzlin M.E. Antiepileptics and bone health. Ther Adv Musculoskelet Dis. 2011; 3 (5): 235–43. https://doi.org/10.1177/1759720X11410769.
30. Koppel B.S., Harden C.L., Nikolov B.G., Labar D.R. An analysis of lifetime fractures in women with epilepsy. Acta Neurol Scand. 2005; 111 (4): 225–8. https://doi.org/10.1111/j.1600-0404.2005.00399.x.
31. Arora E., Singh H., Gupta Y.K. Impact of antiepileptic drugs on bone health: need for monitoring, treatment, and prevention strategies. J Family Med Prim Care. 2016; 5 (2): 248–53. https://doi.org/10.4103/2249-4863.192338.
32. Cansu A., Yesilkaya E., Serdaroğlu A., et al. Evaluation of bone turnover in epileptic children using oxcarbazepine. J Pediatr Neurol. 2008; 39 (4): 266–71. https://doi.org/10.1016/j.pediatrneurol.2008.07.001.
33. Vestergaard P., Rejnmark L., Mosekilde L. Fracture risk associated with use of antiepileptic drugs. Epilepsia. 2004; 45 (11): 1330–7. https://doi.org/10.1111/j.0013-9580.2004.18804.x.
34. Nicholas J.M., Ridsdale L., Richardson M.P., et al. Fracture risk with use of liver enzyme inducing antiepileptic drugs in people with active epilepsy: cohort study using the general practice research database. Seizure. 2013; 22 (1): 37–42. https://doi.org/10.1016/j.seizure.2012.10.002.
35. Fan H.C., Wang S.Y., Peng Y.J., Lee H.S. Valproic acid impacts the growth of growth plate chondrocytes. Int J Environ Res Public Health. 2020; 17 (10): 3675. https://doi.org/10.3390/ijerph17103675.
36. Nagarjunakonda S., Amalakanti S., Uppala V., et al. Vitamin D in epilepsy: vitamin D levels in epilepsy patients, patients on antiepileptic drug polytherapy and drug-resistant epilepsy sufferers. Eur J Clin Nutr. 2016; 70 (1): 140–2. https://doi.org/10.1038/ejcn.2015.127.
37. Verrotti A., Coppola G., Parisi P., et al. Bone and calcium metabolism and antiepileptic drugs. Clin Neurol Neurosurg. 2010; 112 (1): 1–10. https://doi.org/10.1016/j.clineuro.2009.10.011.
38. Heo K., Rhee Y., Lee H.W., et al. The effect of topiramate monotherapy on bone mineral density and markers of bone and mineral metabolism in premenopausal women with epilepsy. Epilepsia. 2011; 52 (10): 1884–9. https://doi.org/10.1111/j.1528-1167.2011.03131.x.
39. Chandrasekaran V., Pasco J.A., Stuart A.L., et al. Anticonvulsant use and bone health in a population-based study of men and women: cross-sectional data from the Geelong Osteoporosis Study. BMC Musculoskelet Disord. 2021; 22 (1): 172. https://doi.org/10.1186/s12891-021-04042-w.
40. Valsamis H.A., Arora S.K., Labban B., et al. Antiepileptic drugs and bone metabolism. Nutr Metab. 2006; 3: 36. https://doi.org/0.1186/1743-7075-3-36.
41. Ensrud K.E., Walczak T.S., Blackwell T., et al. Antiepileptic drug use increases rates of bone loss in older women: a prospective study. Neurology. 2004; 62 (11): 2051–7. https://doi.org/10.1212/01.wnl.0000125185.74276.d2.
42. Пигарова Е.А., Рожинская Л.Я., Белая Ж.Е. и др. Клинические рекомендации Российской ассоциации эндокринологов по диагностике, лечению и профилактике дефицита витамина D у взрослых. Проблемы эндокринологии. 2016; 62 (4): 60–84. https://doi.org/10.14341/probl201662460-84.
43. Andress D.L, Ozuna J., Tirschwell D., et al. Antiepileptic drug-induced bone loss in young male patients who have seizures. Arch Neurol. 2002; 59 (5): 781–6. https://doi.org/10.1001/archneur.59.5.781.
44. Christakos S., Dhawan P., Verstuyf A., et al. Vitamin D: metabolism, molecular mechanism of action, and pleiotropic effects. Physiol Rev. 2016; 96 (1): 365–408. https://doi.org/10.1152/physrev.00014.2015.
45. Saponaro F., Saba A., Zucchi R. An update on Vitamin D metabolism. Int J Mol Sci. 2020; 21 (18): 6573. https://doi.org/10.3390/ijms21186573.
46. Wang P., Qin X., Liu M., Wang X. The burgeoning role of cytochrome P450-mediated vitamin D metabolites against colorectal cancer. Pharmacol Res. 2018; 133: 9–20. https://doi.org/10.1016/j.phrs.2018.04.022.
47. Maksymchuk O.V., Kashuba V.I. Altered expression of cytochrome P450 enzymes involved in metabolism of androgens and vitamin D in the prostate as a risk factor for prostate cancer. Pharmacol Rep. 2020; 72 (5): 1161–72. https://doi.org/10.1007/s43440-020-00133-y.
48. Qiu J., Guo H., Li L., et al. Valproic acid therapy decreases serum 25-hydroxyvitamin D level in female infants and toddlers with epilepsy – a pilot longitudinal study. J Biomed Res. 2020; 35 (1): 61–7. https://doi.org/10.7555/JBR.34.20200057.
49. Lee R., Lyles K., Sloane R., et al. The association of newer anticonvulsant medications and bone mineral density. Endocr Pract. 2012; 14: 1–22. https://doi.org/10.4158/EP12119.OR.
50. Boluk A., Guzelipek M., Savli H., et al. The effect of valproate on bone mineral density in adult epileptic patients. Pharmacol Res. 2004; 50 (1): 93–7. https://doi.org/10.1016/j.phrs.2003.11.011.
51. Fan H.C., Lee H.S., Chang K.P., et al. The impact of anti-epileptic drugs on growth and bone metabolism. Int J Mol Sci. 2016; 17 (8): 1242. https://doi.org/10.3390/ijms17081242.
52. Lee R.H., Lyles K.W., Colón-Emeric C.A. Review of the effect of anticonvulsant medications on bone mineral density and fracture risk. Am J Geriatr Pharmacother. 2010; 8 (1): 34–46. https://doi.org/10.1016/j.amjopharm.2010.02.003.
53. Thomas M.K., Lloyd-Jones D.M., Thadhani R.I., et al. Hypovitaminosis D in medical inpatients. New Engl J Med. 1998; 338 (12): 777–83. https://doi.org/10.1056/NEJM199803193381201.
54. Pack A.M., Gidal B., Vazquez B. Bone disease associated with antiepileptic drugs. Cleve Clin J Med. 2004; 71 (Suppl. 2): S42–8. https://doi.org/10.3949/ccjm.71.suppl_2.s42.
55. Zhong R., Chen Q., Zhang X., et al. Bone mineral density loss in people with epilepsy taking valproate as a monotherapy: a systematic review and meta-analysis. Front Neurol. 2019; 10: 1171. https://doi.org/10.3389/fneur.2019.01171.
56. Suljic E.M., Mehicevic A., Mahmutbegovic N. Effect of long-term carbamazepine therapy on bone health. Med Arch. 2018; 72 (4): 262–6. https://doi.org/10.5455/medarh.2018.72.262-266.
Об авторах
Е. А. ДонцеваРоссия
Донцева Евгения Александровна – ассистент кафедры клинической неврологии и нейрогериатрии факультета повышения квалификации и профессиональной переподготовки врачей
Красный пр-т, д. 52, Новосибирск 630091
П. И. Пилипенко
Россия
Пилипенко Павел Иванович – д.м.н., профессор, заведующий кафедрой клинической неврологии и нейрогериатрии факультета повышения квалификации и профессиональной переподготовки врачей
Красный пр-т, д. 52, Новосибирск 630091
Н. А. Шнайдер
Россия
Шнайдер Наталья Алексеевна – д.м.н., профессор, ведущий научный сотрудник отделения персонализированной психиатрии и неврологии ; ведущий научный сотрудник центра коллективного пользования «Молекулярные и клеточные технологии»
WoS ResearcherID: M-7084-2014; РИНЦ SPIN-код: 1952-3043
ул. Бехтерева, д. 3, Санкт-Петербург 192019; ул. Партизана Железняка, д. 1, Красноярск 660022
М. М. Петрова
Россия
Петрова Марина Михайловна – д.м.н., профессор, заведующая кафедрой поликлинической терапии и семейной медицины с курсом последипломного образования
WoS ResearcherID: L-5623-2014; Scopus Author ID: 23987271200; РИНЦ SPIN-код: 3531-2179
ул. Партизана Железняка, д. 1, Красноярск 660022
Р. Ф. Насырова
Россия
Насырова Регина Фаритовна – д.м.н., главный научный сотрудник
РИНЦ SPIN-код: 3799-0099
ул. Бехтерева, д. 3, Санкт-Петербург 192019
Рецензия
Для цитирования:
Донцева Е.А., Пилипенко П.И., Шнайдер Н.А., Петрова М.М., Насырова Р.Ф. Частота встречаемости антиконвульсант-индуцированного дефицита витамина D. Эпилепсия и пароксизмальные состояния. 2022;14(3):304-315. https://doi.org/10.17749/2077-8333/epi.par.con.2022.117
For citation:
Dontseva E.A., Pilipenko P.I., Shnayder N.A., Petrova M.M., Nasyrova R.F. Prevalence of anticonvulsant-induced vitamin D deficiency. Epilepsy and paroxysmal conditions. 2022;14(3):304-315. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.117
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































