Перейти к:
Клинический случай пациентки с фокальной корковой дисплазией IIa, прилежащей к речевому центру: диагностический и лечебный алгоритмы
https://doi.org/10.17749/2077-8333/epi.par.con.2022.122
Аннотация
Представлен клинический случай пациентки с фармакорезистентной эпилепсией вследствие фокальной корковой дисплазии (ФКД), прилежащей непосредственно к речевой зоне в левой височной области. Диагностический поиск и переход от МРТ-негативной формы эпилепсии до структурной фокальной занял более 6 лет. Это обусловлено тем, что тип IIa ФКД визуализируется значительно хуже, чем тип IIb, МРТ-признаки IIa типа ФКД не столь впечатляю щие и данный тип дисплазии нередко пропускается. Функциональные методы исследования в эпилептологии, такие как видеоэлектроэнцефалографический мониторинг, позитронно-эмиссионная томография головного мозга с 18F-фтордезоксиглюкозой, функциональная магнитно-резонансная томография (МРТ) речевых зон, позволяют более точно верифицировать форму эпилепсии и определиться с объемом оперативного лечения. Хирургическое вмешательство у тщательно отобранных пациентов может способствовать благоприятному исходу эпилепсии (класс I по классификации Engel, период наблюдения после операции 51 мес), что приведет к улучшению качества жизни.
Ключевые слова
Для цитирования:
Мужикина Н.В., Королева Н.Ю., Касумов В.Р., Пушной П.В., Коротков А.Д., Котомин И.А., Киреев М.В. Клинический случай пациентки с фокальной корковой дисплазией IIa, прилежащей к речевому центру: диагностический и лечебный алгоритмы. Эпилепсия и пароксизмальные состояния. 2022;14(4):344-354. https://doi.org/10.17749/2077-8333/epi.par.con.2022.122
For citation:
Muzhikina N.V., Koroleva N.Yu., Kasumov V.R., Pushnoy P.V., Korotkov A.D., Kotomin I.A., Kireev M.V. Clinical case of a patient with focal cortical dysplasia IIa adjacent to the speech center: diagnostic and therapeutic algorithms. Epilepsy and paroxysmal conditions. 2022;14(4):344-354. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.122
ВВЕДЕНИЕ / INTRODUCTION
Фокальная корковая дисплазия (ФКД) – это гетерогенная группа нарушений, которые представляют собой тип порока развития коры головного мозга и могут быть причиной фармакорезистентной эпилепсии [1–5]. К такому определению ФКД склоняется большинство авторов.
Существует несколько классификаций ФКД, в основе которых лежит гистологическая структура порока развития коры головного мозга. Одну из них предложили в 2004 г. A. Palmini et al. [6]. Была определена терминология, специфичная для различных типов аномальных клеток, возникающих в коре головного мозга пациентов с ФКД, и составлена более подробная, но, тем не менее, простая классификация различных особенностей гистологического строения, которые обычно включены в гетерогенный термин ФКД.
ФКД – вариации нарушений кортикального развития, представляющих достаточно обширный спектр изменений в коре головного мозга, которые возникают вследствие нарушения процессов внутриутробного развития и являются расстройством клеточного формирования кортикальной мантии [3]. По данным R. Kuzniecky et al. (2011 г.) [7], ФКД можно описать следующими тремя гистологическими признаками: кортикальная дисламинация, наличие дисморфических и баллонных клеток. Помимо этого следует добавить еще два признака (I. Blümcke et al. (2011 г.) [8]): сглаженность границы между серым и белым веществом с включением большого количества гетеротопированных и нередко дисморфичных нейронов и нарушение процессов миелинизации в прилегающем белом веществе.
В настоящее время наиболее удобной для клиницистов и адаптированной для применения в эпилептологии является классификация ФКД на основе гистологической структуры, одобренная Международной Противоэпилептической Лигой в 2011 г. (англ. International League Against Epilepsy, ILAE). Выделяют изолированные типы ФКД (I и II) и ассоциированные (III тип) со склерозом гиппокампа (IIIa), глиальной или глионевральной опухолью (IIIb), сосудистой мальформацией (IIIс). ФКД I типа характеризуются нарушением кортикальной ламинации: радиальной (Ia), тангенциальной (Ib) и смешанной (Ic). Структура ФКД II типа включает дисморфичные нейроны (IIa) или дисморфичные нейроны и баллонные клетки (IIb). Наиболее распространены ФКД Ia и IIb типов [9]. ФКД типов Ib, Ic и IIa крайне редки. По заключению M. Duchowny (2009 г.) [10] и Barkovich A.J. (2012 г.) [11], ФКД представляют собой абсолютно патологические нейрональные сети, в которых постоянно присутствуют процессы возбуждения и образуются аномальные синаптические связи, что влечет за собой крайне высокий уровень эпилептогенеза. Кроме того, у больных ФКД IIb типа изменено функционирование ГАМКергических систем с незрелостью ГАМК-рецепторов1 [12].
Несмотря на значительные успехи в нейровизуализации пороков развития головного мозга, ФКД IIа типа нередко пропускается на магнитно-резонансной томографии (МРТ) и диагностический поиск этиологического фактора фармакорезистентной эпилепсии затягивается на несколько лет [13]. В таком случае целесообразно прибегнуть к использованию метода функциональной нейровизуализации – позитронно-эмиссионной томографии (ПЭТ) с 18F-фтордезоксиглюкозой (18F-ФДГ), который применяется для установления участков нарушения функции серого вещества [14].
При планировании операции по удалению функционально значимых зон головного мозга проводится функциональная МРТ (фМРТ). Это метод, основанный на регистрации BOLD-сигнала (англ. blood oxygen level dependent – «зависимый от уровня оксигенации крови») при исследовании головного мозга в ответ на выполнение исследуемым того или иного задания (стимула) или в состоянии покоя. С помощью фМРТ можно определить языковое доминирование полушария. Также возможно локализовать определенные моторные, сенсорные и языковые области. Эти результаты имеют решающее значение для предоперационного планирования [15]. Хирургия эпилепсии должна контролировать приступы путем резекции эпилептогенной ткани, избегая при этом нейропсихологических и других неврологических нарушений за счет сохранения важных участков головного мозга.
Нам представляется целесообразным описать клинический случай лечения пациентки с фармакорезистентной эпилепсией вследствие ФКД.
КЛИНИЧЕСКИЙ СЛУЧАЙ / CASE REPORT
Пациентка 29 лет обратилась с жалобами на замирания, сопровождающиеся амбулаторными автоматизмами (поправляет одежду, ходит, переставляет предметы), длительностью 2–3 мин, далее дезориентирована в течение 15–30 мин. Периодически приступы сопровождаются мочеиспусканием. Частота приступов 1–3 раза в неделю. Проводится стимуляция блуждающего нерва (англ. vagus nerve stimulation, VNS), сила тока 2 мА. Пациентка принимает леветирацетам (3000 мг/сут), лакосамид (500 мг/сут).
Анамнез заболевания / History of the disease
Впервые в 16 лет (2006 г.) в бодрствовании отмечена потеря сознания с билатеральными тонико-клоническими судорогами длительностью до 5 мин, с постприступным сном. Билатеральные судорожные приступы регистрировались во время сна, без мочеиспускания и прикуса языка. Всего до 2007 г. случилось 5 приступов, далее они не повторялись. С 2007 г. (17 лет) появились эпизоды замираний длительностью до 2 мин с частотой 1 раз в месяц и постепенным учащением до 1 раза в неделю, во время которых пациентка не понимала обращенную речь, на вопросы не отвечала.
Инструментальные исследования / Instrumental examinations
МРТ головного мозга (2007 г.)
В 2007 г. была выполнена МРТ головного мозга (1.5Т), которая выявила картину наружной гидроцефалии и зону глиозных изменений в левой височной доле перинатального генеза. Пациентка наблюдалась у разных эпилептологов с диагнозом: эпилепсия криптогенная, фокальная форма с частыми сложно-парциальными приступами.
ПЭТ головного мозга с глюкозой (2012 г.)
Для установления этиологии эпилепсии в октябре 2012 г. в ФГБУН «Институт мозга человека им. Н.П. Бехтеревой» Российской академии наук (ИМЧ РАН) была выполнена ПЭТ головного мозга с определением метаболизма 18F-ФДГ. Выявлено его снижение в коре левой височной доли: в полюсном отделе на 17%, в латеральном на 15%, в медиальном на 12% (по сравнению с контралатеральными участками). В задних отделах латеральной коры височных долей и смежных отделах латеральной коры затылочных долей отмечено умеренное диффузное симметричное снижение метаболизма глюкозы. В стволе мозга метаболизм снижен на 13% (при сравнении с мозжечком с учетом физиологической вариабельности) (рис. 1, 2).
После выполнения ПЭТ с 18F-ФДГ были верифицированы участки нарушения серого вещества, которые, предположительно, являются эпилептогенным очагом. В последующем при прицельной визуализации на МРТ области заинтересованности удалось обнаружить зону ФКД.
После ПЭТ был уточнен диагноз на симптоматическую эпилепсию, фокальную форму, предположительно височную левостороннюю, фармакорезистентную. В дальнейшем были изменены схемы приема антиконвульсантов и разных их комбинаций (вальпроевая кислота, зонисамид, этосуксимид, окскарбазепин, карбамазепин, ламотриджин, топирамат) – без отчетливого эффекта на частоту приступов. Также отмечались нежелательные явления, такие как набор веса во время приема вальпроевой кислоты, головокружение и рвота во время приема карбамазепина.
В 2014 г. отмечалось прогрессирование заболевания, присоединились амбулаторные автоматизмы длительностью до 2 мин с постепенным увеличением длительности до 30 мин и учащением до 3 раз в неделю.
МРТ головного мозга (2015–2018 гг.)
При повторном МРТ головного мозга через 8 лет, в 2015 г. (ИМЧ РАН), получены изображения суб- и супратенториальных структур головного мозга. Гиппокампы не изменены, симметричны. Срединные структуры не смещены. Боковые желудочки не расширены, симметричны. Структуры хиазмально-селлярной области без особенностей. В левой верхней височной извилине удалось выявить зону структурных изменений, охватывающую кору (с изменением ее архитектоники и нечеткостью контуров) и субкортикальное белое вещество, размерами 12×9×15 мм, что укладывается в картину ФКД левой верхней височной извилины.
Далее МРТ повторяли в 2016 и 2018 гг., но динамики не наблюдалось. На рисунке 3 представлены данные МРТ, выполненной в 2018 г.
Функциональная МРТ головного мозга (2016 г.)
В 2015 г. после верификации зоны ФКД и на фоне резистентности к терапии препаратами впервые встал вопрос о хирургическом вмешательстве. Для определения вида операции в апреле 2016 г. была выполнена фМРТ. При локализации областей мозга, вовлекаемых в обеспечение речевых функций, с применением зрительных и слуховых стимулов, тестовых заданий установлено, что в левой височной доле выявленные активации непосредственно прилегают к зоне измененного сигнала на структурной МРТ. Отмечена доминантность левого полушария (индексы латерализации –0,51 и –0,36) (рис. 4).
Данные фМРТ показали близость участка ФКД к речевому центру, и было решено проводить VNS-терапию. В апреле 2016 г. имплантирована VNS-система. Отчетливого эффекта на частоту приступов за 22 мес наблюдения не выявлено. ПЭТ головного мозга с глюкозой (2016 г.) На контрольной ПЭТ головного мозга с глюкозой в декабре 2016 г. (ИМЧ РАН) отмечены положительная динамика нарушений энергетического метаболизма затылочной области, нарастание гипометаболизма в левой височной доле (рис. 5, 6). Таким образом, выявлено, что первичный эпилептический очаг остался.
Видео-ЭЭГ-мониторинг
Пациентке регулярно, 2–3 раза в год, выполнялся видеоэлектроэнцефалографический (ЭЭГ) мониторинг. Начиная с 2016 г. была прослежена отрицательная динамика в виде появления эпилептиформной активности в правой височной области наряду с основным очагом в левой височной области, которые регистрировались в первом цикле сна.
На видео-ЭЭГ-мониторинге, проведенном в декабре 2016 г. в Медицинском институте им. Березина Сергея (МИБС), с наслоением на физиологические паттерны сна зарегистрирована эпилептиформная активность: региональные разряды редуцированных острых волн в правой височной области. Отмечены также автономно редкие региональные разряды редуцированных острых волн в левой височной области. По сравнению с результатами видео-ЭЭГ-мониторинга от декабря 2015 г. отмечается появление редуцированной эпилептиформной активности в правых отделах (рис. 7).
Хирургическое лечение / Surgery
Таким образом, в связи с неэффективностью разных схем антиконвульсантов и VNS-терапии консилиум эпилептологов, нейрохирургов и радиологов принял решение о проведении открытой операции по удалению эпилептического очага.
В феврале 2018 г. выполнена операция – костно-пластическая трепанация черепа в левой лобно-теменновисочной области. Проведена электрокортикография. Удалены эпилептические очаги левой височной доли под электрофизиологическим контролем.
Гистологическое исследование / Histological examination
Прижизненное патологоанатомическое исследование удаленного материала, выполненное в феврале 2018 г., верифицировало ФКД с эктопией нейронов в белое вещество и дисморфными нейронами (IIа тип), эпилептическую лейкоэнцефалопатию с умеренно выраженным клеточным глиозом, апоптотической активностью глиоцитов.
Описание 1
В первом фрагменте материала (левая височная доля) кора и белое вещество головного мозга с умеренно выраженным глиозом, глиоциты ярко экспрессируют Vim, отмечается эктопия нейронов в белое вещество. В исследуемом корковом веществе формирование слоев и вертикальных колонковых модулей не нарушено, однако наблюдается умеренно выраженный клеточный глиоз коры, часть тел нейронов утратила экспрессию S100. Также в коре выявлены клетки-тени, имеются ишемически измененные гиперхромные нейроны, нейроны с сателлитозом. Обращает на себя внимание повышенная экспрессия Caspase 3 в глиоцитах коры, в то время как экспрессии bcl2 отмечается в нейронах коры и гетеротопированных нейронах. Выявлен умеренно выраженный периваскулярный отек, очаги ангиоматоза. Мягкие мозговые оболочки утолщены, сосуды полнокровны.
Описание 2
Во втором фрагменте (кора височной доли с дисплазией) кора и белое вещество с умеренно выраженным клеточным глиозом. Выявлено нарушение цитоархитектоники коры: не прослеживается четкое формирование горизонтальных слоев и вертикальных колонковых модулей, обнаружены единичные дисморфные нейроны (увеличенные, с крупными ядрами, со смещением субстанции Ниссля к клеточной мембране и формированием перинуклеарного просветления). Также в коре определены выраженный астроцитарный глиоз с яркой экспрессией GFAP и повышенная апоптотическая активность глиоцитов.
Послеоперационные инструментальные исследования / Postoperative instrumental examinations
Видео-ЭЭГ-мониторинг (2019 г.)
Через 1,5 года после операции при проведении видеоЭЭГ-мониторинга в июле 2019 г. (МИБС) типичной эпилептиформной активности не зарегистрировано. Определена неспецифическая патологическая активность в виде пробегов замедления в левых лобных отделах и диффузных разрядов во сне (рис. 8). МРТ головного мозга (2021 г.)
При контрольной МРТ, проведенной в ИМЧ РАН через 3,5 года после операции, в августе 2021 г., на аппарате Achieva 3T (Philips, Нидерланды), визуализировано состояние после удаления эпилептогенного очага в левой височной доле. Выявлены послеоперационные кистозно-глиозные изменения передних отделов левой височной доли и оперкулярного отдела левой лобной доли (рис. 9).
Состояние после хирургического лечения / Condition after surgery
После операции приступы у пациентки отсутствуют (класс I по классификации Engel), несмотря на 13-летнюю продолжительность болезни до хирургического вмешательства. Период наблюдения составляет 51 мес. Пациентка социализировалась, работает. Продолжает принимать леветирацетам и лакосамид, от отмены препаратов отказалась.
Этические аспекты / Ethical aspects
Работа выполнена в соответствии принципами Хельсинкской декларации Всемирной медицинской ассоциации 2013 г. Пациентка дала согласие на публикацию своих медицинских данных.
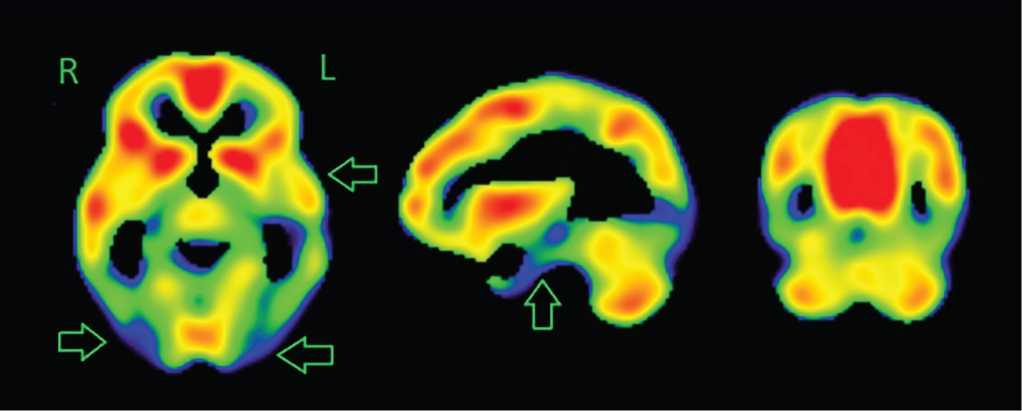
Рисунок 1. Результаты позитронно-эмиссионной томографии головного мозга пациентки с глюкозой, октябрь 2012 г. Стрелками обозначены участки гипометаболизма глюкозы в полюсном отделе и латеральной коре левой височной области, в коре затылочных долей
Figure 1. Brain positron emission tomography with glucose, October 2012. Arrows indicate areas of glucose hypometabolism in the pole and lateral cortex of the left temporal region as well as cortex of the occipital lobes
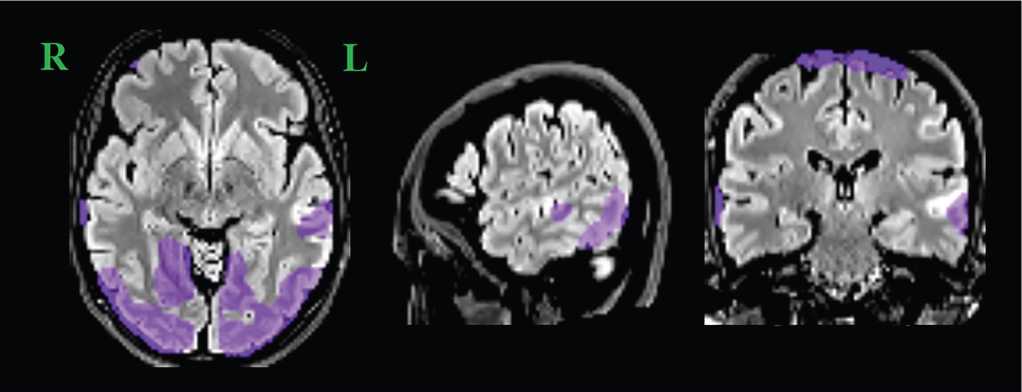
Рисунок 2. Результаты позитронно-эмиссионной томографии головного мозга пациентки, совмещенной с магнитнорезонансной томографией, от 2012 г. (фиолетовым цветом обозначены участки гипометаболизма глюкозы)
Figure 2. Brain positron emission tomography combined with magnetic resonance imaging, dated 2012 (purple color indicates areas of glucose hypometabolism)
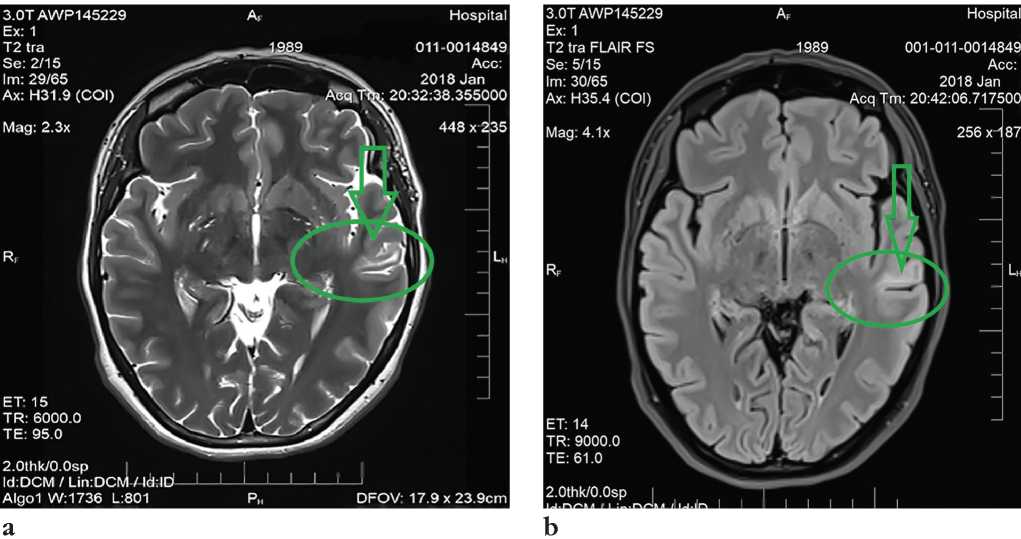
Рисунок 3. Магнитно-резонансные томограммы головного мозга пациентки, январь 2018 г.: картина фокальной дисплазии левой верхней височной извилины (обведено овалами): а – режим T2 tra; b – режим T2 tra FLAIR FS
Figure 3. Brain magnetic resonance imaging, January 2018: focal dysplasia of the left superior temporal gyrus (in ovals): a – T2 tra; b - T2 tra FLAIR FS
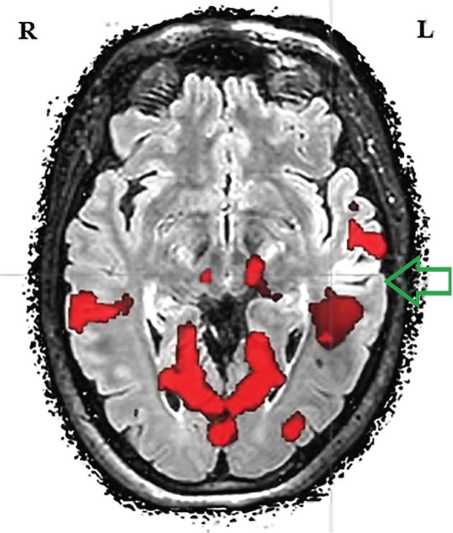
Рисунок 4. Результаты функционального магнитнорезонансного исследования речевой функции пациентки, апрель 2016 г. Области мозга, участвующие в обеспечении называния вслух изображенных на картинке предметов. Стрелка указывает на зону структурных изменений
Figure 4. Functional magnetic resonance scan of the patient's speech function, April 2016. Brain areas involved in naming aloud the objects in the picture. The arrow indicates the zone of structural changes
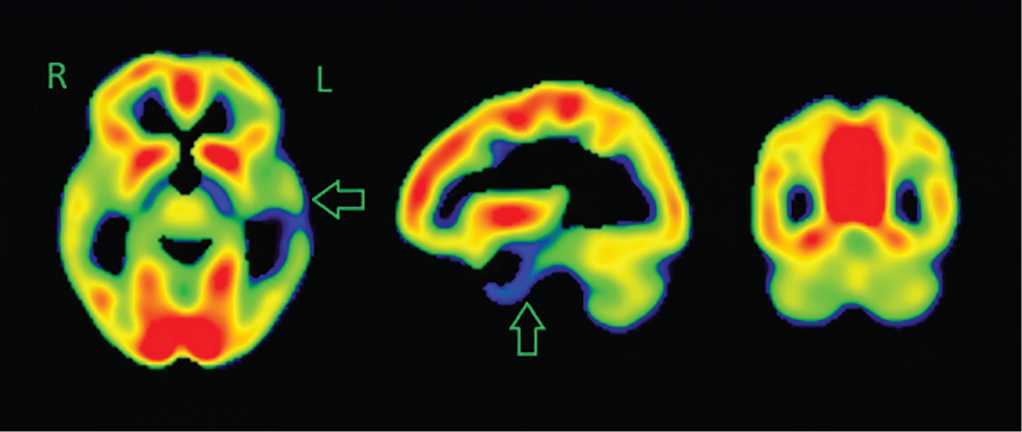
Рисунок 5. Позитронно-эмиссионные томограммы головного мозга пациентки, декабрь 2016 г. Стрелками обозначены участки гипометаболизма глюкозы в полюсном отделе и латеральной коре левой височной области
Figure 5. Brain positron emission tomograms, December 2016. Arrows indicate areas of glucose hypometabolism in the pole and lateral cortex of the left temporal region
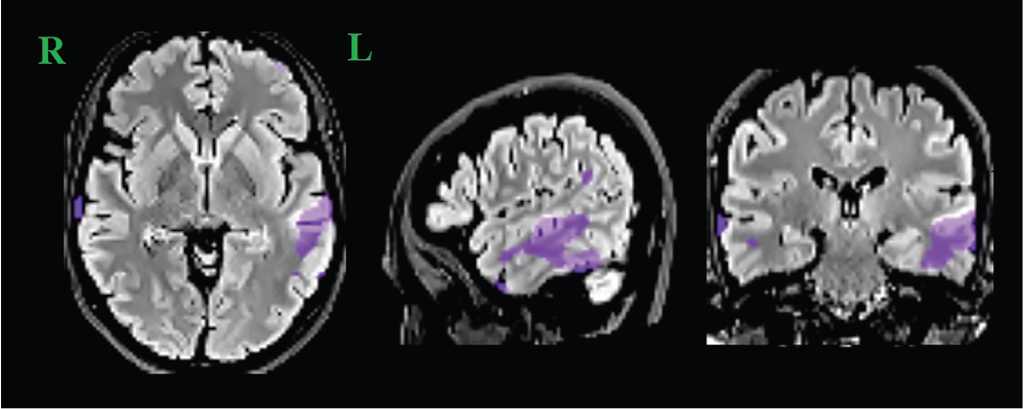
Рисунок 6. Результаты позитронно-эмиссионной томографии, совмещенной с магнитно-резонансной томографией, от 2016 г. (фиолетовым цветом обозначены участки гипометаболизма глюкозы)
Figure 6. Positron emission tomography combined with magnetic resonance imaging, dated 2016 (purple color indicates areas of glucose hypometabolism)
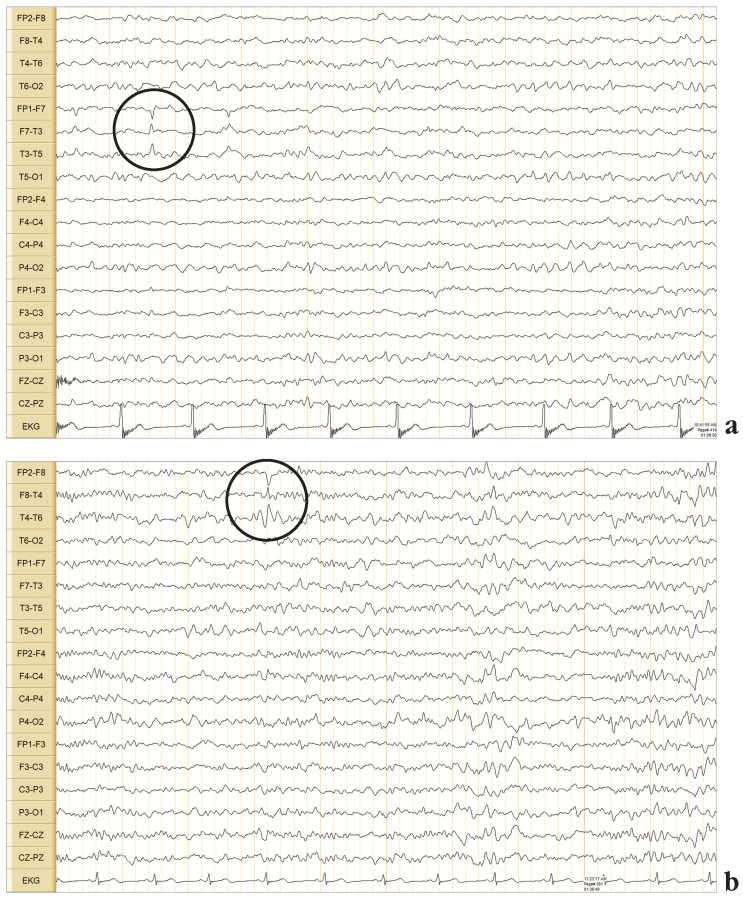
Рисунок 7. Результаты видеоэлектроэнцефалографического мониторинга пациентки, декабрь 2016 г. Первый цикл сна, II стадия фазы медленного сна. Чувствительность 70 мкВ/см, биполярный монтаж: a – региональные разряды острых волн в левой височной области с максимумом в F7, Т3 (обведено овалом); b – деформированные комплексы «острая–медленная волна» в правой височной области с максимумом в Т4 (обведено овалом)
Figure 7. Video electroencephalographic monitoring, December 2016. Sleep cycle I, stage II of slow sleep phase. Sensitivity 70 μV/cm, bipolar montage: a – regional discharges of sharp waves in the left temporal region with a maximum in F7, T3 (in oval); b – deformed sharp-slow wave complexes in the right temporal region with a maximum in T4 (in oval)
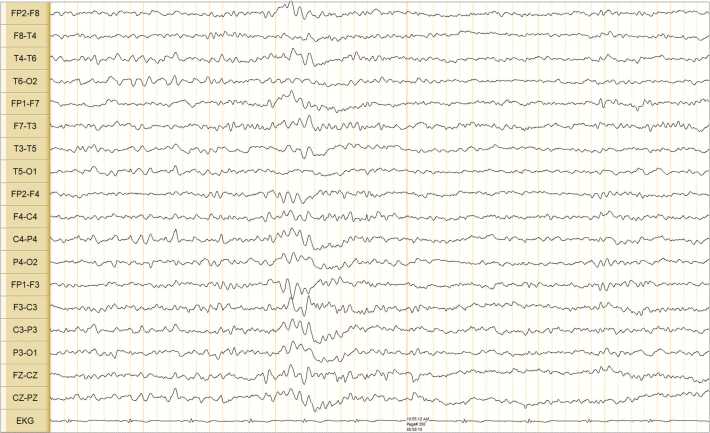
Рисунок 8. Результаты видеоэлектроэнцефалографического мониторинга пациентки, июль 2019 г. Первый цикл сна, II стадия фазы медленного сна. Чувствительность 70 мкВ/см. Биполярный монтаж. Безусловной эпилептиформной активности не зарегистрировано
Figure 8. Videoelectroencephalographic monitoring, July 2019. Sleep cycle I, stage II of slow sleep phase. Sensitivity 70 µV/cm. Bipolar montage. No unconditional epileptiform activity was recorded

Рисунок 9. Результаты магнитнорезонансного исследования головного мозга пациентки, август 2021 г. Стрелками обозначены кистозноглиозные изменения передних отделов левой височной доли: a – режим FLAIR Long_TR, аксиальный срез; b – режим T2W_TSE, коронарный и сагиттальный срезы
Figure 9. Brain magnetic resonance imaging, August 2021 Arrows indicate cystic-gliotic changes in the anterior sections of the left temporal lobe: a – FLAIR Long_TR, axial section; b – T2W_TSE, coronal and sagittal sections
ОБСУЖДЕНИЕ / DISCUSSION
ФКД IIа типа в нашем клиническом случае была установлена с помощью диагностических методов нейровизуализации и подтверждена гистологически.
Второй тип ФКД в дополнение к изменениям цитоархитектоники коры отличается наличием диспластических нейронов при типе IIa. Диспластические нейроны характеризуются следующими чертами, отличающими их от нормальных нейронов: 1) увеличенный размер; 2) большие клеточные ядра; 3) аномальное накопление субстанции Ниссля и позиционирование ее ближе к мембране; 4) повышенное количество нейрофиламентов в цитоплазме [8]. На ультраструктурном уровне С. Donkels et al. (2020 г.) обнаружили, что аксоны V слоя имеют тонкие миелиновые оболочки. Кроме того, в зоне ФКД IIa типа была снижена плотность клеток-предшественников олигодендроцитов и зрелых олигодендроцитов, что может способствовать эпилептогенности этого порока развития коры головного мозга [16].
Диагностический поиск и переход от МРТ-негативной формы эпилепсии до структурной фокальной составили более 6 лет. Это обусловлено тем, что визуализировать тип IIa ФКД значительно труднее, чем тип IIb, хотя данный тип ФКД и наблюдается гораздо реже. МРТпризнаки ФКД IIa типа не столь убедительны, и этот тип дисплазии нередко пропускается радиологами, которые не обладают достаточным опытом в верификации ФКД. Единственным обнаруженным нейрорадиологическим паттерном ФКД IIa типа может быть усиление сигнала в режимах T2WI и FLAIR в месте дисплазии [13].
По данным литературы, хирургическое вмешательство у тщательно отобранных пациентов может способствовать благоприятному исходу эпилепсии, что приведет к улучшению качества жизни [2][17]. Однако при расположении эпилептогенной зоны близко к речевому центру операция является непростой задачей и требует применения методики пробуждения [18][19]. K. Minkin et al. (2021 г.) на основании анализа результатов операций у 95 пациентов с ФКД, прилежащих к речевой зоне, показали, что исход припадков был удовлетворительным в 71% случаев при использовании пробуждения во время хирургического лечения [20–22].
ЗАКЛЮЧЕНИЕ / CONCLUSION
Выявление ФКД как причины эпилепсии в ряде случаев требует больших усилий в предоперационной подготовке, применения комплекса нейровизуализационных методов и высококвалифицированной командной работы радиологов, врачей функциональной диагностики, эпилептологов, нейрохирургов, нейропсихологов.
Для верификации ФКД особое значение имеет ПЭТ с 18F-ФДГ – метод, позволяющий не только уточнить место расположения предполагаемой ФКД (что при повторном более высокоразрешающем МРТ-исследовании с использованием специальных программ по эпилепсии дает возможность прицельно визуализировать данную зону), но и оценить влияние терапии на метаболический дефицит при эпилепсии. Прослеженная динамика ПЭТ с определением метаболизма 18F-ФДГ у одной и той же пациентки в нашем наблюдении показала нарастание гипометаболизма глюкозы в левой височной доле, вероятно, связанное с прогрессированием заболевания, с одной стороны, и улучшением метаболизма в затылочной области (видимо, терапевтическим эффектом антиконвульсантов и VNSсистемы) – с другой.
Нейрохирургическое вмешательство на функционально значимых структурах головного мозга сопряжено с высоким риском послеоперационного неврологического дефицита. Один из наиболее часто используемых методов функциональной нейровизуализации для предоперационного картирования мозга – фМРТ. Являясь оптимальным способом локализации специфических отделов человеческого мозга, которые управляют двигательными, сенсорными или языковыми функциями, фМРТ облегчает выбор наиболее безопасной тактики лечения и очень полезна для планирования и проведения операций с сохранением функции у пациентов с очаговыми поражениями головного мозга (ФКД, опухоли). Таким образом, передовые методы нейрофизиологии и нейровизуализации способствуют улучшению результатов оперативного вмешательства и снижению риска послеоперационных осложнений.
1. ГАМК – гамма-аминомасляная кислота.
Список литературы
1. Fauser S., Huppertz H.J., Bast T., et al. Clinical characteristics in focal cortical dysplasia: a retrospective evaluation in a series of 120 patients. Brain. 2006; 129 (Pt. 7): 1907–16. https://doi.org/10.1093/brain/awl133.
2. Chen J., Huang Z., Li L., et al. Histological type of focal cortical dysplasia is associated with the risk of postsurgical seizure in children and adolescents. Ther Clin Risk Manag. 2019; 15: 877–84. https://doi.org/10.2147/TCRM.S203039.
3. Мухин К.Ю. Фокальные кортикальные дисплазии: клинико-электро-нейровизуализационные характеристики. Русский журнал детской неврологии. 2016; 11 (2): 8–24. https://doi.org/10.17650/2073-8803-2016-11-2-8-24.
4. Taylor D.C., Falconer M.A., Bruton C.J., Corsellis J.A. Focal dysplasia of the cerebral cortex in epilepsy. J Neurol Neurosurg Psychiatry. 1971; 34 (4): 369–87. https://doi.org/10.1136/jnnp.34.4.369.
5. Kim S.H., Choi J. Pathological classification of focal cortical dysplasia (FCD): personal comments for well understanding FCD classification. J Korean Neurosurg Soc. 2019; 62 (3): 288–95. https://doi.org/10.3340/jkns.2019.0025.
6. Palmini A., Najm I., Avanzini G., et al. Terminology and classification of the cortical dysplasias. Neurology. 2004; 62 (6 Suppl. 3): S2–8. https://doi.org/10.1212/01.wnl.0000114507.30388.7e.
7. Kuzniecky R. Focal cortical dysplasia and related variants. In: Shorvon S., Andermann F., Guerrini R. (Eds.) The causes of epilepsy. Common and uncommon causes in adults and children. N.Y.: Cambridge Medicine; 2011: 293–7. https://doi.org/10.1017/cbo9780511921001.047.
8. Blümcke I., Thom M., Aronica E., et al. The clinicopathologic spectrum of focal cortical dysplasias: a consensus classification proposed by an ad hoc Task Force of the ILAE Diagnostic Methods Commission. Epilepsia. 2011; 52 (1): 158–74. https://doi.org/10.1111/j.1528-1167.2010.02777.x.
9. Blümcke I., Sarnat H.B., Coras R. Surgical neuropathology of focal epilepsies: textbook and atlas. Paris: John Libbey Eurotext; 2015: 158 pp. https://doi.org/10.1111/nan.12343.
10. Duchowny M. Clinical, functional and neurophysiologic assessment of dysplastic cortical networks: implications for cortical functioning and surgical management. Epilepsia. 2009; 50 (Suppl. 9): 19–27. https://doi.org/10.1111/j.1528-1167.2009.02291.x.
11. Barkovich A.J., Guerrini R., Kuzniecky R.I., et al. A developmental and genetic classification for malformations of cortical development: update 2012. Brain. 2012; 135 (Pt. 5): 1348–69. https://doi.org/10.1093/brain/aws019.
12. Cepeda C., Andre V.M., Hauptman J.S., et al. Enhanded GABAergic network and receptor function in pediatric cortical dysplasia type IIb compared with tuberous sclerosis complex. Neurobiol Dis. 2012; 45 (1): 310–21. https://doi.org/10.1016/j.nbd.2011.08.015.
13. Holthausen H., Piper T., Winkler P., et al. Electro-clinical-pathological correlations in focal cortical dysplasia (FCD) at young ages. Childs Nerv Syst. 2014; 30 (12): 2015–26. https://doi.org/10.1007/s00381-014-2549-6.
14. Медведев С.В., Скворцова Т.Ю., Красикова Р.Н. ПЭТ в России: позитронно-эмисионная томография в клинике и физиологии. СПб.; 2008: 318 с.
15. Gene M., Brennan N.P., Holodny A.I. Patient preparation and paradigm design in fMRI. Neuroimaging Clin N Am. 2021; 31 (1): 11–21. https://doi.org/10.1016/j.nic.2020.09.007.
16. Donkels C., Peters M., Fariña Núñez M.T., et al. Oligodendrocyte lineage and myelination are compromised in the gray matter of focal cortical dysplasia type IIa. Epilepsia. 2020; 61 (1): 171–84. https://doi.org/10.1111/epi.16415.
17. Isler C., Kucukyuruk B., Ozkara C., et al. Comparison of clinical features and surgical outcome in focal cortical dysplasia type 1 and type 2. Epilepsy Res. 2017; 136: 130–6. https://doi.org/10.1016/j.eplepsyres.2017.08.008.
18. Korkar G.H., Isnard J., Montavont A., et al. Awake craniotomy for epilepsy surgery on eloquent speech areas: a single-centre experience. Epileptic Disord. 2021; 23 (2): 347–56. https://doi.org/10.1684/epd.2021.1275.
19. Tyndall A.J., Reinhardt J., Tronnier V., et al. Presurgical motor, somatosensory and language fMRI: technical feasibility and limitations in 491 patients over 13 years. Eur Radiol. 2017; 27 (1): 267–8. https://doi.org/10.1007/s00330-016-4369-4.
20. Minkin K., Gabrovski K., Karazapryanov P., et al. Awake epilepsy surgery in patients with focal cortical dysplasia. World Neurosurg. 2021; 151: e257–64. https://doi.org/10.1016/j.wneu.2021.04.021.
21. Маматханов M.P., Касумов В.Р., Куралбаев А.К. и др. Хирургическое лечение эпилепсии и его результаты. Вестник новых медицинских технологий. 2017; 24 (2): 44–54. https://doi.org/10.12737/article_5947cd56962196.53541882.
22. Асатрян Э.А., Абрамов К.Б., Тадевосян А.Р. и др. Современные проблемы хирургии эпилепсии. Вестник неврологии, психиатрии и нейрохирургии. 2017; (3): 36–48.
Об авторах
Н. В. МужикинаРоссия
Мужикина Надежда Викторовна – к.м.н., заведующая Центром эпилептологии и видео-ЭЭГ-мониторинга
WoS ResearcherID: CAH-2597-2022; РИНЦ SPIN-код: 2718-4327
ул. Академика Павлова, д. 9, Санкт-Петербург 197376
Н. Ю. Королева
Россия
Королева Надежда Юрьевна – научный сотрудник лаборатории стереотаксических методов, руководитель Центра эпилептологии и видео-ЭЭГ-мониторинга
РИНЦ SPIN-код: 7016-9057
ул. Академика Павлова, д. 9, Санкт-Петербург 197376
В. Р. Касумов
Россия
Касумов Вугар Рауфович – д.м.н, профессор кафедры неврологии, нейрохирургии и медицинской генетики
РИНЦ SPIN-код: 2118-4417
ул. Литовская, д. 2, Санкт-Петербург 194100
П. В. Пушной
Россия
Пушной Павел Владимирович – заведующий отделением неврологии и эпилептологии
ул. 6-я Советская, д. 24-26/19-21, Санкт-Петербург 194100
А. Д. Коротков
Россия
Коротков Александр Дмитриевич – к.м.н., старший научный сотрудник лаборатории нейровизуализации
WoS ResearcherID: K-3652-2018; Scopus Author ID: 7103063229; РИНЦ SPIN-код: 6515-2014
ул. Академика Павлова, д. 9, Санкт-Петербург 197376
И. А. Котомин
Россия
Котомин Иван Александрович – инженер ПЭТ/КТ отделения лучевой диагностики
Scopus Author ID: 57211890254; РИНЦ SPIN-код: 1127-0808
ул. Академика Павлова, д. 9, Санкт-Петербург 197376
М. В. Киреев
Россия
Киреев Максим Владимирович – д.б.н., старший научный сотрудник лаборатории нейровизуализации
WoS ResearcherID: I-2319-2014; Scopus Author ID: 23091140300; РИНЦ SPIN-код: 4699-8496
ул. Академика Павлова, д. 9, Санкт-Петербург 197376
Рецензия
Для цитирования:
Мужикина Н.В., Королева Н.Ю., Касумов В.Р., Пушной П.В., Коротков А.Д., Котомин И.А., Киреев М.В. Клинический случай пациентки с фокальной корковой дисплазией IIa, прилежащей к речевому центру: диагностический и лечебный алгоритмы. Эпилепсия и пароксизмальные состояния. 2022;14(4):344-354. https://doi.org/10.17749/2077-8333/epi.par.con.2022.122
For citation:
Muzhikina N.V., Koroleva N.Yu., Kasumov V.R., Pushnoy P.V., Korotkov A.D., Kotomin I.A., Kireev M.V. Clinical case of a patient with focal cortical dysplasia IIa adjacent to the speech center: diagnostic and therapeutic algorithms. Epilepsy and paroxysmal conditions. 2022;14(4):344-354. (In Russ.) https://doi.org/10.17749/2077-8333/epi.par.con.2022.122

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































