Перейти к:
Когнитивные нарушения при эпилепсии с дебютом в детском возрасте
https://doi.org/10.17749/2077-8333/epi.par.con.2024.176
Аннотация
Эпилепсия занимает одну из лидирующих позиций в структуре детской неврологической патологии. Наряду с приступами значительную роль в социальной дезинтеграции играют нарушения различных составляющих интеллекта ребенка. Широко исследуются когнитивные дисфункции, возникающие при идиопатических генерализованных эпилепсиях (ИГЭ) и самокупирующейся эпилепсии с центротемпоральными спайками (англ. self-limited epilepsy with centrotemporal spikes, SeLECTS). Эти формы позиционируются как доброкачественные, однако данные литературы указывают на стойкие множественные изменения когнитивной сферы у таких пациентов. Особенности этиопатогенеза эпилепсии в подобных случаях обусловливают раннее начало и глубокие перестройки структур, участвующих в реализации когнитивных функций. Представленный обзор посвящен обобщению информации о механизмах развития и спектре когнитивных нарушений при ИГЭ и SeLECTS.
Ключевые слова
Для цитирования:
Парамонова А.И., Лысова К.Д., Тимечко Е.Е., Сенченко Г.В., Сапронова М.Р., Дмитренко Д.В. Когнитивные нарушения при эпилепсии с дебютом в детском возрасте. Эпилепсия и пароксизмальные состояния. 2024;16(1):54-68. https://doi.org/10.17749/2077-8333/epi.par.con.2024.176
For citation:
Paramonova A.I., Lysova K.D., Timechko E.E., Senchenko G.V., Sapronova M.R., Dmitrenko D.V. Cognitive impairment in childhood-onset epilepsy. Epilepsy and paroxysmal conditions. 2024;16(1):54-68. https://doi.org/10.17749/2077-8333/epi.par.con.2024.176
ВВЕДЕНИЕ / INTRODUCTION
Заболеваемость эпилепсией в детской популяции составляет от 0,5% до 2% [1][2]. В настоящее время все больше внимания уделяется когнитивно-поведенческим проблемам, ассоциированным с этим заболеванием [3]. По современным данным, когнитивные нарушения встречаются у детей с эпилепсией в 20–60% случаев и в 4,8 раза чаще, чем у населения в целом [4][5]. В некоторых проспективных исследованиях пациенты с выраженными когнитивными расстройствами имели наименьший шанс достижения длительной ремиссии приступов и повышенный риск более ранней гибели [6].
Одновременная дезорганизация сразу нескольких интеллектуальных функций при эпилепсии приводит к снижению общей социальной интеграции детей, а также непосредственно влияет на академическую сферу. По последним данным, до 50% пациентов детского возраста имеют проблемы с обучением, включая детей со средним показателем IQ [7].
С учетом анатомо-физиологических особенностей онтогенеза головного мозга влияние эпилептогенных процессов в период детства закономерно ведет к нарушениям нервно-психического развития. Эпилепсия с дебютом в раннем возрасте в двух случаях из трех характеризуется ухудшением общих когнитивных способностей, адаптивного поведения и социального функционирования [8]. В исследовании Ž. Rogač et al. (2022 г.) интеллектуальные и эмоционально-волевые нарушения у детей были выявлены в первые полгода после начала приступов [9]. Другие данные указывают на то, что около 30% детей имеют поведенческие и когнитивные расстройства уже к моменту дебюта заболевания [10].
Самокупирующаяся эпилепсия с центротемпоральными спайками (англ. self-limited epilepsy with centrotemporal spikes, SeLECTS) [11] является одной из наиболее часто встречающихся форм эпилепсии детского возраста и диагностируется в 10–20% случаев. Для SeLECTS понятие доброкачественности в полной мере можно отнести лишь к исходу приступов, т.к. исследования демонстрируют наличие стойких нейропсихологических нарушений у 28–53% пациентов [12].
Идиопатические генерализованные эпилепсии (ИГЭ) встречаются в 15–20% новых случаев и также позиционируются как доброкачественные формы [13]. Согласно классификации Международной Противоэпилептической Лиги (International League Against Epilepsy, ILAE) 2022 г. ИГЭ были выделены в отдельную подгруппу генетических генерализованных эпилепсий с учетом высокой распространенности, схожести клинического течения и электроэнцефалографических (ЭЭГ) паттернов, возможности перехода одной формы в другую, а также относительно благоприятного исхода [11][14]. Однако для пациентов данной группы также характерны нейропсихологические нарушения, сохраняющиеся или прогрессирующие во взрослом возрасте [15].
Цель – обобщение информации о механизмах развития когнитивных нарушений при ИГЭ и SeLECTS и сравнительный анализ их спектра.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Проведен поиск публикаций в базах данных PubMed/MEDLINE, ScienceDirect и Google Scholar за последние 10 лет на русском и английском языках (рис. 1) по следующим ключевым запросам: «эпилепсия детского возраста», «идиопатическая генерализованная эпилепсия», «детская абсансная эпилепсия», «юношеская абсансная эпилепсия», «юношеская миоклоническая эпилепсия», «самокупирующаяся эпилепсия с центротемпоральными спайками» в сочетании с отдельными ключевыми терминами: «когнитивные нарушения», «когнитивные функции», «нейропсихологическое тестирование». Поиск также был повторен с использованием общепринятых сокращений названий заболеваний (например, «ИГЭ», «ДАЭ», «ЮАЭ», «ЮМЭ») и названий, претерпевших изменения в классификации ILAE от 2017 и 2022 г.
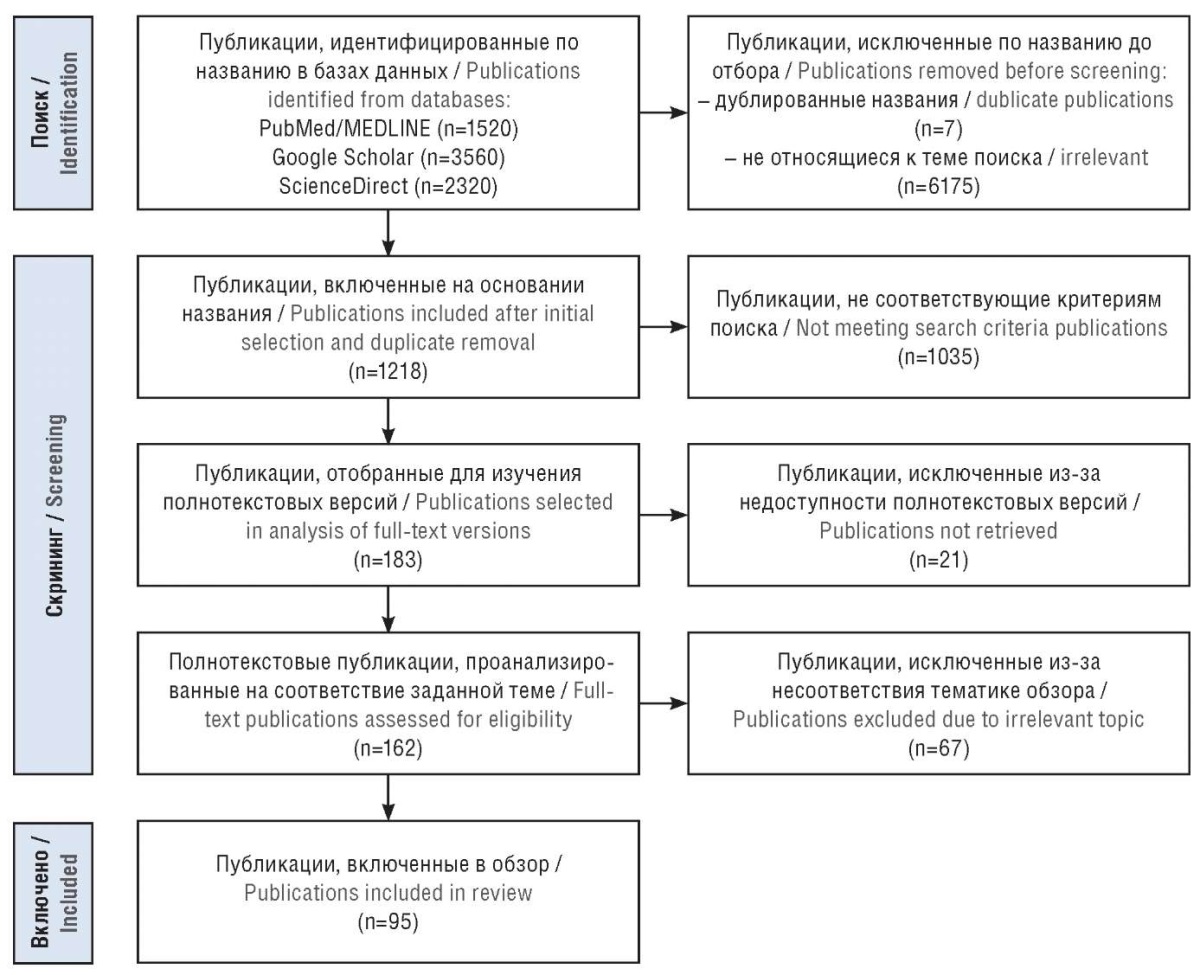
Рисунок 1. Блок-схема PRISMA
(англ. Preferred Reporting Items for Systematic reviews and Meta-Analyses)
Figure 1. PRISMA (Preferred Reporting Items for Systematic reviews and Meta-Analyses) workflow
В анализ включены обзорные статьи и оригинальные исследования по обсуждаемой тематике, дублирующие статьи исключались. Также проанализированы некоторые более ранние работы, отобранные вручную из списков литературы обзорных статей. Отбор публикаций проводился двумя исследователями независимо друг от друга с привлечением третьего исследователя при расхождении мнений.
В обзор не вошли статьи, посвященные эпилепсии с изолированными генерализованными тонико-клоническими приступами.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Характеристика когнитивных нарушений при ИГЭ и SeLECTS / Characteristics of cognitive impairment in IGE and SeLECTS
Согласно современным данным нарушения нейропсихологических функций у пациентов с эпилепсией носят гетерогенный характер и затрагивают сразу несколько сфер: память и обучение, исполнительную функцию, речь, визуальное восприятие, конструктивное мышление и эмоциональный интеллект [16].
По данным оригинальных исследований и систематических обзоров, нейропсихологический профиль нарушений у пациентов различного возраста с ИГЭ характеризуется поражением сразу нескольких когнитивных блоков [17], включающих исполнительную, перцептивную и зрительно-пространственную функции, вербальную генеративность и невербальное мышление, устойчивость внимания, скорость обработки информации и рабочую память [18][19].
Для детской аудитории характерно снижение академической успеваемости и арифметических навыков, чтения и письма [20][21], что также соответствует имеющимся данным о нарушении исполнительных функций и ухудшении внимания у детей при ИГЭ [22].
В соответствии с тяжестью клинических проявлений выделено три когнитивных фенотипа ИГЭ:
- отсутствие нарушений со средними результатами, соответствующими здоровому контролю (44%);
- легкие нарушения в нескольких когнитивных областях (44%);
- изменения во всех когнитивных доменах с тяжелым нарушением внимания (12%).
При этом характерно отсутствие зависимости тяжести клиники от конкретного синдрома ИГЭ. Наибольшее влияние оказывают такие факторы, как семейный анамнез (IQ родителей), нарушение развития в раннем детстве и наличие изменений по результатам нейровизуализации [19].
Детская абсансная эпилепсия (ДАЭ) характеризуется широким спектром изменений, включающих ухудшение вербальной и невербальной памяти, зрительного внимания, расстройства речи и исполнительной функции на фоне нормального или слегка сниженного уровня IQ [23]. Часто выявляются нарушения торможения поведенческих реакций, а также психосоциального функционирования и моторных функций [24]. Совокупность характерных изменений свидетельствует о комплексном поражении с преимущественной дисфункцией лобных долей [25]. При этом имеются данные о сохраняющемся дефиците внимания у детей с ДАЭ как до лечения, так и на фоне компенсации приступов [26], что указывает на первичное вовлечение фронтальной коры в общем патогенезе заболевания.
Спектр когнитивных нарушений при юношеской абсансной эпилепсии (ЮАЭ) также ассоциирован с дисфункцией лобной доли [27]. В исследовании интеллектуального профиля среди взрослых пациентов с ИГЭ группа ЮАЭ/ДАЭ с сохраняющимися приступами показала самый низкий уровень IQ и наиболее заметное ухудшение исполнительной функции, обучаемости и усвоения информации [18][24].
Для детей с юношеской миоклонической эпилепсией (ЮМЭ) характерны множественные когнитивные нарушения [27]. E.H. Kim et al. (2016 г.) отмечают негрубое снижение IQ, дисфункцию внимания, контроля торможения реакций, вербальной и рабочей памяти, а также скорости и качества обработки информации, гибкости и беглости речи [28].
В исследовании D.N. Almane et al. (2019 г.) также продемонстрировано ухудшение результатов по всем тестируемым когнитивным доменам, в большинстве случаев нейропсихологические проблемы возникали до манифестации эпилепсии [29]. В проспективном исследовании развития когнитивных функций у детей с ЮМЭ в сравнении со здоровым контролем были выявлены нарушения как на момент дебюта приступов, так и через 2 года течения заболевания, при этом внутри исследуемой группы отмечались улучшение и рост навыков, но уровень и скорость не соответствовали среднему показателю среди здоровых детей [22].
Известно, что дети с SeLECTS подвержены более высокому риску когнитивных, поведенческих или эмоциональных трудностей [30]. Большинство систематических обзоров указывает на нарушения памяти, внимания, зрительно-пространственных и исполнительных функций [31]. Также отмечено, что средний уровень IQ у детей с SeLECTS более низкий. Многие исследователи выделяют частые расстройства вербальной функции, включающие изменения как экспрессивной, так и рецептивной речи с нарушением семантической обработки языка [32]. Характерно, что риск развития речевой дисфункции повышается с увеличением длительности течения заболевания [33].
Кроме нарушений вербального блока имеются обширные данные, подтверждающие изменение функций памяти у детей с SeLECTS. При этом часть исследований указывает на ухудшение запоминания как вербального, так и невербального материала [31][34]. По другим данным, большую часть составляют расстройства вербальной памяти [35], что, по мнению некоторых авторов, согласуется с преобладающим дефицитом речевых функций и имеет вторичную природу в силу изменений процессов вербального кодирования и хранения информации [31].
Этиологические факторы / Etiological factors
Современные представления о патогенезе эпилепсии указывают на многофакторный характер когнитивных нарушений (рис. 2). Выделяют три основных предиктора [17]:
- этиология, считающаяся наиболее важной причиной;
- характер и частота приступов;
- эффекты противоэпилептической терапии.

Рисунок 2. Факторы развития когнитивных нарушений при эпилепсии
(рисунок авторов)
Figure 2. Factors involved in development of epilepsy-related cognitive impairment
(drawn by authors)
Генетические предикторы / Genetic predictors
Наличие клинической и анамнестической схожести ДАЭ, ЮАЭ и ЮМЭ указывает на общность этиопатогенетических механизмов развития данных форм ИГЭ [11][14]. Общие генетические факторы регуляции эпилептогенеза обсуждаются во многих исследованиях, в частности имеются данные о возможности реализации всех четырех синдромов ИГЭ в одной семье [36]. Кроме того, результаты исследований демонстрируют сходство структурных и функциональных характеристик ЭЭГ и магнитной энцефалографии у пациентов и здоровых братьев и сестер [37].
Также рассматриваются общие механизмы развития сопутствующих когнитивных нарушений. На генетическую этиологию нейропсихологической дисфункции указывает проявление аналогичных изменений когнитивного профиля как у больных ИГЭ, так и у их родственников [36].
Для пациентов с SeLECTS и их сибсов также характерны изменения в схожих когнитивных доменах. Генетическая природа подтверждается исследованиями интеллектуальных функций, демонстрирующими наличие специфического когнитивного фенотипа с нарушением языковых функций, вербальной памяти и внимания как у детей с SeLECTS, так и у здоровых сибсов [38].
Полногеномные исследования демонстрируют полигенный тип наследования и наличие множественных однонуклеотидных полиморфизмов, составляющих около 58% генетических изменений при ИГЭ [39]. Довольно широко известны изменения в генах рецепторов гамма-аминомасляной кислоты GABRA1 (rs2279020), GABRG2 (rs121909673), GABRA6 (rs3219151) [40–42]. По данным генетических исследований, в этиопатогенезе ДАЭ показана роль генов, кодирующих кальциевые каналы, – CACNA1H, CACNA1G и CACNG3 [43][44].
У пациентов с ЮМЭ задействовано несколько отдельных локусов, из которых наиболее патогенными считаются GABRA1, GABRD, EFHC1, BRD2, CASR и ICK со сложным наследованием [45][46]. Также обсуждается Т-аллель гена GJD2, кодирующего белок коннексин 36 и повышающего риск эпилептогенеза [47][48]. Выявленные генетические варианты, тем не менее, не являются единственным достаточным этиологическим фактором развития ИГЭ и сопутствующего когнитивного дефицита. Большое значение имеют кумулятивный и синергетический эффекты, а также эпигенетические и средовые факторы [14][39].
По результатам исследования W. Xiong и D. Zhou (2017 г.), до 59% пациентов с SeLECTS имели положительный семейный анамнез [49]. Для SeLECTS также характерно полигенное наследование, указываются патогенные варианты нескольких генов: GRIN2A, KCNQ2, KCNQ3, DEPDC5, ELP4-PAX6, GABAA-R, GABRG2, RBFOX1/3, RYR2, CHRNA5 и KALRN [50–52]. Имеются данные, подтверждающие наследственный характер центротемпоральных спайков, ассоциированных с локусами 16p12–11,2, 15q14 и 11p13. При этом для локуса 11p13 выявлена плейотропность в отношении речевой диспраксии и спайков. Микродупликация 16p11.2 считается характерной для SeLECTS, т.к. выявляется и при изолированных спайках, и у пациентов с приступами [49].
Характер течения заболевания и эффекты противоэпилептической терапии / Disease course and antiepileptic therapy effects
Тяжесть течения заболевания с сохраняющимися приступами считается значимым фактором развития когнитивных нарушений. Так, A.W. Byars et al. (2014 г.) в исследовании с участием 193 больных детей зарегистрировали корреляцию характера течения эпилепсии и выраженности изменений речевой функции вне зависимости от этиологии и формы заболевания. Наихудшие результаты на момент дебюта и спустя 1,5 года показали дети с персистирующими приступами в сравнении с детьми с непостоянными приступами и когортой здоровых детей [53].
Результаты проспективного исследования когнитивных исходов у пациентов с дебютом эпилепсии в детском возрасте за 50-летний период также продемонстрировали взаимосвязь снижения когнитивных функций с персистирующими приступами. Больные активной эпилепсией на фоне постоянного приема противоэпилептических препаратов (ПЭП) имели клинически значимые нарушения по результатам нейропсихологического тестирования по сравнению с пациентами в состоянии ремиссии [15].
Активно обсуждается развитие когнитивных нарушений на фоне приема ПЭП. Среди детей с различными формами эпилепсии снижение функции внимания и замедленность мышления являются самым частым побочным эффектом от применения ПЭП [54]. В исследовании I.N. Mohamed еt al. (2018 г.) у 1/3 детей отмечена взаимосвязь сниженного уровня IQ и приема более одного ПЭП [55]. По некоторым данным, лекарственная терапия оказывает более сильное влияние на выраженность психоповеденческой дисфункции, чем этиология и течение эпилепсии [56].
Структурные изменения головного мозга / Brain structural alterations
Несмотря на то что описываемые типы эпилепсии позиционируются как формы без структурной патологии головного мозга, данные нейровизуализации свидетельствуют об имеющихся стойких анатомических перестройках (табл. 1).
Таблица 1. Структурные изменения головного мозга
при идиопатических генерализованных эпилепсиях
и самокупирующейся эпилепсии с центротемпоральными спайками
(англ. self-limited epilepsy with centrotemporal spikes, SeLECTS)
Table 1. Brain structural alterations in idiopathic generalized epilepsies
and self-limited epilepsy with centrotemporal spikes (SeLECTS)
|
ДАЭ/ЮАЭ // CAE/JAE |
ЮМЭ / JME |
SeLECTS |
|
– Уменьшение объема серого вещества лобной доли / Decreased gray matter volume in the frontal lobe – Уменьшение объема серого вещества правой передней височной области / Decreased gray matter volume in the right anterior temporal region – Уменьшение объема серого вещества мозжечка / Decreased gray matter volume in the cerebellum – Уменьшение объема базальных ганглиев (хвостатое ядро и скорлупа) / Decreased basal ganglia volume (caudate nucleus and putamen) – Увеличение объема серого вещества таламусов / Increased gray matter volume in the thalamus |
– Уменьшение объема серого вещества лобной доли / Decreased gray matter volume in the frontal lobe – Уменьшение объема серого вещества задней области поясной извилины / Decreased gray matter volume in the posterior cingulate cortex – Уменьшение объема коры дополнительной двигательной области / Decreased volume of the supplementary motor area cortex – Снижение функциональной активности в мозолистом теле / Lowered functional activity in the corpus callosum – Уменьшение объема базальных ганглиев (хвостатое ядро, скорлупа) / Decreased basal ganglia volume (caudate nucleus, putamen) – Снижение плотности белого вещества / Decreased white matter density |
– Уменьшение общего объема лобных долей / Decreased total frontal lobe volume – Утолщение правой лобно-височной коры / Thickened right frontotemporal cortex – Утолщение орбитофронтальной коры слева / Thickened left orbitofrontal cortex – Утолщение коры прецентральных извилин с двух сторон / Thickened bilateral precentral gyrus cortex – Двустороннее увеличение массы и объема скорлуп и миндалевидных тел / Bilaterally increased mass and volume of the putamen and amygdala |
Примечание. ДАЭ – детская абсансная эпилепсия;
ЮАЭ – юношеская абсансная эпилепсия;
ЮМЭ – юношеская миоклоническая эпилепсия.
Note. CAE – childhood absence epilepsy;
JAE – juvenile absence epilepsy;
JME – juvenile myoclonic epilepsy.
В работе J.J. Lin et al. (2014 г.) у детей с ЮМЭ обнаружены нарушения возрастного развития головного мозга со снижением возраст-ассоциированных процессов редукции объема и толщины серого вещества в лобно-теменно-височных областях [22]. Имеются экспериментальные данные о влиянии эпилептогенеза при ЮМЭ на регуляцию процессов развития коры головного мозга. В исследовании на мышах выявлено нарушение миграции нейронов, ассоциированное с геном EFHC1 [22][61].
Особенности организации и функционирования нейронных сетей / Features of neural networks organization and functioning
Другим важным этиопатогенетическим механизмом когнитивной дисфункции являются изменения нейронных сетей при эпилепсии [62]. В рамках концепции сетевой организации эпилепсию можно рассматривать как патологию с расстройством церебральных сетей и нарушением взаимодействия и взаиморегуляции связанных областей головного мозга за счет эпилептогенеза [63]. Данные исследований демонстрируют аномальную структуру сетей мозга и узловых точек, обеспечивающих множественные сложные межсетевые взаимодействия, которые могут принимать непосредственное участие в синтезе и передаче патологического импульса при эпилепсии [62][64].
В исследовании T.S. Kellermann et al. (2015 г.) у детей с эпилепсией организация сетей отличалась меньшей дифференцированностью и нарушением связей блоков некоторых функций с остальной глобальной сетью, а также относительной изоляцией блоков внимания и исполнительной функции. Нейронные сети у детей без эпилепсии и отклонений нервно-психического развития имели четкую модульную организацию [65]. По другим источникам, у больных эпилепсией выявлялись нарушения временной и пространственной изменчивости сетей «режима по умолчанию» (пассивного режима работы мозга), включающих заднюю поясную извилину, префронтальную кору, кору средней и верхней лобной извилин, переднюю поясную и угловую извилины [12][66].
У пациентов с ИГЭ описаны изменения структурных и функциональных характеристик нейронных сетей, включающие нарушение интегративности и изоляцию пораженных функциональных когнитивных центров, перестройку сетей «режима по умолчанию», а также повышенную пространственно-временную изменчивость сетей [63][66][67].
При ДАЭ выделяют наиболее выраженные изменения сетей области лобной доли, в т.ч. дорсолатеральных префронтальных цепей и связей орбитофронтальной зоны с моторной и премоторной областями, ассоциированных с реализацией исполнительной и речевой функций [67]. Среди этих пациентов также выявлены функциональные нарушения сети внимания с изменением сигнала от островковой доли, лобной покрышки и медиальной лобной коры [68]. Нарушение функциональной активности медиальных отделов лобной коры характерно также и для ЮМЭ. Кроме того, у больных ЮМЭ выявлены двусторонние структурные нарушения таламофронтальных связей.
У пациентов с SeLECTS также наблюдается обширная системная дезорганизация мозговых процессов, для которой характерны вовлечение и дисфункция областей вне зоны типичного эпилептогенного очага [66][69]. Некоторые данные указывают на стойкие аномальные функциональные взаимодействия между корковыми и подкорковыми структурами, независимо от наличия приступов и эпилептиформной активности [70].
С высокой частотой среди пациентов с SeLECTS встречаются множественные изменения языковых сетей, для них характерно нарушение интеграции между моторной и языковой системами [64][71]. Исследования демонстрируют снижение прохождения импульса от эпилептогенной зоны, включающей сенсомоторную область, к центру Брока [72]. Также при данной патологии отмечается изменение активности базальных ганглиев и перестройка связей гиппокампа с вентральной областью Бродмана, ответственной за регуляцию синтаксиса языка [33][64][73].
Влияние эпилептиформной активности / The impact of epileptiform activity
По данным функциональных исследований выявлены некоторые закономерности нейропсихологических изменений в зависимости от характера эпилептиформной активности при SeLECTS. Так, дети с односторонними спайками имеют более высокий уровень IQ по сравнению с детьми с двусторонней локализацией эпилептиформной активности [74]. В работе A.Е. Vaudano et al. (2019 г.) определено негативное влияние интериктальной эпилептиформной активности на функционирование речевых сетей [75]. В другом исследовании показана детальная взаимосвязь речевой дисфункции с локализацией спайков, при этом фонология и речеобразование больше страдают при левосторонних спайках, тогда как правосторонняя локализация эпилептиформной активности больше влияет на зрительно-пространственные навыки и обработку речи [76].
Также продемонстрировано влияние интериктальной эпилептиформной активности в фазу NREM-сна1 на процессы консолидации памяти [34]. Подобные результаты получили и J. Zhang et al. (2020 г.), выявив нарушения памяти, скорости реакции и зрительно-пространственных функций у детей с двусторонней локализацией эпилептиформной активности и подтвердив повышенный риск когнитивного дефицита при высоком индексе активности в фазу NREM-сна [77].
У детей с определяемыми на ЭЭГ центротемпоральными спайками обнаружено усиление связей слуховой и соматомоторной сетей, что может являться компенсаторным механизмом нарушений речевой функции [78].
Для ИГЭ также значимо наличие интериктальной эпилептиформной активности. Пациенты с ЮМЭ имеют более выраженные когнитивные нарушения при сохранении длительной генерализованной эпилептиформной активности [79]. Худшие показатели когнитивных тестов характерны для больных ЮМЭ при асимметричной интериктальной генерализованной эпилептиформной активности [80].
Среди пациентов с ЮАЭ также отмечена связь продолжительной (более 3 с) эпилептиформной активности с ухудшением процессов обработки и запоминания информации [81]. Показана зависимость выраженных нарушений внимания и продолжительности эпилептического приступа в дебюте ДАЭ более 20 с по данным ЭЭГ до начала терапии [82].
Сравнительный профиль когнитивных нарушений при ИГЭ и SeLECTS / Comparative profile of cognitive impairment in IGE and SeLECTS
Современные данные отличаются большой неоднородностью как когнитивно-поведенческих, так и функциональных, нейровизуализационных и клинических характеристик пациентов с эпилепсией, что позволяет предположить многофакторную этиологию и патогенез коморбидных когнитивных расстройств [83]. Когнитивные профили пациентов с разными синдромами ИГЭ не имеют четкой дифференцированности [17]. При сравнении (табл. 2) хорошо прослеживается множественность поражений при ИГЭ и SeLECTS с совпадением большинства блоков.
Таблица 2. Сравнительная характеристика когнитивных нарушений
при идиопатических генерализованных эпилепсиях
и самокупирующейся эпилепсии с центротемпоральными спайками
(англ. self-limited epilepsy with centrotemporal spikes, SeLECTS)
Table 2. Comparative characteristics of cognitive impairment
in idiopathic generalized epilepsies
and self-limited epilepsy with centrotemporal spikes (SeLECTS)
|
Когнитивные нарушения / Cognitive impairment |
Распределение по формам эпилепсии / Epilepsy form-specific distribution |
|
|
Речевые функции / Speech functions |
||
|
семантическое восприятие речи / semantic speech perception |
– |
SeLECTS |
|
фонематический анализ речи / phonemic speech analysis |
– |
|
|
экспрессивная речь / expressive speech |
ЮМЭ / JME |
|
|
письмо и чтение / writing and reading |
– |
|
|
Исполнительные функции / Executive function |
ДАЭ, ЮАЭ, ЮМЭ / CAE, JAE, JME |
SeLECTS |
|
Зрительно-пространственный анализ / Visual-spatial analysis |
– |
SeLECTS |
|
Внимание / Attention |
ДАЭ, ЮАЭ, ЮМЭ / CAE, JAE, JME |
SeLECTS |
|
Память / Memory |
||
|
вербальный компонент / verbal component |
ДАЭ, ЮМЭ / CAE, JME |
SeLECTS |
|
невербальный компонент / non-verbal component |
ДАЭ, ЮАЭ / CAE, JАE |
|
|
рабочая память / working memory |
ЮМЭ / JME |
– |
|
Регуляция торможения реакций / Regulated reaction inhibition |
ДАЭ, ЮМЭ / CAE, JME |
– |
|
Скорость мышления и реакций / Speed of thought and action |
ДАЭ, ЮАЭ, ЮМЭ / CAE, JAE, JME |
– |
|
Моторные функции / Motor functions |
ДАЭ / CAE |
SeLECTS |
|
Снижение уровня IQ / Lowered IQ level |
ДАЭ, ЮАЭ, ЮМЭ / CAE, JAE, JME |
SeLECTS |
Примечание. ЮМЭ – юношеская миоклоническая эпилепсия;
ДАЭ – детская абсансная эпилепсия; ЮАЭ – юношеская абсансная эпилепсия.
Note. JME – juvenile myoclonic epilepsy;
CAE – childhood absence epilepsy; JAE – juvenile absence epilepsy.
Авторы исследований сходятся на том, что на определение профиля когнитивных нарушений, помимо ответа на терапию, оказывает влияние локализация эпилептогенной зоны, возраст дебюта, факторы окружающей среды и недифференцированные дополнительные генетические факторы.
Анатомо-физиологические особенности формирования головного мозга на фоне эпилептогенеза / Anatomical and physiological features in developing brain during epileptogenesis
Существующую взаимосвязь возраста начала заболевания и развития нейропсихологических расстройств можно объяснить становлением когнитивных и социальных навыков на фоне эпилептогенеза.
В норме пространственно-временная организация процесса формирования головного мозга характеризуется общими динамическими изменениями объема серого вещества и толщины коры с увеличением в детстве, достигающим максимума в период полового созревания, и постепенным уменьшением в подростковом возрасте. Объем белого вещества растет в первые несколько лет жизни и продолжает линейно расширяться в теменно-лобно-височных областях с началом полового созревания, что соотносится с формированием зон наиболее сложных высших корковых функций [84].
Также характерно соответствие морфометрических изменений серого вещества и процессов психомоторного развития ребенка. Для раннего возраста свойственно первичное вовлечение сенсомоторной коры, по мере взросления преобладает развитие вторичных и мультимодальных областей, связанных с реализацией сложных психосоциальных навыков [85].
Последними в процессе физиологического созревания претерпевают изменения кора и проводящие пути лобных и височных долей, связанных с ассоциативными областями и участвующих в реализации речевых и исполнительных функций. Данные изменения соответствуют периоду совершенствования интеграции языковых и познавательных процессов в подростковом возрасте [84].
С учетом высокой пластичности нервной системы в период детства характер проявлений может зависеть от взаимодействия патологических и компенсаторных механизмов. Например, при ДАЭ изменение лобно-таламических путей и связанные с этим нарушения приводят к вторичной реорганизации граничащих областей коры, которые позволяют частично компенсировать развивающиеся функции [86].
С другой стороны, современные данные описывают нарушения физиологической нейрональной пластичности на фоне эпилептогенеза. Это связано с изменением процессов созревания и формирования серого и белого вещества головного мозга и влияет на компенсаторные возможности. Например, при естественном становлении языковой функции происходит увеличение речевой сети в процессе взросления. У здоровых детей отмечается более выраженное и дифференцированное развитие по сравнению с детьми с эпилепсией, для которых характерны слабая организация и снижение связи вербальных функций с другими когнитивными модулями [69]. Подобные расстройства можно интерпретировать как показатель возможной незрелости и нарушения развития.
Также одной из возможных причин появления когнитивных дисфункций может являться снижение способности к динамической перестройке нейронной сети в соответствии с задачей, которое приводит к ухудшению качества реализации уже имеющихся навыков [87].
Данные возрастные особенности допускают более динамичное и вариативное влияние эпилептогенных процессов на формирование интеллектуальных функций. Также это может обусловливать различную степень вовлеченности когнитивных доменов у разных пациентов при одной форме заболевания.
Остается неясным, носит ли реорганизация нейронных сетей лишь патологический или компенсаторный характер или изначально существует возможность комбинированного взаимодействия [65]. Так, на момент дебюта пациенты с ДАЭ и SeLECTS с учетом уже имеющихся структурно-функциональных изменений могут демонстрировать легкие или субклинические расстройства [31]. В исследовании A.N. Datta et al. (2013 г.) дети с SeLECTS показали лишь тенденцию к нарушениям речи. При этом пациенты имели аномально расширенные и усиленные двусторонние языковые сети, тогда как физиологически языковая сеть представлена преимущественно в левом полушарии [69].
Механизмы формирования когнитивных нарушений при ИГЭ и SeLECTS / Mechanisms of cognitive impairment formation in IGE and SeLECTS
Описанные особенности развития взаимосвязаны с возрастом дебюта и выявляемыми когнитивными и анатомо-функциональными изменениями при разных формах эпилепсии. Существует мнение, что SeLECTS может представлять собой нарушение развития, ассоциированное с задержкой созревания сетей мозга [71][88]. Тогда причинами диффузного поражения с выраженной речевой дисфункцией могут являться генетически обусловленные доклинические процессы формирования аномальных нейронных сетей и ранний старт заболевания с наличием фокальной эпилептиформной активности в зонах локализации речевой функции [89].
В случае ИГЭ различная тяжесть когнитивных исходов среди взрослых пациентов при разных формах позволяет предположить важную роль возраста дебюта заболевания в формировании когнитивного дефицита [18]. Однако в некоторых исследованиях не было выявлено зависимости тяжести проявлений когнитивных нарушений от формы ИГЭ [17].
Большое значение приобретают общие генетические факторы регуляции эпилептогенеза при ИГЭ. Они могут играть определяющую роль и в предрасположенности к развитию приступов, и в перестройке вещества головного мозга и дезорганизации нейронных сетей уже к моменту старта заболевания. В частности, при ЮМЭ одним из механизмов развития когнитивного дефицита является дисфункция таламофронтальной сети. При этом выявлено, что снижение лобной функциональной активности больше влияет на тяжесть проявлений заболевания, нежели на профиль когнитивных нарушений [90].
Отсутствие преобладающего пораженного домена при ИГЭ, как в случае с SeLECTS, указывает на задействованность эпилептического очага. У детей с SeLECTS выявляется снижение активности в средней лобной и верхней теменной извилинах, сохраняющееся и после купирования центротемпоральных спайков [91], что может влиять на появление когнитивной дисфункции.
Некоторые исследователи предполагают, что развитие абсансных приступов не носит первично-генерализованный характер, а имеет фокальное начало с участием нейронных сетей, объединяющих вентромедиальную лобную кору с ядрами таламуса, базальными ганглиями и ретикулярной формацией ствола мозга и мозжечка [92]. Возможно, диффузный характер поражения в данном случае связан с участием эпилептогенных зон во взаимодействии и переключении множества нейронных сетей. Для SeLECTS также обсуждается возможность непосредственного участия таламусов в генерации эпилептической активности [91][93].
Большинство данных указывает на взаимосвязь специфики когнитивных расстройств и структурно-морфометрических изменений головного мозга при эпилепсии [94]. Характерные для SeLECTS снижение импульса в центрально-височных отделах и нарушение активности базальных ганглиев коррелируют с нейровизуализационным фенотипом [88]. Выявляемое двустороннее утолщение коры в прецентральных отделах считается признаком задержки развития головного мозга и влияет не только на речевую, но и на исполнительную функцию [95].
Cтруктурные изменения при ИГЭ также имеют непосредственную связь с пораженными когнитивными доменами. При этом, по некоторым данным, перестройки нейронных сетей при ИГЭ носят лишь субоптимальный характер. Наблюдаемые изменения с изоляцией функциональных центров и нарушением связей лимбической системы и базальных ганглиев частично компенсируются за счет глобальных интегративных процессов, которые, тем не менее, также снижены [67].
Схожесть локализации функционально-анатомических перестроек и спектра нейропсихологических изменений позволяет предположить наличие общих закономерностей развития когнитивных расстройств при ИГЭ и SeLECTS. Качественные и временные характеристики нарушений свидетельствуют о важной роли доклинических патологических процессов, приводящих к изначальному отклонению траектории нервно-психического развития и формированию диффузных изменений.
В случае SeLECTS невозможно отрицать взаимосвязь фокуса эпилептиформной активности и превалирующих речевых расстройств, однако проблематично интерпретировать другие изменения когнитивной сферы как вторично обусловленные с учетом общей морфофункциональной картины. Широко представленная и сохраняющаяся с возрастом когнитивная дисфункция у пациентов с ИГЭ также может свидетельствовать о раннем глобальном нарушении физиологического созревания и функционирования мозга, усугубляющемся под влиянием эпилептиформной активности и персистирующих приступов.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Раннее начало патологического процесса с обширными морфофункциональными перестройками и нарушением этапов созревания головного мозга оказывает значительное влияние на дальнейшее развитие когнитивных функций у пациентов детского возраста с эпилепсией.
Даже при условии доброкачественного течения и купирования приступов следует учитывать, что эпилептогенез влияет на нервно-психическое развитие задолго до манифестации приступов. Наличие когнитивных нарушений к моменту дебюта в совокупности с данными о более тяжелом течении заболевания на фоне выраженных интеллектуально-мнестических расстройств позволяют рассматривать когнитивную дезинтеграцию как важное самостоятельное звено эпилептогенеза при ИГЭ и SeLECTS. Это также соотносится с актуальной на сегодняшний день сменой парадигмы этиологической вторичности нейропсихологической дисфункции при эпилепсии.
С учетом распространенности и тяжести когнитивных нарушений актуальными являются определение тактики ведения таких пациентов и разработка протокола нейропсихологического тестирования, наиболее доступного и информативного в повседневной практике. Своевременная диагностика позволит уже на момент дебюта выявлять и корректировать возможные отклонения вектора развития когнитивных функций и организовывать мультидисциплинарное взаимодействие специалистов на ранних сроках заболевания.
1. NREM (англ. non-rapid eye movement sleep) – фаза сна без быстрых движений глаз.
Список литературы
1. Baumer F.M., Cardon A.L., Porter B.E. Language dysfunction in pediatric epilepsy. J Pediatr. 2018; 194: 13–21. https://doi.org/10.1016/j.jpeds.2017.10.031.
2. Aaberg K.M., Gunnes N., Bakken I.J., et al. Incidence and prevalence of childhood epilepsy: a nationwide cohort study. Pediatrics. 2017; 139 (5): e20163908. https://doi.org/10.1542/peds.2016-3908/38809.
3. Rozensztrauch A., Kołtuniuk A. The quality of life of children with epilepsy and the impact of the disease on the family functioning. Int J Environ Res Public Health. 2022; 19 (4): 2277. https://doi.org/10.3390/ijerph19042277.
4. Sager G., Vatansever Z., Batu U., et al. Neuropsychiatric comorbidities in genetic/idiopathic generalized epilepsies and their effects on psychosocial outcomes. Epilepsy Behav. 2021; 124: 108339. https://doi.org/10.1016/j.yebeh.2021.108339.
5. Kumar G. Evaluation and management of drug resistant epilepsy in children. Curr Probl Pediatr Adolesc Health Care. 2021; 51 (7): 101035. https://doi.org/10.1016/j.cppeds.2021.101035.
6. Sillanpää M., Saarinen M.M., Karrasch M., et al. Neurocognition in childhood epilepsy: impact on mortality and complete seizure remission 50 years later. Epilepsia. 2019; 60 (1): 131–8. https://doi.org/10.1111/epi.14606.
7. Lenck-Santini P.P., Scott R.C. Mechanisms responsible for cognitive impairment in epilepsy. Cold Spring Harb Perspect Med. 2015; 5 (10): a022772. https://doi.org/10.1101/cshperspect.a022772.
8. Hunter M.B., Yoong M., Sumpter R.E., et al. Neurobehavioral problems in children with early-onset epilepsy: a population-based study. Epilepsy Behav. 2019; 93: 87–93. https://doi.org/10.1016/j.yebeh.2019.01.019.
9. Rogač Ž., Stevanović D., Bečanović S., et al. Cognitive profile, psychopathological symptoms, and quality of life in newly diagnosed pediatric epilepsy: a six-month, naturalistic follow-up study. Epilepsy Res. 2022; 179: 106844. https://doi.org/10.1016/j.eplepsyres.2021.106844.
10. Shalkevich L.V., Zhаuniaronak I.V. Comorbid disorders and their features in children with the manifestation of epilepsy. Int Neurol J. 2019; 6: 5–10. https://doi.org/10.22141/2224-0713.6.108.2019.180529.
11. Блинов Д.В. Эпилептические синдромы: определение и классификация Международной Противоэпилептической Лиги 2022 года. Эпилепсия и пароксизмальные состояния. 2022; 14 (2): 101–82. https://doi.org/10.17749/2077-8333/epi.par.con.2022.123.
12. Li Y., Sun Y., Niu K., et al. The relationship between neuromagnetic activity and cognitive function in benign childhood epilepsy with centrotemporal spikes. Epilepsy Behav. 2020; 112: 107363. https://doi.org/10.1016/j.yebeh.2020.107363.
13. Nilo A., Gelisse P., Crespel A. Genetic/idiopathic generalized epilepsies: not so good as that! Rev Neurol. 2020; 176 (6): 427–38. https://doi.org/10.1016/j.neurol.2020.03.018.
14. Hirsch E., French J., Scheffer I.E., et al. ILAE definition of the idiopathic generalized epilepsy syndromes: position statement by the ILAE Task Force on Nosology and Definitions. Epilepsia. 2022; 63 (6): 1475–99. https://doi.org/10.1111/epi.17236.
15. Karrasch M., Tiitta P., Hermann B., et al. Cognitive outcome in childhood-onset epilepsy: a five-decade prospective cohort study. J Int Neuropsychol Soc. 2017; 23 (4): 332–40. https://doi.org/10.1017/S1355617716001077.
16. Menlove L., Reilly C. Memory in children with epilepsy: a systematic review. Seizure. 2015; 25: 126–35. https://doi.org/10.1016/j.seizure.2014.10.002.
17. Loughman A., Bowden S.C., D’Souza W. Cognitive functioning in idiopathic generalised epilepsies: a systematic review and metaanalysis. Neurosci Biobehav Rev. 2014; 43: 20–34. https://doi.org/10.1016/j.neubiorev.2014.02.012.
18. Abarrategui B., Parejo-Carbonell B., García García M.E., et al. The cognitive phenotype of idiopathic generalized epilepsy. Epilepsy Behav. 2018; 89: 99–104. https://doi.org/10.1016/j.yebeh.2018.10.007.
19. Hermann B.P., Zhao Q., Jackson D.C., et al. Cognitive phenotypes in childhood idiopathic epilepsies. Epilepsy Behav. 2016; 61: 269–74. https://doi.org/10.1016/j.yebeh.2016.05.013.
20. Germanò E., Gagliano A., Arena C., et al. Reading–writing disorder in children with idiopathic epilepsy. Epilepsy Behav. 2020; 111: 107118. https://doi.org/10.1016/j.yebeh.2020.107118.
21. Cheng D., Yan X., Xu K., et al. The effect of interictal epileptiform discharges on cognitive and academic performance in children with idiopathic epilepsy. BMC Neurol. 2020; 20 (1): 233. https://doi.org/10.1186/s12883-020-01807-z/tables/3.
22. Lin J.J., Dabbs K., Riley J.D., et al. Neurodevelopment in new-onset juvenile myoclonic epilepsy over the first 2 years. Ann Neurol. 2014; 76 (5): 660–8. https://doi.org/10.1002/ana.24240.
23. Cheng D., Yan X., Gao Z., et al. Common and distinctive patterns of cognitive dysfunction in children with benign epilepsy syndromes. Pediatr Neurol. 2017; 72: 36–41.e1. https://doi.org/10.1016/j.pediatrneurol.2016.12.005.
24. Jackson D.C., Dabbs K., Walker N.M., et al. The neuropsychological and academic substrate of new-onset epilepsies. J Pediatr. 2013; 162 (5): 1047. https://doi.org/10.1016/j.jpeds.2012.10.046.
25. Cheng D., Yan X., Gao Z., et al. Neurocognitive profiles in childhood absence epilepsy. J Child Neurol. 2017; 32 (1): 46–52. https://doi.org/10.1177/0883073816668465.
26. Masur D., Shinnar S., Cnaan A., et al. Pretreatment cognitive deficits and treatment effects on attention in childhood absence epilepsy. Neurology. 2013; 81 (18): 1572–80. https://doi.org/10.1212/wnl.0b013e3182a9f3ca.
27. Caciagli L., Ratcliffe C., Xiao F., et al. The cognitive phenotype of juvenile absence epilepsy and its heritability: an investigation of patients and unaffected siblings. medRxiv. 2022.04.12.22273461. https://doi.org/10.1101/2022.04.12.22273461.
28. Kim E.H., Ko T.S. Cognitive impairment in childhood onset epilepsy: up-to-date information about its causes. Korean J Pediatr. 2016; 59 (4): 155. https://doi.org/10.3345/kjp.2016.59.4.155.
29. Almane D.N., Jones J.E., McMillan T., et al. The timing, nature, and range of neurobehavioral comorbidities in juvenile myoclonic epilepsy. Pediatr Neurol. 2019; 101: 47–52. https://doi.org/10.1016/j.pediatrneurol.2019.03.011.
30. Kwon S., Seo H.E., Hwang S.K. Cognitive and other neuropsychological profiles in children with newly diagnosed benign rolandic epilepsy. Korean J Pediatr. 2012; 55 (10): 383. https://doi.org/10.3345/kjp.2012.55.10.383.
31. Wickens S., Bowden S.C., D’Souza W. Cognitive functioning in children with self-limited epilepsy with centrotemporal spikes: a systematic review and meta-analysis. Epilepsia. 2017; 58 (10): 1673–85. https://doi.org/10.1111/epi.13865.
32. Smith A.B., Bajomo O., Pal D.K. A meta-analysis of literacy and language in children with rolandic epilepsy. Dev Med Child Neurol. 2015; 57 (11): 1019–26. https://doi.org/10.1111/dmcn.12856.
33. Yang Y., Wang F., Andrade-Machado R., et al. Disrupted functional connectivity patterns of the left inferior frontal gyrus subregions in benign childhood epilepsy with centrotemporal spikes. Transl Pediatr. 2022; 11 (9): 1552–61. https://doi.org/10.21037/tp-22-270/coif.
34. Verrotti A., Filippini M., Matricardi S., et al. Memory impairment and benign epilepsy with centrotemporal spike (BECTS): a growing suspicion. Brain Cogn. 2014; 84 (1): 123–31. https://doi.org/10.1016/j.bandc.2013.11.014.
35. Lopes A.F., Monteiro J.P., Fonseca M.J., et al. Memory functioning in children with epilepsy: frontal lobe epilepsy, childhood absence epilepsy, and benign epilepsy with centrotemporal spikes. Behav Neurol. 2014; 2014: 218637. https://doi.org/10.1155/2014/218637.
36. Chowdhury F.A., Elwes R.D.C., Koutroumanidis M., et al. Impaired cognitive function in idiopathic generalized epilepsy and unaffected family members: an epilepsy endophenotype. Epilepsia. 2014; 55 (6): 835–40. https://doi.org/10.1111/epi.12604/supinfo.
37. Stier C., Loose M., Kotikalapudi R., et al. Combined electrophysiological and morphological phenotypes in patients with genetic generalized epilepsy and their healthy siblings. Epilepsia. 2022; 63 (7): 1643–57. https://doi.org/10.1111/epi.17258.
38. Verrotti A., Matricardi S., Di Giacomo D.L., et al. Neuropsychological impairment in children with Rolandic epilepsy and in their siblings. Epilepsy Behav. 2013; 28 (1): 108–12. https://doi.org/10.1016/j.yebeh.2013.04.005.
39. Gesche J., Beier C.P. Drug resistance in idiopathic generalized epilepsies: evidence and concepts. Epilepsia. 2022; 63 (12): 3007–19. https://doi.org/10.1111/epi.17410.
40. Riaz M., Abbasi M.H., Sheikh N., et al. GABRA1 and GABRA6 gene mutations in idiopathic generalized epilepsy patients. Seizure. 2021; 93: 88–94. https://doi.org/10.1016/j.seizure.2021.10.013.
41. Perucca P., Bahlo M., Berkovic S.F. The genetics of epilepsy. Annu Rev Genomics Hum Genet. 2020; 21: 205–30. https://doi.org/10.1146/annurev-genom-120219-074937.
42. Thakran S., Guin D., Singh P., et al. Genetic landscape of common epilepsies: advancing towards precision in treatment. Int J Mol Sci. 2020; 21 (20): 7784. https://doi.org/10.3390/ijms21207784.
43. Rinaldi V.E., Di Cara G., Mencaroni E., Verrotti A. Therapeutic options for childhood absence epilepsy. Pediatr Rep. 2021; 13 (4): 658–67. https://doi.org/10.3390/pediatric13040078.
44. Yalin Ö. Genes and molecular mechanisms involved in the epileptogenesis of idiopathic absence epilepsies. Seizure. 2012; 21 (2): 79–86. https://doi.org/10.1016/j.seizure.2011.12.002.
45. Gilsoul M., Grisar T., Delgado-Escueta A.V., et al. Subtle brain developmental abnormalities in the pathogenesis of juvenile myoclonic epilepsy. Front Cell Neurosci. 2019; 13: 465519. https://doi.org/10.3389/fncel.2019.00433.
46. Тимечко Е.Е., Шилкина О.С., Орешкова Н.В. и др. Полноэкзомное секвенирование пациентов с юношеской миоклонической эпилепсией. Эпилепсия и пароксизмальные состояния. 2022; 14 (3): 254–66. https://doi.org/10.17749/2077-8333/epi.par.con.2022.119.
47. Shilkina O.S., Zobova S.N., Domoratskaya E.A., Dmitrenko D.V. Clinical and genetic characteristics of juvenile myoclonic epilepsy. Personalized Psychiatry and Neurology. 2021; 1 (2): 95–105. https://doi.org/10.52667/2712-9179-2021-1-2-95-105.
48. Шилкина О.С., Шнайдер Н.А., Зобова С.Н. и др. Ассоциация носительства полиморфизмов rs206787 и rs516535 гена BRD2 и rs3743123 гена GJD2 с юношеской миоклонической эпилепсией у пациентов европейского происхождения в Сибири. Неврология, нейропсихиатрия, психосоматика. 2019; 11 (4): 61–7. https://doi.org/10.14412/2074-2711-2019-4-61-67.
49. Xiong W., Zhou D. Progress in unraveling the genetic etiology of rolandic epilepsy. Seizure. 2017; 47: 99–104. https://doi.org/10.1016/j.seizure.2017.02.012.
50. Li X., Jiang L. Research progress in genetic studies of Rolandic epilepsy. Chinese Journal of Applied Clinical Pediatrics. 2020; 24: 314–7. https://doi.org/10.3760/cma.j.cn101070-20190306-00167.
51. Shi X.Y., Wang G., Li T., et al. Identification of susceptibility variants to benign childhood epilepsy with centro-temporal spikes (BECTS) in Chinese Han population. EBioMedicine. 2020; 57: 102840. https://doi.org/10.1016/j.ebiom.2020.102840.
52. Ma M.G., Liu X.R., Wu Y., et al. RYR2 mutations are associated with benign epilepsy of childhood with centrotemporal spikes with or without arrhythmia. Front Neurosci. 2021; 15: 629610. https://doi.org/10.3389/FNINS.2021.629610.
53. Byars A.W., deGrauw T.J., Johnson C.S., et al. Language and social functioning in children and adolescents with epilepsy. Epilepsy Behav. 2014; 31: 167–71. https://doi.org/10.1016/j.yebeh.2013.11.007.
54. Egunsola O., Choonara I., Sammons H.M., Whitehouse W.P. Safety of antiepileptic drugs in children and young people: a prospective cohort study. Seizure. 2018; 56: 20–5. https://doi.org/10.1016/j.seizure.2018.01.018.
55. Mohamed I.N., Osman A.H., Mohamed S., et al. Intelligence quotient (IQ) among children with epilepsy: national epidemiological study – Sudan. Epilepsy Behav. 2020; 103: 106813. https://doi.org/10.1016/j.yebeh.2019.106813.
56. Azad C., Guglani V., Siddiqui A., et al. Psychopathological aspects in children with epilepsy and its contributing factors: a cross-sectional study from India. J Neurosci Rural Pract. 2022; 13 (2): 301–6. https://doi.org/10.1055/s-0042-1743459.
57. Fujiwara H., Tenney J., Kadis D.S., et al. Cortical and subcortical volume differences between benign epilepsy with centrotemporal spikes and childhood absence epilepsy. Epilepsy Res. 2020; 166: 106407. https://doi.org/10.1016/j.eplepsyres.2020.106407.
58. Si X., Zhang X., Zhou Y., et al. White matter structural connectivity as a biomarker for detecting juvenile myoclonic epilepsy by transferred deep convolutional neural networks with varying transfer rates. J Neural Eng. 2021; 18 (5): 056053. https://doi.org/10.1088/1741-2552/ac25d8.
59. Kim E.H., Yum M.S., Shim W.H., et al. Structural abnormalities in benign childhood epilepsy with centrotemporal spikes (BCECTS). Seizure. 2015; 27: 40–6. https://doi.org/10.1016/j.seizure.2015.02.027.
60. Garcia-Ramos C., Jackson D.C., Lin J.J., et al. Cognition and brain development in children with benign epilepsy with centrotemporal spikes. Epilepsia. 2015; 56 (10): 1615–22. https://doi.org/10.1111/epi.13125.
61. Suzuki T., Inoue I., Yamakawa K. Epilepsy protein Efhc1/myoclonin1 is expressed in cells with motile cilia but not in neurons or mitotic apparatuses in brain. Sci Rep. 2020; 10 (1): 22076. https://doi.org/10.1038/s41598-020-79202-4.
62. Royer J., Bernhardt B.C., Larivière S., et al. Epilepsy and brain network hubs. Epilepsia. 2022; 63 (3): 537–50. https://doi.org/10.1111/epi.17171.
63. Pegg E.J., Taylor J.R., Keller S.S., Mohanraj R. Interictal structural and functional connectivity in idiopathic generalized epilepsy: a systematic review of graph theoretical studies. Epilepsy Behav. 2020; 106: 107013. https://doi.org/10.1016/j.yebeh.2020.107013.
64. Wu Y., Ji G.J., Zang Y.F., et al. Local activity and causal connectivity in children with benign epilepsy with centrotemporal spikes. PLoS One. 2015; 10 (7): e0134361. https://doi.org/10.1371/journal.pone.0134361.
65. Kellermann T.S., Bonilha L., Lin J.J., Hermann B.P. Mapping the landscape of cognitive development in children with epilepsy. Cortex. 2015; 66: 1–8. https://doi.org/10.1016/j.cortex.2015.02.001.
66. Jiang S., Pei H., Huang Y., et al. Dynamic temporospatial patterns of functional connectivity and alterations in idiopathic generalized epilepsy. Int J Neural Syst. 2020; 30 (12): 2050065. https://doi.org/10.1142/S0129065720500653.
67. Zhang T., Zhang Y., Ren J., et al. Aberrant basal ganglia-thalamocortical network topology in juvenile absence epilepsy: a resting-state EEG-fMRI study. Seizure. 2021; 84: 78–83. https://doi.org/10.1016/j.seizure.2020.11.015.
68. Barone V., van Putten M.J., Visser G.H. Absence epilepsy: characteristics, pathophysiology, attention impairments, and the related risk of accidents. A narrative review. Epilepsy Behav. 2020; 112: 107342. https://doi.org/10.1016/j.yebeh.2020.107342.
69. Datta A.N., Oser N., Bauder F., et al. Cognitive impairment and cortical reorganization in children with benign epilepsy with centrotemporal spikes. Epilepsia. 2013; 54 (3): 487–94. https://doi.org/10.1111/epi.12067.
70. Li R., Liao W., Yu Y., et al. Differential patterns of dynamic functional connectivity variability of striato–cortical circuitry in children with benign epilepsy with centrotemporal spikes. Hum Brain Mapp. 2018; 39 (3): 1207–17. https://doi.org/10.1002/hbm.23910.
71. Besseling R.M., Jansen J.F., Overvliet G.M., et al. Delayed convergence between brain network structure and function in rolandic epilepsy. Front Hum Neurosci. 2014; 8: 704. https://doi.org/10.3389/fnhum.2014.00704.
72. Besseling R.M., Jansen J.F., Overvliet G.M., et al. Reduced functional integration of the sensorimotor and language network in rolandic epilepsy. Neuroimage Clin. 2013; 2 (1): 239–46. https://doi.org/10.1016/j.nicl.2013.01.004.
73. Ito Y., Maki Y., Okai Y., et al. Involvement of brain structures in childhood epilepsy with centrotemporal spikes. Pediatr Int. 2022; 64 (1): e15001. https://doi.org/10.1111/ped.15001.
74. Jeong M.H., Yum M.S., Ko T.S., et al. Neuropsychological status of children with newly diagnosed idiopathic childhood epilepsy. Brain Dev. 2011; 33 (8): 666–71. https://doi.org/10.1016/j.braindev.2010.11.003.
75. Vaudano A.E., Avanzini P., Cantalupo G., et al. Mapping the effect of interictal epileptic activity density during wakefulness on brain functioning in focal childhood epilepsies with centrotemporal spikes. Front Neurol. 2019; 10: 486513. https://doi.org/10.3389/fneur.2019.01316.
76. Vannest J., Tenney J.R., Gelineau-Morel R., et al. Cognitive and behavioral outcomes in benign childhood epilepsy with centrotemporal spikes. Epilepsy Behav. 2015; 45: 85–91. https://doi.org/10.1016/j.yebeh.2015.01.041.
77. Zhang J., Yang H., Wu D., et al. Electroencephalographic abnormalities are correlated with cognitive deficits in children with benign childhood epilepsy with centrotemporal spikes: a clinical study of 61 cases. Epilepsy Behav. 2020; 106: 107012. https://doi.org/10.1016/j.yebeh.2020.107012.
78. Li R., Ji G.J., Yu Y., et al. Epileptic discharge related functional connectivity within and between networks in benign epilepsy with centrotemporal spikes. Int J Neural Syst. 2017; 27 (7): 1750018. https://doi.org/10.1142/S0129065717500186.
79. Balcik Z.E., Senadim S., Tekin B., et al. Do interictal EEG findings reflect cognitive function in juvenile myoclonic epilepsy? Epilepsy Behav. 2020; 111: 107281. https://doi.org/10.1016/j.yebeh.2020.107281.
80. Sezikli S., Pulat T.A., Tekin B., et al. Frontal lobe cognitive functions and electroencephalographic features in juvenile myoclonic epilepsy. Epilepsy Behav. 2018; 86: 102–7. https://doi.org/10.1016/j.yebeh.2018.06.009.
81. Dharan A.L., Bowden S.C., Peterson A., et al. A cross-sectional investigation of cognition and epileptiform discharges in juvenile absence epilepsy. Epilepsia. 2023; 64 (3): 742–53. https://doi.org/10.1111/epi.17505.
82. Dlugos D., Shinnar S., Cnaan A., et al. Pretreatment EEG in childhood absence epilepsy. Neurology. 2013; 81 (2): 150–6. https://doi.org/10.1212/wnl.0b013e31829a3373.
83. Hermann B.P., Struck A.F., Busch R.M., et al. Neurobehavioural comorbidities of epilepsy: towards a network-based precision taxonomy. Nat Rev Neurol. 2021; 17 (12): 731–46. https://doi.org/10.1038/s41582-021-00555-z.
84. Addis L., Lin J.J., Pal D.K., et al. Imaging and genetics of language and cognition in pediatric epilepsy. Epilepsy Behav. 2013; 26 (3): 303–12. https://doi.org/10.1016/j.yebeh.2012.09.014.
85. Shaw P., Kabani N.J., Lerch J.P., et al. Neurodevelopmental trajectories of the human cerebral cortex. J Neurosci. 2008; 28 (14): 3586–94. https://doi.org/10.1523/jneurosci.5309-07.2008.
86. Verrotti A., Matricardi S., Rinaldi V.E., et al. Neuropsychological impairment in childhood absence epilepsy: review of the literature. J Neurol Sci. 2015; 359 (1-2): 59–66. https://doi.org/10.1016/j.jns.2015.10.035.
87. Tailby C., Kowalczyk M.A., Jackson G.D. Cognitive impairment in epilepsy: the role of reduced network flexibility. Ann Clin Transl Neurol. 2018; 5 (1): 29–40. https://doi.org/10.1002/acn3.503.
88. Zhang Q., He Y., Qu T., et al. Delayed brain development of Rolandic epilepsy profiled by deep learning-based neuroanatomic imaging. Eur Radiol. 2021; 31 (12): 9628–37. https://doi.org/10.1007/S00330-021-08048-9.
89. Zhang Q., Li J., He Y., et al. Atypical functional connectivity hierarchy in Rolandic epilepsy. Commun Biol. 2023; 6: 704. https://doi.org/10.1038/s42003-023-05075-8.
90. Kim J.H., Suh S.I., Park S.Y., et al. Microstructural white matter abnormality and frontal cognitive dysfunctions in juvenile myoclonic epilepsy. Epilepsia. 2012; 53 (8): 1371–8. https://doi.org/10.1111/j.1528-1167.2012.03544.x.
91. Zhu Y., Yu Y., Shinkareva S.V., et al. Intrinsic brain activity as a diagnostic biomarker in children with benign epilepsy with centrotemporal spikes. Hum Brain Mapp. 2015; 36 (10): 3878–89. https://doi.org/10.1002/hbm.22884.
92. Depaulis A., Charpier S. Pathophysiology of absence epilepsy: insights from genetic models. Neurosci Lett. 2018; 667: 53–65. https://doi.org/10.1016/j.neulet.2017.02.035.
93. Li Q., Westover M.B., Zhang R., Chu C.J. Computational evidence for a competitive thalamocortical model of spikes and spindle activity in Rolandic epilepsy. Front Comput Neurosci. 2021; 15: 680549. https://doi.org/10.3389/fncom.2021.680549.
94. Garcia-Ramos C., Lin J.J., Kellermann T.S., et al. Graph theory and cognition: a complementary avenue for examining neuropsychological status in epilepsy. Epilepsy Behav. 2016; 64: 329–35. https://doi.org/10.1016/j.yebeh.2016.02.032.
95. Xu Y., Xu Q., Zhang Q., et al. Influence of epileptogenic region on brain structural changes in Rolandic epilepsy. Brain Imaging Behav. 2022; 16 (1): 424–34. https://doi.org/10.1007/s11682-021-00517-5.
Об авторах
А. И. ПарамоноваРоссия
Парамонова Анастасия Ивановна – аспирант кафедры медицинской генетики и клинической нейрофизиологии Института последипломного образования
ул. Партизана Железняка, д. 1, Красноярск 660022, Россия
WoS ResearcherID: HMP-3496-2023
К. Д. Лысова
Россия
Лысова Кристина Дмитриевна – ассистент кафедры медицинской генетики и клинической нейрофизиологии Института последипломного образования
ул. Партизана Железняка, д. 1, Красноярск 660022, Россия
Е. Е. Тимечко
Россия
Тимечко Елена Евгеньевна – младший научный сотрудник лаборатории медицинской генетики центра коллективного пользования «Молекулярные и клеточные технологии»
ул. Партизана Железняка, д. 1, Красноярск 660022, Россия
WoS ResearcherID: CAF-2677-2022
Г. В. Сенченко
Россия
Сенченко Галина Васильевна – старший преподаватель кафедры клинической психологии и педагогики с курсом последипломного образования
ул. Партизана Железняка, д. 1, Красноярск 660022, Россия
WoS ResearcherID: AAO-2210-
2020
М. Р. Сапронова
Россия
Сапронова Маргарита Рафаильевна – к.м.н., доцент кафедры медицинской генетики и клинической нейрофизиологии Института последипломного образования
ул. Партизана Железняка, д. 1, Красноярск 660022, Россия
WoS ResearcherID: AAJ-2507-2020
Д. В. Дмитренко
Россия
Дмитренко Диана Викторовна – д.м.н., заведующая кафедрой медицинской генетики и клинической нейрофизиологии Института последипломного образования
ул. Партизана Железняка, д. 1, Красноярск 660022, Россия
WoS ResearcherID: H-7787-2016
Рецензия
Для цитирования:
Парамонова А.И., Лысова К.Д., Тимечко Е.Е., Сенченко Г.В., Сапронова М.Р., Дмитренко Д.В. Когнитивные нарушения при эпилепсии с дебютом в детском возрасте. Эпилепсия и пароксизмальные состояния. 2024;16(1):54-68. https://doi.org/10.17749/2077-8333/epi.par.con.2024.176
For citation:
Paramonova A.I., Lysova K.D., Timechko E.E., Senchenko G.V., Sapronova M.R., Dmitrenko D.V. Cognitive impairment in childhood-onset epilepsy. Epilepsy and paroxysmal conditions. 2024;16(1):54-68. https://doi.org/10.17749/2077-8333/epi.par.con.2024.176
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































