Перейти к:
Влияние антиконвульсантов на метаболизм костной ткани: промежуточные результаты кросс-секционного исследования
https://doi.org/10.17749/2077-8333/epi.par.con.2024.202
Аннотация
Актуальность. Несмотря на широкий выбор противоэпилептических препаратов (ПЭП) с улучшенным фармакологическим профилем, нередко при их длительном приеме пациенты испытывают разнообразные побочные эффекты, одними из которых являются остеопоротические нарушения. Механизмы влияния ПЭП на костный метаболизм в настоящее время остаются недостаточно изученными, что создает определенные сложности в профилактике и лечении антиконвульсант-индуцированного остеопороза.
Цель: изучить минеральную плотность костной ткани и лабораторные параметры костного обмена у больных эпилепсией, длительно принимающих ПЭП.
Материал и методы. Проведено кросс-секционное исследование с включением двух групп сравнения – 100 взрослых пациентов с эпилепсией, получающие ПЭП более 12 мес, и 58 здоровых добровольцев без приема ПЭП. Всем участникам выполняли общеклиническое обследование, компьютерную томографическую (КТ) денситометрию в трех точках (L1, L2 и шейка бедра), лабораторные тесты минерального обмена.
Результаты. По результатам КТ-денситометрии снижение минеральной плотности костной ткани выявлено у большинства участников в обеих группах. При оценке влияния риск-факторов остеопороза на костную ткань в группе больных эпилепсией наиболее значимыми были низкая двигательная активность и длительность ПЭП-терапии, что связано с более низкими показателями минеральной плотности костной ткани. Исследование лабораторных показателей минерального обмена выявило статистически значимые различия между группами по таким индикаторам, как ионизированный кальций, 25-гидроксикальциферол, свободный тироксин и пролактин (p(U)=0,044, p(U)=0,040, p(U)=0,001, p(U)=0,003 соответственно.
Заключение. Промежуточные результаты исследования продемонстрировали, что длительное применение антиконвульсантов оказывает негативное влияние на костный метаболизм у пациентов, страдающих эпилепсией. Полученные данные указывают на необходимость дальнейшего углубленного изучения влияния терапии ПЭП на минеральный обмен.
Ключевые слова
Для цитирования:
Сивакова Н.А., Абрамова И.В., Трухина И.Ю., Рыбасова В.П., Касьянов Е.Д., Лукина Л.В., Михайлов В.А., Мазо Г.Э. Влияние антиконвульсантов на метаболизм костной ткани: промежуточные результаты кросс-секционного исследования. Эпилепсия и пароксизмальные состояния. 2024;16(3):192–201. https://doi.org/10.17749/2077-8333/epi.par.con.2024.202
For citation:
Sivakova N.A., Abramova I.V., Trukhina I.Yu., Rybasova V.P., Kasyanov E.D., Lukina L.V., Mikhailov V.A., Mazo G.E. Anticonvulsants impacting bone metabolism: interim results from a cross-sectional study. Epilepsy and paroxysmal conditions. 2024;16(3):192–201. https://doi.org/10.17749/2077-8333/epi.par.con.2024.202
ВВЕДЕНИЕ / INTRODUCTION
В последние десятилетия достигнуты значительные успехи в диагностике и лечении эпилепсии, однако пациенты вынуждены длительно или пожизненно принимать противоэпилептические препараты (ПЭП). Несмотря на широкий выбор антиконвульсантов с улучшенным фармакологическим профилем и высокой безопасностью, нередко больные испытывают разнообразные неблагоприятные эффекты в процессе лечения. Недавние исследования указывают на то, что негативным эффектом терапии ПЭП может быть патологическая остеорезорбция, при которой кости теряют плотность и склонны к переломам [1][2].
Распространенность патологических переломов среди больных эпилепсией в 2–6 раз выше по сравнению с общей популяцией, и риск повышается с увеличением длительности приема антиконвульсантов [3]. В настоящее время остаются недостаточно изученными механизмы влияния ПЭП на костный метаболизм, что создает определенные сложности в профилактике и лечении антиконвульсант-индуцированного остеопороза. Снижение минеральной плотности костной ткани (МПКТ), развитие остеопоротических нарушений и, как следствие, частые переломы у больных эпилепсией – актуальная и недостаточно изученная проблема.
В рамках научного проекта «Влияние антиконвульсантов на развитие остеопороза у больных эпилепсией», проводимого в ФГБУ «Национальный медицинский исследовательский центр психиатрии и неврологии им. В.М. Бехтерева» Минздрава России (НМИЦ ПН им. В.М. Бехтерева), были получены пилотные данные исследования на выборке 37 пациентов с эпилепсией. Результаты показали тенденцию к снижению МПКТ при длительном приеме антиконвульсантов, а также возможное влияние на минеральный обмен многих экзогенных и эндогенных факторов, таких как алкоголь, табакокурение, ранее перенесенные переломы, физическая активность, пол, возраст [4][5]. Это подтверждает необходимость комплексной оценки показателей минерального обмена и МПКТ у пациентов с эпилепсией и проведения сравнительного анализа с группой контроля – соматически здоровых участников, не принимающих антиконвульсанты.
Поздняя диагностика остеопороза приводит к ухудшению качества жизни пациентов, неблагоприятному прогнозу, увеличению инвалидизации и финансовых затрат на медицинскую помощь. Исследования, направленные на изучение влияния ПЭП на МПКТ и костный метаболизм, имеют большое значение, поскольку позволяют лучше понять механизмы развития остеопоротических нарушений и разработать стратегии мониторинга и лечения для минимизации их влияния на пациентов.
Цель – изучить МПКТ и лабораторные параметры костного обмена у больных эпилепсией, длительно принимающих ПЭП.
МАТЕРИАЛ И МЕТОДЫ / MATERIAL AND METHODS
Проведено кросс-секционное исследование с включением двух групп сравнения – основная группа взрослых больных эпилепсией (БЭ), получающих ПЭП более 12 мес, и контрольная группа относительно здоровых добровольцев (ЗД) без приема ПЭП. Пациенты с эпилепсией проходили стационарное и амбулаторное лечение в отделении лечения больных с экзогенно-органическими расстройствами и эпилепсией НМИЦ ПН им. В.М. Бехтерева.
Критерии включения, невключения и исключения / Inclusion, non-inclusion and exclusion criteria
Критерии включения
Использовали следующие критерии включения для основной группы:
– возраст от 21 года до 60 лет включительно;
– наличие верифицированного диагноза эпилепсии;
– длительность эпилепсии и приема ПЭП не менее 12 мес;
– способность прочитать, понять и подписать форму информированного согласия для участия в исследовании.
Критериями включения для контрольной группы являлись:
– возраст от 21 года до 60 лет включительно;
– отсутствие приема ПЭП;
– способность прочитать, понять и подписать форму информированного согласия для участия в исследовании.
Критерии невключения
Критерии невключения для всех участников:
– возраст до 21 и старше 61 года;
– отказ пациента / здорового добровольца или его законного представителя от участия в исследовании;
– положительный тест на беременность;
– наличие клинически значимых соматических или психиатрических заболеваний в стадии декомпенсации;
– прием препаратов, влияющих на МПКТ (глюкокортикостероиды, антидепрессанты, тиреоидные гормоны, препараты лития, нейролептики, высокие дозы гепарина, ингибиторы протонной помпы и др.);
– выраженные когнитивные расстройства, проявляющиеся неспособностью участника прочитать и понять суть информированного согласия на участие в исследовании.
Критерии исключения
Критерии исключения для всех участников:
– отказ от выполнения мероприятий, предусмотренных протоколом, или отзыв согласия;
– выявленная беременность;
– начало приема по медицинским показаниям антидепрессантов, антипсихотиков, кортикостероидов, гепарина, гормонозаместительной терапии;
– декомпенсация соматических и/или психиатрических заболеваний, затрудняющих участие в исследовании.
Общая характеристика исследуемых групп / General characteristics of study groups
Основную группу (группа БЭ) составили 100 взрослых пациентов (медиана возраста 36 (29-43) лет), среди них 53 (53%) женщины и 47 (47%) мужчин. Диагноз «эпилепсия» верифицирован у всех пациентов со средней продолжительностью заболевания 10 (4–17) лет. В контрольную группу (группа ЗД) включены 58 человек (медиана возраста 29 (25–43) лет), из них 42 (72%) женщины и 16 (27,6%) мужчин.
Распределение групп по возрасту и полу показывает, что группа пациентов с диагнозом «эпилепсия» (группа БЭ) характеризуется более старшим средним возрастом и более равномерным распределением между мужчинами и женщинами по сравнению с контрольной группой (группа ЗД), где преобладают женщины и медианный возраст ниже. Эти различия могут иметь значение при анализе результатов и интерпретации данных исследования.
В зависимости от поколения принимаемого ПЭП пациенты из группы БЭ были разделены на две подгруппы: АК1 – прием традиционных антиконвульсантов (карбамазепин, вальпроевая кислота, бензобарбитал, окскарбазепин, фенобарбитал) и АК2 – прием антиконвульсантов последней генерации (леветирацетам, лакосамид, ламотриджин). В подгруппу АК1 включены 40 пациентов, из них 21 (52,5%) мужчина и 19 (47,5%) женщин, медиана возраста 36 (32–39) лет. Подгруппу АК2 составили 60 человек, из них 26 (43,3%) мужчин и 34 (56,7%) женщины, медиана возраста 37 (34–42) лет.
Методы обследования / Examination methods
Всем участникам проводили клиническое обследование, включая подробный сбор фармакологического анамнеза и оценку факторов риска остеопороза, лабораторное исследование микроэлементов и гормонов, участвующих в костном метаболизме, и радиологическое обследование МПКТ c помощью количественной компьютерной томографии (КТ-денситометрия).
Для оценки МПКТ выполняли рентгеновскую компьютерную остеоденситометрию на мультидетекторном компьютерном томографе Aquilion One 640 (Canon, Япония) в трех точках: поясничные позвонки L1, L2 и шейка бедра. Анализ полученных результатов проводили с помощью денситометрических T- и Z-критериев.
Лабораторное исследование показателей минерального обмена включало определение уровней: тиреотропного гормона, трийодтиронина общего, трийодтиронина свободного, тироксина общего, тироксина свободного, пролактина (методом иммуноферментного анализа (ИФА) с использованием реагента производителя АО «Вектор-Бест-Балтика» (Россия)), паратиреоидного гормона, 25-гидроксикальциферола (методом ИФА с использованием реагента производителя DRG International (США)), N-остеокальцина (методом ИФА с использованием реагента производителя IImmunodiagnostic Systems (Великобритания)), щелочной фосфатазы, кальция общего, фосфора (спектрофотометрическим методом с использованием реагента производителя Randox Laboratories Ltd (Великобритания)), кальция ионизированного (методом ионселективной потенциометрии с использованием реагента производителя Roche (Швейцария)).
Все участники были оценены по уровню двигательной активности (ДА) с использованием опросника двигательной активности (ОДА 23+) [6].
Статистический анализ / Statistical analysis
Cтатистический анализ данных проведен с использованием программы Статтех версии 3.1.10 (ООО «Статтех», Россия). Количественные показатели оценивали на соответствие нормальному распределению с помощью критерия Шапиро–Уилка. Количественные показатели, имеющие нормальное распределение, описывали с помощью средних арифметических величин (M) и стандартных отклонений (SD), границ 95% доверительного интервала (95% ДИ). В случае отсутствия нормального распределения количественные данные представлены в виде медианы (Me) и нижнего и верхнего квартилей (Q25; Q75). Категориальные данные описывали с указанием абсолютных значений и процентных долей. Для сравнения групп применяли t-критерий Стьюдента и U-критерий Манна–Уитни, а также критерии Краскела–Уоллиса и χ2 Пирсона. Корреляционную связь оценивали с помощью коэффициента ранговой корреляции Спирмена и шкалы Чеддока. Для анализа диагностической значимости количественных признаков при прогнозировании определенного исхода использовали метод линейной регрессии. Различия считали статистически значимыми при p<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ / RESULTS AND DISCUSSION
Влияние риск-факторов остеопороза на МПКТ / The impact of osteoporosis risk factors on bone mineral density
Табакокурение и употребление алкоголя
В группе пациентов, длительно принимающих ПЭП, 35 (35%) человек регулярно потребляют табак, включая использование электронных сигарет и систем нагревания табака, в группе здоровых участников – 16 (27,6%) человек. Сравнительный анализ влияния табакокурения на МПКТ не выявил статистически значимых изменений КТ-показателей плотности костей у курящих и некурящих участников в группах БЭ и ЗД (p(χ2)=0,554 и p(χ2)=0,141 соответственно) (табл. 1).
Таблица 1. Сравнительный анализ влияния риск-факторов остеопороза (табакокурение, употребление алкоголя, двигательная активность) на изменения минеральной плотности костной ткани (МПКТ) в группах больных эпилепсией (БЭ) и здоровых добровольцев (ЗД)
Table 1. Comparatively analyzed effect of osteoporosis risk factors (smoking, alcohol consumption, motor activity) on bone mineral density (BMD) changes in epilepsy patients (EPs) and healthy participants (HPs)
|
Группа / Group |
Категория / Category |
МПКТ, n (%) / BMD, n (%) |
p (χ2) |
||
|
Норма / Normal range |
Остеопения / Osteopenia |
Остеопороз / Osteoporosis |
|||
|
Табакокурение / Smoking |
|||||
|
БЭ / EPs |
Курит / Yes |
21 (60,0) |
9 (25,7) |
5 (14,3) |
0,554 |
|
Не курит / No |
32 (49,2) |
23 (35,4) |
10 (15,4) |
||
|
ЗД / HPs |
Курит / Yes |
5 (31,2) |
7 (43,8) |
4 (25,0) |
0,141 |
|
Не курит / No |
24 (57,1) |
14 (33,3) |
4 (9,5) |
||
|
Употребление алкоголя / Alcohol consumption |
|||||
|
БЭ / EPs |
Не употребляет / No |
36 (67,9) |
26 (81,2) |
12 (80) |
0,406 |
|
<3 раз в неделю / <3 times a week |
6 (11,3) |
1 (3,1) |
0 (0,0) |
||
|
≥3 раз в неделю / ≥3 times a week |
11 (20,8) |
5 (15,6) |
3 (20,0) |
||
|
ЗД / HPs |
Не употребляет / No |
24 (82,0) |
9 (42,9) |
1 (12,5) |
0,003* |
|
<3 раз в неделю / <3 times a week |
1 (3,4) |
3 (14,3) |
2 (25,0) |
||
|
≥3 раз в неделю / ≥3 times a week |
4 (13,8) |
9 (42,9) |
5 (62,5) |
||
|
Уровень двигательной активности / Motor activity level |
|||||
|
БЭ / EPs |
Очень высокая / Very high |
3 (100,0) |
0 (0,0) |
0 (0,0) |
<0,001** |
|
Высокая / High |
28 (77,8) |
5 (13,9) |
3 (8,3) |
||
|
Умеренная / Moderate |
20 (47,6) |
18 (42,9) |
4 (9,5) |
||
|
Низкая / Low |
1 (12,5) |
4 (50,0) |
3 (37,5) |
||
|
Очень низкая / Very low |
1 (9,1) |
5 (45,5) |
5 (45,5) |
||
|
ЗД / HPs |
Очень высокая / Very high |
2 (100,0) |
0 (0,0) |
0 (0,0) |
0,120 |
|
Высокая / High |
19 (54,3) |
13 (37,1) |
3 (8,6) |
||
|
Умеренная / Moderate |
8 (40,0) |
8 (40,0) |
4 (20,0) |
||
|
Низкая / Low |
0 (0,0) |
0 (0,0) |
1 (100,0) |
||
|
Очень низкая / Very low |
0 (0,0) |
0 (0,0) |
0 (0,0) |
||
Примечание. Полужирным шрифтом выделены статистически значимые различия (p<0,05). * p(χ2)=0,026 при сравнении подгрупп нормы и остеопении; p(χ2)=0,002 при сравнении подгрупп нормы и остеопороза. ** p(χ2)=0,017 при сравнении подгрупп высокой и низкой двигательной активности; p(χ2)=0,002 при сравнении подгрупп высокой и очень низкой двигательной активности.
Note. Significant differences (p<0.05) are highlighted in bold. * p(χ2)=0.026 while comparing normal and osteopenia subgroups; p(χ2)=0.002 while comparing normal and osteoporosis subgroups. ** p(χ2)=0.017 while comparing high and low physical activity subgroups; p(χ2)=0.002 while comparing high and very low physical activity subgroups.
Для оценки влияния употребления алкоголя на показатели КТ-денситометрии были выделены подгруппы по степени КТ-изменений МПКТ и проведен анализ частоты приема алкогольных напитков в каждой подгруппе. Следует отметить, что пациенты, принимающие ПЭП-терапию, осведомлены, что их основное заболевание и прием антиконвульсантов подразумевают полный отказ от алкоголя, тем не менее в каждой подгруппе были респонденты, которые признавали, что употребляют алкоголь.
В подгруппе пациентов с нормальной МПКТ 36 (67,9%) участников абсолютно не употребляют алкоголь, 6 (11,3%) обследуемых принимают алкоголь до 3 раз в неделю и 11 (20,8%) человек – более 3 раз в неделю. В подгруппе со сниженной МПКТ до уровня остеопении 26 (81,2%) пациентов не употребляют алкоголь, 1 (3,1%) человек принимает алкоголь до 3 раз в неделю и 5 (15,6%) обследуемых – более 3 раз в неделю. В группе пациентов с КТ-снижением плотности костной ткани до уровня остеопороза 12 (80%) человек не употребляют алкоголь, а 3 (20%) употребляют алкоголь чаще 3 раз в неделю. В соответствии с полученными данными статистически значимого влияния частоты употребления алкоголя на изменения МПКТ в группе БЭ не обнаружено (p(χ2)=0,406). Исследование влияния приема алкоголя на МПКТ в группе ЗД также не показало статистически значимого снижения КТ-показателей плотности костной ткани при увеличении частоты употребления алкоголя (p(χ2)=0,003) (см. табл. 1).
Полученные результаты не согласуются с данными исследования A. Vergatti et al., в котором подгруппа никогда не куривших участников показала меньшую распространенность рентгенологических признаков остеопороза и гиповитаминоза D по сравнению с активными и пассивными курильщиками (p<0,05) [7]. Также в метаанализе, проведенном Z. Cheraghi et al., установлено, что у лиц, употребляющих 0,5–1 напиток в день, риск развития остеопороза в 1,38 раза выше в сравнении с группой людей, не употребляющих алкоголь [8]. Тем не менее в исследовании D.R. Baddoo et al., в котором участвовали 835 больных эпилепсией, длительно принимающих антиконвульсанты, не было обнаружено значимого влияния таких факторов, как курение и алкоголь, на МПКТ: p(χ2)=0,83, p(χ2)=0,76 соответственно [9]. Полученные противоречивые результаты различных исследований указывают на необходимость дальнейшего подробного изучения влияния табакокурения и употребления алкоголя на МПКТ у людей, длительно принимающих ПЭП и здоровых добровольцев.
Двигательная активность
При оценке ДА по опроснику ОДА 23+ установлено, что у пациентов с низким и очень низким уровнем ДА отмечается более существенное снижение МПКТ по сравнению с участниками, поддерживающими более активный образ жизни. Из 11 больных с очень низкой ДА у 10 (91%) выявлены изменения МПКТ до уровня остеопении и остеопороза. Среди 36 пациентов с высоким уровнем ДА лишь 8 человек (22%) имели снижение МПКТ. Установлены достоверные различия (p(χ2)<0,001, p=0,017 при сравнении подгрупп с высокой и низкой ДА, p=0,002 при сравнении подгрупп с высокой и очень низкой ДА), указывающие на существенную зависимость между уровнем ДА и изменением МПКТ (см. табл. 1).
Вероятно, полученные результаты связаны с преобладанием высокой ДА в группе ЗД. Средний уровень ДА в данной группе составил 66 (54–78) баллов, что соответствует высокому уровню по ОДА 23+. Согласно отчету рабочей группы по спорту и эпилепсии Международной Противоэпилептической Лиги (МПЭЛ) (англ. International League Against Epilepsy, ILAE) от 2016 г. пациентам с приступами часто не рекомендуют заниматься активными видами спорта из-за страха, чрезмерной опеки или недостаточной осведомленности [10]. Однако занятия физическими упражнениями и спортом способствуют улучшению общего состояния больных, включая повышение самооценки, социализацию и улучшение здоровья в долгосрочной перспективе [10][11]. Исследование по оценке МПКТ у 500 женщин старше 40 лет также показали высокие шансы нормальной плотности костей при умеренной (p=0,053) и высокой (p<0,001) ДА [12]. Таким образом, больные с уровнем ДА ниже умеренной в большей степени, чем пациенты с высокой ДА, подвержены снижению МПКТ. Возможно, это связано с тем, что механическое воздействие в виде сокращений мышц и силы тяжести тела на кости и суставные ткани приводит к активированию остеоцитов, которые производят сигнальные молекулы, стимулирующие дифференцировку остеобластов [13][14].
КТ-денситометрическое обследование / CT densitometry
Общая характеристика МПКТ в группах
Исследование МПКТ с использованием КТ-денситометрии показало, что в группе БЭ снижение костной плотности наблюдалось у 47 (47%) пациентов, в т.ч. 32 (32%) участника имели КТ-признаки остеопении, 15 (15%) – КТ-признаки остеопороза. В группе ЗД изменения МПКТ выявлены у 29 участников (50%), из них КТ-остепения отмечалась у 21 (36,2%) человека, КТ-остеопороз – у 8 (13,8%).
При сравнительном анализе частоты представленности КТ-изменений МПКТ в группах ЗД и БЭ установить значимых различий не удалось (p(χ2)=0,863). В исследовании, проведенном V. Chandrasekaran et al., участвовали 926 мужчин и 1070 женщин, из которых антиконвульсанты принимали 1,8% и 1,9% соответственно, и показано снижение МПКТ у участников, принимавших ПЭП [2]. В нашей работе статистически значимых различий в показателях МПКТ между исследуемыми группами не выявлено, что, вероятно, требует увеличения выборки участников с поправкой на воздействие риск-факторов.
Влияние длительности приема ПЭП на МПКТ
Проведена оценка изменений МПКТ в зависимости от длительности приема ПЭП в группе БЭ. Показано, что у пациентов с нормальной МПКТ средняя продолжительность приема антиконвульсантов составила 4 года, в то время как у больных со снижением МПКТ до уровня остео- пении – 15 лет, а до уровня остеопороза – 10 лет (рис. 1). Установлено достоверно значимое снижение МПКТ до показателей остеопении и остеопороза у пациентов, принимавших ПЭП-терапию в течение более продолжительного периода (p(H)<0,001).
Проведен корреляционный анализ для изучения связи между снижением МПКТ и длительностью приема ПЭП-терапии. По шкале Чеддока выявлена значительная обратная корреляционная связь (ρ=–0,626, p<0,001) между уменьшением денситометрического показателя «Z-критерий L1/L2» и продолжительностью приема антиконвульсантов (рис. 2). Данный анализ также показал, что увеличение продолжительности приема ПЭП на 1 соответствует ожидаемому уменьшению показателя «Z-критерий» на 0,196. Полученные данные свидетельствуют о высоком риске снижения МПКТ при более длительном приеме антиконвульсантов.
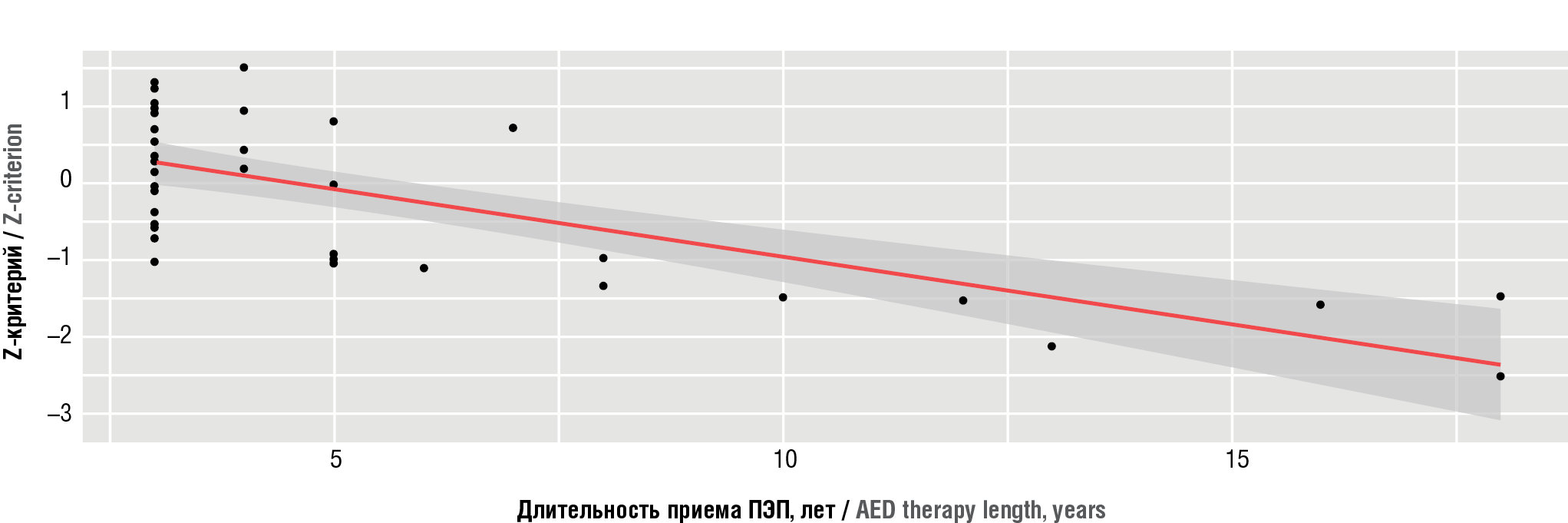
Рисунок 1. Анализ изменений минеральной плотности костной ткани (МПКТ) в зависимости от длительности приема противоэпилептических препаратов (ПЭП)
Figure 1. Analysed bone mineral density (BMD) changes depending on antiepileptic drug (AED) therapy length
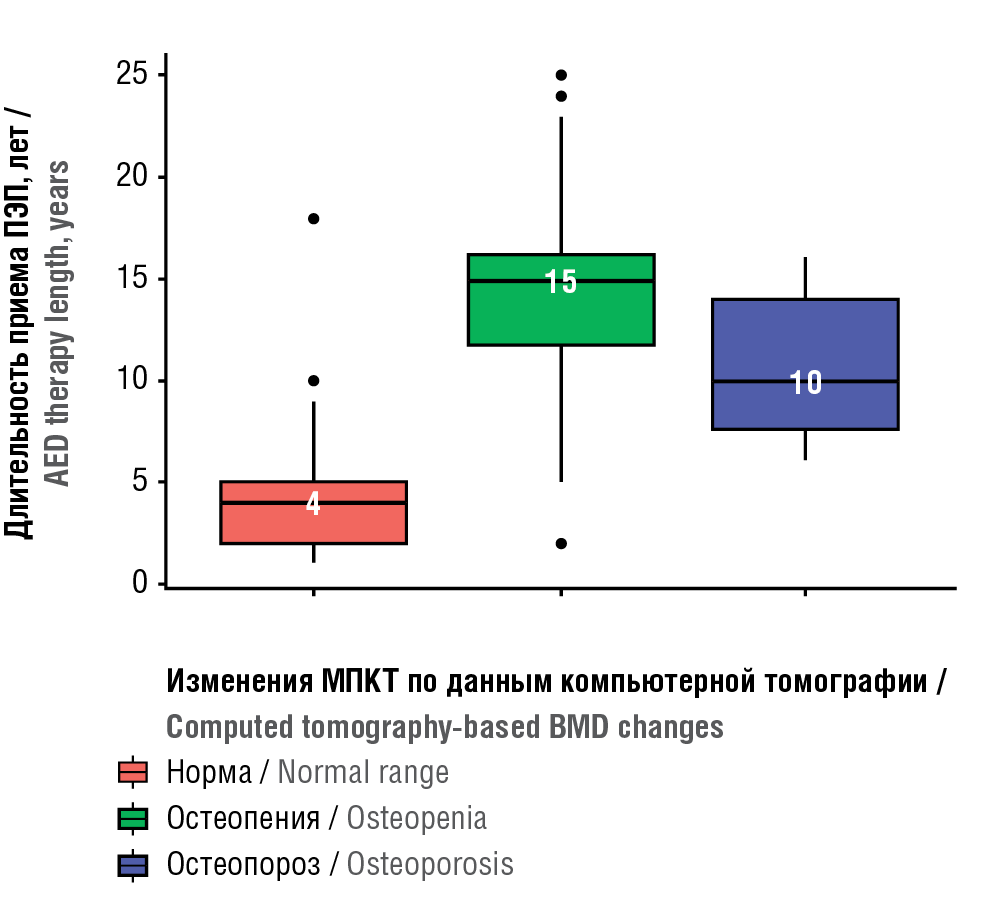
Рисунок 2. График регрессии, показывающий зависимость показателя «минеральная плотность костной ткани» (Z-критерий) от длительности приема противоэпилептических препаратов (ПЭП) в группе больных эпилепсией
Figure 2. Regression graph showing a relation between bone mineral density (Z-criterion) on the duration of antiepileptic drug (AED) administration in epileptic patients
Влияние поколения ПЭП на МПКТ
Результаты КТ-денситометрии показали, что в подгруппе АК1 6 (15%) пациентов имели снижение МПКТ до уровня остеопороза, 15 (37 %) – до уровня остеопении, а в подгруппе АК2 8 (13,6%) обследуемых – до уровня остеопороза, 17 (28,8 %) – до уровня остеопении. При анализе связи между уровнями снижения МПКТ и поколением принимаемого ПЭП не было обнаружено статистически значимых различий (p(χ2)=0,863). Полученные данные могут свидетельствовать о негативном влиянии антиконвульсантов различных поколений на метаболизм костной ткани. Возможно, проведение дополнительных исследований с привлечением большего числа пациентов и длительным периодом наблюдения позволит лучше понять, как ПЭП-терапия влияет на состояние костей.
Лабораторное исследование / Laboratory examination
Проведен сравнительный анализ лабораторных показателей, влияющих на минеральный обмен, в обеих группах исследования.
При сравнении средних величин показателей ионизированного кальция, свободного тироксина и пролактина выявлены статистически значимые различия между группами БЭ и ЗД (p(U)=0,044, p(U)=0,001, p(U)=0,003 соответственно), что может указывать на преобладание процессов остеорезорбции над остеогенезом в группе БЭ. Также получены значимые различия по уровню витамина D (p(U)=0,040) между группами БЭ и ЗД.
Результаты согласуются со многими исследованиями, в которых показано, что индукция системы цитохрома Р450 печени (СYР450) ускоряет катаболизм витамина D в его полярные неактивные метаболиты и ослабляет его биологически активные формы [15][16]. Это объясняет воздействие на костный метаболизм антиконвульсантов – индукторов системы цитохрома Р450 печени. Однако механизмы воздействия последних и влияния ПЭП недостаточно изучены [16].
Другие лабораторные показатели не продемонстрировали статистически значимых различий между сравниваемыми группами (табл. 2).
Таблица 2. Сравнение лабораторных показателей «микроэлементы» и «гормоны» в группах здоровых добровольцев (ЗД) и больных эпилепсией (БЭ)
Table 2. Comparison of “micronutrients” and “hormones” laboratory parameters in epilepsy patients (EPs) and healthy participants (HPs)
|
Показатель / Indicator |
Группа / Group |
n |
Me [Q25; Q75] |
p* |
|
Ионизированный кальций, ммоль/л // Ionized calcium, mmol/l |
БЭ / EPs |
100 |
1,21 [ 1,19; 1,25] |
0,044 |
|
ЗД / HPs |
58 |
1,23 [ 1,21; 1,26] |
||
|
Витамин D, нг/мл // Vitamin D, ng/ml |
БЭ / EPs |
100 |
20,229 [ 10,395; 28,495] |
0,040 |
|
ЗД / HPs |
58 |
21,933 [ 16,826; 29,375] |
||
|
Общий кальций, ммоль/л // Total calcium, mmol/l |
БЭ/ EPs |
100 |
2,48 [ 2,36; 2,58] |
0,612 |
|
ЗД / HPs |
58 |
2,49 [ 2,42; 2,56] |
||
|
Фосфор, ммоль/л // Phosphorus, mmol/l |
БЭ / EPs |
100 |
1,07 [ 0,98; 1,19] |
0,287 |
|
ЗД / HPs |
58 |
1,02 [ 0,93; 1,16] |
||
|
Трийодтиронин свободный, нмоль/л // Free triiodothyronine, nmol/l |
БЭ / EPs |
100 |
5,508 [ 5,002; 6,506] |
0,853 |
|
ЗД / HPs |
58 |
5,913 [ 5,141; 6,285] |
||
|
Трийодтиронин общий, пмоль/л // Total triiodothyronine, pmol/l |
БЭ / EPs |
100 |
1,656 [ 1,279; 1,869] |
0,078 |
|
ЗД / HPs |
58 |
1,731 [ 1,582; 1,899] |
||
|
Тироксин общий, пмоль/л // Total thyroxine, pmol/l |
БЭ / EPs |
100 |
86,500 [ 69,609; 113,181] |
0,665 |
|
ЗД / HPs |
58 |
87,491 [ 78,704; 98,260] |
||
|
Тироксин свободный, нмоль/л // Free thyroxine, nmol/l |
БЭ / EPs |
100 |
15,331 [ 14,114; 17,028] |
0,001 |
|
ЗД / HPs |
58 |
16,564 [ 15,514; 18,127] |
||
|
Тиреотропный гормон, мМЕ/л // Thyroid stimulating hormone, mIU/l |
БЭ / EPs |
100 |
1,866 [ 1,268; 2,851] |
0,903 |
|
ЗД / HPs |
58 |
1,841 [ 1,217; 3,125] |
||
|
Щелочная фосфатаза, ЕД/л // Alkaline phosphatase, U/l |
БЭ / EPs |
100 |
174 [ 139; 226] |
0,828 |
|
ЗД / HPs |
58 |
169 [ 144; 226] |
||
|
Паратиреоидный гормон, пмоль/л // Parathyroid hormone, pmol/l |
БЭ / EPs |
100 |
49,178 [ 39,306; 65,130] |
0,385 |
|
ЗД / HPs |
58 |
50,763 [ 41,861; 67,659] |
||
|
N-остеокальцин, нг/мл // N-osteocalcin, ng/ml |
БЭ / EPs |
100 |
11,179 [ 8,573; 16,937] |
0,967 |
|
ЗД / HPs |
58 |
11,596 [ 9,303; 15,274] |
||
|
Пролактин, мМЕ/мл // Prolactin, mIU/ml |
БЭ / EPs |
100 |
454 [ 273; 596] |
0,003 |
|
ЗД / HPs |
58 |
278 [ 179; 460] |
Примечание. * U–критерий Манна–Уитни. Полужирным шрифтом выделены статистически значимые различия (p<0,05).
Note. * Mann–Whitney U test. Significant differences (p<0.05) are highlighted in bold.
В группе ЗД медиана уровня пролактина составила 278 (179–460) мг/мл, а в группе БЭ – 454 (273–596) мг/мл. Повышение пролактина в крови у пациентов с эпилепсией может быть связано как с самими эпилептическими приступами, так и с принимаемыми антиконвульсантами [11][17][18]. Механизм, посредством которого эпилептические приступы способствуют гиперпролактинемии, полностью не изучен. Тем не менее считается, что это связано с активацией гипоталамо-гипофизарно-надпочечниковой системы, впоследствии приводящей к увеличению уровня пролактина в крови [11][18]. Результаты исследования Y. Panahi et al., проведенного на грызунах, показывают, что у крыс после хронических судорог в течение 10 нед наблюдается повышение уровня пролактина в сыворотке крови [19]. M.F. Wang исследовал 110 пациентов с эпилепсией и выявил, что концентрация пролактина, измеряемая до и после эпилептического приступа в сыворотке крови, была значительно повышена после судорог и достигала уровня, более чем в 5 раз превы- шающего исходный, у 59 пациентов [20].
Установленное в нашем исследовании снижение уровня свободного тироксина в крови у пациентов, длительно принимающих ПЭП, согласуется с данными метаанализа Y.X. Zhang et al., который включал 35 исследований и в общей сложности 997 пациентов. Данный анализ показал, что применение традиционных антиконвульсантов (карбамазепин и вальпроевая кислота) приводит к значительному снижению сывороточных уровней трийодтиронина, тироксина и повышению уровня тиреотропного гормона [21].
При оценке лабораторных показателей, влияющих на костный метаболизм, в зависимости от поколения принимаемого ПЭП статистически значимые различия получены по уровню пролактина. Средняя концентрация пролактина была достоверно выше среди пациентов, принимающих традиционные антиконвульсанты (АК1 – 478 (282–630) мг/мл, АК2 – 445 (266–544) мг/мл, p(Н)=0,01)). В работе W.S. Mohamed et al., включавшей 50 мужчин с эпилепсией, уровень пролактина также был значительно повышен в группе пациентов, принимавших вальпроевую кислоту, по сравнению с больными, получавшими леветирацетам [22]. Гиперпролактинемия, индуцированная вальпроатом, является результатом измененной регуляции ГАМК1-ергических, норадренергических и серотонинергических нейронов, которые, в свою очередь, модулируют высвобождение дофамина [23].
Полученные данные могут быть рассмотрены в качестве дальнейшего вектора исследования влияния различных поколений ПЭП на уровни пролактина в крови у пациентов с эпилепсией и нарушением МПКТ. По результатам метаанализа Y.X. Zhang et al. установлено значительное снижение свободного тироксина в крови у больных, принимавших карбамазепин, фенитоин и вальпроевую кислоту, входящих в группу традиционных антиконвульсантов, по сравнению с группой приема ПЭП последней генерации [21]. В работе F.Y. Shih et al. с участием 298 пациентов, страдающих эпилепсией и с отсутствием в анамнезе патологий щитовидной железы, авторы пришли к выводу, что применение карбамазепина является независимым фактором риска снижения уровня свободного тироксина в крови [24]. В нашем исследовании уровень тироксина также был значимо снижен у больных, принимающих и традиционные ПЭП, и препараты новой генерации, в сравнении с группой ЗД (p(Н)=0,018 при сравнении группы ЗД с подгруппой БЭ, принимавшей ПЭП старого поколения; p(Н)=0,018 при сравнении группы ЗД с подгруппой БЭ, принимавшей ПЭП нового поколения).
Результаты лабораторного исследования подтверждают, что одним из механизмов влияния антиконвульсантов на процессы костного обмена является их воздействие на гормональный обмен. Кроме того, эти наблюдения могут свидетельствовать о различных механизмах влияния ПЭП разных поколений на минеральный обмен, что указывает на необходимость более глубокого их изучения. Очевидно, что коррекция показателей МПКТ у людей, принимающих ПЭП различных генераций, должна основываться на их молекулярном воздействии.
Перспектива исследования / Research perspective
Представленные в статье данные являются промежуточными результатами научного проекта «Влияние антиконвульсантов на развитие остеопороза у больных эпилепсией» (2022–2024 гг). В настоящее время идет завершение набора участников исследования – 200 пациентов с эпилепсией и 100 относительно здоровых добровольцев с формированием сопоставимых групп по полу и возрасту.
В результате комплексного исследования пациентов с эпилепсией, длительно получающих антиконвульсанты, будут получены данные, отражающие состояние костной системы участников исследования, а также их рентгенологические, эндокринологические и метаболические показатели, параметры образа жизни, связанные с риском развития остеопороза. На основании полученных финальных данных будет создана модель оценки рисков развития остеопороза у пациентов, длительно принимаю- щих терапию ПЭП.
ЗАКЛЮЧЕНИЕ / CONCLUSION
Промежуточные результаты исследования показали, что длительное применение антиконвульсантов оказывает негативное влияние на минеральный обмен у пациентов с эпилепсией. Таким образом, данная работа подчеркивает важность мониторинга МПКТ и маркеров костного метаболизма у больных, принимающих ПЭП, а также необходимость разработки индивидуализированных подходов к профилактике и лечению антиконвульсант-индуцированного остеопороза. Кроме того, требуется проведение углубленных многоцентровых лонгитюдных исследований для выявления более точных механизмов действия ПЭП на костную ткань.
1 ГАМК – гаммааминомасляная кислота.
Список литературы
1. Shen C., Chen F., Zhang Y., et al. Association between use of antiepileptic drugs and fracture risk: a systematic review and meta-analysis. Bone. 2014; 64: 246–53. https://doi.org/10.1016/j.bone.2014.04.018.
2. Chandrasekaran V., Pasco J.A., Stuart A.L., et al. Anticonvulsant use and bone health in a population-based study of men and women: cross-sectional data from the Geelong Osteoporosis Study. BMC Musculoskelet Disord. 2021; 22 (1): 172. https://doi.org/10.1186/s12891-021-04042-w.
3. Ecevit C., Aydoğan A., Kavakli T., Altinöz S. Effect of carbamazepine and valproate on bone mineral density. Pediatr Neurol. 2004; 31 (4): 279–82. https://doi.org/10.1016/j.pediatrneurol.2004.03.021.
4. Сивакова Н.А., Абрамова И.В., Рыбасова В.П. и др. Оценка минеральной плотности костной ткани у больных эпилепсией с длительным приемом противоэпилептической терапии: пилотные данные. Обозрение психиатрии и медицинской психологии им. В.М. Бехтерева. 2023; 57 (4): 75–89. https://doi.org/10.31363/2313-7053-2023-859
5. Сивакова Н.А., Абрамова И.В., Рыбасова В.П. и др. Оценка минеральной плотности костной ткани у больных эпилепсией с длительным приемом противоэпилептической терапии. Всероссийская научно-практическая конференция с международным участием «Дни остеопороза в Санкт-Петербурге», 16–17 марта 2023 года, Санкт-Петербург. Сборник тезисов. Остеопороз и остеопатии. 2023; 26 (1S): S46–7. https://doi.org/10.14341/osteo2023261S.
6. Бубнова М.Г., Аронов Д.М. Методические рекомендации. Обеспечение физической активности граждан, имеющих ограничения в состоянии здоровья. КардиоСоматика. 2016; 7 (1): 5–50.
7. Vergatti A., Abate V., D’Elia L, et al. Smoking habits and osteoporosis in community-dwelling men subjected to dual-X-ray absorptiometry: a cross-sectional study. J Endocrinol Invest. 2024 May 28. https://doi.org/10.1007/s40618-024-02402-6.
8. Cheraghi Z., Doosti-Irani A., Almasi-Hashiani A., et al. The effect of alcohol on osteoporosis: a systematic review and meta-analysis. Drug Alcohol Depend. 2019; 197: 197–202. https://doi.org/10.1016/j.drugalcdep.2019.01.025.
9. Baddoo D.R., Mills A.A., Kullab R.B., et al. Metabolic bone disease in patients with epilepsy and the use of antiepileptic drugs – insight from a Danish cross-sectional study. Seizure. 2021; 86: 29–34. https://doi.org/10.1016/j.seizure.2021.01.008.
10. Capovilla G., Kaufman K.R., Perucca E., et al. Epilepsy, seizures, physical exercise, and sports: a report from the ILAE Task Force on Sports and Epilepsy. Epilepsia. 2016; 57 (1): 6–12. http://doi.org/10.1111/epi.13261.
11. Петров К.В., Петрова М.М., Шнайдер Н.А., Насырова Р.Ф. Механизмы действия и безопасность физических упражнений у больных с эпилепсией (обзор). Вестник восстановительной медицины. 2021; 6: 81–91. https://doi.org/10.38025/2078-1962-2020-100-6-81-91.
12. Kopiczko A. Determinants of bone health in adults Polish women: the influence of physical activity, nutrition, sun exposure and biological factors. PLoS One. 2020; 15 (9): e0238127. https://doi.org/10.1371/journal.pone.0238127.
13. Santos A., Bakker A.D., Zandieh-Doulabi B., et al. Pulsating fluid flow modulates gene expression of proteins involved in Wnt signaling pathways in osteocytes. J Orthop Res. 2009; 27 (10): 12807. https://doi.org/10.1002/jor.20888.
14. Robling A.G., Turner C.H. Mechanical signaling for bone modeling and remodeling. Crit Rev Eukaryot Gene Expr. 2009; 19 (4): 319–38. https://doi.org/10.1615/critreveukargeneexpr.v19.i4.50.
15. Донцева Е.А., Пилипенко П.И., Шнайдер Н.А. и др. Частота встречаемости антиконвульсант-индуцированного дефицита витамина D. Эпилепсия и пароксизмальные состояния. 2022; 14 (3): 304–15. https://doi.org/10.17749/2077-8333/epi.par.con.2022.117.
16. Жидкова И.А., Казначеева Т.В., Демидова Е.Ю., Берсенева В.В. Молекулярные механизмы влияния антиэпилептической терапии на минеральную плотность костной ткани пациентов с эпилепсией. Неврология, нейропсихиатрия, психосоматика. 2016; 1S: 59–65. http://doi.org/10.14412/2074-2711-2016-1S-59-65.
17. Li Q., Zhang Z., Fang J. Hormonal changes in women with epilepsy. Neuropsychiatr Dis Treat. 2024; 20: 373–88. https://doi.org/10.2147/NDT.S453532.
18. Bauer J., Stefan H., Schrell U., et al. Neurophysiologic principles and clinical value of post-convulsive serum prolactin determination in epileptic seizure. Fortschr Neurol Psychiatr. 1989; 57 (11): 457–68 (in German). https://doi.org/10.1055/s-2007-1001142.
19. Panahi Y., Fathi E., Shafiian M.A. The link between seizures and prolactin: a study on the effects of anticonvulsant medications on hyperprolactinemia in rats. Epilepsy Res. 2023; 196: 107206. https://doi.org/10.1016/j.eplepsyres.2023.107206.
20. Wang M.F. Effect of seizures and antiepileptic drugs on prolactin secretions. Di Yi Jun Yi Da Xue Xue Bao. 2002; 22 (8): 742–4.
21. Zhang Y.X., Shen C.H., Lai Q.L., et al. Effects of antiepileptic drug on thyroid hormones in patients with epilepsy: a meta-analysis. Seizure. 2016; 35: 72–9. https://doi.org/10.1016/j.seizure.2016.01.010.
22. Mohamed W.S., Nageeb R.S., Hashim N.A., Omran A.A. Effect of valproate versus levetiracetam monotherapy on reproductive functions in newly diagnosed epileptic males. Egypt J Neurol Psychiatr Neurosurg. 2019; 55 (1): 1–6. https://doi.org/10.1186/s41983-0190088-5.
23. Xiaotian X., Hengzhong Z., Yao X., et al. Effects of antiepileptic drugs on reproductive endocrine function, sexual function and sperm parameters in Chinese Han men with epilepsy. J Clin Neurosci. 2013; 20 (11): 1492–7. https://doi.org/10.1016/j.jocn.2012.11.028.
24. Shih F.Y., Chuang Y.C., Chuang M.J., et al. Effects of antiepileptic drugs on thyroid hormone function in epilepsy patients. Seizure. 2017; 48: 7–10. https://doi.org/10.1016/j.seizure.2017.03.011.
Об авторах
Н. А. СиваковаРоссия
Сивакова Наталия Александровна, к.м.н.
ул. Бехтерева, д. 3, Санкт-Петербург 192019
WoS ResearcherID: I-7015-2018
И. В. Абрамова
Россия
Абрамова Ирина Викторовна
ул. Бехтерева, д. 3, Санкт-Петербург 192019
И. Ю. Трухина
Россия
Трухина Ирина Юрьевна
ул. Бехтерева, д. 3, Санкт-Петербург 192019
В. П. Рыбасова
Россия
Рыбасова Варвара Павловна
ул. Бехтерева, д. 3, Санкт-Петербург 192019
Е. Д. Касьянов
Россия
Касьянов Евгений Дмитриевич, к.м.н.
ул. Бехтерева, д. 3, Санкт-Петербург 192019
Scopus Author ID: 57205549541
Л. В. Лукина
Россия
Лукина Лариса Викторовна, к.м.н.
ул. Бехтерева, д. 3, Санкт-Петербург 192019
Scopus Author ID: 16520904200
В. А. Михайлов
Россия
Михайлов Владимир Алексеевич, д.м.н.
ул. Бехтерева, д. 3, Санкт-Петербург 192019
WoS ResearcherID: B-3272-2017
Г. Э. Мазо
Россия
Мазо Галина Элевна, д.м.н.
ул. Бехтерева, д. 3, Санкт-Петербург 192019
Scopus Author ID: 6603942525
Рецензия
Для цитирования:
Сивакова Н.А., Абрамова И.В., Трухина И.Ю., Рыбасова В.П., Касьянов Е.Д., Лукина Л.В., Михайлов В.А., Мазо Г.Э. Влияние антиконвульсантов на метаболизм костной ткани: промежуточные результаты кросс-секционного исследования. Эпилепсия и пароксизмальные состояния. 2024;16(3):192–201. https://doi.org/10.17749/2077-8333/epi.par.con.2024.202
For citation:
Sivakova N.A., Abramova I.V., Trukhina I.Yu., Rybasova V.P., Kasyanov E.D., Lukina L.V., Mikhailov V.A., Mazo G.E. Anticonvulsants impacting bone metabolism: interim results from a cross-sectional study. Epilepsy and paroxysmal conditions. 2024;16(3):192–201. https://doi.org/10.17749/2077-8333/epi.par.con.2024.202
JATS XML

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.







































