Перейти к:
Стимул-индуцированные периодические разряды в ответ на низкочастотную фотостимуляцию у пациентки в восстановительном периоде инсульта в бассейне средней мозговой артерии
https://doi.org/10.17749/2077-8333/epi.par.con.2023.155
Аннотация
Стимул-индуцированные ритмичные периодические или иктальные разряды (англ. stimulus-induced rhythmic, periodic, or ictal discharges, SIRPIDs) – это электрофизиологический паттерн, регистрируемый у пациентов в критическом состоянии в ответ на слуховую, тактильную или ноцицептивную стимуляцию. Феномен является нозологически неспецифичным, его связь с иктальным событием дискутабельна. Представлены результаты стандартной электроэнцефалографии (ЭЭГ) пациентки в восстановительном периоде острого нарушения мозгового кровообращения в бассейне средней мозговой артерии с регистрацией SIRPIDs в виде периодических латерализованных разрядов в пораженном доминантном полушарии в ответ на низкочастотную фотостимуляцию. Иктальных событий во время регистрации ЭЭГ не зафиксировано, состояние обследуемой пациентки не было критическим.
Ключевые слова
Для цитирования:
Каньшина Д.С., Окунева И.В., Сурма М.А., Бронов О.Ю., Никитин С.С. Стимул-индуцированные периодические разряды в ответ на низкочастотную фотостимуляцию у пациентки в восстановительном периоде инсульта в бассейне средней мозговой артерии. Эпилепсия и пароксизмальные состояния. 2023;15(3):275–281. https://doi.org/10.17749/2077-8333/epi.par.con.2023.155
For citation:
Kanshina D.S., Okuneva I.V., Surma M.A., Bronov O.Yu., Nikitin S.S. Stimulus-induced periodic discharges in response to low-frequency photostimulation in a female patient in recovery period after middle cerebral artery stroke. Epilepsy and paroxysmal conditions. 2023;15(3):275–281. https://doi.org/10.17749/2077-8333/epi.par.con.2023.155
ВВЕДЕНИЕ / INTRODUCTION
Стимул-индуцированные ритмичные периодические или иктальные разряды (англ. stimulus-induced rhythmic, periodic, or ictal discharges, SIRPIDs) – электрографический паттерн, который характеризует до 12% случаев длительного электроэнцефалографического (ЭЭГ) мониторинга у пациентов в критическом состоянии в ответ на предъявляемые стимулы: слуховые, тактильные, ноцицептивные [1–3]. Феномен является нозологически неспецифичным и описан при кровоизлияниях, постгипоксическом, потстравматическом, токсико-метаболическом, инфекционном поражении головного мозга, прионных болезнях [1]. Большинство упоминаний
в литературе касаются регистрации SIRPIDs в отделении реанимации и интенсивной терапии [3].
В ряде исследований рассматривалась связь между регистрацией SIRPIDs и спонтанными электрографическими приступами при отсутствии нейровизуализационного подтверждения увеличения церебрального кровотока в зоне генерации паттерна [4]. В настоящее время ведущей теорией формирования SIRPIDs является нарушение таламокортикальных проекций в аномально или гипервозбудимой зоне коры головного мозга [1][2]. В небольших популяционных исследованиях корреляции между полом, возрастом, наличием в анамнезе эпилепсии, реактивности фонового ритма и регистрацией SIRPIDs обнаружено не было [3]. В литературе имеется описание возможности регистрации периодических латерализованных разрядов (англ. periodic lateralized discharges, PLDs), индуцированных низкочастотной фотостимуляцией у пациентки с пароксизмальным дистоническим хореоатетозом, в контралатеральном относительно двигательных пароксизмов полушарии, при этом состояние пациентки не было критическим [5].
КЛИНИЧЕСКИЙ СЛУЧАЙ / CASE REPORT
В 2020 г. В ФГБУ «Национальный медико-хирургический центр им. Н.И. Пирогова» Минздрава России в отделении восстановительного лечения находилась пациентка З. 60 лет, поступившая на курс реабилитации спустя 14 мес после перенесенного геморрагического инсульта в левом полушарии головного мозга с формированием внутримозговой гематомы с прорывом в желудочковую систему мозга (проведена трепанация черепа, удаление внутримозговой гематомы левой лобно-височной области).
Этические аспекты / Ethical aspects
Вся медицинская помощь оказывалась в полном соответствии со стандартами, порядками и клиническими рекомендациями, а также принципами Хельсинкской декларации Всемирной медицинской ассоциации (Форталеза, Бразилия, 2013 г.). Пациенткой при госпитализации заполнена форма добровольного информированного согласия, включающая возможность использования полученных данных в научных целях, в т.ч. для публикаций.
Неврологический статус / Neurological status
При поступлении в неврологическим статусе: правосторонний гемипарез с минимальными движениями в верхней конечности, в нижней конечности в проксимальных отделах 2,5–3 балла по шкале оценки мышечной силы (англ. Medical Research Council Weakness Scale, MRC), в стопе – минимальные движения. Мышечный тонус в паретичных конечностях умеренно повышен по спастическому типу (1 балл по шкале Эшфорта), правосторонняя гемигипестезия, сенсомоторная афазия, значение по шкале Рэнкина 3 балла.
Методы реабилитации / Rehabilitation methods
Лечение проводилось по индивидуальному плану медицинской реабилитации с включением сеансов нейро-психологической реабилитации, транскраниальной магнитной стимуляции, занятий по восстановлению речи, лечебной гимнастики, индивидуальной механотерапии в режиме биологической обратной связи, занятий на роботизированном комплексе для верхних конечностей, а также на роботизированном комплексе Lokomat (Hocoma AG, Швейцария).
ЭЭГ / EEG
За время госпитализации проведена стандартная ЭЭГ по утвержденному протоколу [6][7] с использованием электроэнцефалографа «Нейрон-Спектр-3» (Нейрософт, Россия). Параметры записи: монтаж double banana, развертка 30 мм/с, чувствительность 7 мкВ/дел, фильтр высоких частот 0,5 Гц, фильтр низких частот 70 Гц.
При проведении пробы с фотостимуляцией на частоте 1 Гц были зарегистрированы стимул-индуцированные латерализованные периодические разряды в пораженном полушарии вне иктального события. Регистрация фоновой ЭЭГ в состоянии пассивного бодрствования сопровождалась наличием преходящего дельта-замедления, латерализованного соответственно зоне структурных изменений (рис. 1).
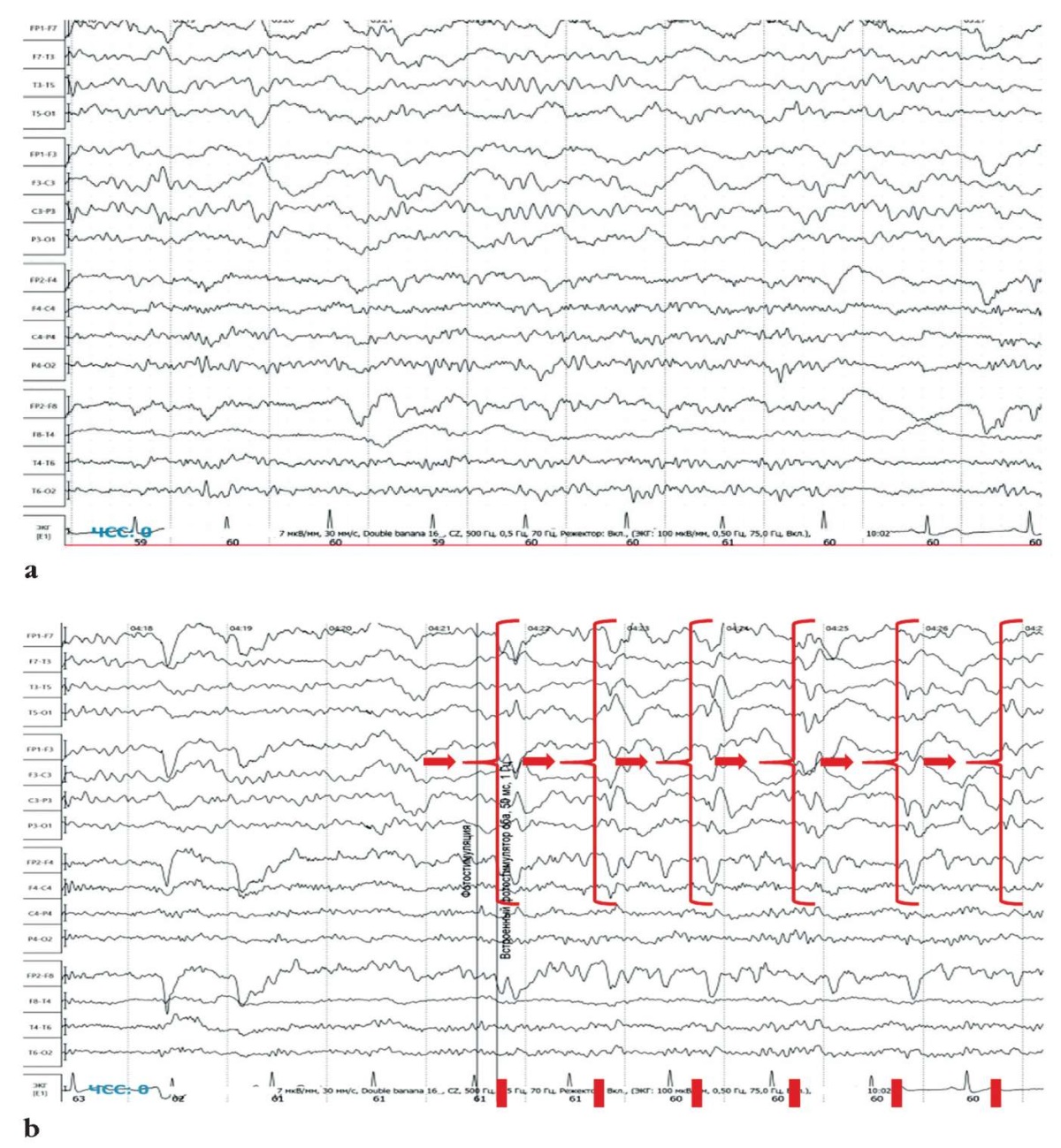
Рисунок 1. Фрагменты электроэнцефалографической записи пациентки З.
(фоновая запись, монтаж double banana, развертка 30 мм/с,
чувствительность 7 мкВ/дел, фильтр высоких частот 0,5 Гц,
фильтр низких частот 70 Гц):
а – регистрация в состоянии пассивного бодрствования,
преходящее латерализованное по левому полушарию дельта-замедление;
b – фотостимуляция с частотой 1 Гц,
стимул-индуцированные ритмичные периодические латерализованные
левополушарные разряды выделены стрелками и скобками,
частота разрядов соответствует частоте фотостимуляции
Figure 1. Patient Z. Electroencephalographic recording fragments
(background recording, double banana montage,
sweep 30 mm/sec, sensitivity 7 µV/div, high-pass filter 0.5 Hz, low-pass filter 70 Hz):
a – in passive wakefulness state, continued lateralized
left hemispheric delta deceleration was registered;
b – 1 Hz rhythmic photostimulation, lateralized left hemispheric discharges
of three-phase morphology were registered (highlighted by arrows and brackets),
the frequency of discharges corresponds to the frequency of photostimulation
МРТ / MRI
Выполнялась нейровизуализация с помощью магнитно-резонансного томографа Magnetom Aera (Siemens, Германия) с индукцией магнитного поля 1,5 Тл. Использовался стандартный протокол, включающий следующие последовательности: Т1-взвешенное изображение (англ. T1 weighted image, Т1 WI) 3D, T2 WI в аксиальной плоскости, T2 FLAIR (англ. fluid attenuated inversion recovery) в корональной плоскости, SWI (англ. susceptibility weighted imaging) в аксиальной плоскости, а также диффузионно-взвешенное изображение (англ. diffusion-weighted image, DWI) (b=0, b=1000) и измеряемый коэффициент диффузии (англ. apparent diffusion coefficient, ACD).
При нейровизуализации выявлена обширная зона структурных изменений с пролабированием мозговой ткани в области послеоперационного костного дефекта (рис. 2).
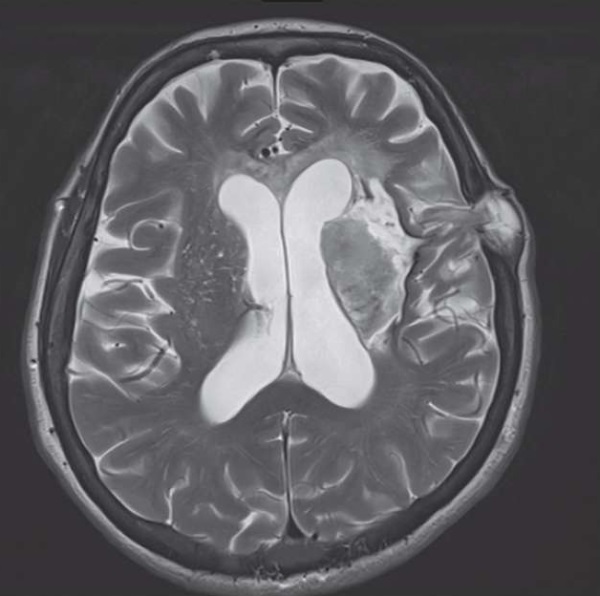
Рисунок 2. Магнитно-резонансная томограмма пациентки З.,
режим T2-WI, аксиальный срез. Кистозно-глиозные (с геморрагическим компонентом)
изменения лобной доли левого полушария головного мозга, области таламуса,
скорлупы и чечевицеобразного ядра, островка, внутренней и наружной капсулы.
Определяется послеоперационный костный дефект
с небольшим пролабированием мозговой ткани
Figure 2. Patient Z. Axial T2-WI magnetic resonance image.
Cystic-glial (with hemorrhagic component) changes in the left frontal lobe, thalamus,
internal capsule, lentiform nucleus, putamen, insula and external capsule.
Small portion of brain tissue herniated through the postsurgical bone defect
ОБСУЖДЕНИЕ / DISCUSSION
При поиске в базе данных PubMed/MEDLINE c использованием ключевого слова “SIRPIDs” выделено 33 статьи, подавляющее большинство которых посвящено регистрации феномена у пациентов в критическом состоянии. Впервые SIRPIDs был описан в 2004 г. L.J. Hirsh et al. как воспроизводимый феномен, регистрируемый в ответ на звуковую или физическую стимуляцию у пациентов в критическом состоянии [8].
Cогласно стандартизированной терминологии Американского общества клинической нейрофизиологии (англ. American Clinical Neurophysiology Society, ACNS) выделяют следующие электрографические паттерны SIRPIDs: ритмичная дельта-активность (англ. stimulus-induced rhythmic delta activity, SI-RDA), периодические разряды (англ. stimulus-induced periodic discharges, SI-PD), комплексы «спайк – волна» (англ. stimulus-induced spike-wave, SI-SW), иктальные паттерны (англ. SI-seizures), вспышки (англ. SI-bursts), иктально-интериктальный континуум (англ. stimulus-induced ictal-interictal continuum, SI-IIC), короткие иктальные ритмичные разряды (англ. stimulus-induced brief ictal rhythmic discharges, SI-BIRDs) [9].
Ряд исследований продемонстрировал взаимосвязь между локализацией SIRPIDs и зоной поражения головного мозга [10]. При этом нет данных, подтверждающих наличие или отсутствие связи между модальностью стимула и зоной регистрации паттерна.
Согласно представленным теориям таламокортикальные проекции, передающие афферентную стимуляцию, топографически организованы в средних слоях определенных кортикальных областей, при этом существуют отдельные группы таламических нейронов, имеющих более диффузное кортикальное представительство, в результате чего формируется таламо-кортико-таламическая сеть [11]. Латерализационное распространение феномена объясняется, с одной стороны, опосредованным торможением таламического ретикулярного ядра – одного из ведущих афферентов системы с последующей избыточной стимуляцией кортикальных проекций на фоне субкортикального повреждения, а с другой – снижением возбуждающих таламокортикальных проекций за счет структурного повреждения таламуса. Интересным представляется мнение, что SIRPIDs можно рассматривать как тип реактивности в контексте жизнеспособной гипервозбудимой коры головного мозга [12].
В представленном клиническом наблюдении примечателен факт возникновения SIRPIDs в ответ на фотостимуляцию на низких частотах (1 Гц) у пациентки, не пребывавшей на момент записи в критическом состоянии. Латерализация феномена путем распространения активирующего стимула от затылочной коры в проекцию таламуса с последующим объемным проведением по таламокортикальным связям пораженного полушария представляет интерес с точки зрения существующих теорий патогенеза паттерна.
Описанный ранее в литературе случай регистрации PLDs в ответ на низкочастотную фотостимуляцию у пациентки с пароксизмальным дистоническим хореоатетозом в контралатеральной стороне двигательных пароксизмов полушария подтвердил отсутствие структурных изменений в зоне регистрации феномена [5]. По предположению J.W. Lance, любое нарушение коркового контроля неостриатума и его таламических связей неизвестным нейротрансмиттерным механизмом может вызвать фотосенситивные PLDs, которые способны существовать в «скрытой» форме; при этом его морфология опосредована сложным (световым) рефлекторным механизмом [13].
Единого мнения о необходимости лечения пациентов противоэпилептическими препаратами в случае регистрации у них SIRPIDs нет. Последние исследования демонстрируют противоречивые данные между индуцированными ритмичными паттернами и приступами [12].
Наше наблюдение доказывает возможность регистрации редкого паттерна – стимул-индуцированных ритмичных латерализованных периодических разрядов (SI-PLDs) при проведении фотостимуляции на низких частотах у пациентки в восстановительном периоде острого нарушения мозгового кровообращения (ОНМК) в бассейне средней мозговой артерии (СМА) (см. рис. 1, 2) в пораженном полушарии. Регистрируемый паттерн соответствует разработанным ACNS критериям SIRPIDs и не является ни фотопароксизмальным ответом, ни зрительным вызванным потенциалом в связи с его отсроченным появлением в ответ на предъявляемый стимул, морфологией и амплитудой комплексов, областью регистрации, не связанной со зрительным анализатором.
Благодарность / Acknowledgement
Авторы выражают благодарность за помощь в интерпретации клинического случая руководителю лаборатории клинической нейрофизиологии ФГБУ «Научный центр неврологии» Российской академии наук Амаяку Грачевичу Брутяну.
ЗАКЛЮЧЕНИЕ / CONCLUSION
В представленном клиническом наблюдении SI-PLDs зарегистрированы в стандартной ЭЭГ бодрствования в восстановительном периоде ОНМК в бассейне СМА при обширном поражении доминантного (левого) полушария с вовлечением таламических структур вне критического состояния. В данном случае паттерн не являлся иктальным. Низкочастотная фотостимуляция, индуцирующая проба способны спровоцировать регистрацию периодических ритмичных латерализованных разрядов, в т.ч. в зоне с выраженным структурным повреждением таламокортикальных проекций.
Список литературы
1. Johnson E.L., Kaplan P.W., Ritzl E.K. Stimulus-Induced Rhythmic, Periodic, or Ictal Discharges (SIRPIDs). J Clin Neurophysiol. 2018; 35 (3): 229–33. https://doi.org/10.1097/WNP.0000000000000434.
2. Fernández-Torre J.L., Martín-García M., Marco de Lucas E., Hernández-Hernández M.A. Asymmetric SIRPIDs in a vertebrobasilar stroke: implications for understanding its origin. Clin Neurol Neurosurg. 2020; 196: 105980. https://doi.org/10.1016/j.clineuro.2020.105980.
3. Van Straten A.F., Fesler J.R., Hakimi R., et al. SIRPIDs: prevalence and outcome in critically ill patients. J Clin Neurophysiol. 2014; 31 (5): 418–21. https://doi.org/10.1097/WNP.0000000000000094.
4. Zeiler S.R., Turtzo L.C., Kaplan P.W. SPECT-negative SIRPIDs argues against treatment as seizures. J Clin Neurophysiol. 2011; 28 (5): 493–6. https://doi.org/10.1097/WNP.0b013e318231c00a.
5. Jacome D.E., Risko M. Photic induced-driven PLEDs in paroxysmal dystonic choreoathetosis. Clin Electroencephalogr. 1984; 15 (3): 151–4. https://doi.org/10.1177/155005948401500306.
6. Dash D., Dash C., Primrose S., et al. Update on minimal standards for electroencephalography in Canada: a review by the Canadian Society of Clinical Neurophysiologists. Can J Neurol Sci. 2017; 44 (6): 631–42. https://doi.org/10.1017/cjn.2017.217.
7. Рeкомендации экспертного совета по нейрофизиологии Российской Противоэпилептической Лиги по проведению рутинной ЭЭГ. Эпилепсия и пароксизмальные состояния. 2016; 8 (4): 99–108.
8. Hirsch L.J., Claassen J., Mayer S.A., Emerson R.G. Stimulus-induced rhythmic, periodic, or ictal discharges (SIRPIDs): a common EEG phenomenon in the critically ill. Epilepsia. 2004; 45 (2): 109–23. https://doi.org/10.1111/j.0013-9580.2004.38103.x.
9. Hirsch L.J., Fong M.W.K., Leitinger M., et al. American Clinical Neurophysiology Society's standardized critical care EEG terminology: 2021 version. J Clin Neurophysiol. 2021; 38 (1): 1–29. https://doi.org/10.1097/WNP.0000000000000806.
10. Benarroch E.E. The midline and intralaminar thalamic nuclei: anatomic and functional specificity and implications in neurologic disease. Neurology. 2008; 71 (12): 944–9. https://doi.org/10.1212/01.wnl.0000326066.57313.13.
11. Barbella G., Lee J.W., Alvarez V., et al. Prediction of regaining consciousness despite an early epileptiform EEG after cardiac arrest. Neurology. 2020; 94 (16): e1675–83. https://doi.org/10.1212/WNL.0000000000009283.
12. Rodriguez Ruiz A., Vlachy J., Lee J.W., et al. Association of periodic and rhythmic electroencephalographic patterns with seizures in critically ill patients. JAMA Neurol. 2017; 74 (2): 181–8. https://doi.org/10.1001/jamaneurol.2016.4990.
13. Lance J.W. Familial paroxysmal dystonic choreoathetosis and its differentiation from related syndromes. Ann Neural. 1977; 2 (4): 285– 93. https://doi.org/10.1002/ana.410020405.
Об авторах
Д. С. КаньшинаРоссия
Каньшина Дарья Сергеевна – к.м.н., старший научный сотрудник отдела функциональной диагностики
Scopus Author ID: 57221390389
ул. Большая Полянка, д. 22, Москва 119180
И. В. Окунева
Россия
Окунева Ирина Владимировна – научный сотрудник группы клинической нейрофизиологии отделения неотложной нейрохирургии
Большая Сухаревская пл., д. 3, Москва 129090
М. А. Сурма
Россия
Сурма Мария Александровна – врач-невролог, врач функциональной диагностики
ул. Нижняя Первомайская, д. 70, Москва 105203
О. Ю. Бронов
Россия
Бронов Олег Юрьевич – к.м.н., заведующий кафедрой лучевой диагностики с курсом клинической радиологии Института усовершенствования врачей; врач-рентгенолог
Scopus Author ID: 57215892759
ул. Нижняя Первомайская, д. 70, Москва 105203
ул. Петровка, д. 24, стр. 1, Москва 127051
С. С. Никитин
Россия
Никитин Сергей Сергеевич – д.м.н., профессор, заведующий кафедрой генетики неврологических болезней
ул. Москворечье, д. 1, Москва 115522
Рецензия
Для цитирования:
Каньшина Д.С., Окунева И.В., Сурма М.А., Бронов О.Ю., Никитин С.С. Стимул-индуцированные периодические разряды в ответ на низкочастотную фотостимуляцию у пациентки в восстановительном периоде инсульта в бассейне средней мозговой артерии. Эпилепсия и пароксизмальные состояния. 2023;15(3):275–281. https://doi.org/10.17749/2077-8333/epi.par.con.2023.155
For citation:
Kanshina D.S., Okuneva I.V., Surma M.A., Bronov O.Yu., Nikitin S.S. Stimulus-induced periodic discharges in response to low-frequency photostimulation in a female patient in recovery period after middle cerebral artery stroke. Epilepsy and paroxysmal conditions. 2023;15(3):275–281. https://doi.org/10.17749/2077-8333/epi.par.con.2023.155

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.










































