ОРИГИНАЛЬНЫЕ СТАТЬИ
Актуальность. Появление новейших фармакотерапевтических методов открыло новые возможности рождения здоровых детей у женщин, страдающих эпилепсией, а проведение комплексной прегравидарной подготовки стало «золотым стандартом» лечения, снижающим риски тератогенеза и появления нарушений психического развития и адаптации у потомства.
Цель: изучение влияния комплекса прегравидарной подготовки женщин с эпилепсией на психическое развитие и адаптацию их детей.
Материал и методы. Проведено многоцентровое ретроспективное неконтролируемое открытое наблюдательное исследование психического развития детей, рожденных женщинами, страдающими эпилепсией. В исследовании приняли участие 176 человек: 88 детей в возрасте 3–9 лет и их матери, больные эпилепсией. В качестве методов использовались: медицинская анкета (биографические и клинические данные о форме, течении и лечении эпилепсии у матери, протекании беременности и родов, а также информация о раннем развитии ребенка), Луриевские батареи нейропсихологических тестов в адаптации Ж.М. Глозман (для детей дошкольного и младшего школьного возраста), методика исследования интеллекта Д. Векслера (англ. Wechsler Intelligence Scale for Children, WISC) для детей 5 лет и старше, Контрольный лист поведения ребенка (англ. Child Behavior Checklist, CBCL) Т. Ахенбаха и анкета для выявления симптомов синдрома дефицита внимания с гиперактивностью и других поведенческих расстройств в модификации Н.Н. Заваденко (для детей 5 лет и старше).
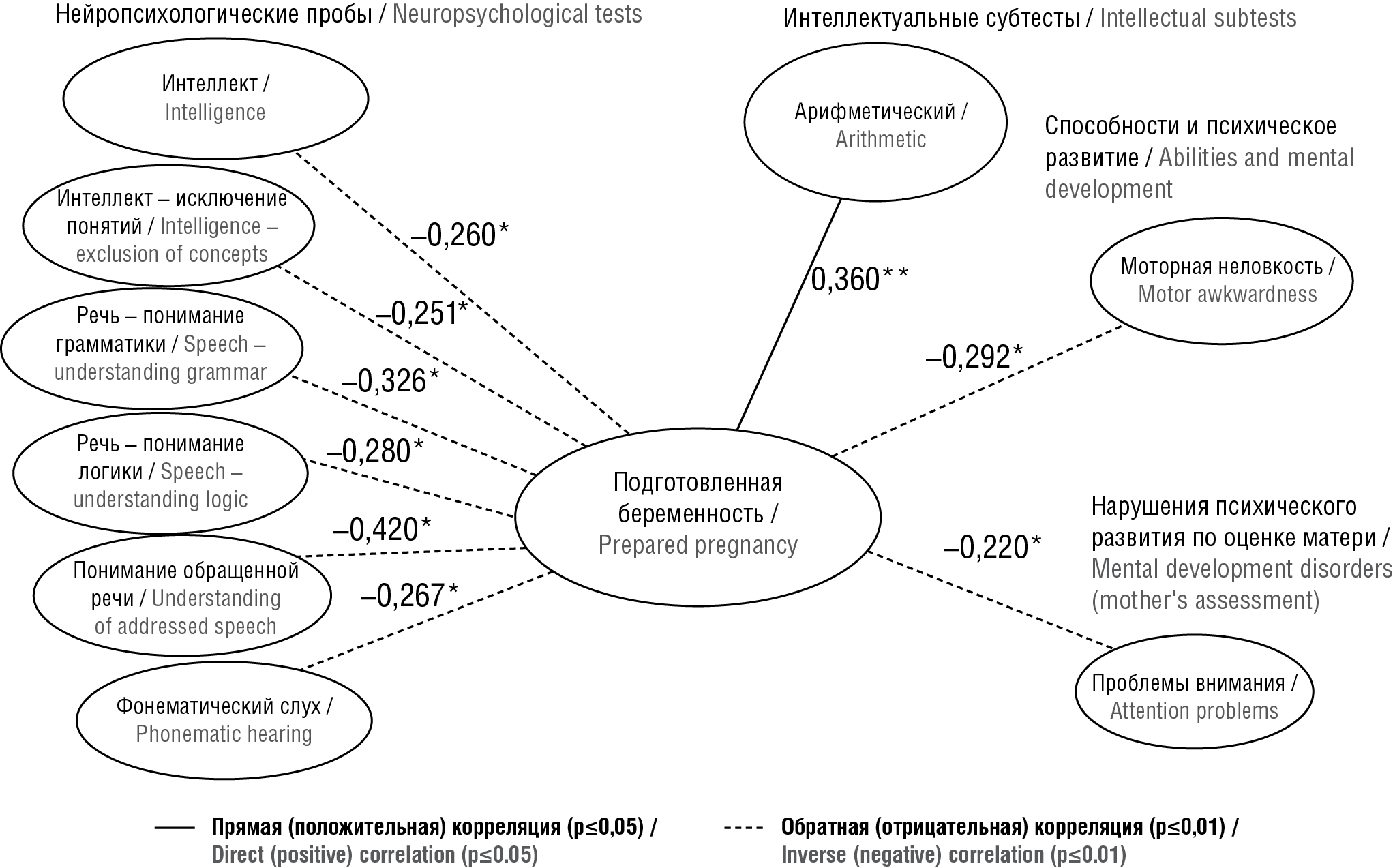
Результаты. У детей матерей, не прошедших прегравидарную подготовку, общий показатель нарушений развития и адаптации был выше: сильнее выражены тревожность, расстройства внимания, моторная неловкость, гиперактивность и интернализационные проблемы. Общий показатель нейропсихологических нарушений у них также был выше – особенно страдали гнозис, фонематический слух, понимание обращенной речи и логики речи, логические операции. Сравнение возрастных групп показало, что к 7–9 годам дети, матери которых прошли прегравидарную подготовку, компенсировались лучше. Приступы во время беременности являются предиктором появления у ребенка в дальнейшем большого количества нарушений психического развития (соматические расстройства, ухудшение социализации и внимания, моторная неловкость, экстернализационные проблемы), а проведение прегравидарной подготовки достоверно снижает предсказательную силу этого влияния, что позволяет рассматривать ее в качестве модератора. Прегравидарная подготовка также является модератором, снижающим негативное влияние токсикоза на вероятность появления у ребенка проблем экстернализации (агрессии) и задержки в развитии нейродинамики.
Заключение. Комплексная прегравидарная подготовка оказывает модерирующий эффект – снижает негативное влияние эпилептических приступов и осложнений беременности (токсикоз) на дальнейшее психическое развитие и адаптацию ребенка, а также повышает его компенсаторные возможности. Результаты исследования имеют как научную, так и практическую значимость для неврологов, акушеров-гинекологов и клинических психологов.
Актуальность. В связи с прогрессом в лечении пациентов, перенесших инсульт, увеличивается распространенность постинсультной эпилепсии (ПИЭ). Поиск биомаркеров, определяющих прогноз осложнений ишемического инсульта (ИИ) и развитие ПИЭ, с разработкой протокола диагностики полезен для совершенствования тактики терапии ПИЭ.
Цель: исследование уровней нейронспецифической енолазы (англ. neuron-specific enolase, NSE) и фактора роста эндотелия сосудов (англ. vascular endothelial growth factor, VEGF) в сыворотке крови пациентов с ПИЭ, изучение клинико-нейроиммунологических корреляций.
Материал и методы. Обследованы 140 пациентов в возрасте от 28 до 84 лет с последствиями первого ИИ. Из них у 70 больных впервые развились поздние эпилептические приступы (основная группа), у 70 имел место ИИ без эпилептических приступов (группа сравнения). В контрольную группу вошли 30 пациентов без ИИ и эпилепсии. Степень тяжести ИИ оценивали по шкале инсульта Национальных институтов здравоохранения США (англ. National Institutes of Health Stroke Scale, NIHSS), степень инвалидизации – по модифицированной шкале Рэнкина (англ. modified Rankin Scale, mRS), уровень базовой функциональной активности пациента – по индексу Бартела (англ. Barthel Index, BI). Прогнозирование появления поздних приступов после ИИ осуществляли по шкале SeLECT (англ. SEverity of stroke, Large artery atherosclerosis, Early seizure, Cortical involvement, Territory of the middle cerebral artery). Для оценки тяжести течения эпилепсии использовали классификацию K. Lühdorf et al. У всех пациентов проводили иммуноферментный анализ уровня нейротрофического фактора NSE и фактора ангиогенеза VEGF в сыворотке крови.
Результаты. Отмечено значительное увеличение концентрации NSE в основной группе (в 4,72 раза) и группе сравнения (в 4,45 раза), в отличие от контрольной группы. Выявлено статистически значимое повышение показателей VEGF в основной группе (в 1,59 раза) и группе сравнения (в 1,54 раза) относительно контрольных значений. Кроме того, уровни NSE и VEGF в основной группе статистически значимо превышали таковые в группе сравнения (в 1,06 и 1,03 раза соответственно). Также наблюдалась тенденция к повышению обоих биомаркеров у больных со среднетяжелым и тяжелым течением ПИЭ. Определен уровень корреляционных взаимосвязей между показателями, которые характеризуют повреждение нервной ткани и процесс ангиогенеза, и степенью тяжести, инвалидизации, реабилитационного потенциала, активности пациентов в повседневной жизни, а также прогностической значимости NSE и VEGF в развитии и утяжелении эпилепсии у больных с последствиями ИИ и эпилептическими приступами.
Заключение. Гиперэкспрессия NSE и VEGF имеет значение в прогнозировании развития или прогрессирования (утяжеления) эпилепсии после ИИ.
КЛИНИЧЕСКИЕ СЛУЧАИ
Особенную сложность на приеме врача-невролога представляет дифференциальная диагностика эпилептических и неэпилептических пароксизмов. Нарколепсия – это хроническое заболевание, одним из проявлений которого является чрезмерная дневная сонливость. Некоторые симптомы нарколепсии, особенно катаплексия, могут быть очень похожи на эпилептические приступы. Представленное наблюдение демонстрирует важность междисциплинарного подхода при проведении дифференциальной диагностики эпилептических приступов. Приведены клинические маркеры типичных и атипичных проявлений катаплексии, критерии диагностики нарколепсии.
Избыточная мышечная активность при генерализованных судорожных приступах у больных эпилепсией в ряде случаев может приводить к существенным изменениям биохимических показателей плазмы крови, повышению уровня ряда метаболитов, в частности сывороточной креатинкиназы, сопровождаться азотемией, что вызывает значительные диагностические и терапевтические трудности. Необходимо осуществлять мониторинг концентрации креатинкиназы после судорог, особенно при наличии у пациента электролитных нарушений. Для коррекции повышенного уровня креатинкиназы или миоглобина следует проводить инфузионную терапию, ощелачивание мочи, вводить диуретики.
Актуальность. Семейная эпилепсия DEPDC5 (белок 5, содержащий домены disheveled, Egl-10 и pleckstrin) представляет собой группу эпилептических расстройств, вызванных мутациями в гене DEPDC5, который является частью комплекса GATOR1 (GAP-активность в отношении Rag 1). Указанные мутации вызывают гиперактивацию пути mTOR, что нарушает морфогенез нейронов и приводит к увеличению проведения возбуждающих потенциалов и развитию эпилепсии. Частота и распространенность семейной эпилепсии DEPDC5 не установлены, но исследования показывают, что она может составлять до 10% случаев семейной фокальной эпилепсии. Генетическое тестирование, электроэнцефалография (ЭЭГ) и магнитно-резонансная томография (МРТ) мозга важны для диагностики данного расстройства, хотя часто регистрируется нормальная картина МРТ.
Цель: исследовать редкую спорадическую мутацию в гене DEPDC5 с полиморфизмом p.R389H неизвестного значения.
Клинический случай. Девочка (возраст 6 лет) из Южной Азии родилась на 34-й неделе от некровного брака без каких-либо пренатальных осложнений: гипербилирубинемия отмечена на 1-й неделе от рождения, успешно купирована применением фототерапии. Первый приступ, расцененный как простой фебрильный, случился у ребенка в возрасте 3 мес, лишь через 2 дня после того, как спала лихорадка после вакцинации. Лечения не проводилось. В возрасте 3,5 мес у пациентки начались рецидивирующие приступы. Обследование с проведением МРТ, исследование на инфекционные возбудители и оценка метаболической панели не дали окончательных результатов. ЭЭГ во время первичного осмотра показала эпилептиформную активность в левой височной области. Принимая во внимание прием нескольких противоэпилептических препаратов, пациентке поставили диагноз «рефрактерная эпилепсия». Впоследствии при проведении ЭЭГ в возрасте 2,5 года обнаружена интериктальная биполушарная эпилептиформная активность. На ЭЭГ в возрасте 5 лет выявлены интериктальные спайки и волновые разряды в лобно-височной области с обеих сторон со вторичной генерализацией. К возрасту 3 лет МРТ-исследование пациентки продемонстрировало легкую деформацию мозолистого тела с недостаточной толщиной его валика. ДНК-анализ подтвердил наличие гетерозиготной миссенс-мутации в экзоне 16 гена DEPDC5 без хромосомных аномалий. Мать девочки также является гетерозиготной по обнаруженной мутации, отец мутаций не имеет. У пациентки диагностирована выраженная задержка развития. Скорректированный возраст составляет приблизительно 1 год для мелкой моторики и речи, 1,5 года – для крупной моторики, 2,5 года – для когнитивных и социальных навыков. У ребенка также развились аутистические черты со значительным нарушением слуховой/визуальной обработки, отмечены гипотония (D>S), походка с широкой базой шага и экстрапирамидные движения.
Заключение. Мутация в гене DEPDC5, наследуемая по семейному типу, приводит к замене аминокислоты гистидина на аргинин в кодоне 389. Указанный вариант R389H отсутствует в базе данных 1000 геномов (англ. 1000 genomes) и, как предполагается, является доброкачественным. Напротив, описанный вариант скорее представляет собой спорадическую крайне редкую мутацию. Пациенты с подобными мутациями могут хорошо отвечать на терапию ингибиторами mTOR, такие как рапамицин, что делает критически важным проведение быстрой диагностики и лечения.
НАУЧНЫЕ ОБЗОРЫ
Актуальность. Индуцированное вальпроевой кислотой (ВК) расстройство пищевого поведения (РПП) является одной из составных частей патогенеза такого серьезного осложнения терапии ВК и ее солями, как ВК-индуцированный метаболический синдром (МетС). Около 20% пациентов, получающих ВК, имеют увеличение веса, которое также обусловлено изменением пищевого поведения у таких больных. В регуляции пищевого поведения участвуют такие вещества, как нейропептид Y (англ. neuropeptide Y, NPY), лептин, орексин и грелин. В последние годы особое внимание уделяется NPY, поскольку он представляет собой один из самых мощных орексигенных пептидов головного мозга, а уровень его экспрессии непосредственно влияет на количество и качество потребляемой пищи. Гиперэкспрессия NPY ассоциирована с РПП, пищевыми предпочтениями, развитием ожирения и МетС.
Цель: провести обзор результатов доклинических и клинических исследований роли NPY как потенциального чувствительного и специфического сывороточного биомаркера ВК-РПП, вторичного увеличения веса и развития ВК-МетС у детей и взрослых с эпилепсией.
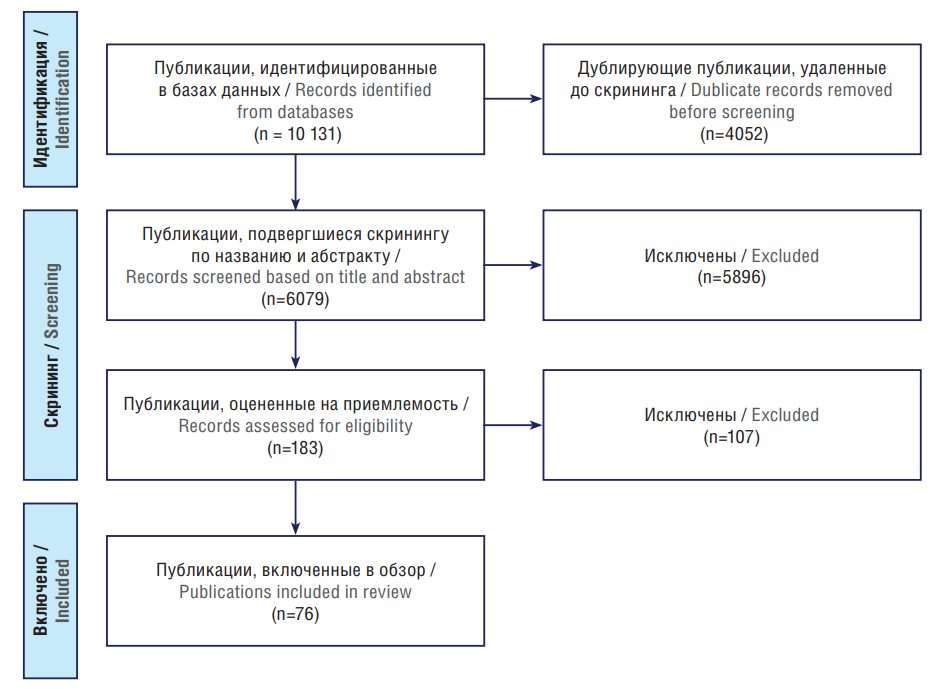
Материал и методы. Проанализированы отечественные и зарубежные публикации, поступившие в базы данных eLibrary, PubMed/MEDLINE, Scopus, Google Scholar за период 2014–2024 гг. Рассматривали полнотекстовые статьи на русском и английском языках (оригинальные исследования, систематические обзоры, метаанализы, кокрейновские обзоры, клинические случаи). После процедуры отбора из 1105 публикаций, найденных по ключевым словам, в анализ вошли 53.
Результаты. ВК-РПП относится к мультифакторным заболеваниям, при оценке риска развития которых необходимо учитывать аддитивный вклад внешних (пищевое воспитание, пищевые привычки у пациента и членов семьи) и внутренних (ключевые гормоны и нейропептиды регуляции аппетита и пищевых предпочтений, доза и длительность приема ВК, скорость метаболизма ВК) факторов. NPY-ассоциированное ВК-РПП влияет на пищевые предпочтения в пользу высококалорийных пищи и напитков, увеличения частоты приемов пищи, повышает риски инсулинорезистентности, гипергликемии как одних из основных доменов патогенеза МетС.
Заключение. ВК-РПП требует своевременной диагностики, поскольку может стать причиной ВК-МетС. NPY является важным биомаркером ВК-РПП, поскольку исследования последних лет убедительно продемонстрировали, что этот нейропептид участвует в регуляции пищевого поведения у больных эпилепсией.
Актуальность. Между сном и эпилепсией имеются многочисленные сложные взаимодействия – активирующее влияние сна на возникновение эпилептических приступов, нарушение структуры сна эпилептической активностью, влияние противоэпилептических препаратов на структуру и качество сна у пациентов с эпилепсией, а также коморбидность нарушений сна и эпилепсии.
Цель: изучение взаимосвязи между сном и эпилептической активностью, подходов к диагностике и лечению нарушений сна при эпилепсии по данным литературы.
Материал и методы. Изучены результаты современных исследований, посвященных взаимосвязи эпилепсии и сна. Поиск публикаций проводили в электронных базах данных PubMed/MEDLINE и eLibrary по ключевым словам и словосочетаниям: «эпилепсия», «сон», «противоэпилептические препараты», «расстройства сна», «инсомния», «синдром обструктивного апноэ сна», «синдром беспокойных ног», «депрессия», «тревога», «непсихотические психические расстройства» на русском и английском языках.
Результаты. Обзор литературы выявил сложные взаимосвязи между эпилепсией и нарушениями сна. Эпилептическая активность, особенно в ночное время, может фрагментировать сон, снижая его восстановительный потенциал и провоцируя увеличение частоты и тяжести приступов. Также различные противоэпилептические препараты (ПЭП) оказывают неоднозначное влияние на структуру сна: седативные ПЭП могут способствовать улучшению сна, однако при неправильно подобранной дозировке и времени приема вызывают избыточную дневную сонливость. Имеют место трудности дифференциальной диагностики нарушений сна при лечении эпилепсии, требующем мультидисциплинарного подхода из-за сложности разграничения симптомов, вызванных как эпилептической активностью, так и побочными эффектами ПЭП и сопутствующими психическими расстройствами. Для решения этих проблем предложен алгоритм диагностики и коррекции нарушений сна у больных эпилепсией, направленный на оптимизацию терапии и улучшение качества жизни у данной группы пациентов.
Заключение. Нарушения сна у больных эпилепсией могут привести к формированию «порочного круга» и ухудшению течения обоих заболеваний, в связи с чем необходимо обеспечить их своевременное выявление и коррекцию.
В настоящее время проблема эффективной терапии фармакорезистентной эпилепсии остается крайне актуальной. Тяжесть фармакорезистентной эпилепсии, значительные негативные социальные последствия и внезапная смерть при эпилепсии ложатся тяжелым грузом на институт здравоохранения. Хотя за последние десятилетия было разработано множество инновационных противоэпилептических препаратов, единственным эффективным способом лечения фармакорезистентной эпилепсии остается хирургический подход, сопряженный со значительными рисками для здоровья и не гарантирующий при этом свободу от приступов. Камнем преткновения при преодолении данной патологии является недостаток знаний патогенетических механизмов, оставляющий значительную часть больных без качественной медицинской помощи. Различные взгляды на формирование фармакорезистентности при эпилепсии характеризуются комплексностью и наличием пересекающихся молекулярных основ заболевания. В настоящем обзоре проведен анализ существующих концепций о механизмах развития фармакорезистентности при эпилепсии.
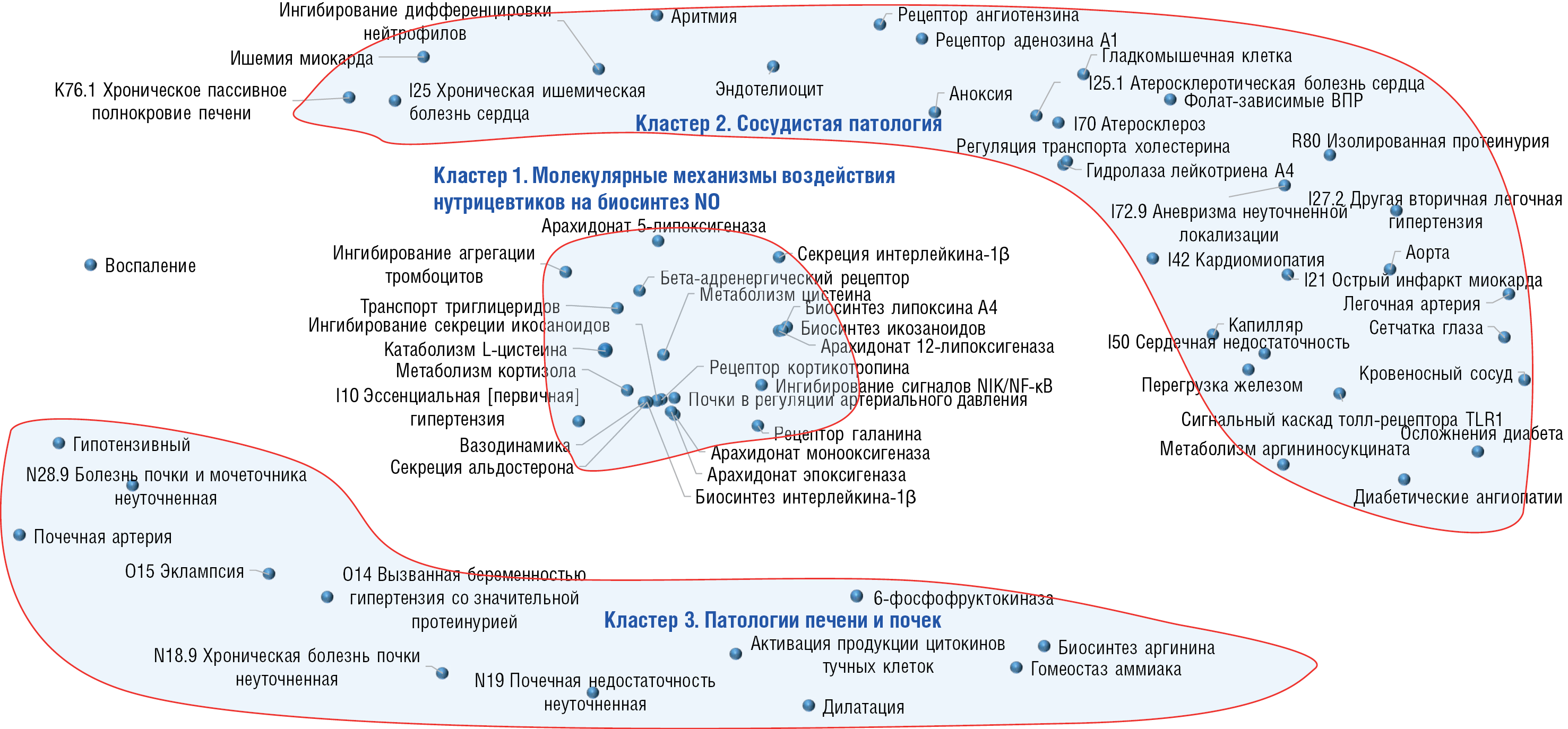
Поддержание надлежащих уровней оксида азота (NO) в крови и других тканях организма необходимо для регуляции тонуса сосудов, артериального давления, обеспечения обмена кислорода и функции эндотелия. NO также участвует в регуляции баланса возбуждающей (глутамат) и тормозящей (гамма-аминомасляная кислота) нейротрансмиссии. Нутриентные факторы оказывают существенное влияние на обмен NO. Систематический компьютерный анализ 26 103 публикаций с применением топологического подхода к распознаванию позволил выделить наиболее важные направления клинических исследований взаимосвязей между обменом NO и нутриентами: выработка NO из аргинина посредством NO-синтетазы, нитратосодержащие продукты, фолаты и витамин В12 в гомеостазе NO (включая эффекты модификаций молекулы витамина В12), другие витамины группы В (В1, В2, В7), витамины-антиоксиданты (С и Е), гормоноподобные витамины D3 и А, электролиты магний и кальций, участие микробиома в выработке NO.
ПРАКТИЧЕСКИЕ И ТЕХНИЧЕСКИЕ АСПЕКТЫ ЭЭГ
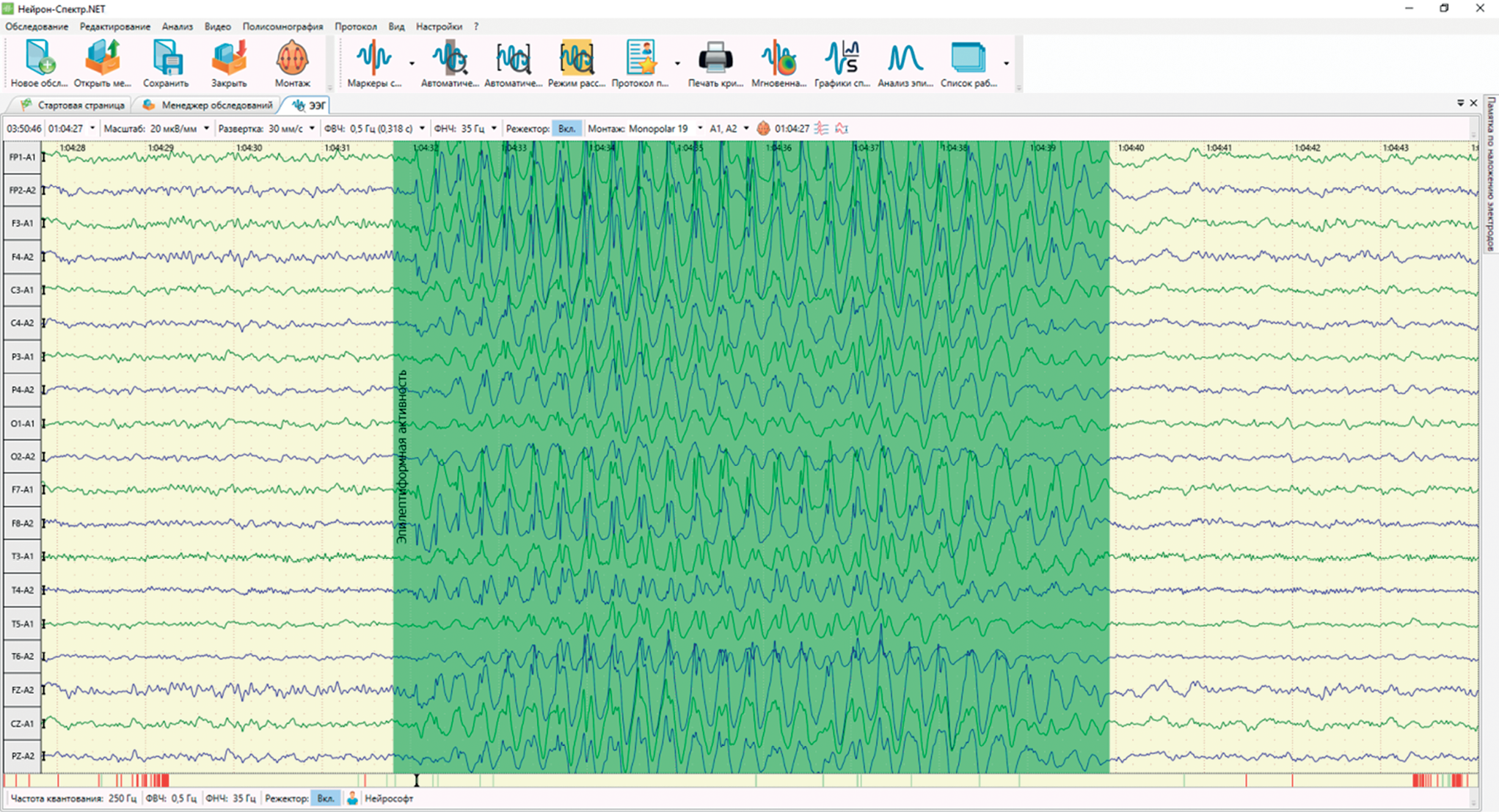
Основная область применения электроэнцефалографии (ЭЭГ) в современной клинической практике – это диагностика эпилепсии. Одним из важнейших количественных параметров оценки эпилептиформной активности на ЭЭГ является индекс эпилептиформной активности (ИЭА). Однако в зависимости от способа расчета данного параметра результат может существенно изменяться. Да и сам термин «индекс эпилептиформной активности» неоднозначен. Разные производители ЭЭГ-оборудования, как и разные медицинские специалисты, могут вкладывать в это понятие разные смыслы и понимать его по-разному. В статье рассмотрены возможные способы расчета ИЭА на ЭЭГ, внесена ясность в понимание данного термина.
ИЗ ИСТОРИИ
Фантом – ощущение присутствия утраченной части тела. Фантом может возникать после ампутации практически любой части тела, но чаще – верхних или нижних конечностей, определяемых как «фантомная конечность». Эти ощущения зачастую достигают выраженности мучительной боли – фантомной боли, существенно снижающей качество жизни пациентов. Сообщения о фантомах, фантомных конечностях и фантомных болях фиксируются с начала XVI века, но точный патогенез явления до сих пор не определен – предложено множество теорий их развития. В обзоре рассмотрена история описания фантомов, фантомных конечностей и фантомных болей в научной литературе.
ЮБИЛЕЙ
7 ноября 2024 г. доктор медицинских наук, профессор кафедры неврологии, нейрохирургии и медицинской генетики РНИМУ им. Н.И. Пирогова Андрей Сергеевич Петрухин отметил 80-летний юбилей.

Контент доступен под лицензией Creative Commons Attribution-NonCommercial-ShareAlike 4.0 International License.
ISSN 2311-4088 (Online)